Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Содержание
- 1. БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
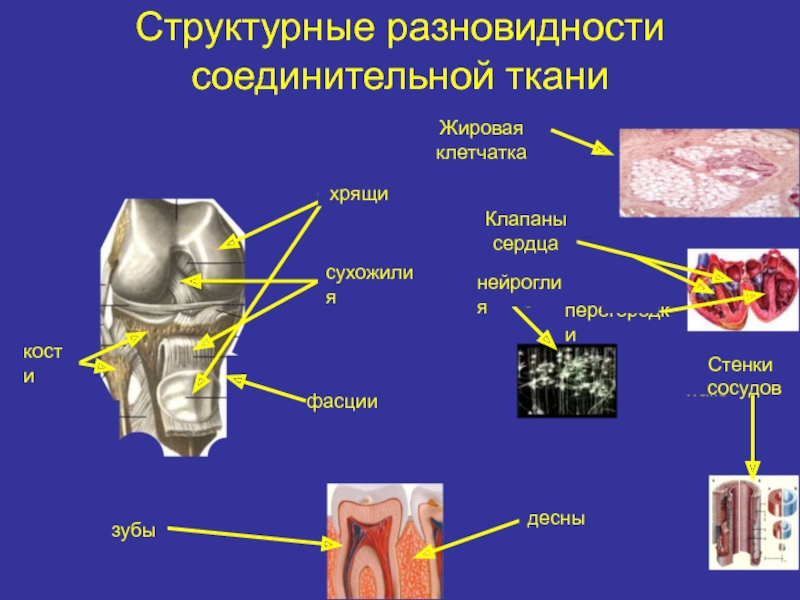
- 2. Структурные разновидности соединительной тканиЖировая клетчаткахрящиКлапаны сердцасухожилиякостифасциинейроглиязубыдесныперегородки Стенки сосудов
- 3. ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИСтруктурная Универсальный биологический клейОбеспечение постоянства тканевой проницаемостиОбеспечение водно-солевого равновесияЗащитная функция Депонирующая функция
- 4. Слайд 4
- 5. Слайд 5
- 6. КоллагенСамый распространенный белок (25-33% всех белков организма)Входит
- 7. Полипептидные цепиТропоколлагеновые молекулы(тройная спираль)Коллагеновые фибриллыКоллагеновое волокно
- 8. Первичная структура коллагена -мало или совсем нет
- 9. Вторичная структура коллагена Вторичная структура коллагена
- 10. Третичная структура коллагена Коллаген – мультимерный белокСубъединицей
- 11. Четвертичная структура коллагенаКовалентные Поперечные связиИонные связи по
- 12. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ КОЛЛАГЕНА
- 13. Синтез и процессинг коллагена в фибробластах соединительной ткани
- 14. СИНТЕЗ И ПРОЦЕССИНГ КОЛЛАГЕНА
- 15. 1. СИНТЕЗ ПРЕПРОКОЛЛАГЕНАМолекула-предшественник- препроколлаген, содержащий на N-конце
- 16. 2. ТРАНСПОРТ В ЭПР, ГИДРОЛИТИЧЕСКОЕ ОТЩЕПЛЕНИЕ СИГНАЛЬНОГО
- 17. 3. ГИДРОКСИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ПРОЛИНА И ЛИЗИНАНеобходимые
- 18. 4. ГЛИКОЗИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ГИДРОКСИЛИЗИНАУглеводные остатки связываются
- 19. 5. ОБРАЗОВАНИЕ ТРОЙНОЙ СПИРАЛИ ПРОКОЛЛАГЕНА включает несколько
- 20. 6. СЕКРЕЦИЯ В МЕЖКЛЕТОЧНЫЙ МАТРИКСПосле завершения внутриклеточного
- 21. 7. ОТЩЕПЛЕНИЕ С- и N-КОНЦЕВЫХ ПЕПТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙВнеклеточные
- 22. 8. ОБЪЕДИНЕНИЕ МОЛЕКУЛ ТРОПОКОЛЛАГЕНАа) Самопроизвольное объединение молекул
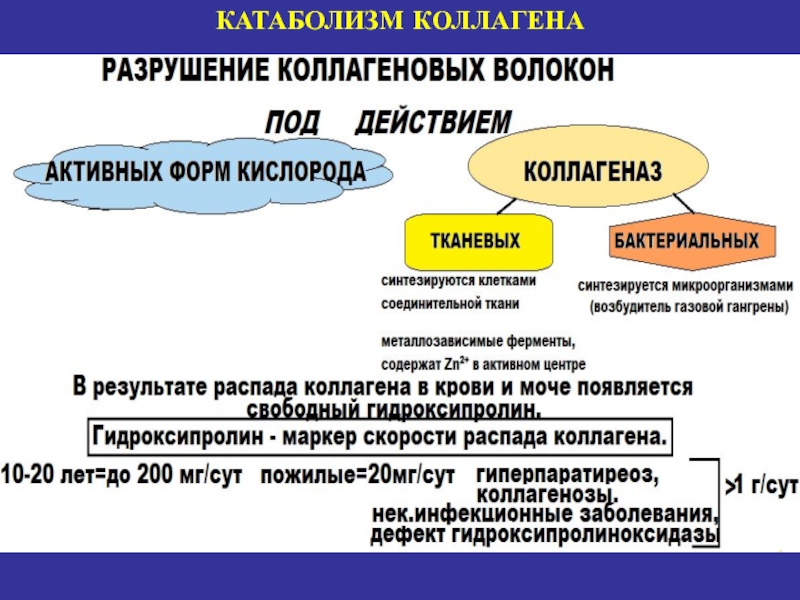
- 23. КАТАБОЛИЗМ КОЛЛАГЕНА
- 24. Слайд 24
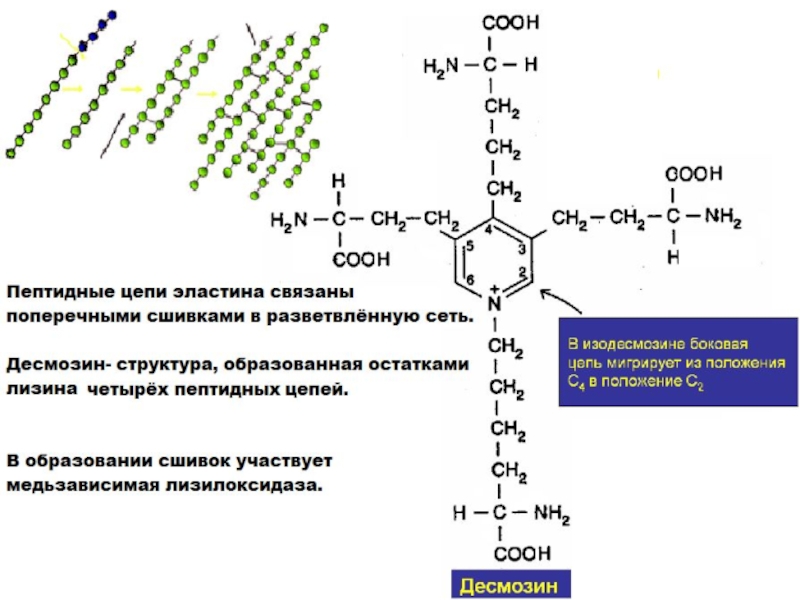
- 25. Эластин- основной белок эластических волокон, которые содержатся
- 26. Слайд 26
- 27. Различия между коллагеном и эластином
- 28. Слайд 28
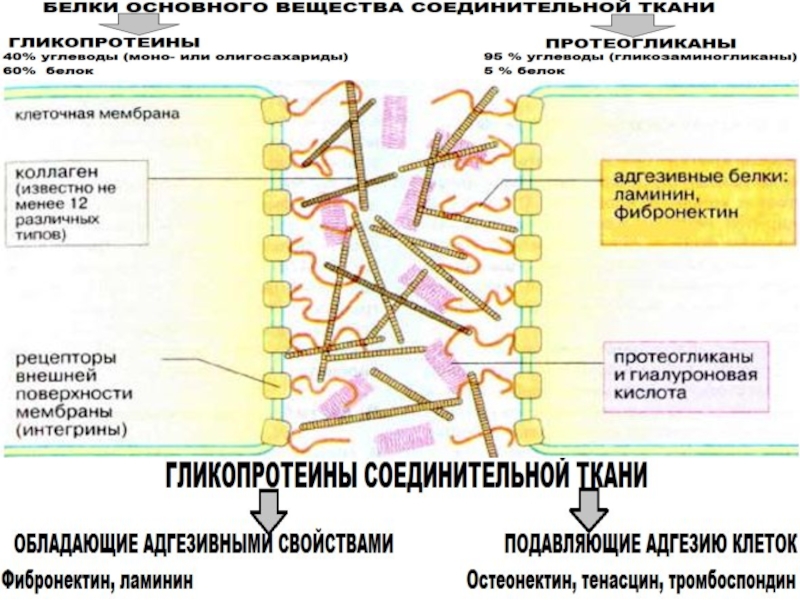
- 29. Основные гликопротеины соединительной ткани
- 30. Протеогликаны
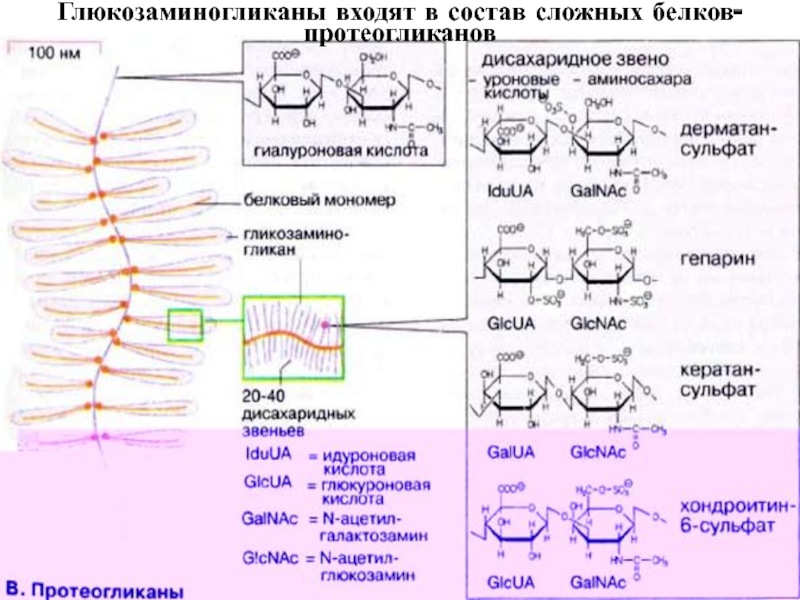
- 31. Структура мономера гликозамингликанов{Уроновая кислота или галактоза-O-Ацетилир. или (и) гликозилир. гексозамин}n
- 32. СОСТАВ ГЛЮКОЗАМИНГЛИКАНОВНазвание глюкозамин-гликанаДисахаридный мономер
- 33. Глюкозаминогликаны входят в состав сложных белков- протеогликанов
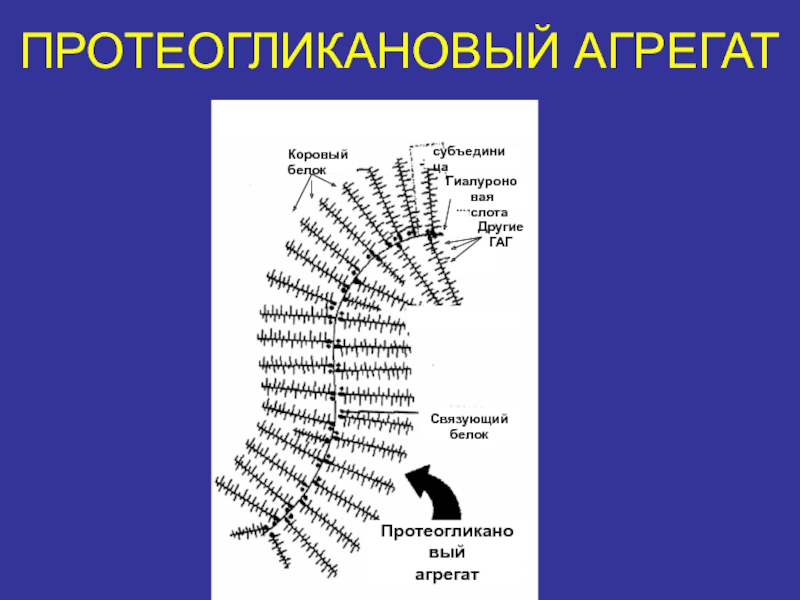
- 34. ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТКоровыйбелоксубъединицаГиалуроноваякислотаДругие ГАГСвязующийбелокПротеогликановыйагрегат
- 35. Функции протеогликановДепонирование воды,Депонирование жира (адипоциты)Депонирование осмотически активных
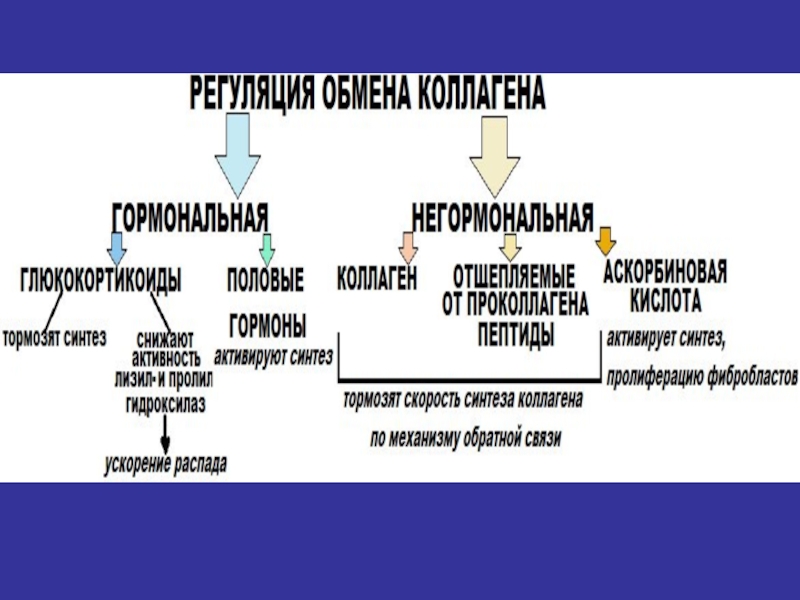
- 36. Особенности метаболизма соединительной ткани1. Низкая скорость обновления
- 37. Особенности метаболизма соединительной ткани2. Возрастные изменения метаболизма
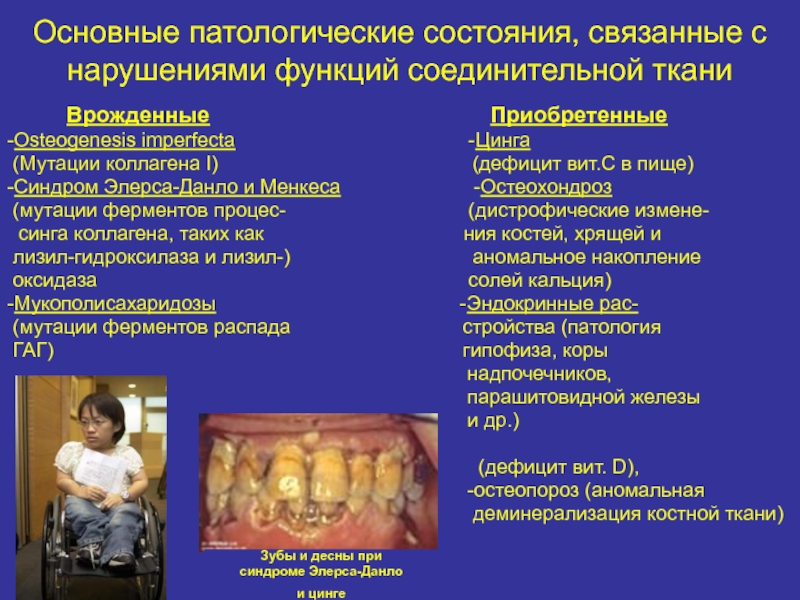
- 38. Основные патологические состояния, связанные с нарушениями функций
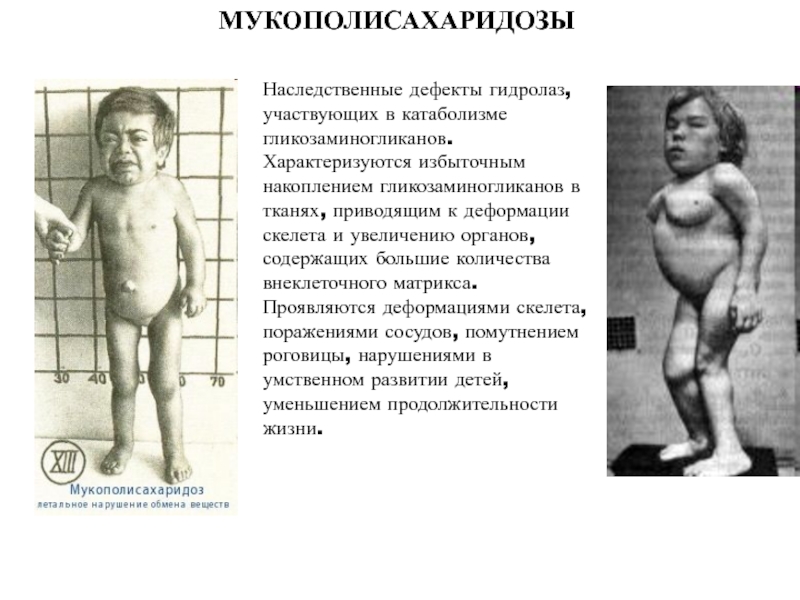
- 39. МУКОПОЛИСАХАРИДОЗЫНаследственные дефекты гидролаз, участвующих в катаболизме гликозаминогликанов.
- 40. Слайд 40
- 41. Слайд 41
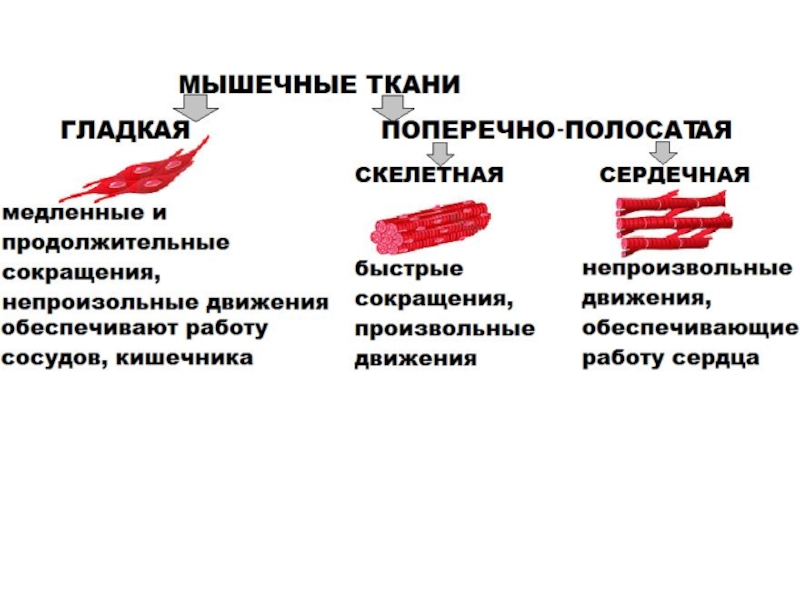
- 42. БИОХИМИЯ МЫШЦ
- 43. Функции мышцЛокомоторная2. Обеспечение подвижности организма и сопротивление
- 44. Слайд 44
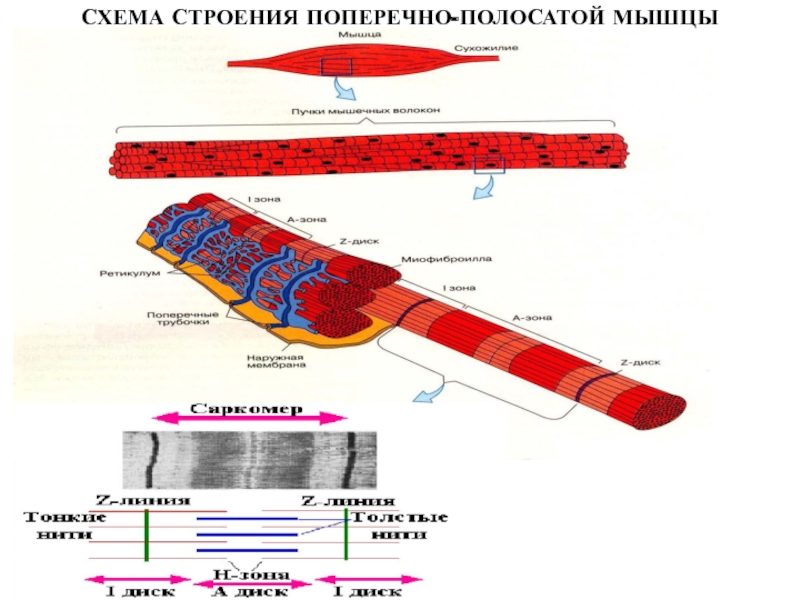
- 45. СХЕМА СТРОЕНИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ
- 46. ХИМИЧЕСКИЙ СОСТАВ ПОПЕРЕЧНО-ПОЛОСАТЫХ МЫШЦ
- 47. МИОЗИН- гексамер, фибриллярный белокФункции миозина:▪структурная ▪каталитическая ▪контактная
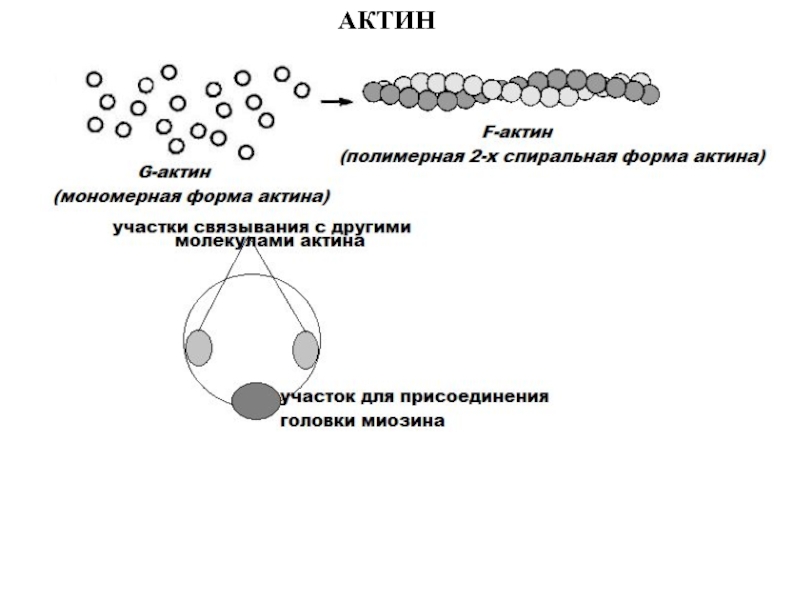
- 48. АКТИН
- 49. Тропомиозин состоит из двух α-спиралей закрученных друг
- 50. Слайд 50
- 51. Сокращение и расслабление мышц- энергозависимые процессы. Непосредственным
- 52. Состояние покоя- нет контакта актина с миозином,
- 53. Поступает сигнал- импульсы двигательного нерва, происходит освобождение
- 54. Под действием импульса двигательного нерва, происходит освобождение
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Структурные разновидности соединительной ткани
Жировая
клетчатка
хрящи
Клапаны
сердца
сухожилия
кости
фасции
нейроглия
зубы
десны
перегородки
Стенки
сосудов
Слайд 3ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Структурная
Универсальный биологический клей
Обеспечение постоянства тканевой проницаемости
Обеспечение водно-солевого
равновесия
Защитная функция
Депонирующая функция
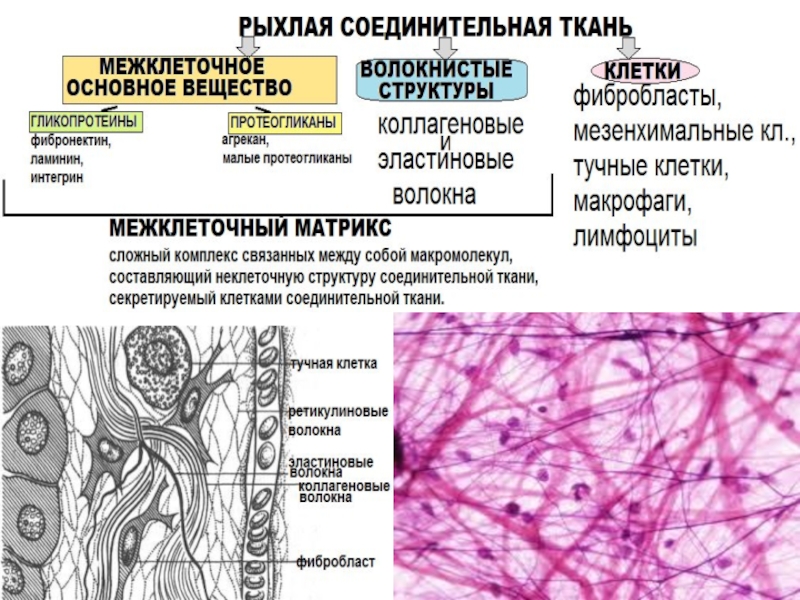
Слайд 6Коллаген
Самый распространенный белок (25-33% всех белков организма)
Входит в состав коллагеновых
волокон
Самый прочный белок
Водонерастворимый, но набухающий белок
Мультимерный белок(субъединица–тропоколлаген)
Выполняет структурную и минерализующую
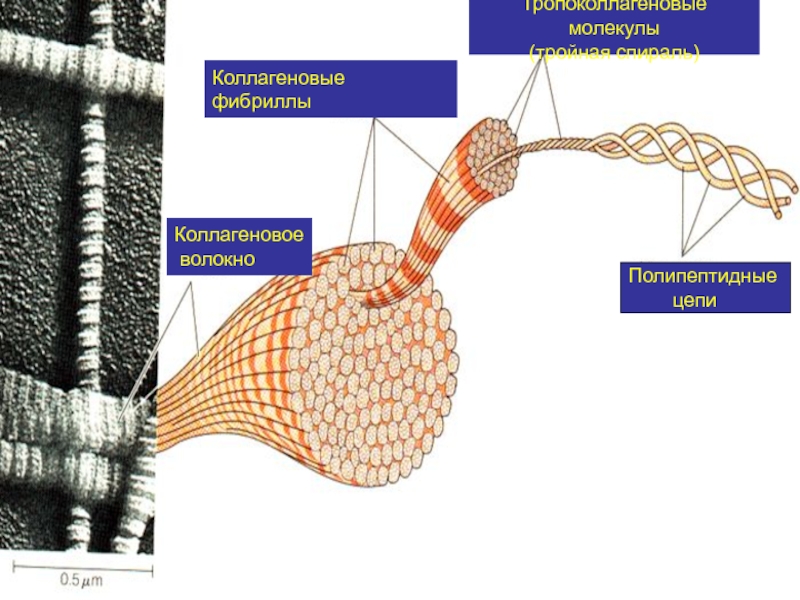
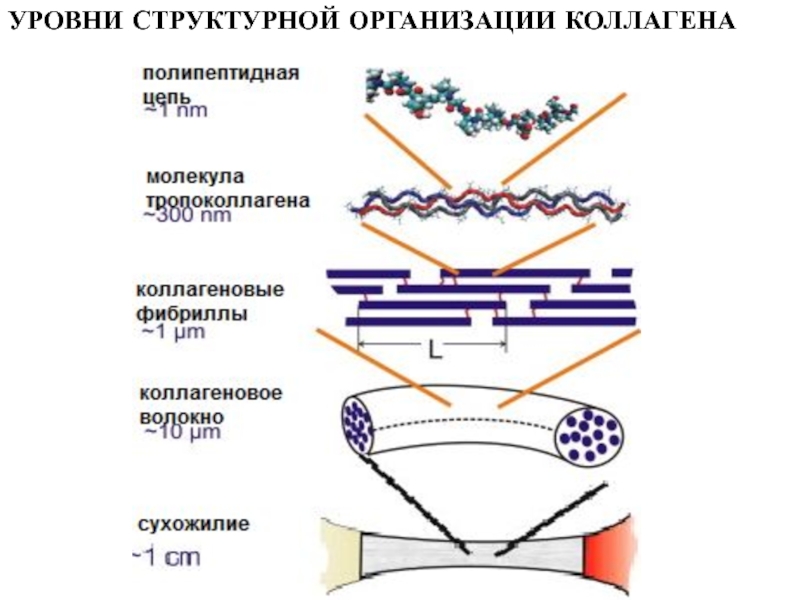
функциюСлайд 7Полипептидные
цепи
Тропоколлагеновые молекулы
(тройная спираль)
Коллагеновые фибриллы
Коллагеновое
волокно
Слайд 8Первичная структура коллагена
-мало или совсем нет триптофана, цистеина
-каждая третья аминокислота–
глицин,
-содержание пролина и гидроксипролина колеблется от 14 до 23%,
- высока
доля лизина и гидрокслизина-наиболее часто повторяемый фрагмент первичной структуры – [гли-про-Х], где Х – какая-либо из остальных аминокислот.
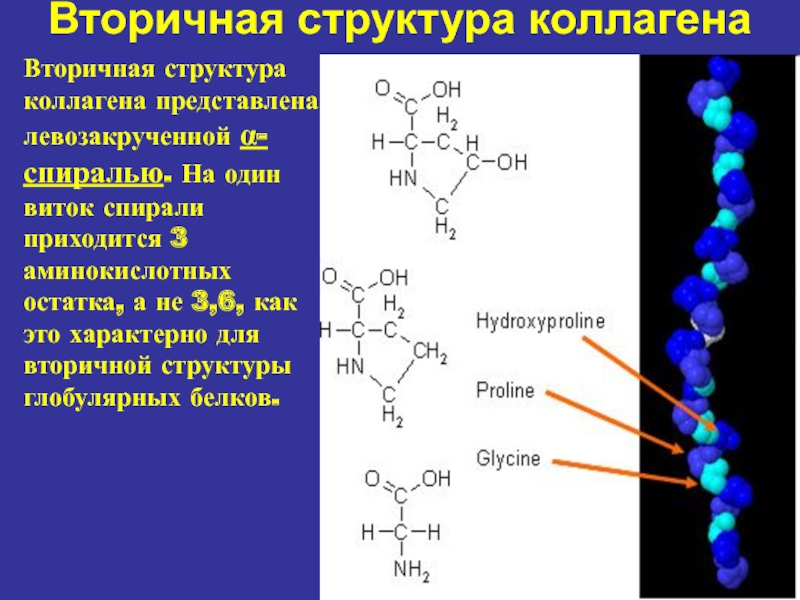
Слайд 9Вторичная структура коллагена
Вторичная структура коллагена представлена левозакрученной α-спиралью. На
один виток спирали приходится 3 аминокислотных остатка, а не 3,6,
как это характерно для вторичной структуры глобулярных белков.Слайд 10Третичная структура коллагена
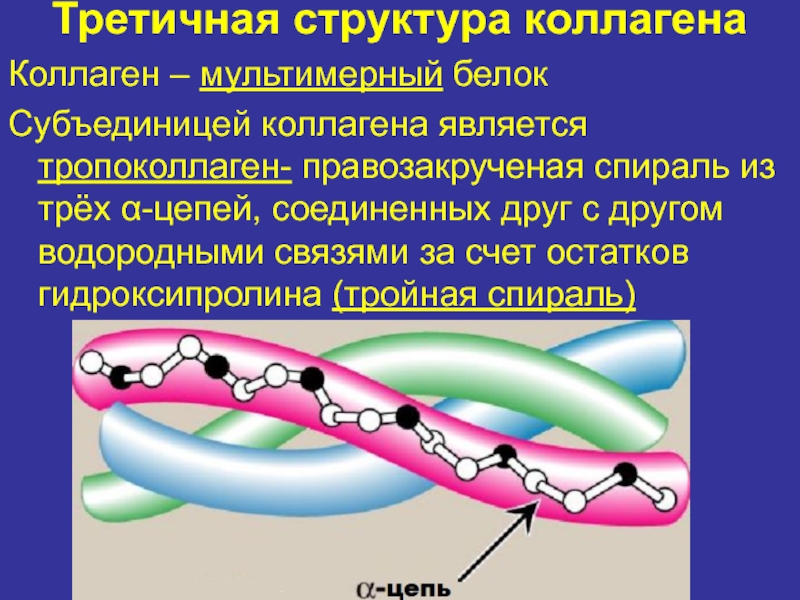
Коллаген – мультимерный белок
Субъединицей коллагена является тропоколлаген- правозакрученая
спираль из трёх α-цепей, соединенных друг с другом водородными связями
за счет остатков гидроксипролина (тройная спираль)Слайд 11Четвертичная структура коллагена
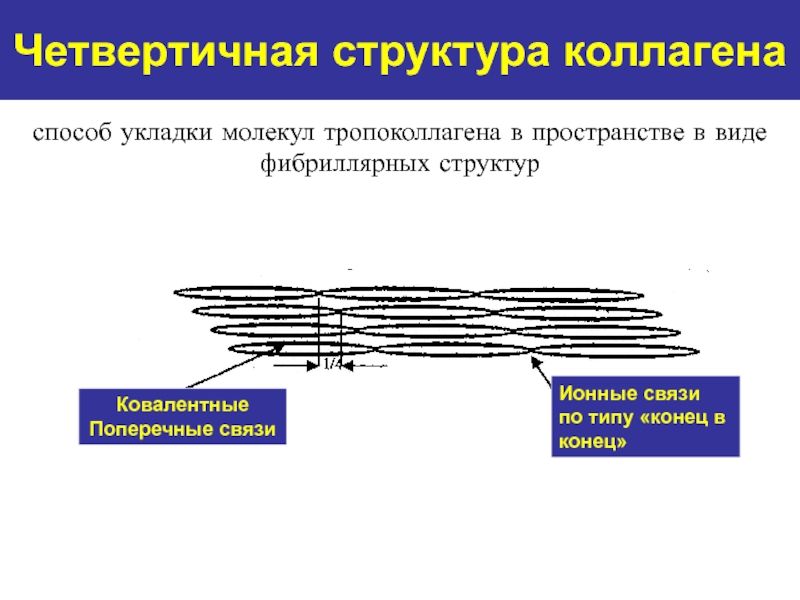
Ковалентные
Поперечные связи
Ионные связи
по типу «конец в
конец»
способ
укладки молекул тропоколлагена в пространстве в виде фибриллярных структур
Слайд 15
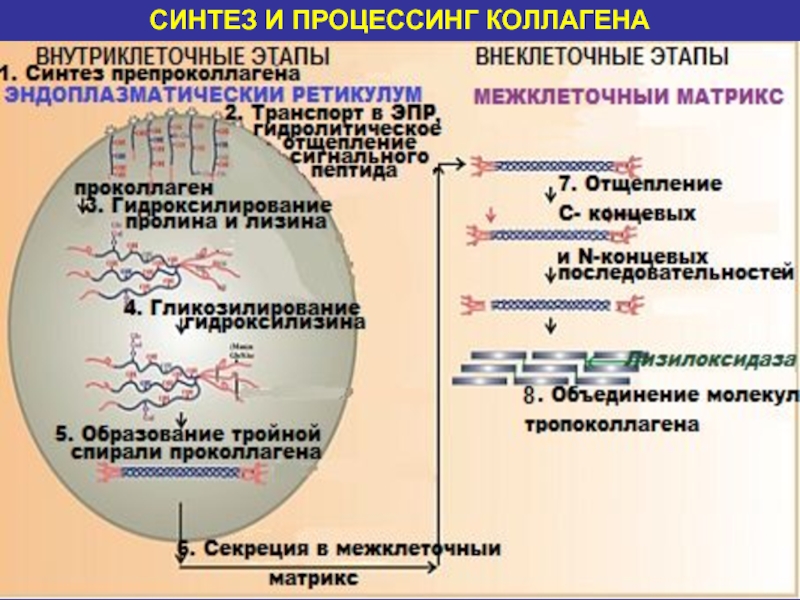
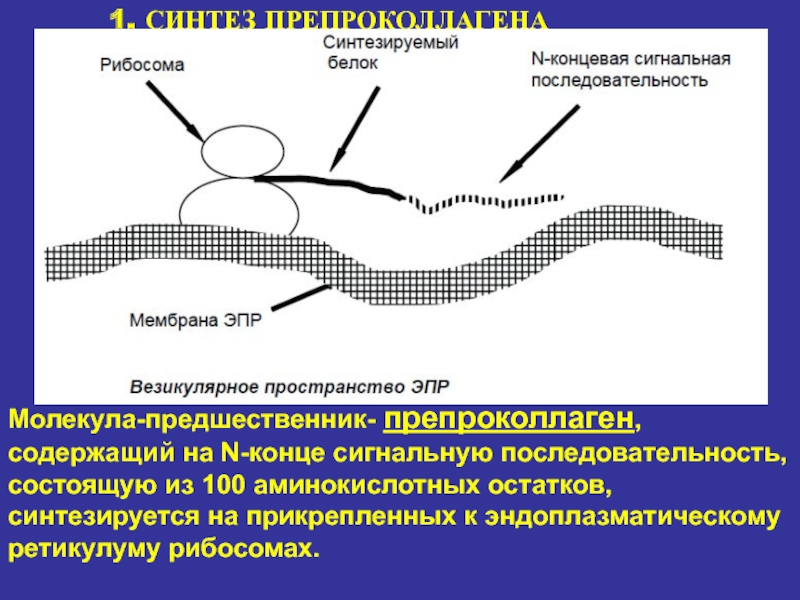
1. СИНТЕЗ ПРЕПРОКОЛЛАГЕНА
Молекула-предшественник- препроколлаген, содержащий на N-конце сигнальную последовательность, состоящую
из 100 аминокислотных остатков, синтезируется на прикрепленных к эндоплазматическому ретикулуму
рибосомах.Слайд 16
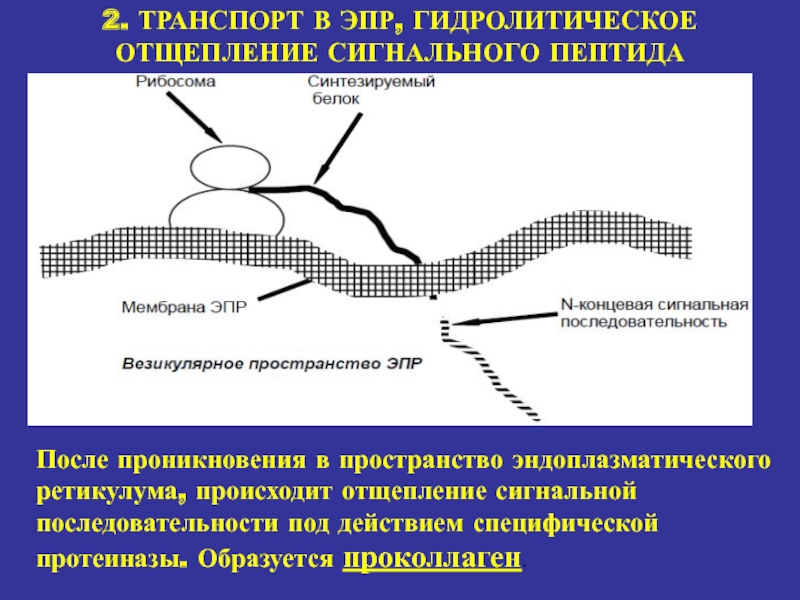
2. ТРАНСПОРТ В ЭПР, ГИДРОЛИТИЧЕСКОЕ ОТЩЕПЛЕНИЕ СИГНАЛЬНОГО ПЕПТИДА
После проникновения в
пространство эндоплазматического ретикулума, происходит отщепление сигнальной последовательности под действием специфической
протеиназы. Образуется проколлаген.Слайд 17
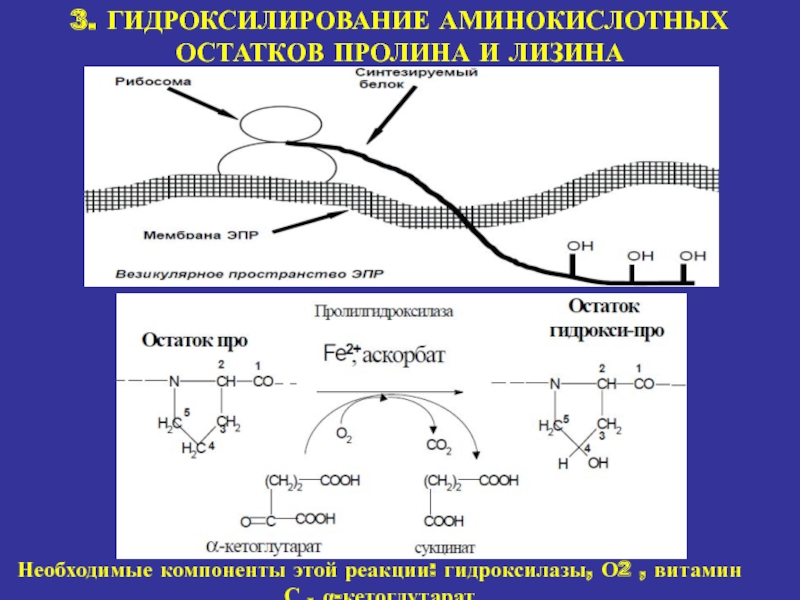
3. ГИДРОКСИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ПРОЛИНА И ЛИЗИНА
Необходимые компоненты этой реакции:
гидроксилазы, О2 , витамин С , α-кетоглутарат
Слайд 18
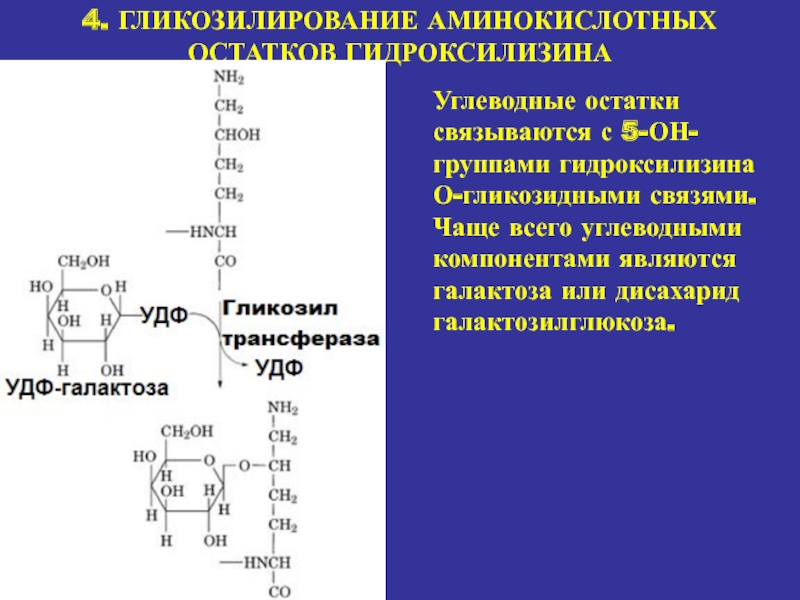
4. ГЛИКОЗИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ГИДРОКСИЛИЗИНА
Углеводные остатки связываются с 5-ОН-группами гидроксилизина
О-гликозидными связями. Чаще всего углеводными компонентами являются галактоза или дисахарид
галактозилглюкоза.Слайд 19
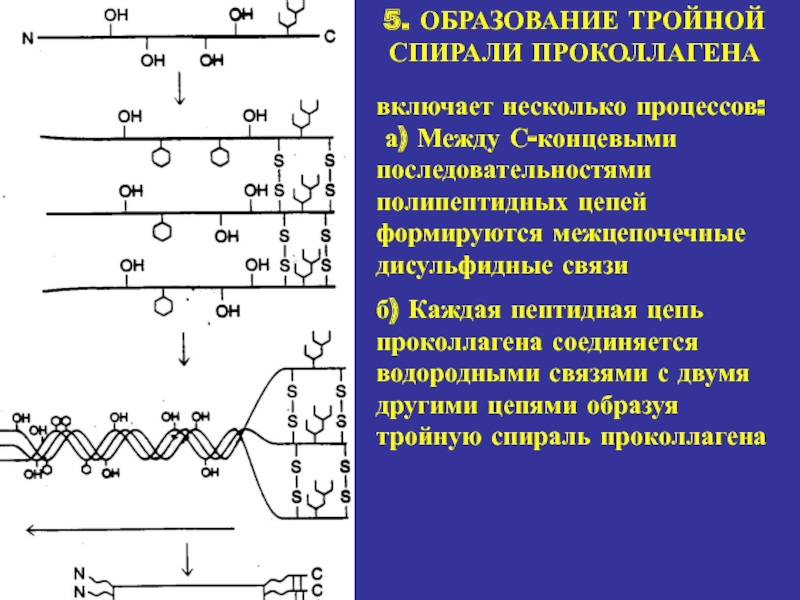
5. ОБРАЗОВАНИЕ ТРОЙНОЙ СПИРАЛИ ПРОКОЛЛАГЕНА
включает несколько процессов:
а) Между
С-концевыми последовательностями полипептидных цепей формируются межцепочечные дисульфидные связи
б) Каждая
пептидная цепь проколлагена соединяется водородными связями с двумя другими цепями образуя тройную спираль проколлагена Слайд 20
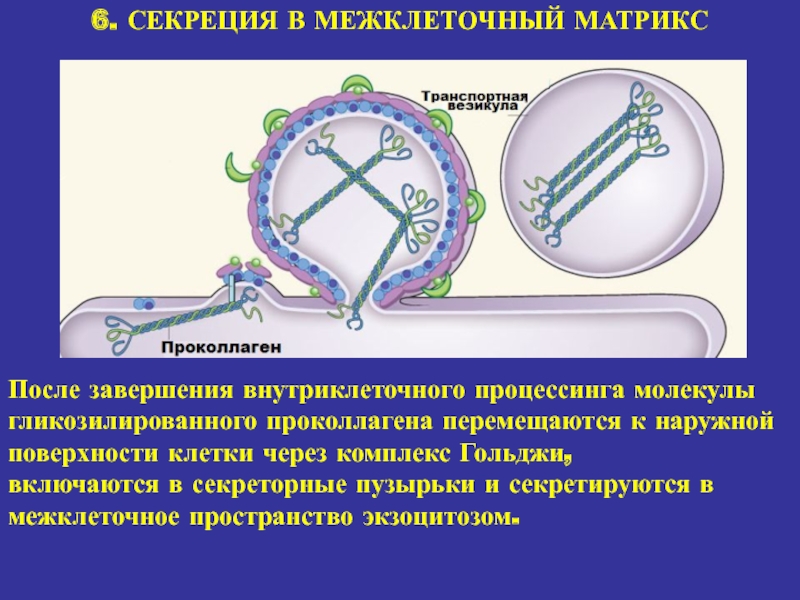
6. СЕКРЕЦИЯ В МЕЖКЛЕТОЧНЫЙ МАТРИКС
После завершения внутриклеточного процессинга молекулы гликозилированного
проколлагена перемещаются к наружной поверхности клетки через комплекс Гольджи,
включаются в
секреторные пузырьки и секретируются в межклеточное пространство экзоцитозом. Слайд 21
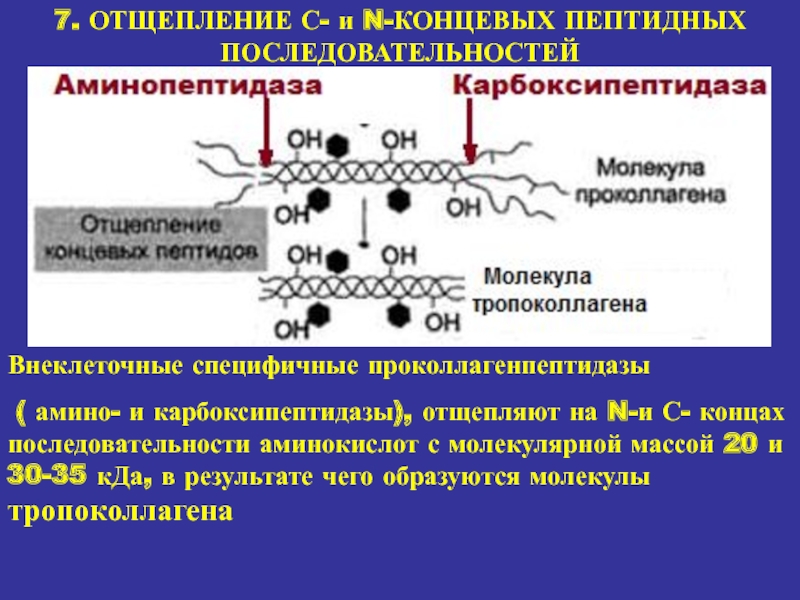
7. ОТЩЕПЛЕНИЕ С- и N-КОНЦЕВЫХ ПЕПТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Внеклеточные специфичные проколлагенпептидазы
(
амино- и карбоксипептидазы), отщепляют на N-и С- концах последовательности аминокислот
с молекулярной массой 20 и 30-35 кДа, в результате чего образуются молекулы тропоколлагенаСлайд 22
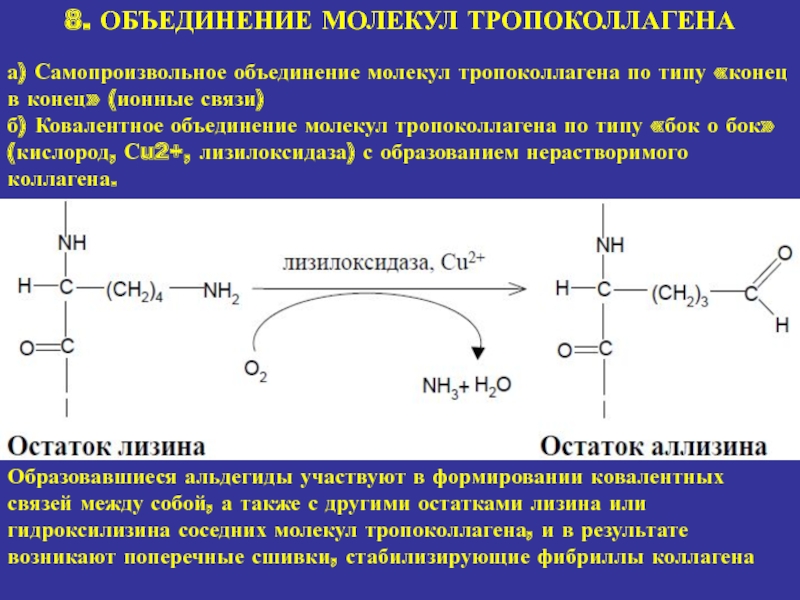
8. ОБЪЕДИНЕНИЕ МОЛЕКУЛ ТРОПОКОЛЛАГЕНА
а) Самопроизвольное объединение молекул тропоколлагена по типу
«конец в конец» (ионные связи)
б) Ковалентное объединение молекул тропоколлагена
по типу «бок о бок» (кислород, Сu2+, лизилоксидаза) с образованием нерастворимого коллагена. Образовавшиеся альдегиды участвуют в формировании ковалентных связей между собой, а также с другими остатками лизина или гидроксилизина соседних молекул тропоколлагена, и в результате возникают поперечные сшивки, стабилизирующие фибриллы коллагена
Слайд 25Эластин- основной белок
эластических волокон, которые
содержатся в межклеточном веществе
кожи,
стенок кровеносных сосудов,
связок, лёгких, желчного пузыря,
мочевого пузыря,
кишечника,(тканей, которые могут растягиваться).
преобладают аминокислоты с неполярными радикалами: глицин, валин, аланин
много пролина и лизина
нет гидроксилизина
мало гидроксипролина
- не формируют регулярные вторичную и третичную структуры
Слайд 31Структура мономера гликозамингликанов
{Уроновая кислота или галактоза-O-
Ацетилир. или (и) гликозилир. гексозамин}n
Слайд 34ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТ
Коровый
белок
субъединица
Гиалуроновая
кислота
Другие
ГАГ
Связующий
белок
Протеогликановый
агрегат
Слайд 35Функции протеогликанов
Депонирование воды,
Депонирование жира (адипоциты)
Депонирование осмотически активных ионов (Na+, Cl-),
Формирование
тургора ткани,
Минерализационная роль (связывание Ca2+ в кости и зубе),
Формирование гисто-гематических
барьеров,Противосвертывающая функция (гепарин)
Защитная функция (сайты связывания иммуноглобулинов)
Слайд 36Особенности метаболизма соединительной ткани
1. Низкая скорость обновления всех молекул
(более длительный период полураспада
по сравнению с другими тканями). Например:- τ1/2 белков печени, почек, легких ~ 5 дней
- τ1/2 альбуминов плазмы крови ~ 7-26 дней,
- τ1/2 коллагена кости ~ 10 лет
Слайд 37Особенности метаболизма соединительной ткани
2. Возрастные изменения метаболизма соединительной ткани:
-снижение количества
ГАГ,
-снижение отношения ХС/KС (12.0 – дети; 0.95 – старше
60 лет),-увеличение отношения коллаген/эластин,
-увеличение числа поперечных сшивок в коллагене,
-увеличение резистентности коллагена к протеолизу,
-снижение уровня экскреции оксипролина с мочой,
-снижение содержания воды (тургор),
-аномальное накопление солей кальция и
других труднорастворимых солей,
-накопление липофусцина,
-накопление гликозилированных белков (белков Амадори)
-развитие пародонтоза и выпадение зубов
Слайд 38Основные патологические состояния, связанные с нарушениями функций соединительной ткани
Врожденные
Приобретенные-Osteogenesis imperfecta -Цинга
(Мутации коллагена I) (дефицит вит.С в пище)
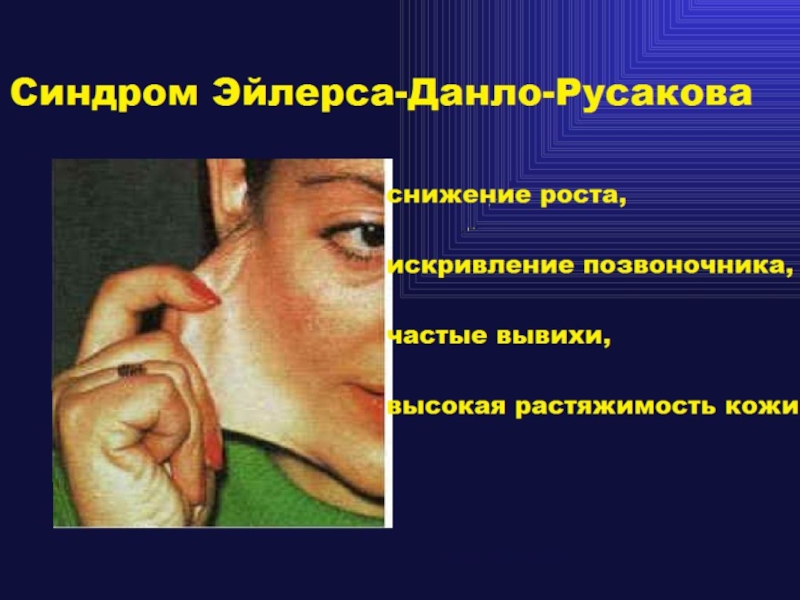
-Синдром Элерса-Данло и Менкеса -Остеохондроз
(мутации ферментов процес- (дистрофические измене-
синга коллагена, таких как ния костей, хрящей и
лизил-гидроксилаза и лизил-) аномальное накопление
оксидаза солей кальция)
-Мукополисахаридозы -Эндокринные рас-
(мутации ферментов распада стройства (патология
ГАГ) гипофиза, коры
надпочечников,
парашитовидной железы
и др.)
-Рахит
(дефицит вит. D),
-остеопороз (аномальная
деминерализация костной ткани)
Зубы и десны при
синдроме Элерса-Данло
и цинге
Слайд 39МУКОПОЛИСАХАРИДОЗЫ
Наследственные дефекты гидролаз, участвующих в катаболизме гликозаминогликанов. Характеризуются избыточным накоплением
гликозаминогликанов в тканях, приводящим к деформации скелета и увеличению органов,
содержащих большие количества внеклеточного матрикса. Проявляются деформациями скелета, поражениями сосудов, помутнением роговицы, нарушениями в умственном развитии детей, уменьшением продолжительности жизни.Слайд 43Функции мышц
Локомоторная
2. Обеспечение подвижности организма и сопротивление механической силе, в
том числе и статическим нагрузкам
3. Теплопродукции
4. Место утилизации глюкозы и
нейтральных жиров (ТАГ)5. Резерв белков
6. Место депонирования кислорода (миоглобин)
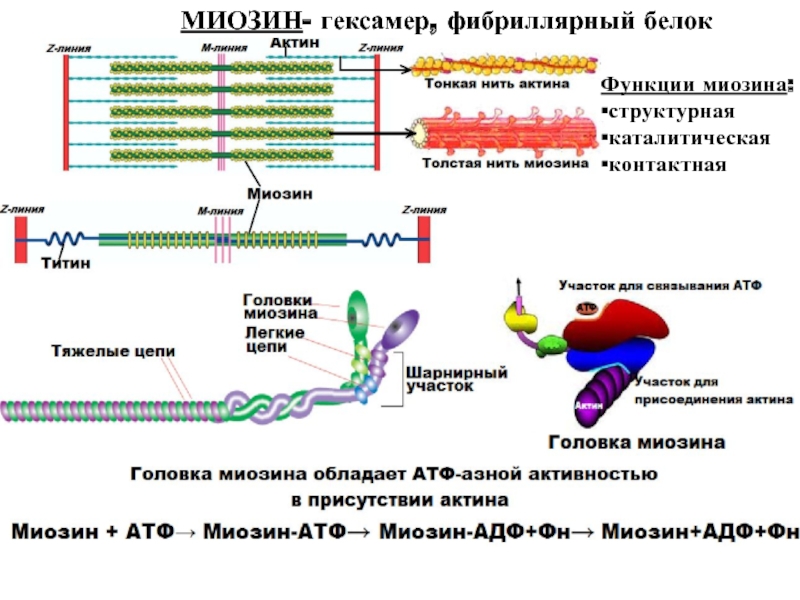
Слайд 47МИОЗИН- гексамер, фибриллярный белок
Функции миозина:
▪структурная ▪каталитическая ▪контактная
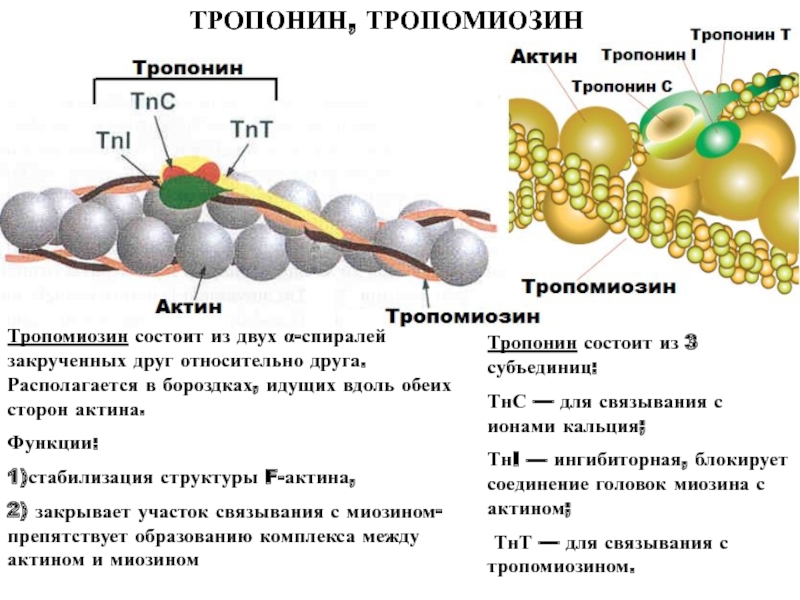
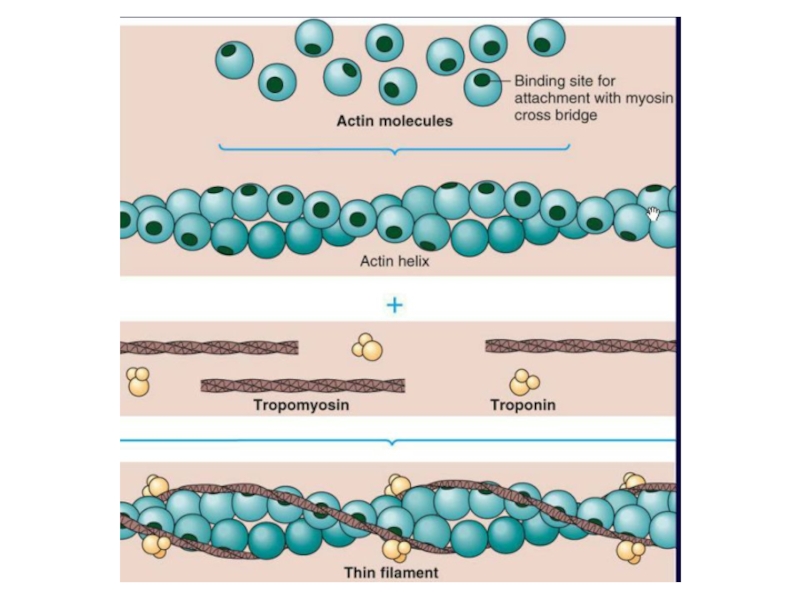
Слайд 49Тропомиозин состоит из двух α-спиралей закрученных друг относительно друга. Располагается
в бороздках, идущих вдоль обеих сторон актина.
Функции:
1)стабилизация структуры F-актина,
2)
закрывает участок связывания с миозином- препятствует образованию комплекса между актином и миозином Тропонин состоит из 3 субъединиц:
ТнС — для связывания с ионами кальция;
ТнI — ингибиторная, блокирует соединение головок миозина с актином;
ТнТ — для связывания с тропомиозином.
ТРОПОНИН, ТРОПОМИОЗИН
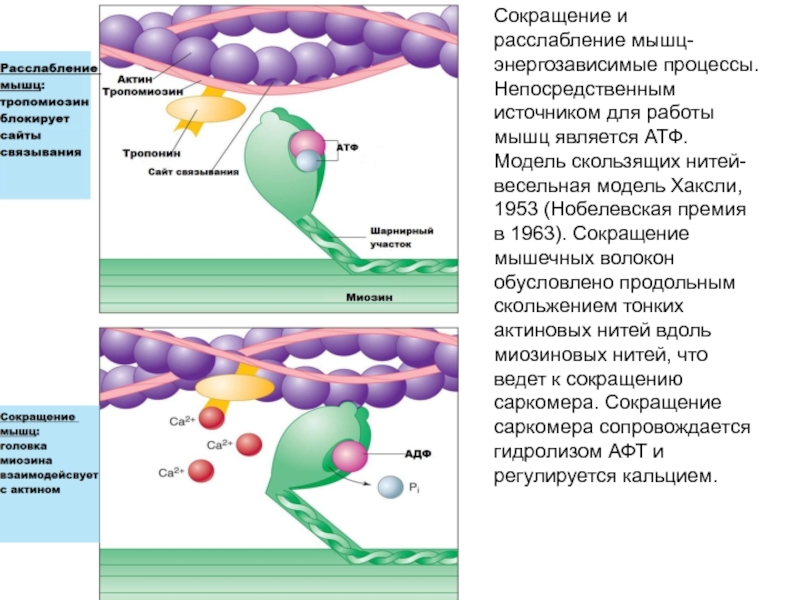
Слайд 51Сокращение и расслабление мышц- энергозависимые процессы. Непосредственным источником для работы
мышц является АТФ. Модель скользящих нитей- весельная модель Хаксли, 1953
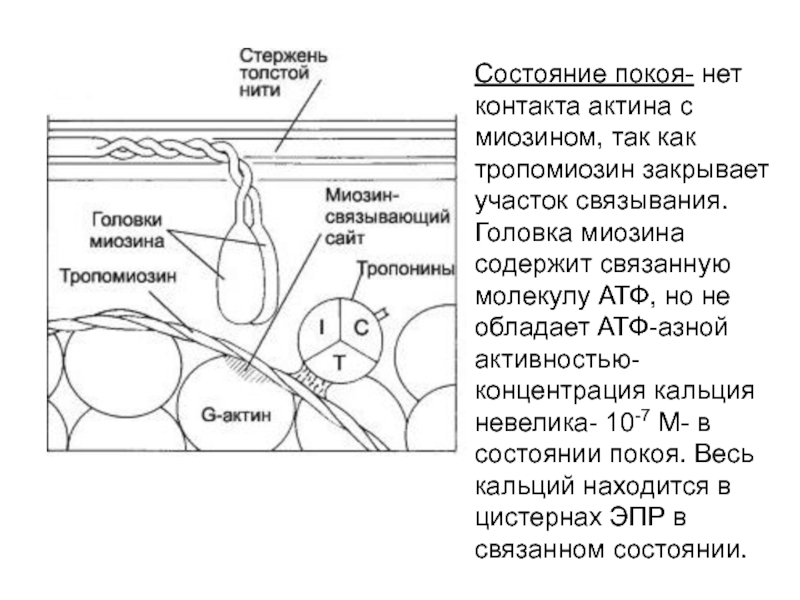
(Нобелевская премия в 1963). Сокращение мышечных волокон обусловлено продольным скольжением тонких актиновых нитей вдоль миозиновых нитей, что ведет к сокращению саркомера. Сокращение саркомера сопровождается гидролизом АФТ и регулируется кальцием.Слайд 52Состояние покоя- нет контакта актина с миозином, так как тропомиозин
закрывает участок связывания. Головка миозина содержит связанную молекулу АТФ, но
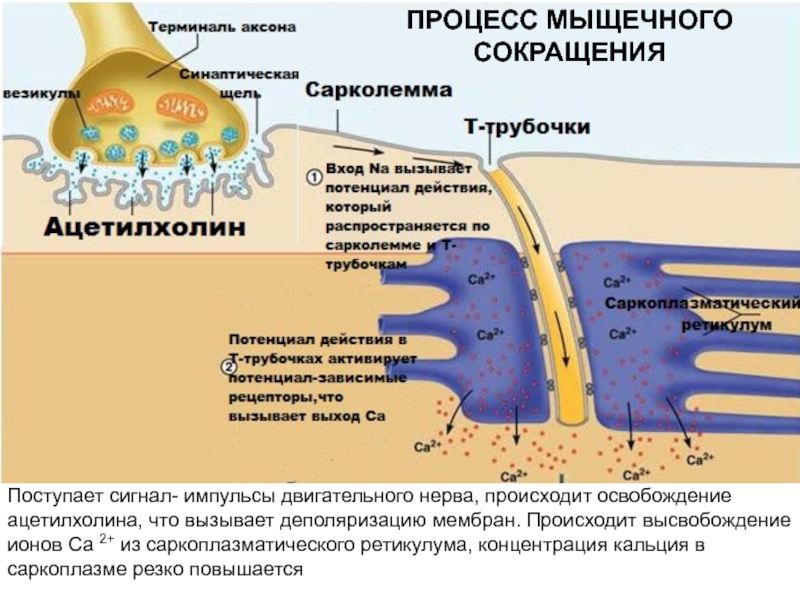
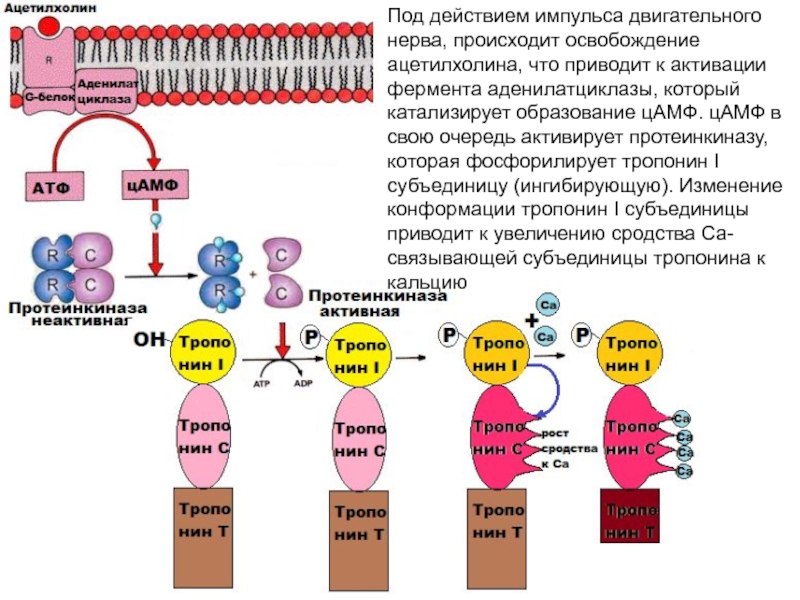
не обладает АТФ-азной активностью- концентрация кальция невелика- 10-7 М- в состоянии покоя. Весь кальций находится в цистернах ЭПР в связанном состоянии.Слайд 53Поступает сигнал- импульсы двигательного нерва, происходит освобождение ацетилхолина, что вызывает
деполяризацию мембран. Происходит высвобождение ионов Са 2+ из саркоплазматического ретикулума,
концентрация кальция в саркоплазме резко повышаетсяПРОЦЕСС МЫЩЕЧНОГО СОКРАЩЕНИЯ