вызываются силы, удерживающие их
Аналитически задача решается полностью только в
случае простейших атомов H и He
Два приближения
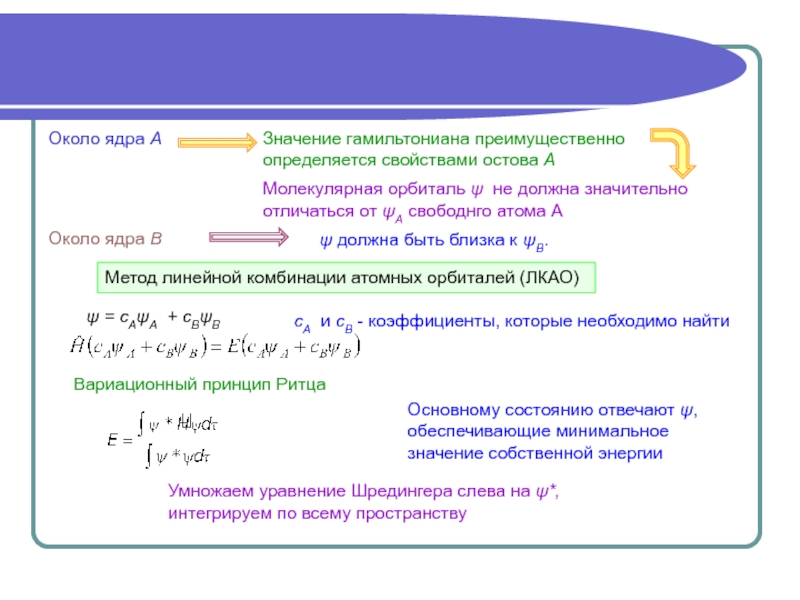
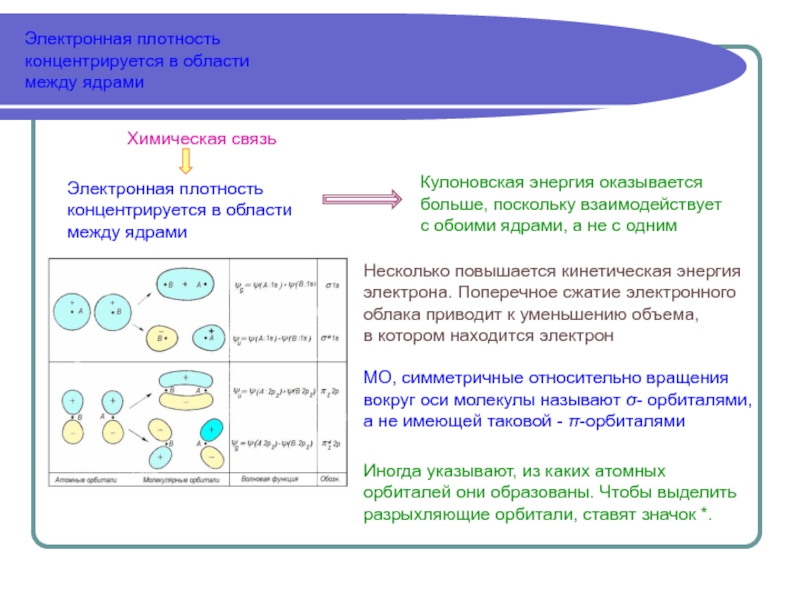
4.3.3.А. Метод молекулярных орбиталей
Одноэлектронное приближение
Вопросы
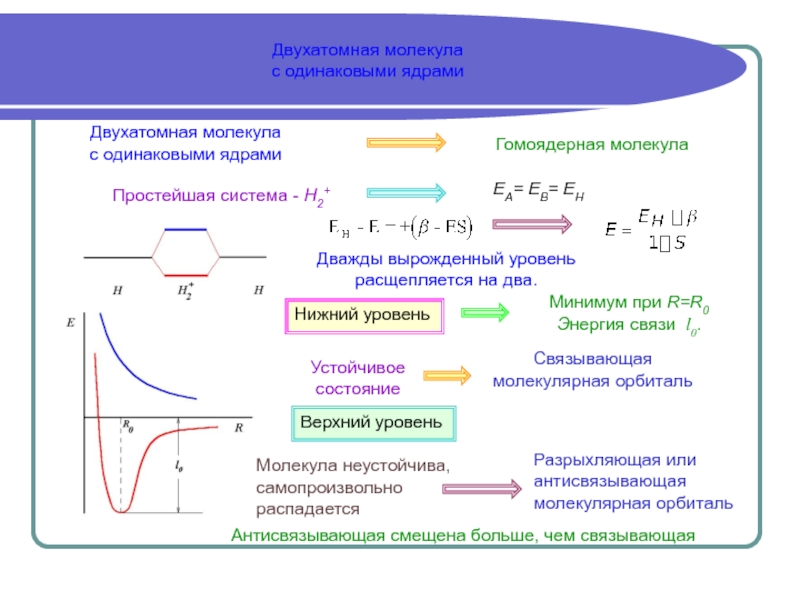
Почему одни атомы способны объединиться, а другие - нет
Какова величина энергии связи
Можно получить рассчитав электронную структуру образований
Ответ
Метод молекулярных орбиталей (ММО
Метод валентных связей (МВС).
Как и в случае атома
Движение данного электрона в некотором усредненном поле, создаваемом ядрами и остальными электронами.