Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ Лекция 3. Ферменты - строение, механизм
Содержание
- 1. 1 БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ Лекция 3. Ферменты - строение, механизм
- 2. План лекцииФерменты – биокатализаторы. Сходство и отличия
- 3. Ферменты - биокатализаторы Практически все реакции в живом
- 4. Ферменты - биокатализаторы Ферменты, энзимы – это белки,
- 5. Ферменты - биокатализаторы Ферменты - строение, механизм
- 6. Ферменты - биокатализаторы1. катализируют только энергетически возможные
- 7. Ферменты - биокатализаторы1. скорость ферментативных реакций выше,
- 8. Ферменты - биокатализаторы Ферменты - строение, механизм действия, свойства, регуляцияВысокая каталитическая активность ферментов
- 9. Структурная организация ферментов Ферменты
- 10. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Структура ферментов
- 11. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Кофакторы
- 12. Кофакторы - производные витаминов Ферменты - строение, механизм действия, свойства, регуляция
- 13. Кофакторы - производные витаминов Ферменты - строение, механизм действия, свойства, регуляция
- 14. Кофакторы - производные витаминов
- 15. Кофакторы Ферменты - строение, механизм
- 16. Кофакторы Ферменты - строение, механизм действия, свойства, регуляция Невитаминные кофакторы
- 17. Кофакторы Ферменты - строение, механизм действия, свойства, регуляция Невитаминные кофакторы
- 18. Структурная организация ферментов
- 19. Структурная организация ферментов
- 20. Структурная организация ферментов
- 21. Структурная организация ферментов
- 22. Структурная организация ферментов
- 23. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Аллостерические центры
- 24. Механизм действия ферментов Ферменты - строение, механизм
- 25. Механизм действия ферментов Ферменты - строение, механизм действия, свойства, регуляцияСтадии ферментативного катализа
- 26. Механизм действия ферментов Ферменты - строение, механизм
- 27. Механизм действия ферментов Ферменты - строение,
- 28. Свойства ферментов Ферменты - строение, механизм действия,
- 29. Свойства ферментов Ферменты - строение, механизм действия, свойства, регуляция Влияние рН на скорость ферментативной реакции
- 30. Свойства ферментов Ферменты - строение, механизм действия, свойства, регуляциярН-оптимумы для некоторых ферментов
- 31. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия, свойства, регуляцияЗависимость скорости ферментативной реакции от концентрации субстратаУравнение Михаэлиса-Ментен
- 32. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия,
- 33. Ферменты - строение, механизм действия, свойства Уравнение
- 34. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия,
- 35. Ферменты - строение, механизм действия, свойства, регуляцияУравнение Михаэлиса-МентенМетод Лайнуивера-Берка (метод двойных обратных величин)
- 36. Единицы ферментов Ферменты - строение, механизм действия,
- 37. Специфичность ферментов Ферменты - строение, механизм действия,
- 38. Специфичность ферментовФерменты - строение, механизм действия, свойства,
- 39. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Ферменты, проявляющие абсолютную специфичностьКарбоангидразаЛактазаСахаразаМальтазаГлюкокиназа
- 40. Специфичность ферментов Ферменты - строение, механизм действия,
- 41. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляцияОтносительная специфичность ферментов
- 42. Специфичность ферментовФерменты - строение, механизм действия, свойства, регуляцияОтносительная специфичность ферментов
- 43. Активаторы и ингибиторы ферментов Активаторы
- 44. Активаторы ферментов Ферменты - строение, механизм
- 45. Активаторы ферментов Ферменты - строение,
- 46. Активаторы ферментов Ферменты - строение,
- 47. Активаторы ферментов Ферменты - строение,
- 48. Ингибиторы ферментов Ингибиторы ферментовИнгибиторы - вещества,
- 49. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляцияНеобратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом
- 50. Ингибиторы ферментов Ферменты - строение,
- 51. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляцияСравнение конкурентного и неконкурентного ингибитора
- 52. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляцияОбратимое неконкурентное ингибирование
- 53. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляцияОбратимое конкурентное ингибирование сукцинатдегидрогеназы
- 54. Ингибиторы ферментов Ферменты - строение, механизм
- 55. Ингибиторы ферментов Ферменты - строение,
- 56. Регуляция активности ферментов1. Изменение количества ферментного белка
- 57. Регуляция активности ферментов Основные виды: аллостерическая
- 58. Регуляция активности ферментов Ферменты - строение, механизм
- 59. Регуляция активности ферментов Ферменты - строение, механизм
- 60. Регуляция активности ферментов Ферменты - строение,
- 61. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляцияКовалентная модификация (фосфорилирование - дефосфорилирование)
- 62. Регуляция активности ферментов
- 63. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляцияМеханизм активации трипсиногена быка
- 64. Классификация ферментовКлассификация и номенклатура ферментов1. Оксидоредуктазы 2. Tрансферазы3. Гидролазы4. Лиазы5. Изомеразы6. Лигазы (синтетазы)Классы ферментов
- 65. Классификация ферментов Ферменты - строение,
- 66. Номенклатура ферментовКлассификация и номенклатура ферментовКаждому ферменту присвоен
- 67. Классы ферментовКлассификация и номенклатура ферментов
- 68. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
Лекция 3. Ферменты - строение, механизм действия,
свойства, регуляция
Слайд 2План лекции
Ферменты – биокатализаторы. Сходство и отличия с небиологическими катализаторами
Структурная
организация ферментов
Кофакторы
Активные и аллостерические центры
Механизм действия ферментов
Свойства ферментов: влияние температуры
и рН на активность ферментовСпецифичность действия ферментов
Активаторы и ингибиторы ферментов
Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Слайд 3Ферменты - биокатализаторы
Практически все реакции в живом организме протекают с
участием природных биокатализаторов, называемых ферментами, или энзимами.
Слово «фермент» происходит
от лат. fеrmеntum - закваска, а «энзим» - от греч. еп - в, внутри и zyme – дрожжи. Данная терминология возникла исторически при изучении ферментативных процессов спиртового брожения.В настоящее время известно более 5600
ферментов.
Ферменты - строение, механизм действия, свойства, регуляция
Слайд 4Ферменты - биокатализаторы
Ферменты, энзимы – это белки, действующие как специфические
высокоэффективные катализаторы химических реакций, протекающих в живых организмах.
Посредством ферментов
реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в клетках. В отсутствие ферментов большинство химических реакций клеточного метаболизма не может происходить, и поэтому жизнь без ферментов невозможна. Ферменты - строение, механизм действия, свойства, регуляция
Слайд 5Ферменты - биокатализаторы
Ферменты - строение, механизм действия, свойства, регуляция
Рибозимы – рибонуклеиновые кислоты,
Проявляющие свойства катализаторов.
За открытие каталитических свойств
РНК Т. Чеку и С. Ольтману в 2989 году присуждена
Нобелевская премия по химии.
Слайд 6Ферменты - биокатализаторы
1. катализируют только энергетически возможные реакции, т.е. те
реакции которые могут протекать и без них;
2. не изменяют направление
реакции;3. не сдвигают равновесие обратимой реакции, а лишь ускоряют его наступление;
4. не расходуются в процессе реакции и выходят из реакции в первоначальном виде.
Ферменты - строение, механизм действия, свойства
Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты:
Слайд 7Ферменты - биокатализаторы
1. скорость ферментативных реакций выше, чем реакций, катализируемых
небелковыми катализаторами (эффективность действия ферментов).
2. ферменты обладают высокой специфичностью
действия;3. ферменты катализируют реакции в очень мягких условиях (обычное давление, нейтральная рН, невысокая t);
4. активность ферментов в клетках строго регулируется как на генетическом уровне, так и посредством определённых низкомолекулярных соединений (субстраты и продукты реакций, катализируемых этими же ферментами);
5. скорость ферментативной реакции прямо пропорциональна количеству фермента.
Ферменты - строение, механизм действия, свойства
Oтличия ферментов от небиологических катализаторов:
Слайд 8Ферменты - биокатализаторы
Ферменты - строение, механизм действия, свойства, регуляция
Высокая
каталитическая активность ферментов
Слайд 9Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Молекулярная масса ферментов
Чаще всего встречаются ферменты с мол. массой
20 – 60 тысяч,более крупные обычно состоят из субъединиц одинаковых или различных. Субъединица может состоять из двух и более
полипептидных цепей, соединенных дисульфидными связями.
Слайд 10
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Структура ферментов
Слайд 11
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Кофакторы
Слайд 12
Кофакторы - производные витаминов
Ферменты - строение, механизм действия,
свойства, регуляция
Слайд 13
Кофакторы - производные витаминов
Ферменты - строение, механизм действия,
свойства, регуляция
Слайд 14
Кофакторы - производные витаминов
Ферменты - строение, механизм действия,
свойства, регуляция
Коферментная форма – тиаминпирофосфат (ТПФ)
Слайд 15
Кофакторы
Ферменты - строение, механизм действия, свойства, регуляция
Невитаминные
кофакторы
К невитаминным кофакторам относятся следующие соединения:
- Восстановленный глутатион
(GSH),АТP,
липоевая кислота,
производные нуклеозидов (уридинфосфат, цитидинфосфат,
порфиринсодержащие вещества.
Слайд 16
Кофакторы
Ферменты - строение, механизм действия, свойства, регуляция
Невитаминные
кофакторы
Слайд 17
Кофакторы
Ферменты - строение, механизм действия, свойства, регуляция
Невитаминные
кофакторы
Слайд 18
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства,
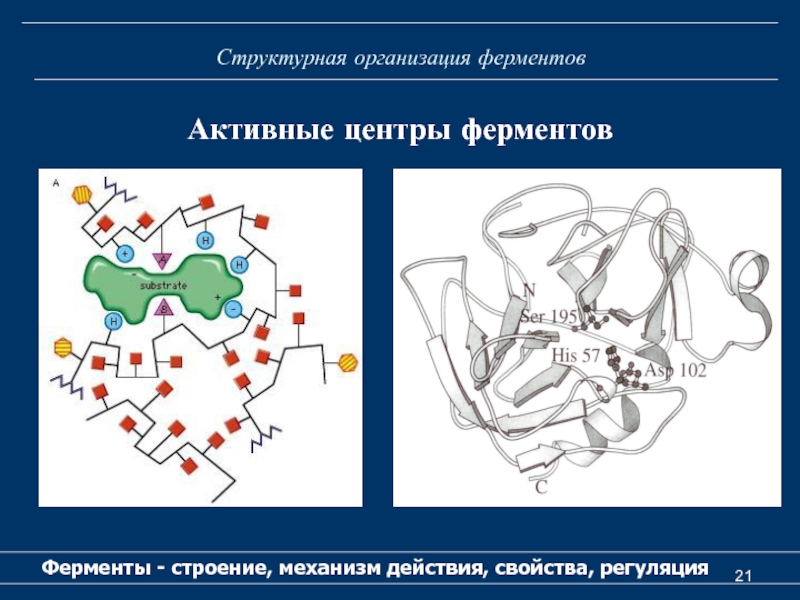
Активный центр фермента
Активный центр - участок молекулы фермента, который
предназначен для специфического связывания и каталитического превращения субстрата.
Структура активного центра фермента складывается из двух составляющих:
1) сорбционного участка (подцентра, сайта), ответственного за связывание, фиксацию и ориентацию субстратов; свойства этого центра определяют специфичность действия фермента;
2) каталитического участка (подцентра, сайта), осуществляющего химическое превращение молекул субстрата.
Слайд 19
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства,
Активный центр фермента
Слайд 20
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Активный центр у простых ферментов образует уникальная комбинация
аминокислотных остатков. У сложных ферментов в состав активного центра наряду с аминокислотными остатками входят также кофактор.
Активный центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру.
Слайд 21
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Активные центры ферментов
Слайд 22
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Аллостерический центр (или центры) (от греч. аllos -
другой, иной и steros - пространственный, структурный) - участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Слайд 23
Структурная организация ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Аллостерические центры
Слайд 24Механизм действия ферментов
Ферменты - строение, механизм действия, свойства, регуляция
I. Диффузия субстрата к ферменту и стерическое связывание его с
активным центром фермента, т.е. образование фермент-субстратного комплекса (ES).II. Преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов (ES*, ES**…);
III. Отделение продуктов (Р) реакции от активного центра и диффузия его в окружающую среду.
Стадии ферментативного катализа
Слайд 25Механизм действия ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Стадии
ферментативного катализа
Слайд 26Механизм действия ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Типы связей, участвующие в образовании фермент-субстратного комплекса
Слайд 27
Механизм действия ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Энергетический профиль ферментативной и неферментативной химических реакций
S - исходный субстрат;
Р - продукт;
ΔЕНФ - энергия активации неферментативной реакции;
ΔЕФ - энергия активации ферментативной реакции;
ΔG - стандартное изменение свободной энергии.
Слайд 28Свойства ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Влияние
температуры на скорость ферментативной реакции
Температура, при
которой каталитическая
активность фермента
максимальна,
называется температурным оптимумом ферментаСлайд 29Свойства ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Влияние
рН на скорость ферментативной реакции
Слайд 30Свойства ферментов
Ферменты - строение, механизм действия, свойства, регуляция
рН-оптимумы для
некоторых ферментов
Слайд 31Уравнение Михаэлиса-Ментен
Ферменты - строение, механизм действия, свойства, регуляция
Зависимость скорости
ферментативной реакции от концентрации субстрата
Уравнение
Михаэлиса-Ментен
Слайд 32Уравнение Михаэлиса-Ментен
Ферменты - строение, механизм действия, свойства, регуляция
Ученые –
основоположники ферментативной кинетики
Браун А., 1900
Анри В., 1902
Михаэлис Л. и
Ментен
М., 1913Бриггс Дж. и
Холден Д., 1925
Слайд 33Ферменты - строение, механизм действия, свойства
Уравнение Михаэлиса-Ментен
Км и Vmax
- важнейшие характеристики ферментов
Км - константа Михаэлиса - это
концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной. Км – мера сродства фермента к субстрату. Чем меньше Км, тем больше сродство фермента к субстрату, тем выше скорость реакции и наоборот, чем больше Кm, тем меньше сродство фермента к субстрату, тем медленнее идет реакция.
Слайд 34Уравнение Михаэлиса-Ментен
Ферменты - строение, механизм действия, свойства, регуляция
Для большинства
ферментативных реакций Км колеблется в пределах 10-2 – 10-5 М.
Vmax
- максимальную скорость образования продукта при данной концентрации фермента и в условиях избытка субстрата. Vmax наблюдается, когда все активные центры заняты субстратом. Км и Vmax - важнейшие
характеристики ферментов
Слайд 35Ферменты - строение, механизм действия, свойства, регуляция
Уравнение Михаэлиса-Ментен
Метод Лайнуивера-Берка (метод
двойных обратных величин)
Слайд 36Единицы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
-
О количестве ферментов судят по скорости катализируемой им реакции в
стандартных условиях измерения.- Скорость ферментативной реакции определяют по скорости убыли субстрата, или по скорости образования продукта реакции в единицу времени.
- За единицу активности любого фермента (Е или U) принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин) .
- 1 катал есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с).
Определение количественного содержания ферментов
Слайд 37Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Модели
взаимодействия фермента с субстратом
А) Модель "жесткой матрицы" по
Э. Фишеру
Б)
Модель "перчатка - рука" по Д. Кошланду. Слайд 38Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
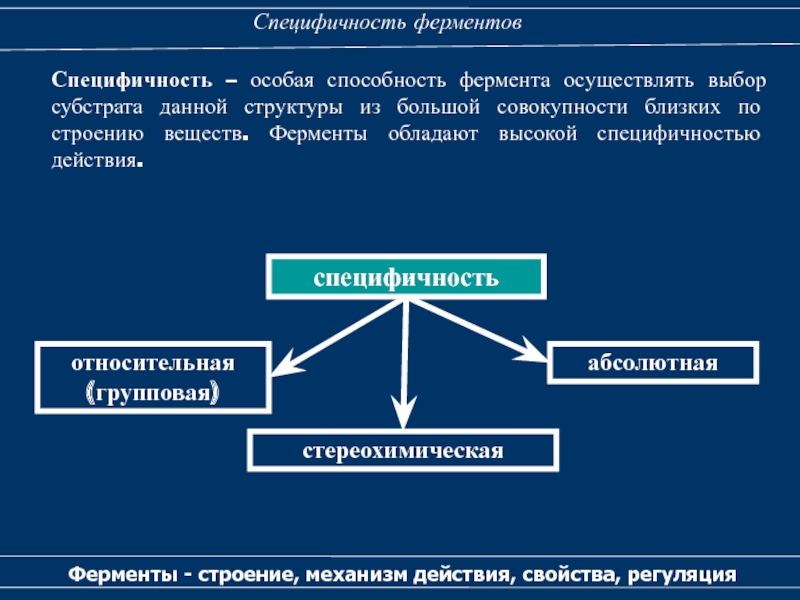
Специфичность – особая
способность фермента осуществлять выбор субстрата данной структуры из большой совокупности
близких по строению веществ. Ферменты обладают высокой специфичностью действия.специфичность
относительная
(групповая)
абсолютная
стереохимическая
Слайд 39Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Ферменты,
проявляющие абсолютную специфичность
Карбоангидраза
Лактаза
Сахараза
Мальтаза
Глюкокиназа
Слайд 40Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Стереоспецифичность ферментов
Стереоспецифичность
к
цис-транс изомерам
Стереоспецифичность к D-изомерам моносахаридов
Фермент специфичен не только к субстрату,
но и к его оптической конфигурацииL-аминооксидазы
D-аминооксидаза
Слайд 41Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Относительная специфичность
ферментов
Слайд 42Специфичность ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Относительная специфичность ферментов
Слайд 43
Активаторы и ингибиторы ферментов
Активаторы ферментов
Активаторами называют вещества, увеличивающие каталитическую активность
ферментов. Среди активаторов встречаются самые разнообразные вещества.
Особенно часто роль
активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определенная концентрация ионов-активаторов в среде.Ферменты - строение, механизм действия, свойства, регуляция
Слайд 44
Активаторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Примеры активаторов
- Соляная
кислота активирует действие пепсина желудочного сока;
- Желчные кислоты повышают
активность панкреатической липазы;- Соединения, содержащими свободные SН-группы (глутатион, цистеин) активируют некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназу и др);
- Ионы металлов особенно часто выступают активаторами. Около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов.
Слайд 45
Активаторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Металлы – стабилизаторы субстратов и кофакторов
Рис. 14.2. Структура АТР
Комплекс
Мg2+-ATPСлайд 46Активаторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Ропь
ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы
Слайд 47Активаторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Ропь
ионов Са2+ в стабилизации структуры
α-амилазы
Стабильность α-амилазы Bacillиs sиbtilis при
инкубации в течение двух часов при 25º и разных рН (по Э. Фишеру и сотр.). 1 – без Cа2+; 2 – с Са2+
Влияние ЭДТА и трипсина на α-амилазу
Bacillиs sиbtilis .1 – инкубация с
трипсином; 2 – инкубация с ЭДТА;
3 – инкубация с ЭДТА и трипсином (рН 7,5; 25º)
Слайд 48
Ингибиторы ферментов
Ингибиторы ферментов
Ингибиторы - вещества, вызывающие снижение активности фермента.
Если ингибитор вызывает
стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных
групп фермента, то такой тип ингибирования называется необратимым.Необратимое действие ингибитора в самом простом случае может быть описано уравнением:
E + I → EI, где Е – фермент, I – ингибитор, EI – комплекс.
Ферменты - строение, механизм действия, свойства, регуляция
Слайд 49
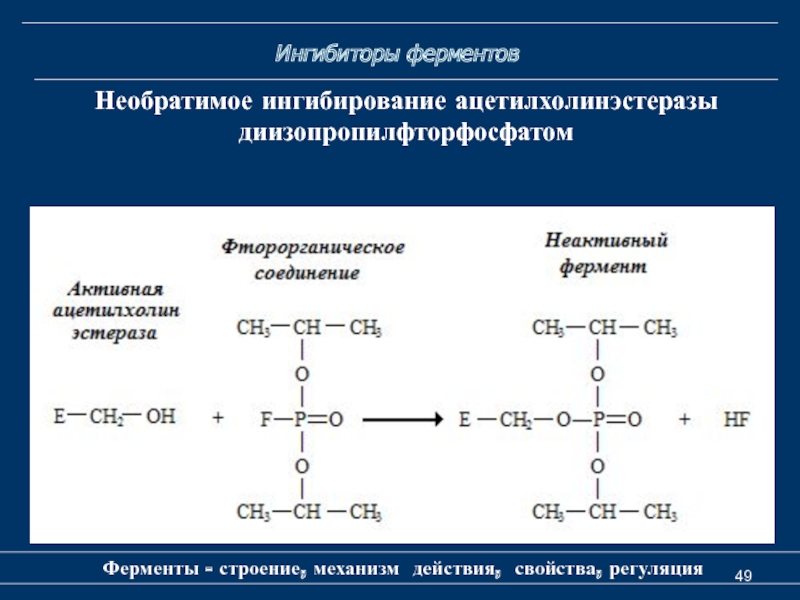
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Необратимое ингибирование
ацетилхолинэстеразы
диизопропилфторфосфатом
Слайд 50
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Обратимое ингибирование
В случае обратимого действия ингибитор образует с ферментом непрочный комплекс,
способный распадаться, в результате чего снова возникает активный фермент. Обратимое действие ингибитора может быть описано уравнением:
E + I EI, где Е – фермент, I – ингибитор, EI – комплекс.
Обратимое ингибирование делят на:
- Конкурентное
- Неконкурентное
Слайд 51Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Сравнение конкурентного
и неконкурентного ингибитора
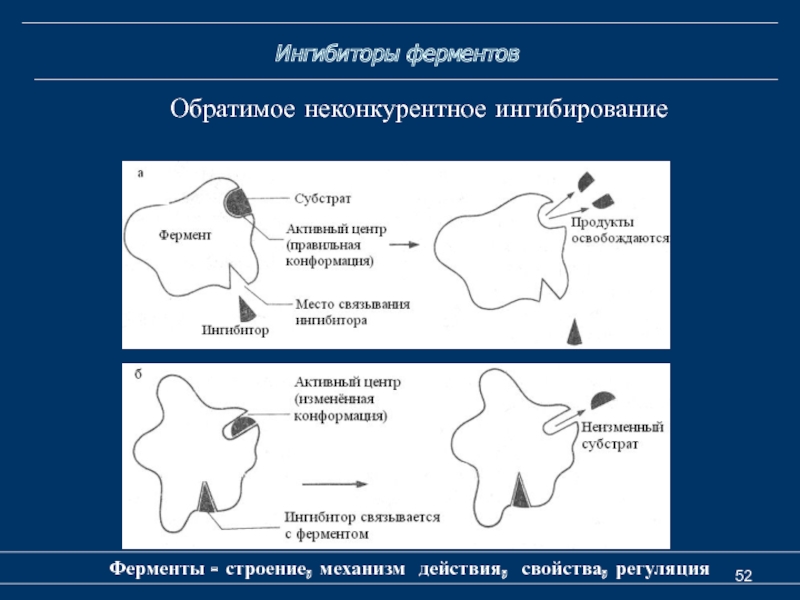
Слайд 52
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Обратимое неконкурентное
ингибирование
Слайд 53
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Обратимое конкурентное ингибирование
сукцинатдегидрогеназы
Слайд 54
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Зависимость скорости ферментативной
реакции от концентрации субстрата в присутствии конкурентного ингибитора
Графики зависимости скорости
ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора.а- в координатах v от [S]; б- в координатах l/v от l/[S]; Vmах И Vi- максимальные скорости реакции; Кm И Kmi- константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора
Слайд 55
Ингибиторы ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Зависимость скорости
ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора
Графики зависимости
скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора. Обозначения те же.Слайд 56Регуляция активности ферментов
1. Изменение количества ферментного белка – индукция или
репрессия синтеза ферментного белка.
2. Изменение каталитической активности молекул ферментов.
3. Доступность молекул субстрата и кофермента. Чем выше концентрация исходного субстрата, тем выше скорость реакции.
Ферменты - строение, механизм действия, свойства, регуляция
Регуляция активности ферментов
Слайд 57
Регуляция активности ферментов
Основные виды:
аллостерическая регуляция;
ковалентная (химическая) модификация;
частичный (ограниченный)
протеолиз.
Ферменты - строение, механизм действия, свойства, регуляция
Изменение
каталитической активности молекул ферментовСлайд 58Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства,
Аллостерическая
регуляция: активация
Аллостерические активаторы изменяют конформацию
фермента и повышают
сродство активного центра к субстрату (повышают активность).Слайд 59Регуляция активности ферментов
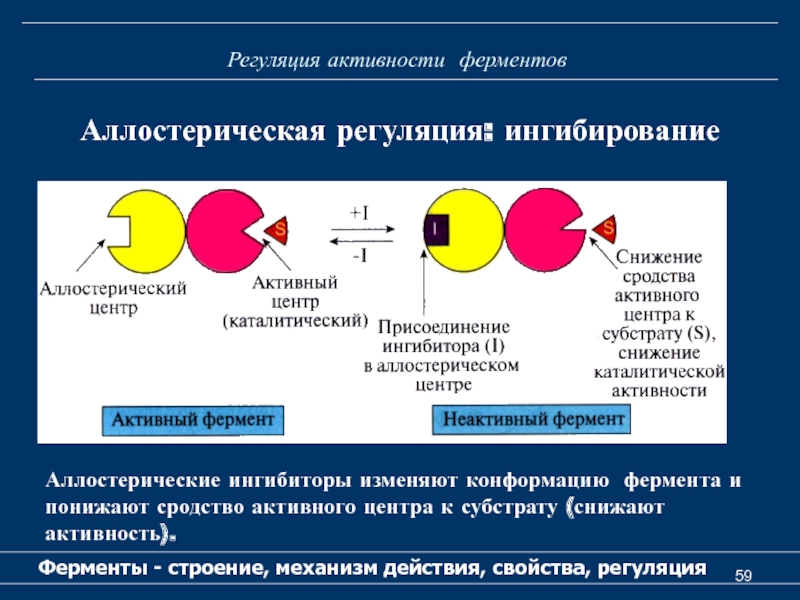
Ферменты - строение, механизм действия, свойства, регуляция
Аллостерическая
регуляция: ингибирование
Аллостерические ингибиторы изменяют конформацию фермента и понижают сродство активного
центра к субстрату (снижают активность).Слайд 60
Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Аллостерический контроль
активности ферментов
Аспартаткарбамоилтрансфераза
Фермент состоит из
12 субъединиц.
6 каталитических
субъединиц и
6 –
регуляторных.GTP – аллостерический
ингибитор,
АТР – аллостерический
активатор.
Слайд 61Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства,
регуляция
Ковалентная модификация
(фосфорилирование - дефосфорилирование)
Слайд 62
Регуляция активности ферментов
Ферменты - строение, механизм действия,
свойства, регуляция
Регуляция путем частичного протеолиза
Проферменты - неактивные предшественники ферментов.
Частичный протеолиз профермента – отщепление фрагмента
его молекулы в результате гидролиза одной или нескольких
пептидных связей, вызывающее конформационную перестройку оставшейся части молекулы и формирование активного центра.
Слайд 63
Регуляция активности ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Механизм активации
трипсиногена быка
Слайд 64Классификация ферментов
Классификация и номенклатура ферментов
1. Оксидоредуктазы
2. Tрансферазы
3. Гидролазы
4. Лиазы
5.
Изомеразы
6. Лигазы (синтетазы)
Классы ферментов
Слайд 65
Классификация ферментов
Ферменты - строение, механизм действия, свойства, регуляция
Международная классификация и номенклатура ферментов
6 классов ферментов в зависимости от
типа катализируемой реакции;в каждом классе выделяют несколько подклассов;
в каждом подклассе – несколько подподклассов;
в каждом подподклассе – индивидуальные ферменты.
Слайд 66Номенклатура ферментов
Классификация и номенклатура ферментов
Каждому ферменту присвоен четырехзначный классификационный номер
(шифр).
КФ 1.1.1.37 – Малатдегидрогеназа
КФ – Комиссия по ферментам
1. – Класс
1.1
– Подкласс1.1.1 – Подподкласс
37 - Порядковый номер в своем подподклассе.