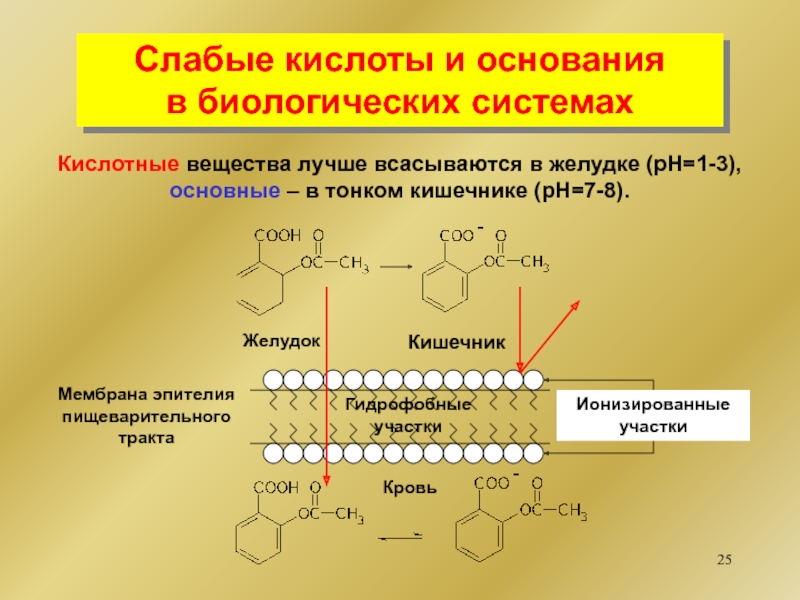
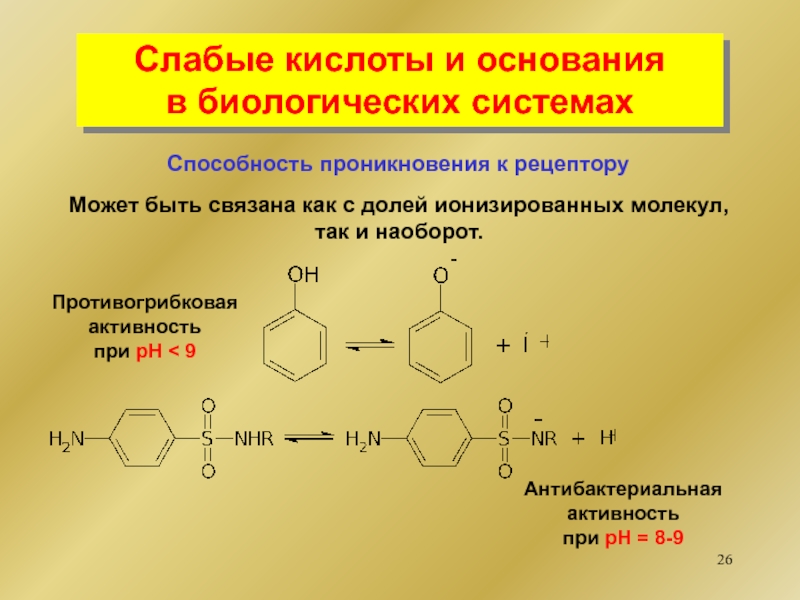
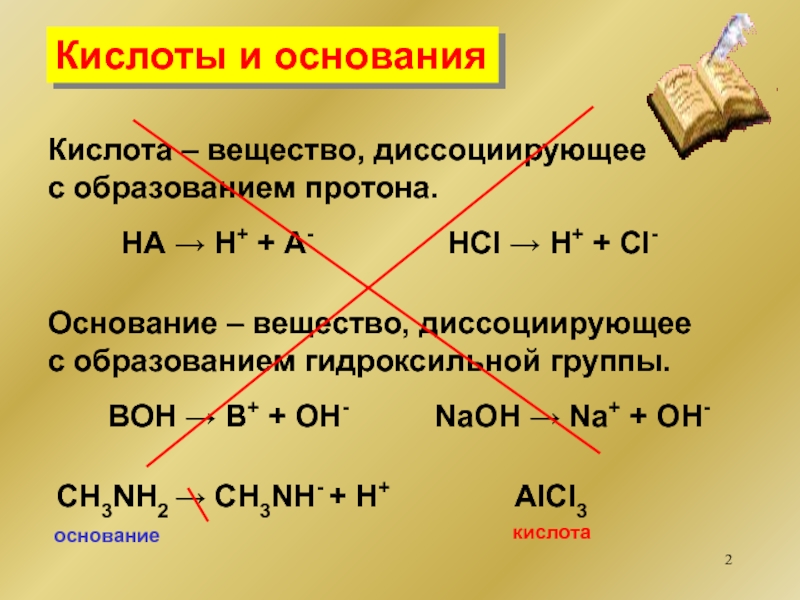
диссоциирующее
с образованием гидроксильной группы.
НА Н+ + А-
НCl Н+
+ Cl-BOH B+ + OH-
NaOH Na+ + OH-
СН3NH2 СН3NH- + H+
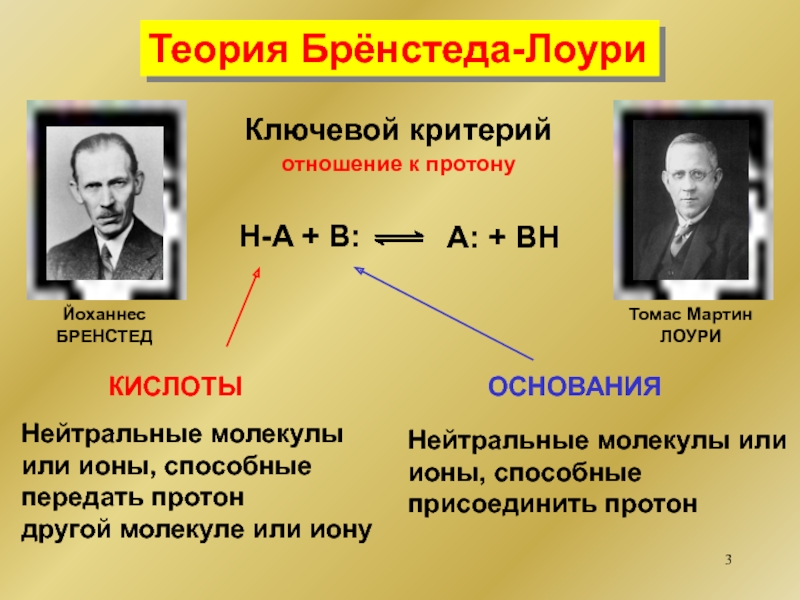
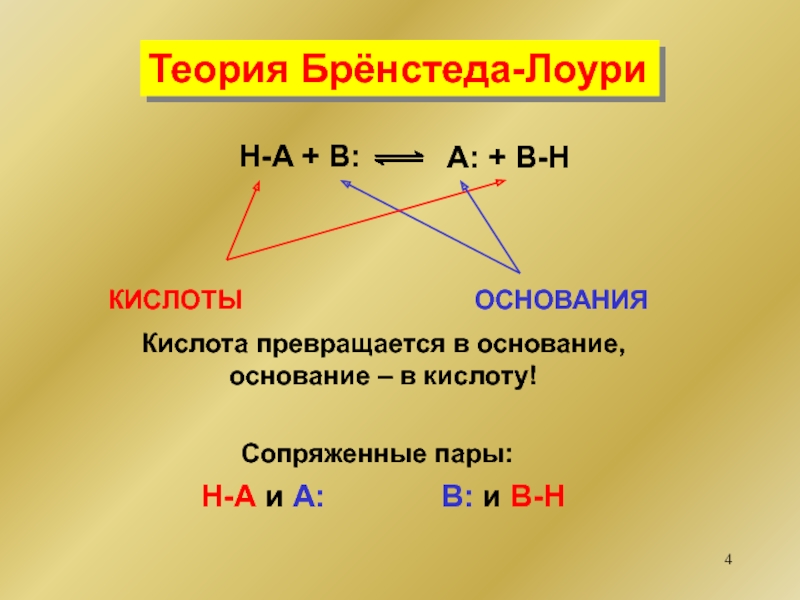
основание
AlCl3
кислота




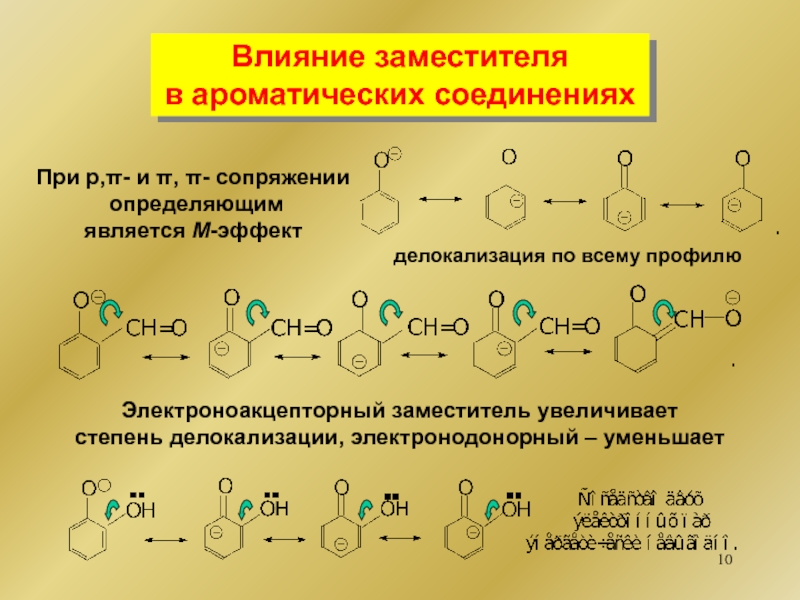
![1
Кафедра химии
Тема лекции:
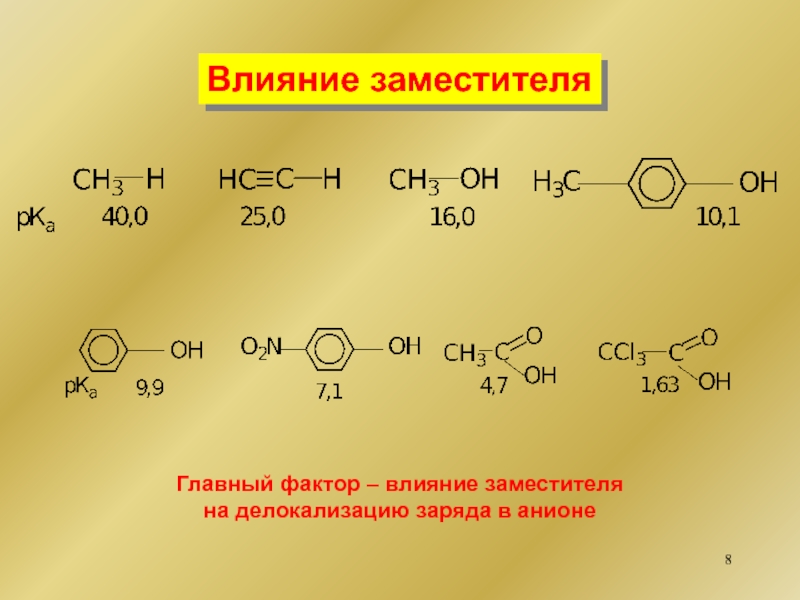
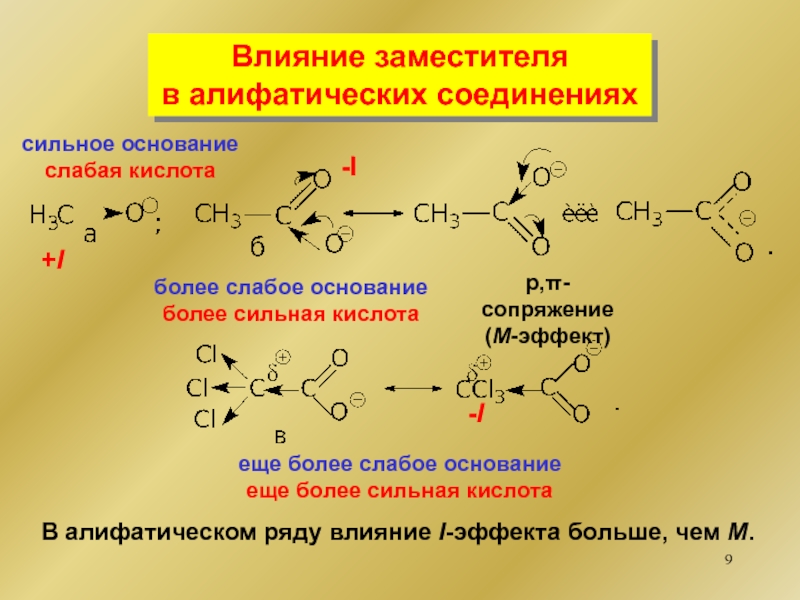
Кислотно-основные свойства
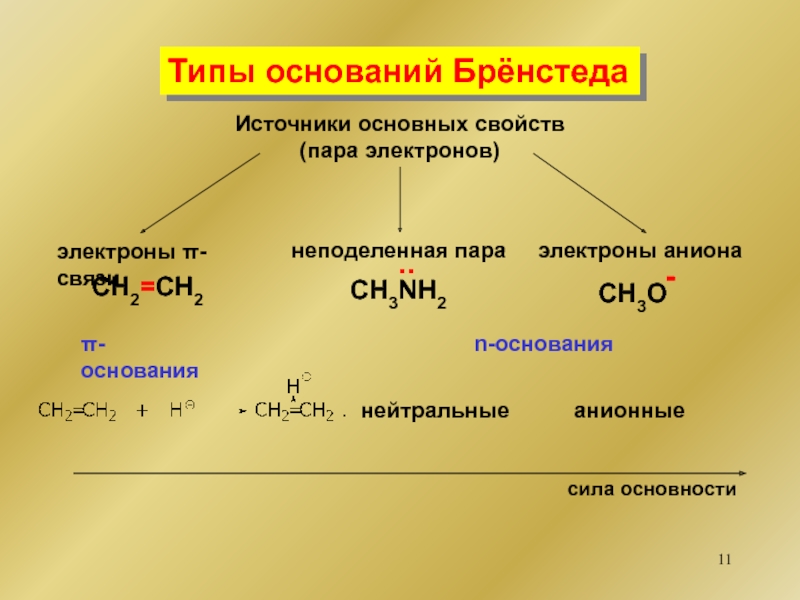
органических соединений Типы оснований БрёнстедаНейтральные n-основанияR-Het-X + Н+..[R-Het-Х]+HN-основанияS-основанияO-основания Типы оснований БрёнстедаНейтральные n-основанияR-Het-X + Н+..[R-Het-Х]+HN-основанияS-основанияO-основания](/img/thumbs/6d2e68ba31acd4130f42f361ae279724-800x.jpg)