Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
Содержание
- 1. 1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
- 2. Лекция № 17Комплексные соединения(теория кристаллического поля)
- 3. Слайд 3
- 4. Теория кристаллического поля (ТКП) -
- 5. Ханс Альбрехт Бете 7.07.1906 - 7.03.2005Джон Хазбрук Ван Флек 13.03.1899 – 27.10.1980
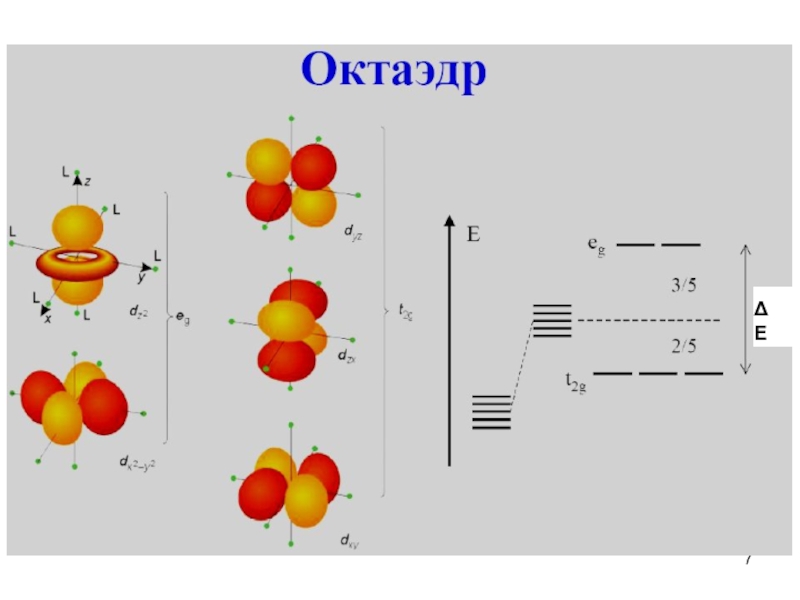
- 6. Расщепление d-орбиталей в октаэдрическом поле
- 7. E
- 8. Теория кристаллического поля222У изолированного атомаEd6 Dq4 Dq10
- 9. Расщепление d-орбиталей в тетраэдрическом поле
- 10. E2/53/5
- 11. Тетраэдрическое окружениеEd4Dq6Dqt2gegИз симметрии d-уровней только со слабыми лигандами(с сильными – плоский квадрат)
- 12. Лиганды, вызывающее большое расщепление
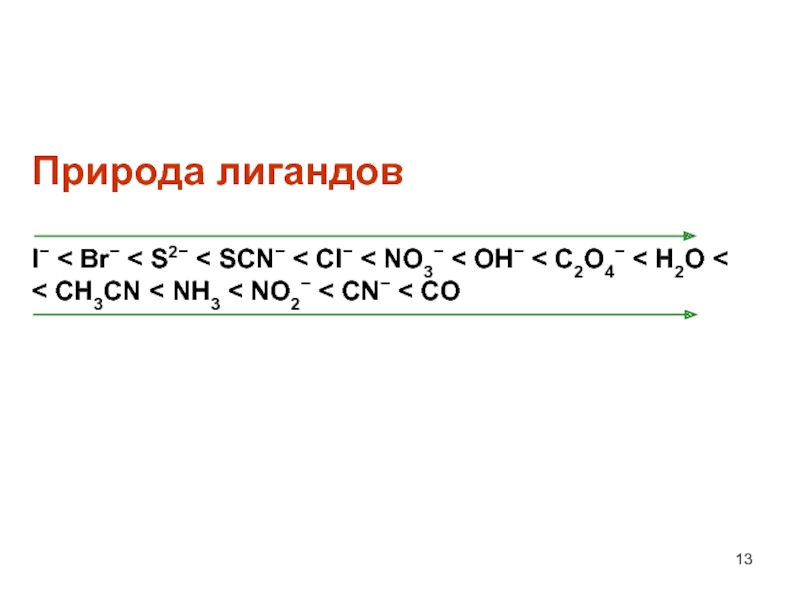
- 13. Природа лигандов I < Br <
- 14. Изучение параметров расщепления d-орбиталей,
- 15. Цветность комплексовдля [Ti(H2O)6]3+Е = 57 ккал/мольλ =
- 16. Слайд 16
- 17. Взаимосвязь между цветом поглощенного света и окраской
- 18. Слайд 18
- 19. Природа центрального атома3d < 4d <
- 20. Стабилизация комплексов полем лигандов
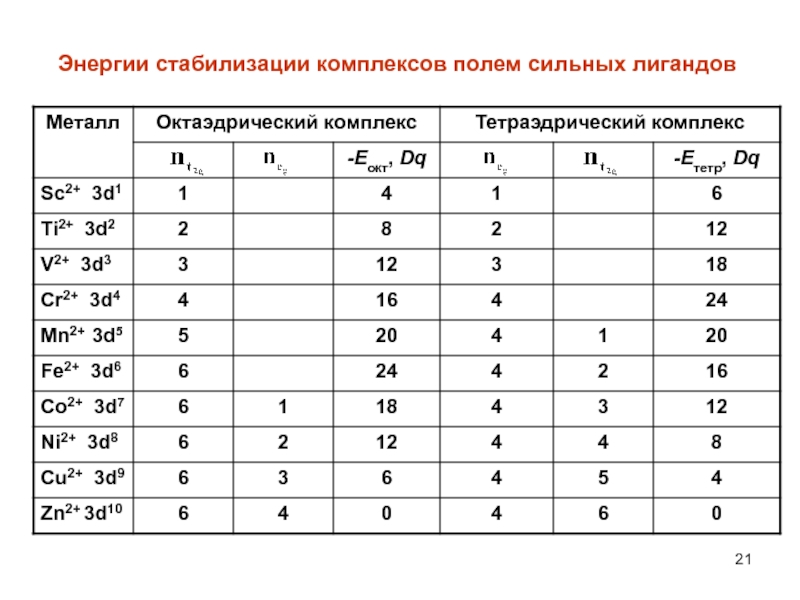
- 21. Энергии стабилизации комплексов полем сильных лигандов
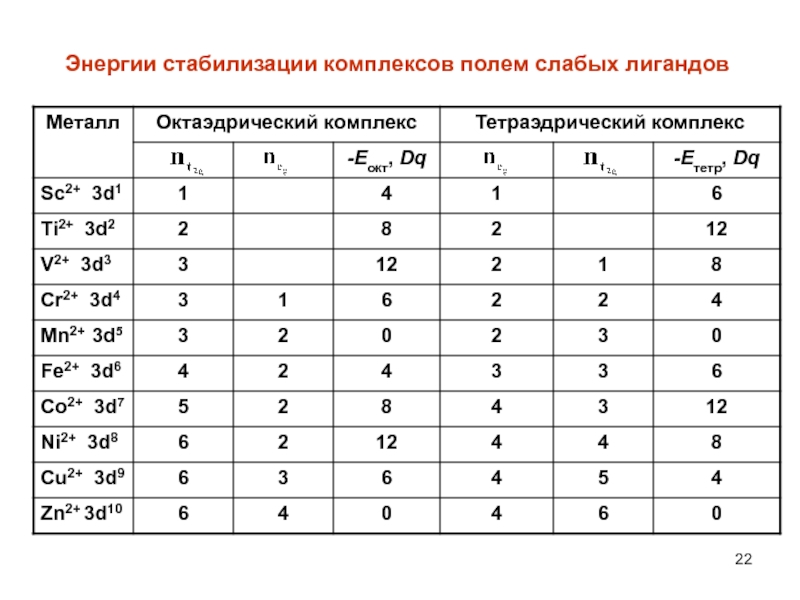
- 22. Энергии стабилизации комплексов полем слабых лигандов
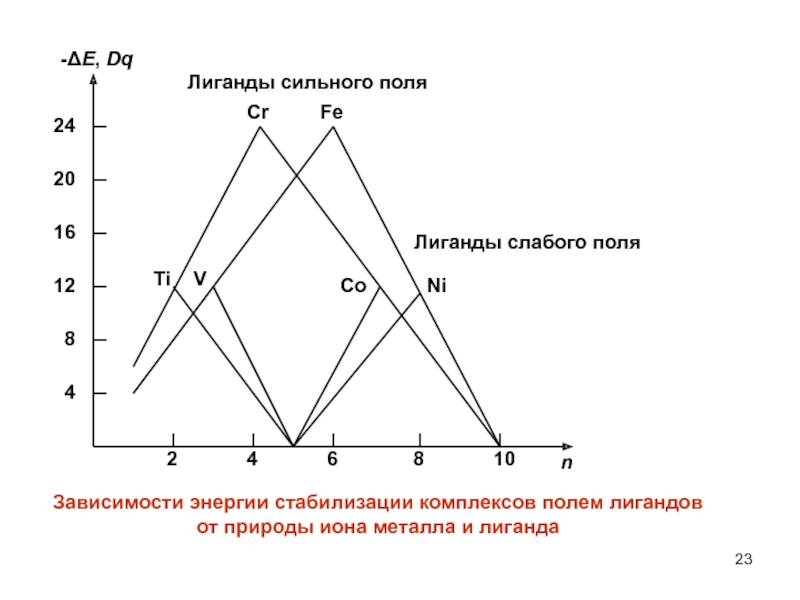
- 23. -E, Dqn4128162024246810Зависимости энергии стабилизации комплексов полем лигандов
- 24. lg KCa Sc Ti V Cr Mn
- 25. Теория Кристаллического Поля (ТКП)
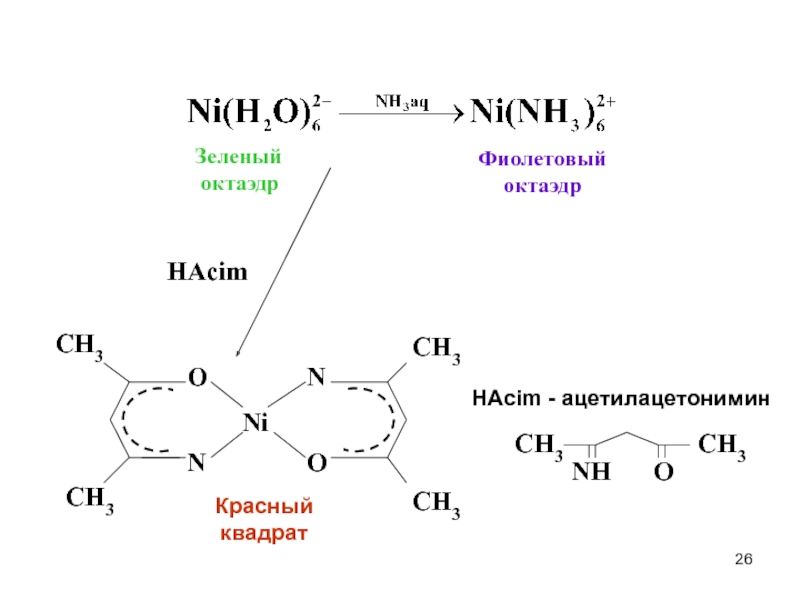
- 26. Зеленый октаэдрФиолетовыйоктаэдрHAcimКрасный квадратHАcim - ацетилацетониминNHOCH3CH3
- 27. Благодарю за внимание
- 28. Скачать презентанцию
Лекция № 17Комплексные соединения(теория кристаллического поля)
Слайды и текст этой презентации
Слайд 1Курс «Общая химия»
Лектор: проф. Майстренко Валерий Николаевич
Башкирский государственный университет
Кафедра неорганической
химии
Слайд 4 Теория кристаллического поля (ТКП) - модель, описывающая электронную
конфигурацию комплексных соединений переход-ных металлов. ТКП объясняет магнитные свойства, цвет,
энталь-пию гидратации комплексов, но не объясняет природу связи в них. ТКП была разработана Гансом Бете и Джоном Ван Флеком в 1930 годах. В дальнейшем она была объединена с теорией моле-кулярных орбиталей в более общую теорию поля лигандов, рас-сматривающую химические связи в комплексных соединениях.Согласно ТКП, взаимодействие между металлом и лигандами возникает вследствие притяжения между положительно заря-женным катионом металла и отрицательным зарядом на несвя-зывающих электронах лиганда. Теория рассматривает изменение энергии пяти d-орбиталей в окружении точечных зарядов лиган-дов. По мере приближения лигандов к иону металла электроны лигандов отталкиваются от d-электронов металла как заряды с одинаковым знаком. Энергия d-электронов на орбиталях, которые ближе к лигандам, становится выше, чем тех, которые дальше, что приводит к расщеплению уровней энергии d-орбиталей атома металла.
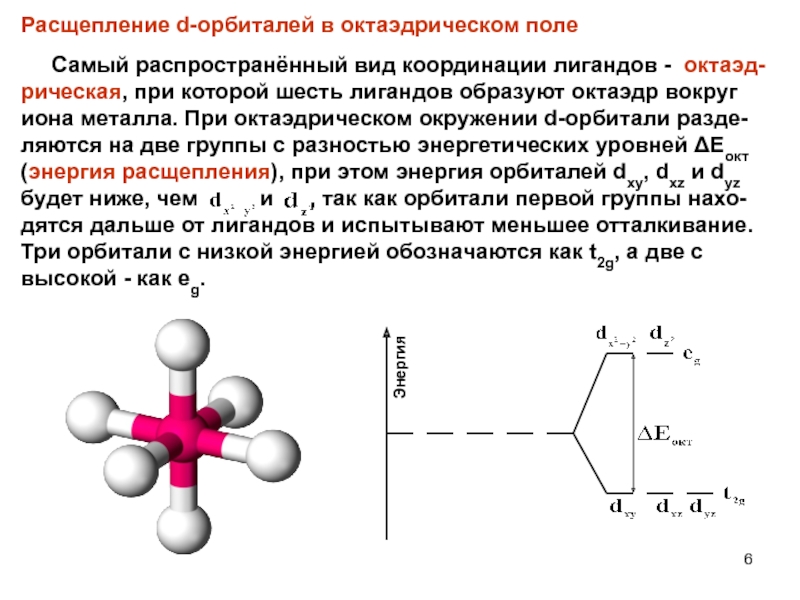
Слайд 6Расщепление d-орбиталей в октаэдрическом поле
Самый распространённый вид
координации лигандов - октаэд-рическая, при которой шесть лигандов образуют октаэдр вокруг
иона металла. При октаэдрическом окружении d-орбитали разде-ляются на две группы с разностью энергетических уровней ΔЕокт (энергия расщепления), при этом энергия орбиталей dxy, dxz и dyz будет ниже, чем и , так как орбитали первой группы нахо-дятся дальше от лигандов и испытывают меньшее отталкивание. Три орбитали с низкой энергией обозначаются как t2g, а две с высокой - как eg.Энергия
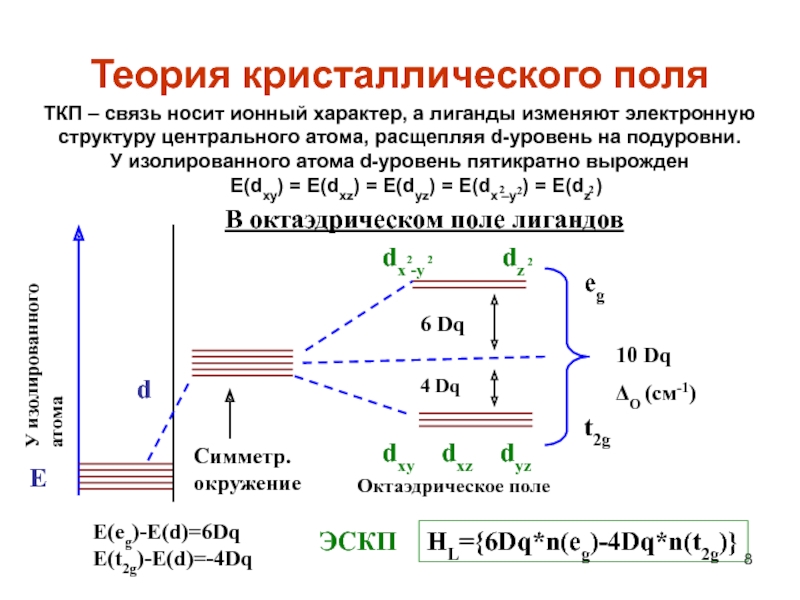
Слайд 8Теория кристаллического поля
2
2
2
У изолированного атома
E
d
6 Dq
4 Dq
10 Dq
ΔO (см-1)
t2g
eg
dxy
dxz dyz
dx -y
2
2
dz
2
Симметр.
окружение
В октаэдрическом поле лигандов
Октаэдрическое поле
E(eg)-E(d)=6Dq
E(t2g)-E(d)=-4Dq
HL={6Dq*n(eg)-4Dq*n(t2g)}
ЭСКП
ТКП – связь
носит ионный характер, а лиганды изменяют электронную структуру центрального атома, расщепляя d-уровень на подуровни.У изолированного атома d-уровень пятикратно вырожден
E(dxy) = E(dxz) = E(dyz) = E(dx –y ) = E(dz )
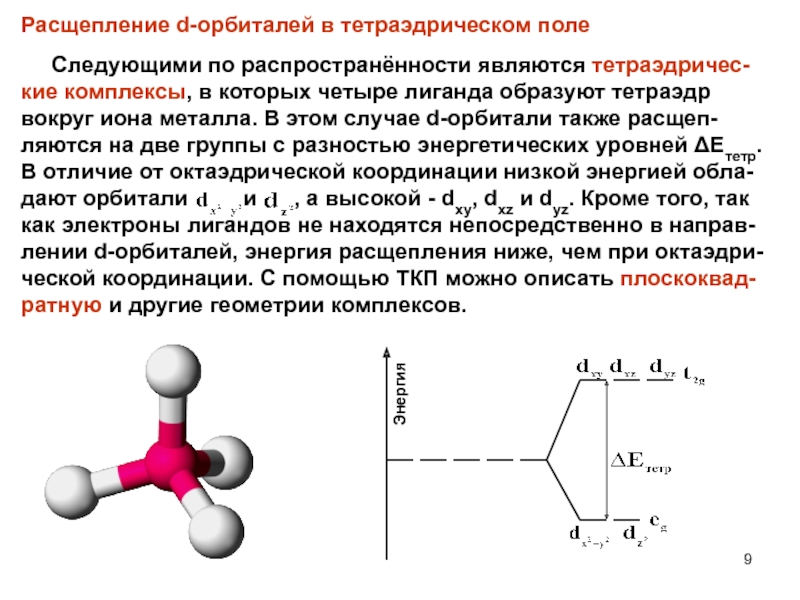
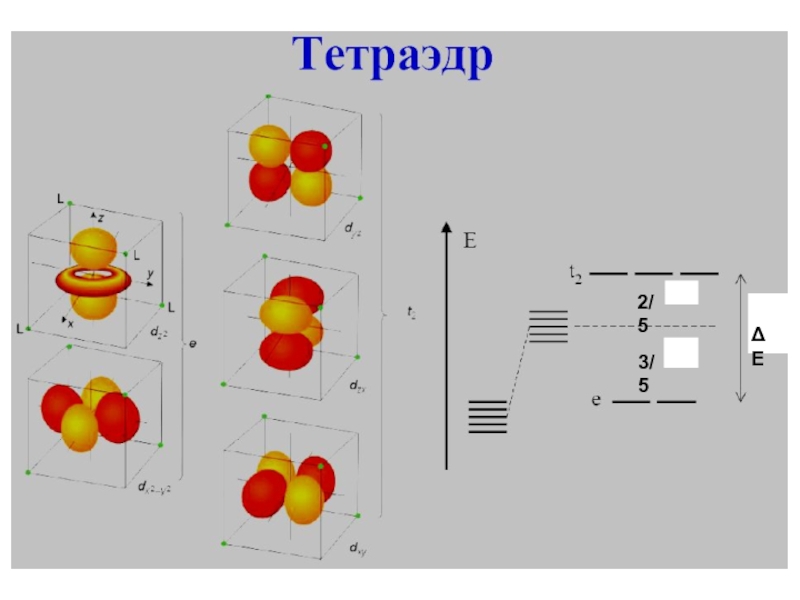
Слайд 9Расщепление d-орбиталей в тетраэдрическом поле
Следующими по распространённости
являются тетраэдричес-кие комплексы, в которых четыре лиганда образуют тетраэдр вокруг
иона металла. В этом случае d-орбитали также расщеп-ляются на две группы с разностью энергетических уровней ΔЕтетр. В отличие от октаэдрической координации низкой энергией обла-дают орбитали и , а высокой - dxy, dxz и dyz. Кроме того, так как электроны лигандов не находятся непосредственно в направ-лении d-орбиталей, энергия расщепления ниже, чем при октаэдри-ческой координации. С помощью ТКП можно описать плоскоквад-ратную и другие геометрии комплексов.Энергия
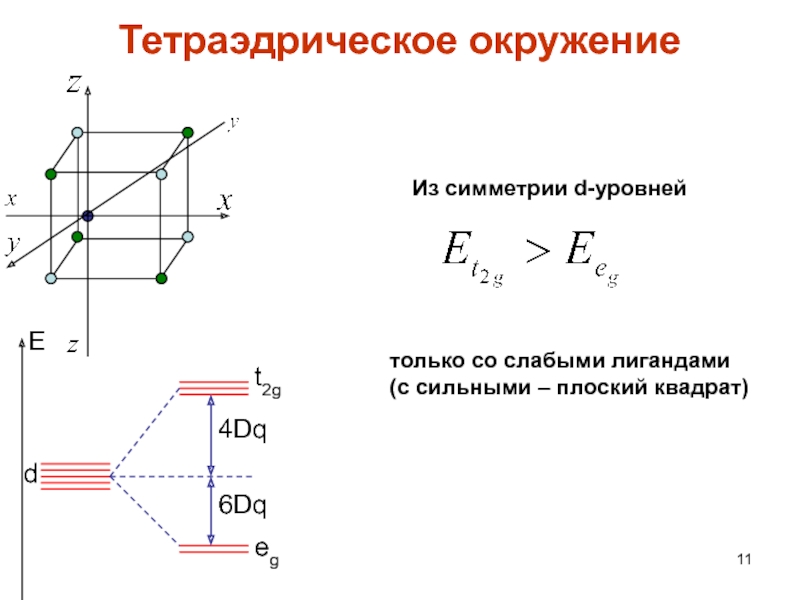
Слайд 11Тетраэдрическое окружение
E
d
4Dq
6Dq
t2g
eg
Из симметрии d-уровней
только со слабыми лигандами
(с сильными –
плоский квадрат)
Слайд 12 Лиганды, вызывающее большое расщепление d-уровней, на-пример CN−
и CO, называются лигандами сильного поля. В комп-лексах с такими
лигандами электронам невыгодно занимать орбитали с высокой энергией. Следовательно, орбитали с низкой энергией полностью заполняются до того, как начинается запол-нение орбиталей с высокой энергией. Такие комплексы называ-ются низкоспиновыми. Например, в ионе [Fe(NO2)6]3− все 5 d-элек-тронов будут располагаться на нижнем уровне t2g.Лиганды, вызывающие малое расщепление, например I− и Br−, называются лигандами слабого поля. В этом случае легче помес-тить электроны на орбитали с высокой энергией, чем располо-жить два электрона на одной орбитали с низкой энергией, потому что электроны отталкиваются друг от друга, и затраты энергии на размещение второго электрона выше, чем ΔЕ. Такие комплексы называются высокоспиновыми. Например, все 5 d-орбиталей иона [FeBr6]3−, у которого 5 d-электронов, будут заняты.
Слайд 13Природа лигандов I < Br < S2 < SCN < Cl
< NO3 < OH < C2O4 < H2O <
< CH3CN < NH3 < NO2 < CN < COСлайд 14 Изучение параметров расщепления d-орбиталей, как правило, основано
на спектроскопических исследованиях. Длины волн полос поглощения комплексов в кристаллическом
состоянии или в растворе, обусловленные переходом электронов с t2g на eg уро-вень или наоборот, связаны с энергией расщепления Е = 1 / ; Е = E2 – E1 = h. = h.(с / ) = h.c.
Многие комплексные соединения отличаются яркой окраской. Так, водный раствор [Cu(NH3)4]2+, окрашен в интенсивно синий цвет, ионы [Ti(H2O)6]3+ придают раствору фиолетовую окраску, а [Co(NH3)5H2O]2+ - красную. Если через раствор пропускать свет видимой части спектра, то возможны три варианта: отсутствие поглощения света (образец бесцветен); полное поглощение света (образец будет черным); поглощение света определенной длины волны (образец будет иметь цвет, дополнительный к поглощен-ному участку спектра). Таким образом, цвет раствора будет определяется частотой полосы поглощенного света. Например, при пропускании света через раствор, содержащий [Ti(H2O)6]3+, наблюдается поглощение света в желто-зеленой области спектра (20300 см-1, 500 нм) и раствор имеет фиолетовую окраску.
Слайд 15Цветность комплексов
для [Ti(H2O)6]3+
Е = 57 ккал/моль
λ = 5000 Å
(фиол. окр.)
K+, Ca2+, Sc3+, Cu+1, Zn2+, In3+
Бесцветны
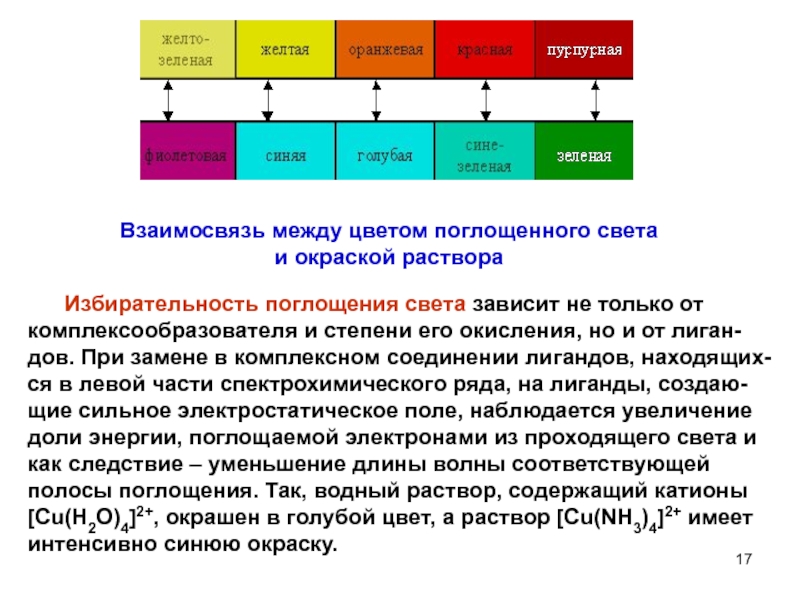
Слайд 17Взаимосвязь между цветом поглощенного света
и окраской раствора
Избирательность поглощения света зависит не только от комплексообразователя и степени
его окисления, но и от лиган-дов. При замене в комплексном соединении лигандов, находящих-ся в левой части спектрохимического ряда, на лиганды, создаю-щие сильное электростатическое поле, наблюдается увеличение доли энергии, поглощаемой электронами из проходящего света и как следствие – уменьшение длины волны соответствующей полосы поглощения. Так, водный раствор, содержащий катионы [Cu(H2O)4]2+, окрашен в голубой цвет, а раствор [Cu(NH3)4]2+ имеет интенсивно синюю окраску.Слайд 19 Природа центрального атома
3d < 4d < 5d
Cr Mo,
Co Rh ΔE увеличивается на 50%
комплексы 3d: низко- и
высокоспиновые4d и 5d – только низкоспиновые
Слайд 20Стабилизация комплексов полем лигандов
Размещение электрона в октаэдрических комплексах на t2g орбитали вызывает
уменьшение (выигрыш) энергии на 2/5 Е.Наоборот, размещение электрона на eg орбитали вызывает увеличение (затрату) энергии на 3/5 Е. Если заселить электро-нами t2g и eg орбитали полностью, то никакого выигрыша энер-гии не будет (как не будет и дополнительной затраты энергии). Если исходные d-орбитали заселены частично и содержат от 1 до 6 электронов, то получим значительный выигрыш энергии. Выигрыш энергии за счет преимущественного заселения элект-ронами t2g атомных орбиталей называют энергией стабилизации комплексов полем лигандов.
Точно также, в тетраэдрических комплексах размещение электрона на eg орбитали уменьшает энергию на 3/5 Е, а его размещение на t2g орбитали увеличивает энергию на 2/5 Е.
Очевидно, что






![1
Курс Общая химия
Лектор: проф. Майстренко Валерий Николаевич
Башкирский Цветность комплексовдля [Ti(H2O)6]3+Е = 57 ккал/мольλ = 5000 Å (фиол. окр.) Цветность комплексовдля [Ti(H2O)6]3+Е = 57 ккал/мольλ = 5000 Å (фиол. окр.) K+, Ca2+, Sc3+, Cu+1, Zn2+,](/img/thumbs/ae6ef6787b9cb0a3801fc379246f7aa0-800x.jpg)



![1
Курс Общая химия
Лектор: проф. Майстренко Валерий Николаевич
Башкирский lg KCa Sc Ti V Cr Mn Fe Co Ni Cu lg KCa Sc Ti V Cr Mn Fe Co Ni Cu ZnM2+ + 6L=[ML6]2+Зависимость величин констант образования](/img/thumbs/58bb56d6f188a411667032b9624a18f8-800x.jpg)