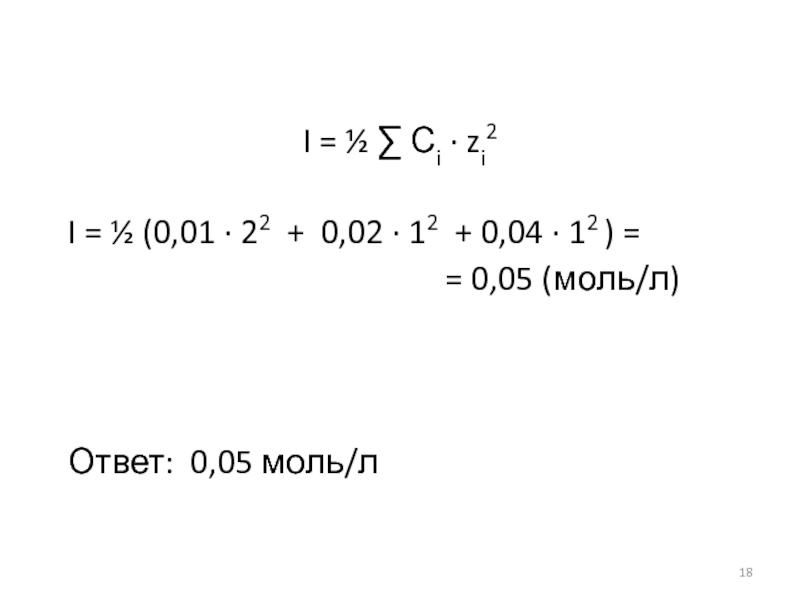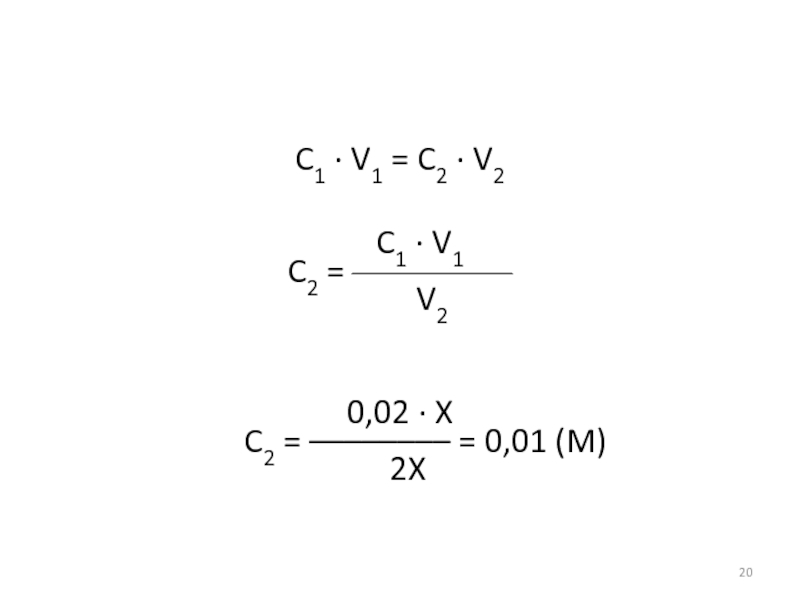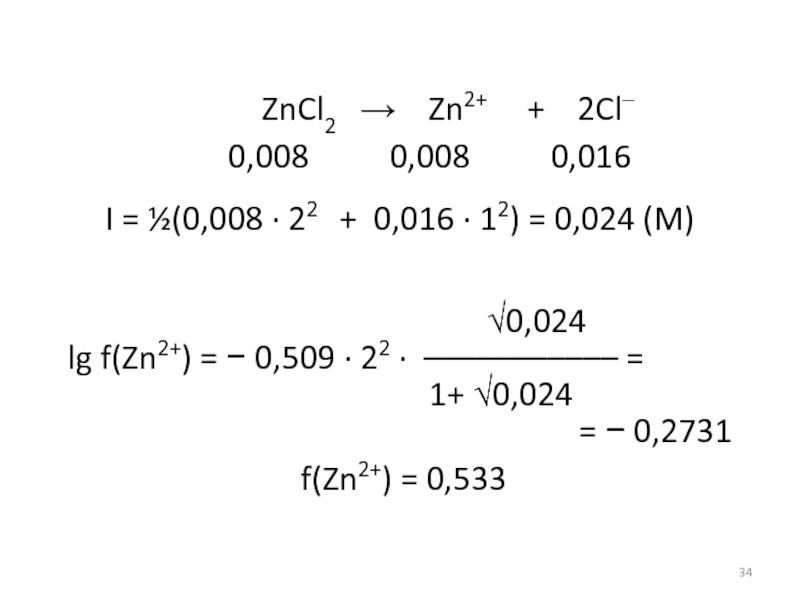Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Основные положения теории растворов электролитов, используемых в
Содержание
- 1. 1 Основные положения теории растворов электролитов, используемых в
- 2. Майкл Фарадей 1791 – 1867
- 3. Электролиты – вещества, водные растворы которых проводят
- 4. В 1887 году Аррениус предложил теорию электролитической диссоциации
- 5. Сванте Аррениус 1859 – 1927
- 6. Суть теории: все электролиты при раство-рении в
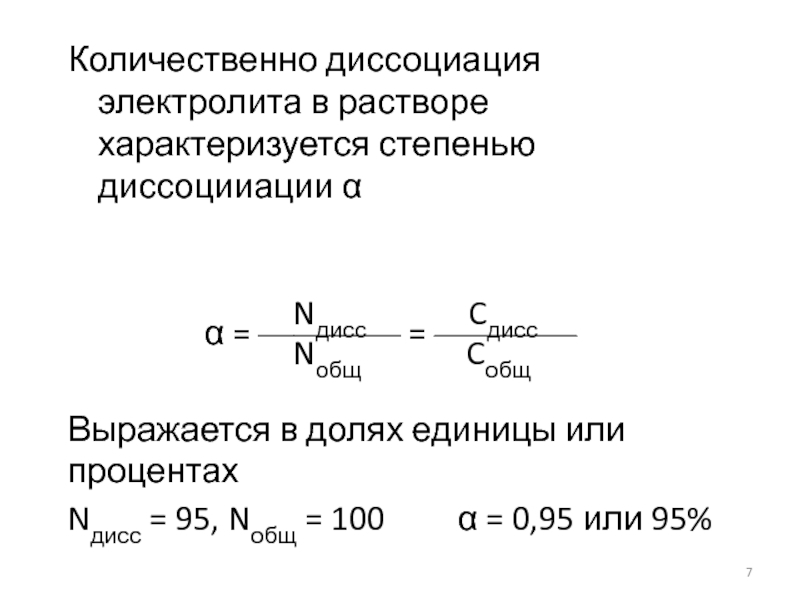
- 7. Количественно диссоциация электролита в растворе характеризуется степенью
- 8. Классификация электролитов < 3% – слабые электролиты3%
- 9. Сильные электролитыНеорганические кислоты: HNO3, HBr, HI, HCl,
- 10. Слабые электролитыНеорганические кислоты: H2S, H3PO4, H2SO4(по второй
- 11. Общая (истинная) и активная концентрация ионов в растворе
- 12. Общая концентрация ионов в растворе определяется молярной
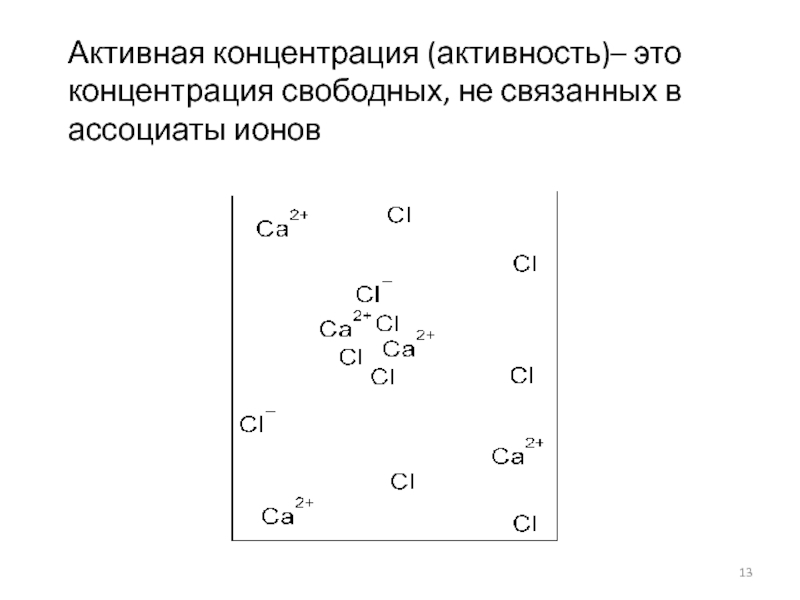
- 13. Активная концентрация (активность)– это концентрация свободных, не связанных в ассоциаты ионов
- 14. aA = fA·[A]aA – активная концентрация вещества AfA – коэффициент активностиA – общая концентрация вещества A
- 15. Коэффициент активности зависит от ионной силы раствора
- 16. Задача 1. Рассчитайте ионную силу раствора, содержащего
- 17. CaCl2 Ca2+
- 18. I = ½ Сi · zi2I
- 19. Задача 2. Смешали равные объемы 0,02 М
- 20. C1 · V1 = C2 · V2
- 21. H2SO4 H+ +
- 22. Расчет коэффициента активности 1. Расчетный путь 2. Используя справочные данные
- 23. Водные растворы t = 25 оСI =
- 24. I < 0,01 Mlg fi = 0,509 · zi2 · I
- 25. Правило ионной силы(выведено эмпирически Льюисом и Рендаллом)В
- 26. Слайд 26
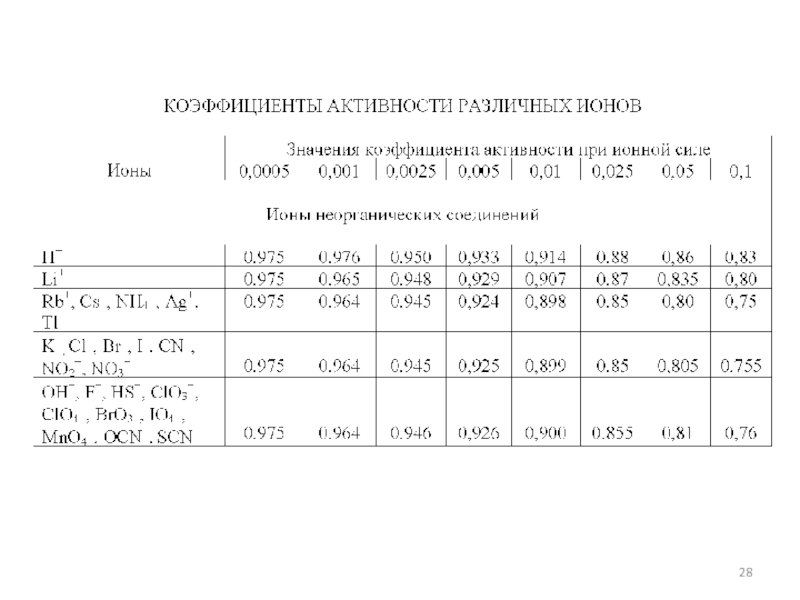
- 27. Задача 3. Рассчитать (по справочнику) коэффициент активности иона калия для ионной силы 0,015 моль/л.
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Чем меньше ионная сила раствора, тем больше
- 33. Задача 4. 0,3264 г хлорида
- 34. ZnCl2
- 35. Слайд 35
- 36. СПАСИБО ЗА ВНИМАНИЕ!
- 37. Скачать презентанцию
Майкл Фарадей 1791 – 1867
Слайды и текст этой презентации
Слайд 3
Электролиты – вещества, водные растворы которых проводят электрический ток
Неэлектролиты –
вещества, водные раство-ры которых не проводят электрический ток
Слайд 6
Суть теории: все электролиты при раство-рении в воде распадаются на
ионы, создавая электропроводящую среду
NaCl Na+ + Cl–
Al2(SO4)3 2Al3+
+ 3SO42–Слайд 7Количественно диссоциация электролита в растворе характеризуется степенью диссоцииации
Nдисс Cдисс
= ———— = ————
Nобщ Cобщ
Выражается в долях единицы или
процентах
Nдисс = 95, Nобщ = 100 = 0,95 или 95%
Слайд 8Классификация электролитов
< 3% – слабые электролиты
3% <
30% – электролиты средней силы
> 30% – сильные электролиты
Слайд 9Сильные электролиты
Неорганические кислоты: HNO3, HBr, HI, HCl, H2SO4(по первой ступени)
и др.
2. Гидроксиды щелочных и щелочно-земель-ных металлов: NaOH, KOH, Ca(OH)2,
Ba(OH)2, Sr(OH)23. Большинство солей: CaCl2, NH4Cl, Na3PO4, CH3COONa и т.д.
Слайд 10Слабые электролиты
Неорганические кислоты: H2S, H3PO4, H2SO4(по второй ступени), H2CO3 и
др.
2. Большинство органических кислот: янтарная, уксусная, щавелевая и др.
3.
Аммиак и большинство органических оснований: пиридин, N2H4, NH2OH, (CH3)2NH и др.
Слайд 12Общая концентрация ионов в растворе определяется молярной концентрацией растворенного электролита
Na2SO4
2Na+ + SO42–
0,02 м/л 0,04 м/л 0,02 м/лK4[Fe(CN)6] 4K+ + [Fe(CN)6]4–
0,005 м/л 0,02 м/л 0,005 м/л
Слайд 13Активная концентрация (активность)– это концентрация свободных, не связанных в ассоциаты
ионов
Слайд 14
aA = fA·[A]
aA – активная концентрация вещества A
fA – коэффициент
активности
A – общая концентрация вещества A
Слайд 15Коэффициент активности зависит от ионной силы раствора и заряда иона
I
= ½ Сi · zi2
При вычислении ионной силы раствора
учитываются концентрации и заряды всех ионов, находящихся в растворе (ионами слабых электролитов пренебрегают)Слайд 16Задача 1. Рассчитайте ионную силу раствора, содержащего 0,01 М CaCl2,
0,02 M HCl и 0,025 M уксусной кислоты.
Решение:
Какие электролиты сильные,
какие электро-литы слабые.2. Проверить концентрацию сильных электро-литов.
3. Найти концентрацию каждого иона и ион-ную силу раствора.
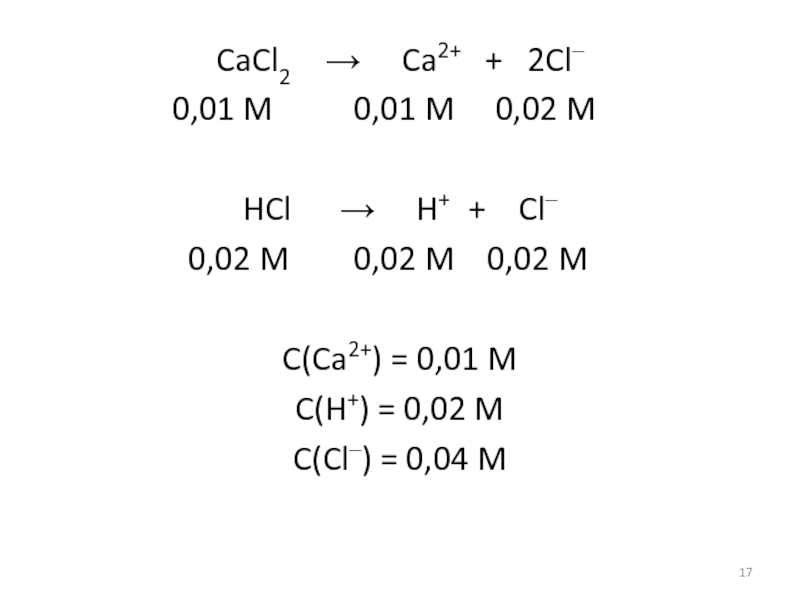
Слайд 17CaCl2 Ca2+ +
2Cl–
0,01 M
0,01 M 0,02 MHCl H+ + Cl–
0,02 M 0,02 M 0,02 M
C(Ca2+) = 0,01 M
C(H+) = 0,02 M
C(Cl–) = 0,04 M
Слайд 18
I = ½ Сi · zi2
I = ½ (0,01
· 22 + 0,02 · 12 + 0,04 ·
12 ) == 0,05 (моль/л)
Ответ: 0,05 моль/л
Слайд 19
Задача 2. Смешали равные объемы 0,02 М раствора серной кислоты
и 0,01 М раствора щавелевой кислоты. Рассчитайте ионную силу полученного
раствора.Слайд 21H2SO4 H+ + HSO4–
0,01 M
0,01 M 0,01 MI = ½ Сi · zi2
I = ½(0,01 · 12 + 0,01 · 12) = 0,01 (M)
Ионная сила растворов сильных электро-литов, состоящих только из однозаряд-ных ионов, равна их общей молярной концентрации
Слайд 23Водные растворы
t = 25 оС
I = 0,01 0,2
М
Уравнение Дебая Хюккеля:
Ilg fi = 0,509 · zi2 · –––––––––––
1+ I
Слайд 25
Правило ионной силы
(выведено эмпирически Льюисом и Рендаллом)
В разбавленном растворе с
данной ионной силой все ионы с одинаковым зарядом по абсолют-ной
величине имеют один и тот же коэффи-циент активностиСлайд 27
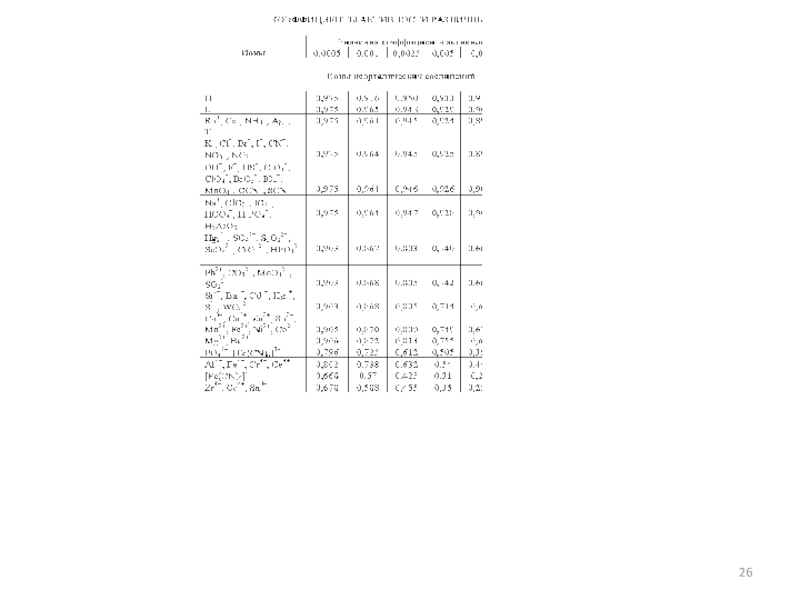
Задача 3. Рассчитать (по справочнику) коэффициент активности иона
калия для ионной силы 0,015 моль/л.
Слайд 29
I
f0,01 – 0,899
0,025 – 0,850
——— ———
I ' = - 0,015 f ' = 0,049
0,01 – 0,899
0,015 – x
——— ———
I " = - 0,005 f " = 0,899 –x
Слайд 31
(- 0,005) · 0,049
X =
0,899 — —————— = 0,883(- 0,015)
I = 0,015 моль/л f (K+) = 0,883
Ответ: f (K+) = 0,883
Слайд 32 Чем меньше ионная сила раствора, тем больше коэффициент активности
Для сильно
разбавленных растворов
(I < 0,0001 M)
f 1Тогда aA = [A]
Слайд 33Задача 4.
0,3264 г хлорида цинка растворили в
300 мл воды. Рассчитайте активность ионов в растворе.
m 0,3264С(ZnCl2) = ———— = ———— = 0,008 M
M · V(л) 136 · 0,3
Слайд 34
ZnCl2
Zn2+ + 2Cl–
0,008 0,008 0,016I = ½(0,008 · 22 + 0,016 · 12) = 0,024 (M)
0,024
lg f(Zn2+) = 0,509 · 22 · ––––––––––– =
1+ 0,024
= 0,2731
f(Zn2+) = 0,533
Слайд 35
0,024
lg f(Cl–) = 0,509 ·
12 · ––––––––––– = 1+ 0,024
= 0,0683
f(Cl–) = 0,854
a(Zn2+) = 0,533 · 0,008 = 0,004 (моль/л)
a(Cl–) = 0,854 · 0,016 = 0,014 (моль/л)
Ответ: 0,004 моль/л; 0,014 моль/л.











![1
Основные положения теории растворов электролитов, используемых в aA = fA·[A]aA – активная концентрация вещества AfA – коэффициент активностиA – общая концентрация вещества A aA = fA·[A]aA – активная концентрация вещества AfA – коэффициент активностиA – общая концентрация вещества A](/img/thumbs/cc7632b326e9f7cecf547c0278160ffb-800x.jpg)