Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
3 2 1
Содержание
- 1. 3 2 1
- 2. Физиология прокариотЛекция № 6
- 3. Жизненные функции микроорганизмов: питание, дыхание, рост и
- 4. Слайд 4
- 5. Физиоло́гия (от греческого φύσις — природа и λόγος —
- 6. Питание клеток микроорганизмов – включение в метаболические
- 7. К макроэлементам (биогенным) относятся десять элементов, содержащихся
- 8. Некоторые виды микроорганизмов не способны сами синтезировать
- 9. По способу поступления питательных веществ в клетки
- 10. В зависимости от того, какие питательные вещества
- 11. Слайд 11
- 12. Среди бактерий выделяют:1) прототрофы (способны сами синтезировать необходимые
- 13. Метаболиты и ионы поступают в микробную клетку
- 14. Слайд 14
- 15. Встречаются модифицированные варианты активного транспорта - перенос
- 16. Особенности метаболизма у бактерий:1) многообразие используемых субстратов;2) интенсивность процессов
- 17. Слайд 17
- 18. В процессе метаболизма выделяют два вида обмена:1) пластический
- 19. В зависимости от акцептора протонов и электронов
- 20. Факультативные анаэробы в кислородных условиях используют процесс
- 21. Токсичность молекулярного кислорода для анаэробных бактерий связана
- 22. Слайд 22
- 23. В микробной клетке ферменты являются биологическими катализаторами.
- 24. Различают также:1) конституитивные ферменты (синтезируются постоянно независимо от наличия субстрата);2) индуцибельные ферменты (синтезируются только в присутствии субстрата).
- 25. По месту действия выделяют:1) экзоферменты (действуют вне клетки;
- 26. Слайд 26
- 27. Основными видами пластического обмена являются:1) белковый;2) углеводный;3) липидный;4) нуклеиновый.
- 28. Белковый обмен характеризуется катаболизмом и анаболизмом. В
- 29. В результате распада аминокислот клетка получает ионы
- 30. В углеводном обмене у бактерий катаболизм преобладает
- 31. Часть ее идет на синтез собственных полисахаридов
- 32. В зависимости от конечных продуктов выделяют следующие виды брожения:1) спиртовое;2) пропионионово-кислое;3) молочнокислое;4) маслянокислое;5) бутилденгликолевое.
- 33. Слайд 33
- 34. Наряду с основным анаэробным распадом (гликолизом) могут
- 35. Липидный обмен осуществляется с помощью ферментов -
- 36. Нуклеиновый обмен бактерий связан с генетическим обменом.
- 37. Рестриктазы вырезают участки ДНК, убирая нежелательные вставки,
- 38. Слайд 38
- 39. Под ростом понимают согласованное увеличение количества всех
- 40. Иными словами, культуры, растущие сбалансированно, сохраняют постоянный
- 41. Кривая роста бактериальной популяции: 1 –
- 42. Лаг-фаза, или фаза задержанного роста, охватывает промежуток
- 43. Фаза экспоненциального (логарифмического) роста характеризуется постоянной максимальной
- 44. Стационарная фаза наступает тогда, когда число жизнеспособных
- 45. В стационарную фазу роста поведение клеток в
- 46. В фазе отмирания происходит экспоненциальное снижение числа
- 47. Культивирование иммобилизованных клеток микроорганизмов находит широкое применение
- 48. Под иммобилизацией понимают такую процедуру, в результате
- 49. Первым иммобилизованным ферментом, примененным в промышленном масштабе,
- 50. Преимущества использования иммобилизованных ферментов: 1. Чистые препараты
- 51. Иммобилизованный (гетерогенный) катализатор легко отделить от реакционной
- 52. Иммобилизация фермента даёт возможность регулировать их каталитическую
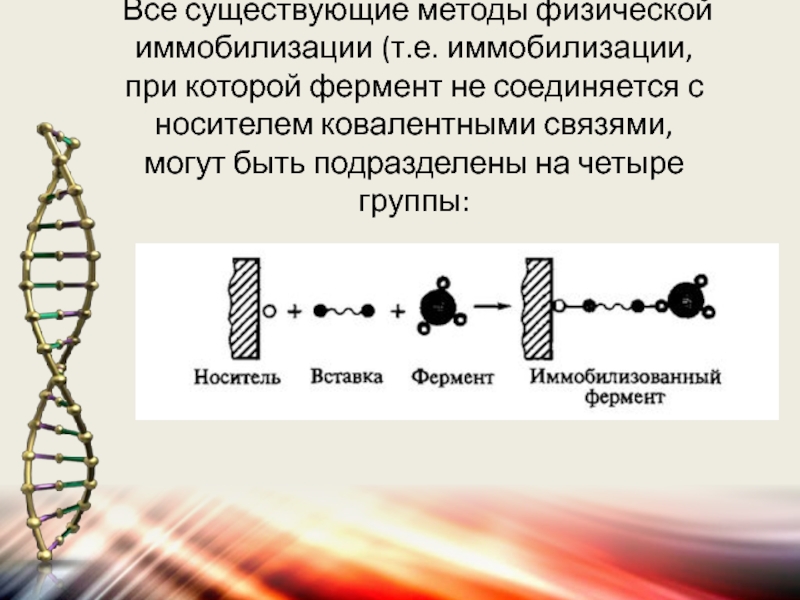
- 53. Все существующие методы физической иммобилизации (т.е. иммобилизации,
- 54. 1) адсорбция на поверхности нерастворимого носителя; 2)
- 55. Слайд 55
- 56. Основные требования, которым должны соответствовать носители:- Высокая
- 57. - Легкое перевода в реакционно-способную форму (активация):-
- 58. В зависимости от природы носители делятся на:
- 59. К преимуществам природных носителей следует отнести:
- 60. Из природных аминосахаридов в качестве носителей для
- 61. Синтетические полимерные носители включают полимеры на основе
- 62. Носители неорганической природы представляют собой материалы изготовленные
- 63. При адсорбционной иммобилизации белковая молекула удерживается на
- 64. Эффективность адсорбции молекулы белка на носителе определяется
- 65. Иммобилизация ферментов путём включения в гель. Способ
- 66. 1. Фермент вводят в водный раствор мономера,
- 67. Метод инкапсулирования разработан в 1974 г. и
- 68. Метод включения водных растворов ферментов в липосомыВпервые
- 69. Оставшуюся тонкую плёнку липидов выдерживают в водном
- 70. Химические методы иммобилизации ферментов. Представляют иммобилизацию ферментов
- 71. СПАСИБО ЗА ВНИМАНИЕ!
- 72. Скачать презентанцию
Физиология прокариотЛекция № 6
Слайды и текст этой презентации
Слайд 5Физиоло́гия (от греческого φύσις — природа и λόγος — знание) — наука о
сущности живого, жизни в норме и при патологиях, то есть
о закономерностях функционирования и регуляции биологических систем разного уровня организацииСлайд 6Питание клеток микроорганизмов – включение в метаболические реакции любого характера
тех или иных соединений внешней среды. Питательным веществом следует считать
любое химическое вещество, которое способно удовлетворять энергетические потребности клетки либо анаболические функции, либо те и другие.Слайд 7К макроэлементам (биогенным) относятся десять элементов, содержащихся в основных биополимерах
всех организмов: С, O, H, N, S, P, K, Ca,
Mg, Fe. Микроэлементы включают в себя Mn, Mo, Zn, Cu, Co, Ni, Ba, B, Cr, Na, Se, Si, W и другие, однако в них нуждаются не все организмы.Слайд 8Некоторые виды микроорганизмов не способны сами синтезировать отдельные органические вещества:
аминокислоты, азотистые основания, витамины, вследствие чего не могут расти при
их отсутствии в питательной среде. Такие соединения являются для них факторами роста. Микроорганизмы, нуждающиеся в определенном факторе роста, называются ауксотрофными в отличие от прототрофных, которые способны синтезировать все необходимые для них соединения.Слайд 9По способу поступления питательных веществ в клетки микроорганизмов различают два
типа питания: осмотрофное и фаготрофное. Подавляющее большинство микроорганизмов питается по
осмотрофному типу: поглощают растворенные в воде вещества. Фаготрофное питание у большинства микроорганизмов невозможно, так как их клетки имеют ригидные клеточные стенки, и поэтому они не способны захватывать твердые частицы.Слайд 10В зависимости от того, какие питательные вещества – органические или
неорганические – являются донорами электронов, все микроорганизмы также подразделяют на
две группы. Органотрофными являются организмы, использующие в качестве доноров электронов органические соединения, к литотрофным относятся организмы, способные использовать в качестве доноров электронов неорганические вещества (H2, NH3, H2S, CO, Fe2+ и т. д.).Слайд 12Среди бактерий выделяют:
1) прототрофы (способны сами синтезировать необходимые вещества из более
простых соединений);
2) ауксотрофы (являются мутантами прототрофов, потерявшими гены; ответственны за синтез
некоторых веществ - витаминов, аминокислот, поэтому нуждаются в этих веществах в готовом виде).Слайд 13Метаболиты и ионы поступают в микробную клетку различными путями.
Пути поступления
метаболитов и ионов в микробную клетку.
1. Пассивный транспорт (без энергетических затрат):
1) простая
диффузия;2) облегченная диффузия (по градиенту концентрации, с помощью белков-переносчиков).
2. Активный транспорт (с затратой энергии, против градиента концентрации; при этом происходит взаимодействие субстрата с белком-переносчиком на поверхности цитоплазматической мембраны).
Слайд 15Встречаются модифицированные варианты активного транспорта - перенос химических групп. В
роли белков-переносчиков выступают фосфорилированные ферменты, поэтому субстрат переносится в фосфорилированной
форме. Такой перенос химической группы называется транслокацией.Слайд 16Особенности метаболизма у бактерий:
1) многообразие используемых субстратов;
2) интенсивность процессов метаболизма;
3) направленность всех процессов
метаболизма на обеспечение процессов размножения;
4) преобладание процессов распада над процессами синтеза;
5) наличие
экзо- и эндоферментов метаболизма.Слайд 18В процессе метаболизма выделяют два вида обмена:
1) пластический (конструктивный):
а) анаболизм (с затратами
энергии);
б) катаболизм (с выделением энергии);
2) энергетический обмен (протекает в дыхательных мезосомах):
а) дыхание;
б) брожение.
Слайд 19В зависимости от акцептора протонов и электронов среди бактерий различают
аэробы, факультативные анаэробы и облигатные анаэробы.
Слайд 20Факультативные анаэробы в кислородных условиях используют процесс дыхания, в бескислородных
- брожение. Для облигатных анаэробов характерно только брожение, в кислородных
условиях наступает гибель микроорганизма из-за образования перекисей, идет отравление клетки.Слайд 21Токсичность молекулярного кислорода для анаэробных бактерий связана с отсутствием в
их клетках механизмов, обеспечивающих детоксикацию сильных окислителей, которые образуются в
его присутствии в процессе развития.Многие клетки синтезируют ферменты каталазу и пероксидазу, защищающие их содержимое от токсичного действия радикалов кислорода:
Слайд 23В микробной клетке ферменты являются биологическими катализаторами. По строению выделяют:
1) простые
ферменты (белки);
2) сложные; состоят из белковой (активного центра) и небелковой частей;
необходимы для активизации ферментов.Слайд 24Различают также:
1) конституитивные ферменты (синтезируются постоянно независимо от наличия субстрата);
2) индуцибельные ферменты
(синтезируются только в присутствии субстрата).
Слайд 25По месту действия выделяют:
1) экзоферменты (действуют вне клетки; принимают участие в
процессе распада крупных молекул, которые не могут проникнуть внутрь бактериальной
клетки; характерны для грамположительных бактерий);2) эндоферменты (действуют в самой клетке, обеспечивают синтез и распад различных веществ).
Слайд 27Основными видами пластического обмена являются:
1) белковый;
2) углеводный;
3) липидный;
4) нуклеиновый.
Слайд 28Белковый обмен характеризуется катаболизмом и анаболизмом. В процессе катаболизма бактерии
разлагают белки под действием протеаз с образованием пептидов.
Под действием
пептидаз из пептидов образуются аминокислоты.Распад белков в аэробных условиях называется тлением, в анаэробных - гниением.
Слайд 29В результате распада аминокислот клетка получает ионы аммония, необходимые для
формирования собственных аминокислот. Бактериальные клетки способны синтезировать все 20 аминокислот.
Ведущими из них являются аланин, глютамин, аспарагин. Они включаются в процессы переаминирования и трансаминирования.Слайд 30В углеводном обмене у бактерий катаболизм преобладает над анаболизмом. Сложные
углеводы внешней среды могут расщеплять только те бактерии, которые выделяют
ферменты - полисахаридазы. Полисахариды расщепляются до дисахаров, которые под действием олигосахаридаз распадаются до моносахаров, причем внутрь клетки может поступать только глюкоза.Слайд 31Часть ее идет на синтез собственных полисахаридов в клетке, другая
часть подвергается дальнейшему расщеплению, который может идти по двум путям:
по пути анаэробного распада углеводов - брожению (гликолизу) и в аэробных условиях - по пути горения.Слайд 32В зависимости от конечных продуктов выделяют следующие виды брожения:
1) спиртовое;
2) пропионионово-кислое;
3) молочнокислое;
4) маслянокислое;
5) бутилденгликолевое.
Слайд 34Наряду с основным анаэробным распадом (гликолизом) могут быть вспомогательные пути
расщепления углеводов (пентозофосфатный, кетодезоксифосфоглюконатный и др.). Они отличаются ключевыми продуктами
и реакциями.Слайд 35Липидный обмен осуществляется с помощью ферментов - липопротеиназ, летициназ, липаз,
фосфолипаз.
Липазы катализируют распад нейтральных жирных кислот, т. е. ответственны за отщепление
этих кислот от глицерина. При распаде жирных кислот клетка запасает энергию. Конечным продуктом распада является ацетил-КоА.Слайд 36Нуклеиновый обмен бактерий связан с генетическим обменом. Синтез нуклеиновых кислот
имеет значение для процесса деления клетки. Синтез осуществляется с помощью
ферментов: рестриктазы, ДНК-полимеразы, лигазы, ДНК-зависимой-РНК-полимеразы.Слайд 37Рестриктазы вырезают участки ДНК, убирая нежелательные вставки, а лигазы обеспечивают
сшивку фрагментов нуклеиновой кислоты. ДНК-полимеразы ответственны за репликацию дочерней ДНК
по материнской. ДНК-зависимые-РНК-полимеразы отвечают за транскрипцию, осуществляют построение РНК на матрице ДНК.Слайд 39Под ростом понимают согласованное увеличение количества всех химических компонентов, формирующих
клеточные структуры. Рост клеток обычно сопровождается увеличением их массы и
размеров. Однако эта закономерность наблюдается не всегда, так как в некоторых условиях клетки способны просто накапливать запасные или резервные вещества, т. е. масса может увеличиваться, но роста при этом не наблюдается.Слайд 40Иными словами, культуры, растущие сбалансированно, сохраняют постоянный химический состав. В
условиях сбалансированного роста легко определить величину скорости роста бактериальной популяции
в каждый момент времени, если измерить прирост любого компонента клетки по отношению к его исходному количеству.Удельную скорость роста можно рассчитать по следующим формулам:
Слайд 41 Кривая роста бактериальной популяции: 1 – лаг-фаза; 2 –
экспоненцальная фаза; 3 – стационарная фаза; 4 – фаза отмирания
Слайд 42Лаг-фаза, или фаза задержанного роста, охватывает промежуток времени между инокуляцией
бактерий и достижением ими максимальной скорости деления. В клетках бактерий
в этот период идут в основном процессы, связанные с приспособлением их к условиям культивирования (составу среды, температуре, рН и т. п.).Слайд 43Фаза экспоненциального (логарифмического) роста характеризуется постоянной максимальной скоростью деления клеток
и скоростью роста. Для различных видов бактерий эти величины могут
варьировать в значительных пределах. Например, бактерииE. coli при 37 ºС делятся примерно каждые 20 мин, а бактерии родов Nitrosomonas и Nitrobacter – 5–10 ч. Культуры бактерии E. coli вступают в стационарную фазу при концентрации клеток 2–5 . 109/мл.
Слайд 44Стационарная фаза наступает тогда, когда число жизнеспособных клеток достигает максимума
и не увеличивается, так как скорость размножения бактерий равна скорости
их отмирания.Слайд 45В стационарную фазу роста поведение клеток в бактериальной популяции может
регулировать явление, которое получило название апоптоз. Суть его сводится к
тому, что при исчерпании питательного субстрата голодающая популяция бактерий разделяется на две субпопуляции, одна из которых погибает и подвергается автолизу, клетки же другой популяции, используя продукты автолиза как субстрат, продолжают размножаться.Слайд 46В фазе отмирания происходит экспоненциальное снижение числа живых клеток. Скорость
отмирания бактерий существенно варьирует в зависимости от условий среды и
физиологических особенностей организма.Слайд 47Культивирование иммобилизованных клеток микроорганизмов находит широкое применение в биотехнологии, а
именно в производстве ценных органических веществ, в деградации токсичных природных
и неприродных соединений, а также промышленных отходов, для очистки сточных вод от загрязнений.Слайд 48Под иммобилизацией понимают такую процедуру, в результате которой молекула фермента
тем или иным способом прикрепляется к определенным объектам (носителей), нерастворимых
в воде. Эти объекты вместе с ферментом легко отделяются от раствора после завершения реакции. Химическое «пришивание» фермента к носителю закрепляет конформацию фермента, и является причиной повышения устойчивости и снижения лабильности.Слайд 49Первым иммобилизованным ферментом, примененным в промышленном масштабе, была аминоацилаза. Она
была использована в Японии в 1969 г. для производства аминокислот,
добавляемых в корм животных. На мировом рынке эта продукция пользуется большим спросом.Слайд 50Преимущества использования иммобилизованных ферментов: 1. Чистые препараты ферментов неустойчивы при длительном
хранении. 2. Многократное использование ферментов затруднено в промышленных условиях, т.к. их
сложно отделить от реагентов.Слайд 51Иммобилизованный (гетерогенный) катализатор легко отделить от реакционной среды. Это обусловливает: 1)
возможность остановки реакции в любой нужный момент: 2) повторное использование катализатора; 3)
получение конечного продукта, не загрязнённого ферментом.Слайд 52Иммобилизация фермента даёт возможность регулировать их каталитическую активность за счёт
изменения свойств носителя. Иммобилизация представляет собой включение фермента в такую среду,
в которой для него доступной оказывается лишь ограниченная часть общего объёма.Слайд 53Все существующие методы физической иммобилизации (т.е. иммобилизации, при которой фермент
не соединяется с носителем ковалентными связями, могут быть подразделены на
четыре группы:Слайд 541) адсорбция на поверхности нерастворимого носителя; 2) включение в поры геля; 3)
пространственное разделение фермента от остальной части с помощью полупроницаемой мембраны; 4)
введение фермента в двухфазную реакционную среду, в которой он растворим, но может находиться только в одной из фаз.Слайд 56Основные требования, которым должны соответствовать носители:
- Высокая химическая и биологическая
стойкость;
- Высокая механическая прочность;
- Достаточная проницаемость для фермента и субстратов;
-
Высокая пористость;- Возможность получения в виде удобных в технологическом отношении форм (гранул, мембран, труб, листов и т.д.);
Слайд 57- Легкое перевода в реакционно-способную форму (активация):
- Высокая гидрофильность, которая
обеспечивает возможность проведения реакции связывания фермента с носителем в водной
среде;- Невысокая стоимость.
Слайд 58В зависимости от природы носители делятся на: 1. Органические материалы; 2. Неорганические
материалы.
Органические полимерные носители можно разделить на 2 класса:
а) природные;
б) синтетические.
В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют: белковые; полисахаридные; липидные носители, а среди синтетических: полиметиленовые; полиамидные; полиэфирные носители.
Слайд 59
К преимуществам природных носителей следует отнести:
Доступность;
2. Полифункциональность;
3. Гидрофильность,
а
к недостаткам – высокую стоимость. Из полисахаридов для иммобилизации наиболее часто
используют: целлюлозу, декстран, агарозу и их производные. Для придания химической устойчивости их линейные цепи поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры легко вводят различные ионогенные группировки.Слайд 60Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин,
который в значительных количествах накапливается в виде отходов в процессе
промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру. Среди белков практическое применение в качестве носителей нашли структурные протеины, такие как: кератин, фиброин, коллаген и продукт переработки коллагена – желатин.Слайд 61Синтетические полимерные носители включают полимеры на основе стирола, акриловой кислоты,
поливинилового спирта, полиамидные и полиуретановые поли меры.
Их преимущество:
1.
Механическая прочность; 2. Возможность варьирования в широких пределах величины пор и введения различных функциональных групп.
Синтетические полимеры воспроизведены в таких изделиях, как трубы, волокна, гранулы. Все эти свойства полезны для разных способов иммобилизации ферментов.
Слайд 62Носители неорганической природы представляют собой материалы изготовленные из стекла, глины,
керамики, графитовой сажи, а также оксиды металлов. Их можно подвергать
химической модификации, для чего носители покрывают плёнкой оксидов алюминия, титана, циркония. Или обрабатывают органическими полимерами. Преимущество неорганических носителей:лёгкость регенерации.
Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.