Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
S-образная кривая зависимости скорости реакции от концентрации субстрата
Содержание
- 1. S-образная кривая зависимости скорости реакции от концентрации субстрата
- 2. S-образная кривая зависимости скорости реакции от концентрации
- 3. Работа регуляторных субъединиц АКТ-азыПротекание реакции во времени
- 4. Кооперативное связывание Аллостерические ферменты обладают свойством кооперативности:
- 5. Коэффициент Хилла h – безразмерная величина, характеризующая
- 6. Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5
- 7. Для изостерических ферментов, у которых кооперативного взаимодействия
- 8. Особенности строения и функционирования аллостерических ферментов:- обычно
- 9. - аллостерические ферменты обладают свойством кооперативности;- регуляция
- 10. Эффект кооперативности:Присоединение первой молекулы соответствующего лиганда (субстрата
- 11. Кооперативные эффекты подразделяют на гомотропные и гетеротропные.
- 12. У аллостерических ферментов, так же как и
- 13. Скачать презентанцию
Слайды и текст этой презентации
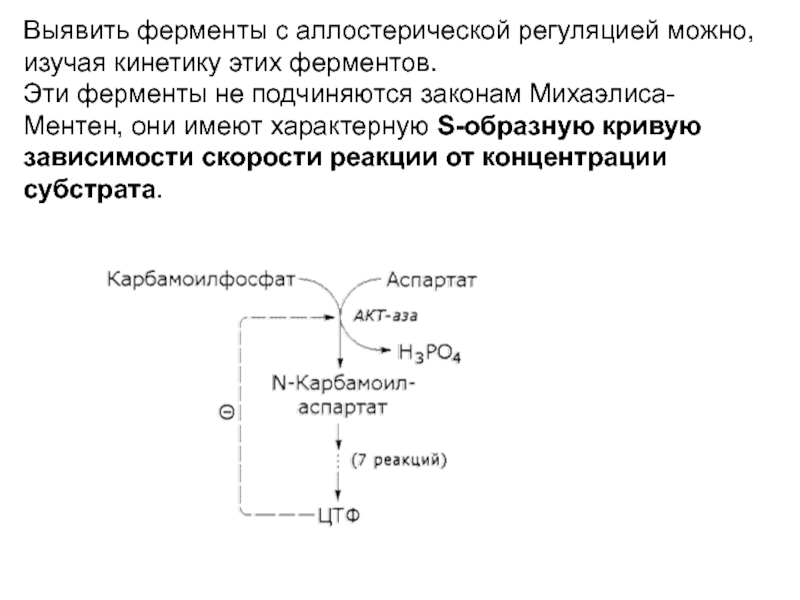
Слайд 1Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов.
кривую зависимости скорости реакции от концентрации субстрата.
Слайд 2
S-образная кривая зависимости скорости реакции от концентрации субстрата
Арчибальд Хилл
1886-1977
Английский физиолог
Нобелевская
премия по
физиологии и медицине
1922 г.
График зависимости скорости реакции от
концентрации субстрата в виде S-образной
кривой на примере АКТ-азы: без эффектора, с АТР, с СTP. Субстрат – аспартат.
Впервые S-образные функции для насыщения были
получены в 1909 году (А. Хилл)
Слайд 3
Работа регуляторных субъединиц АКТ-азы
Протекание реакции во времени приводит к появлению
СTP – конечного
продукта цепи. По мере накопления СTP и
его связывания с ферментом сродство к субстратам снижается и фермент включается в работу только
при гораздо больших концентрациях субстрата. АТР конкурирует с СTP
и может устранять его ингибирующее действие. Регуляция является
обратимой и при изменении в клетке концентрации АТР или СTP скорость
работы фермента изменяется.
Таким образом АКТ-аза обеспечивает постоянное присутствие
в клетке нужных количеств СТР.
Регуляторные субъединицы
СTP
Аллостерический
ингибитор
АТР
Аллостерический
активатор
Слайд 4
Кооперативное связывание
Аллостерические ферменты обладают
свойством кооперативности: взаимодействие эффектора с
аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее
к изменению конформации активного центра и к изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.Слайд 5
Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда
ферментом
Y – степень насыщения, [L] – равновесная концентрация
лиганда и
[L]0,5 – равновесная концентрация лиганда, при которой Y=0,5 от максимального насыщения.
Vmax – максимальная скорость при S0→∞, [S]0,5 – концентрация
субстрата при половине максимальной скорости, которая
входит в уравнение вместо константы Михаэлиса KМ.
Слайд 7Для изостерических ферментов, у которых кооперативного взаимодействия между активными центрами
нет, то есть сродство фермента к субстрату не зависит от
уже присоединенных молекул субстрата, h=1.Положительная кооперативность (h>1) характеризуется тем, что присоединение одной молекулы субстрата к активному центру фермента увеличивает сродство к субстрату остальных активных центров.
S-образные кривые зависимости скорости реакции от концентрации субстрата характерны для положительной кооперативности. Связывание кислорода с гемоглобином, имеющим 4 центра связи, характеризуется параметром Хилла h=2,9.
Отрицательная кооперативность (h<1) характеризуется тем, что присоединение одной молекулы лиганда к активному центру фермента уменьшает сродство к лиганду остальных активных центров.
Слайд 8Особенности строения и функционирования аллостерических ферментов:
- обычно это олигомерные белки,
состоящие из нескольких протомеров (субъединиц);
- они имеют аллостерический центр, пространственно
удалённый от каталитического активного центра;- эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
- аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
Слайд 9- аллостерические ферменты обладают свойством кооперативности;
- регуляция аллостерических ферментов обратима:
отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
-
аллостерические ферменты катализируют ключевые реакции данного метаболического пути.Слайд 10Эффект кооперативности:
Присоединение первой молекулы соответствующего лиганда (субстрата к активному центру
или эффектора к аллостерическому центру) сопровождается конформационными изменениями, которые изменяют
его сродство к субстрату или эффектору.Слайд 11Кооперативные эффекты подразделяют на гомотропные и гетеротропные.
Гомотропные эффекты, при
которых взаимодействия с лигандами могут быть кооперативными и антикооперативными, наблюдаются
для идентичных лигандов, например, для молекул субстрата (а также для молекул кофермента или ингибитора).Гетеротропные эффекты, при которых взаимодействия, также являющиеся либо кооперативными, либо антикооперативными, наблюдаются для молекул различных лигандов.



![S-образная кривая зависимости скорости реакции от концентрации субстрата Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментомY Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментомY – степень насыщения, [L] – равновесная](/img/thumbs/7fee444c793e8a4e97d6f6dce34142bf-800x.jpg)
![S-образная кривая зависимости скорости реакции от концентрации субстрата Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5 Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5](/img/thumbs/96a7f535fa027bd191b7e0ee103fc150-800x.jpg)

























