Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алканы
Содержание
- 1. Алканы
- 2. АлканыАлканами называются насыщенные углеводороды, молекулы которых состоят
- 3. Алканыметан
- 4. Алканыsp3
- 5. АлканыСnН2n+2
- 6. Алканы. Номенклатура.Названия нормальных алканов по заместительной номенклатуре
- 7. Алканы. Номенклатура2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 8. Алканы. Номенклатура
- 9. Алканы. Номенклатура
- 10. Алканы. Номенклатура1) определяют самую длинную цепь атомов
- 11. Алканы. Номенклатура4) при наличии двух и более
- 12. Алканы. Номенклатура3,5-диметил-3-этилоктан
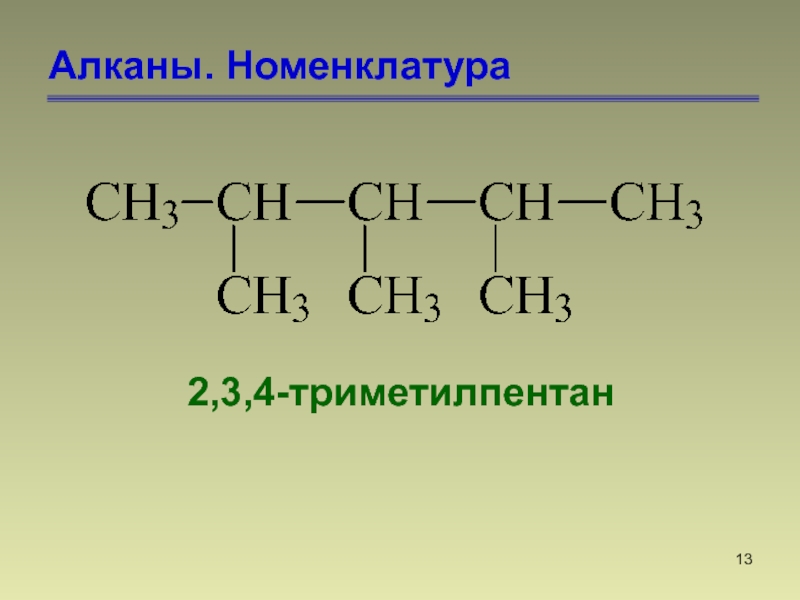
- 13. Алканы. Номенклатура2,3,4-триметилпентан
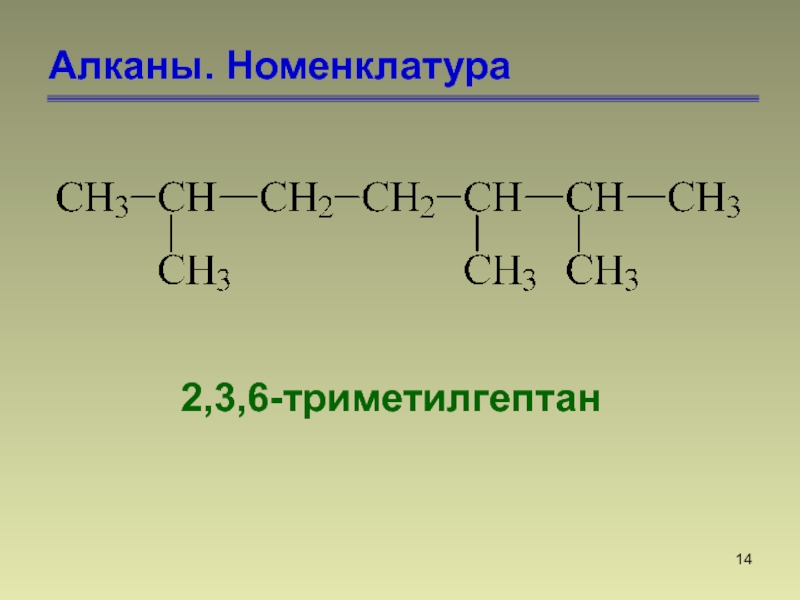
- 14. Алканы. Номенклатура2,3,6-триметилгептан
- 15. Алканы. НоменклатураРациональная номенклатуратетраметилметан(2,2-диметилпропан) метилэтилизопропилметан(2,3-диметилпентан)
- 16. Алканы. НоменклатураСтруктурная изомерия
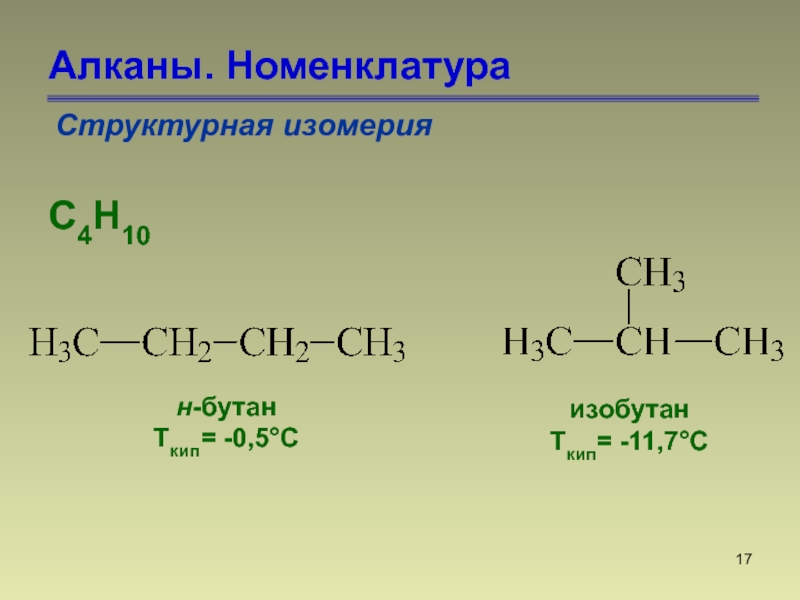
- 17. Алканы. НоменклатураСтруктурная изомерияС4Н10 н-бутан Ткип= -0,5°С изобутан Ткип= -11,7°С
- 18. Алканы. НоменклатураСтруктурная изомерияС5Н12 пентан Ткип= 36.2°С 2-метилбутан Ткип= 28°С 2,2-диметилпропан Ткип= 9.5°С
- 19. Алканы. НоменклатураЧисло изомеров в ряду алканов
- 20. Алканы. Физические свойства
- 21. Алканы. Физические свойстваЗависимость температуры кипения от числа атомов углерода в молекуле алкана
- 22. Алканы. Физические свойстваЗависимость температуры плавления от числа атомов углерода в молекуле алкана
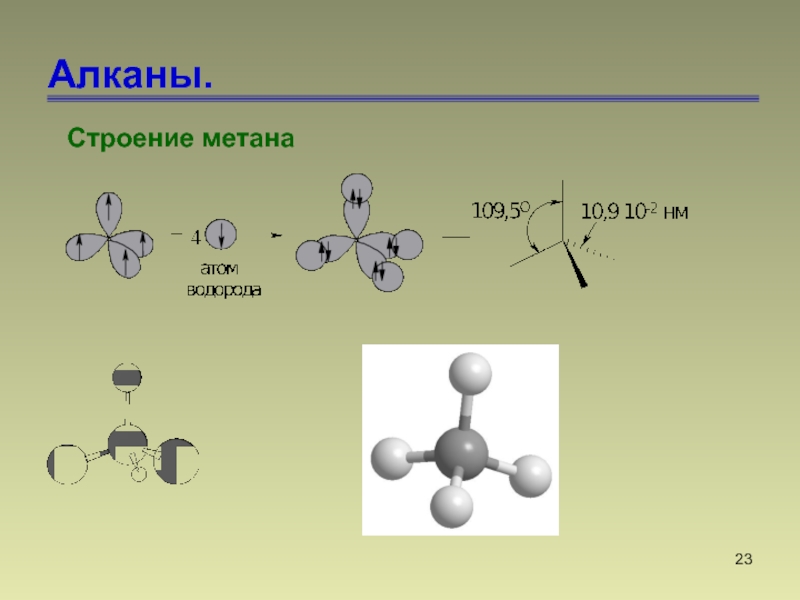
- 23. Алканы. Строение метана
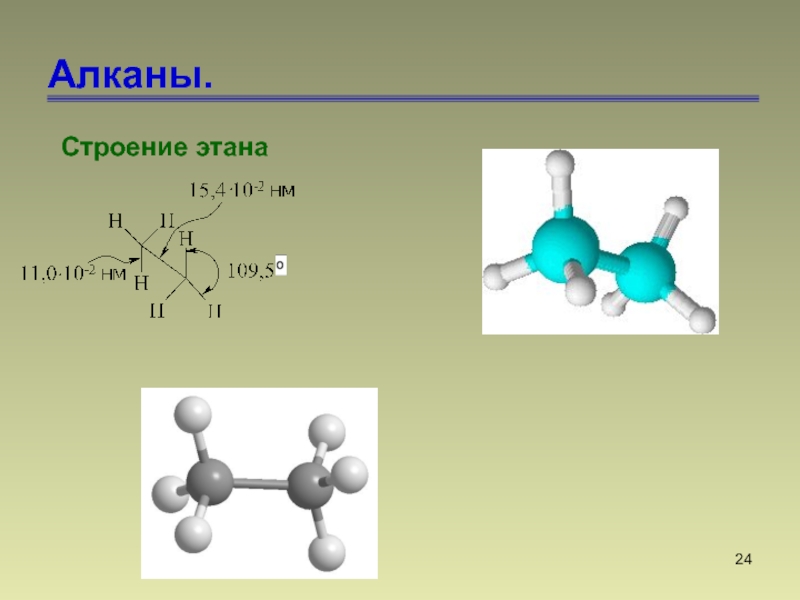
- 24. Алканы. Строение этана
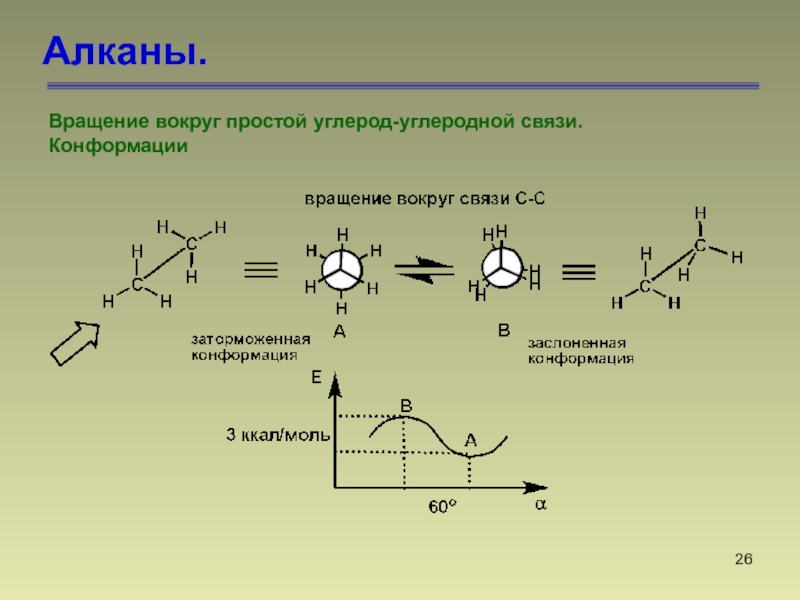
- 25. Алканы. Вращение вокруг простой углерод-углеродной связи. КонформацииКонформация
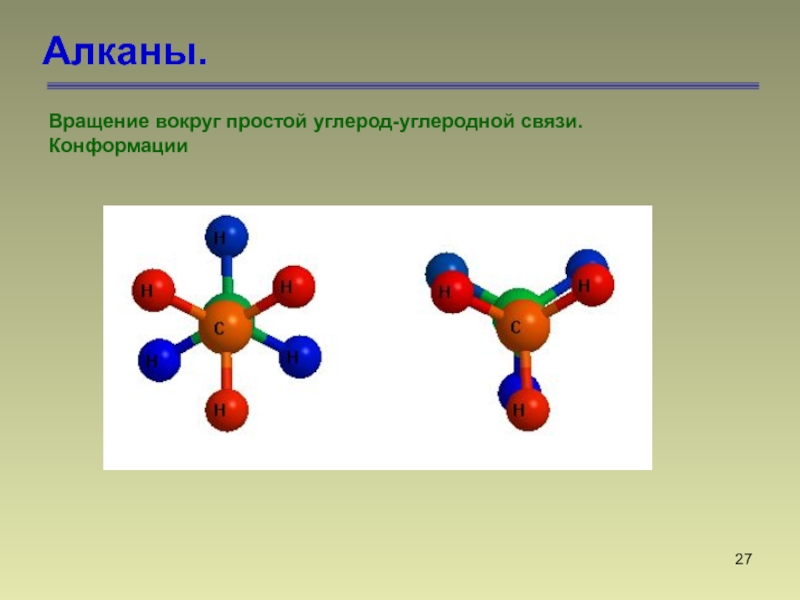
- 26. Алканы. Вращение вокруг простой углерод-углеродной связи. Конформации
- 27. Алканы. Вращение вокруг простой углерод-углеродной связи. Конформации
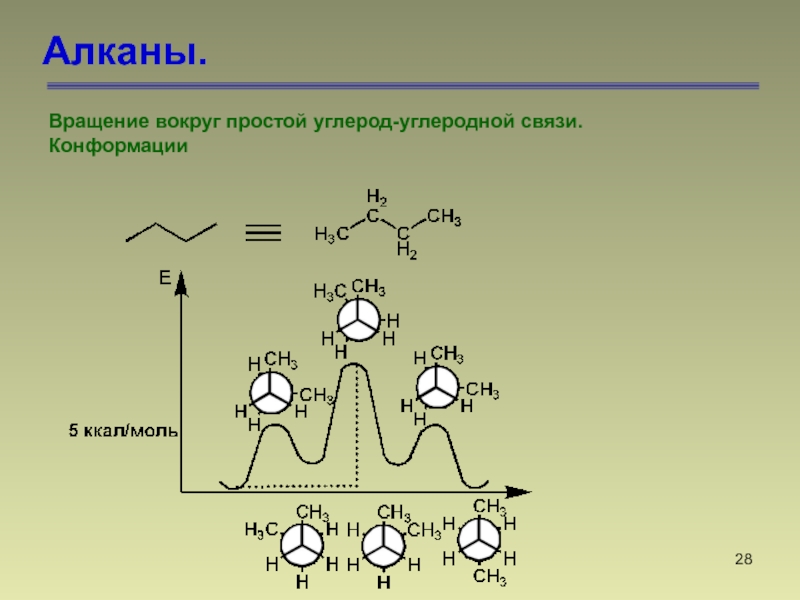
- 28. Алканы. Вращение вокруг простой углерод-углеродной связи. Конформации
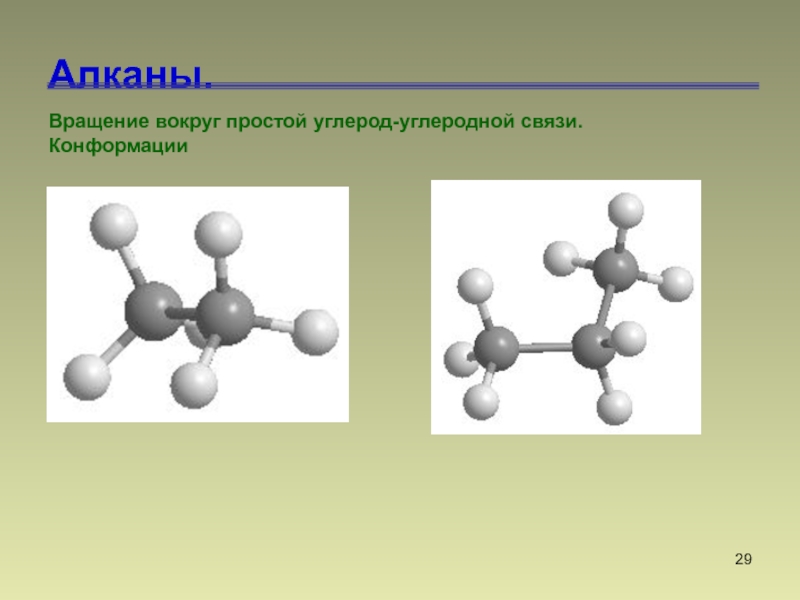
- 29. Алканы. Вращение вокруг простой углерод-углеродной связи. Конформации
- 30. Алканы. Химические свойстваАлканы – малополярные и слабополяризуемые
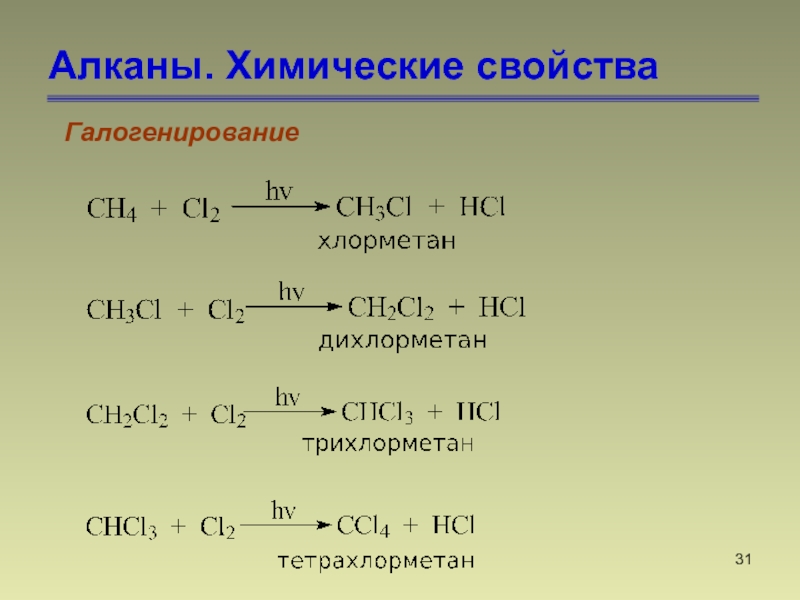
- 31. Алканы. Химические свойстваГалогенирование
- 32. Алканы. Химические свойстваРассмотрим механизм хлорирования метанаГалогенирование
- 33. Алканы. Химические свойстваГалогенирование (Механизм реакции)Инициирование
- 34. Алканы. Химические свойстваГалогенирование (Механизм реакции)Рост цепи
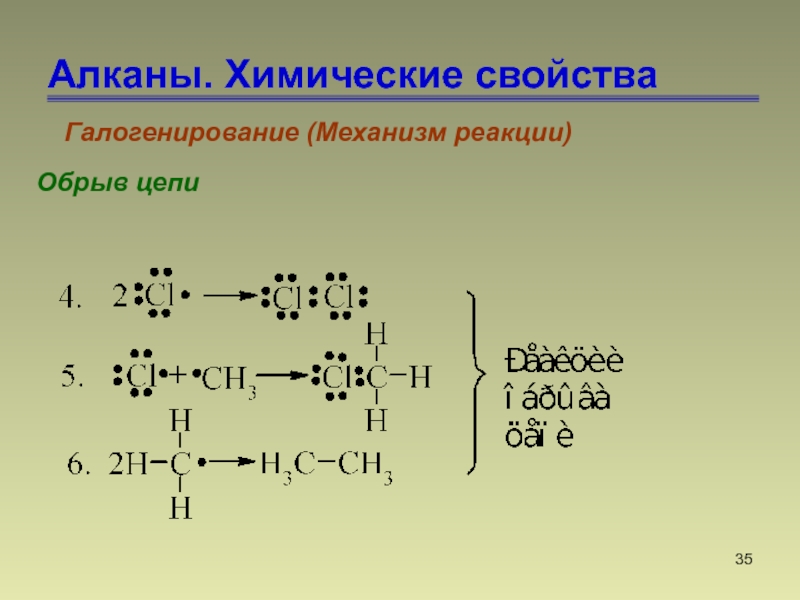
- 35. Алканы. Химические свойстваГалогенирование (Механизм реакции)Обрыв цепи
- 36. Алканы. Химические свойстваГалогенирование (Механизм реакции)Скорость цепной реакции
- 37. Алканы. Химические свойстваСтроение метильного радикала)Один из электронов
- 38. Алканы. Химические свойстваГалогенирование (Механизм реакции)1.Галогенирование начинается только
- 39. Алканы. Химические свойстваГалогенирование (Механизм реакции)Изменение энергии в ходе реакции Реакция хлорирования метанаРеакция бромирования метана
- 40. Алканы. Химические свойстваГалогенирование (Механизм реакции SR )Реакция
- 41. Алканы. Химические свойстваЭнергетическая диаграмма реакции. Связь энергии активации с экзотермичностью.
- 42. .CH4 + Cl.Ea(2)H ..3Cl...Ea(2)=16Ea(3)=4Ea(3)ΔH = - 4HCl
- 43. Алканы. Химические свойстваГалогенирование (Механизм реакции SR )В
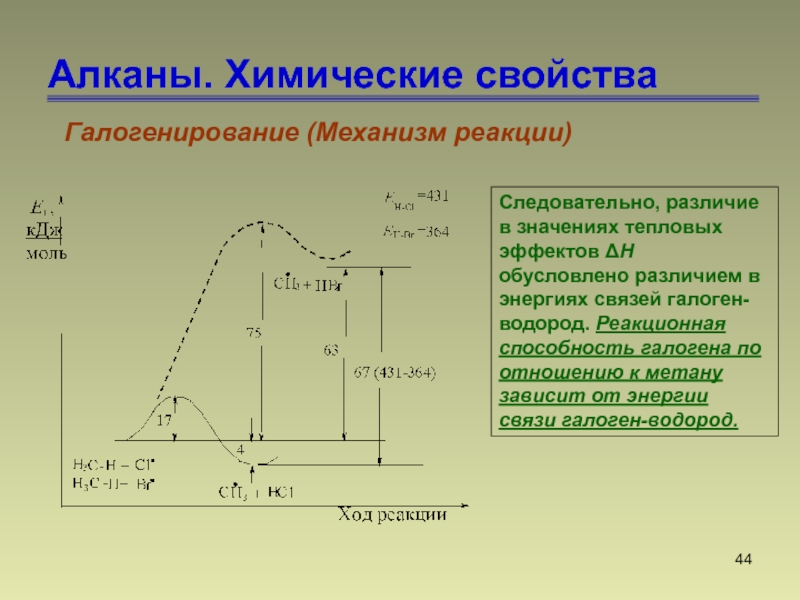
- 44. Алканы. Химические свойстваГалогенирование (Механизм реакции)Следовательно, различие в
- 45. Алканы. Химические свойстваГалогенирование Зависимость реакционной способности галогенов от энергии связи H–Hal
- 46. Алканы. Химические свойстваГалогенирование высших алкановХлорирование изо-бутанаБромирование изо-бутана
- 47. Механизм реакции (SR) хлорирования изо-бутана
- 48. Алканы. Химические свойстваГалогенирование высших алкановОбразование третичного радикала
- 49. Алканы. Химические свойстваГалогенирование высших алкановРяд легкости образования
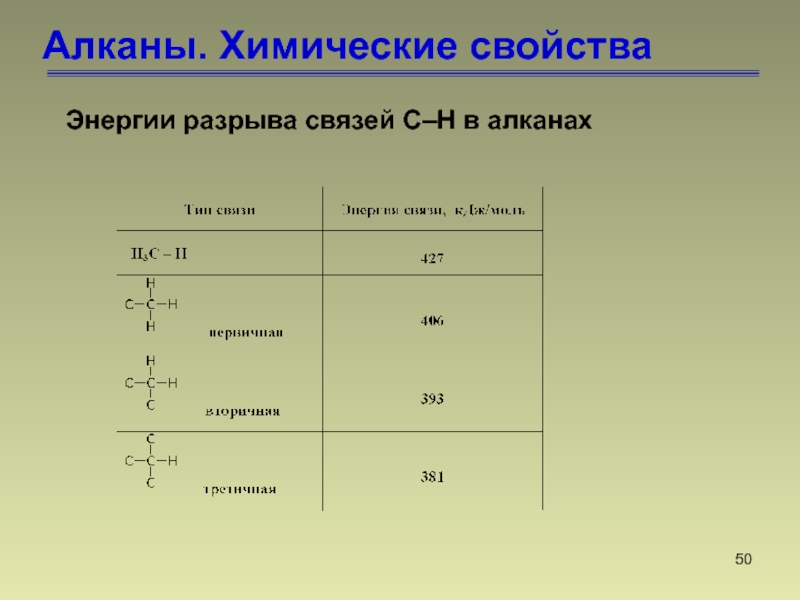
- 50. Энергии разрыва связей С–Н в алканахАлканы. Химические свойства
- 51. Алканы. Химические свойстваГалогенирование высших алкановРяд устойчивости радикалов:третичный
- 52. Алканы. Химические свойстваПричина различной устойчивости радикалов Связь
- 53. Алканы. Химические свойстваГалогенирование высших алкановВо всех случаях,
- 54. Алканы. Химические свойстваСелективность в реакциях хлорирования и
- 55. Алканы. Химические свойстваРеакционная способность первичной, вторичной, третичной
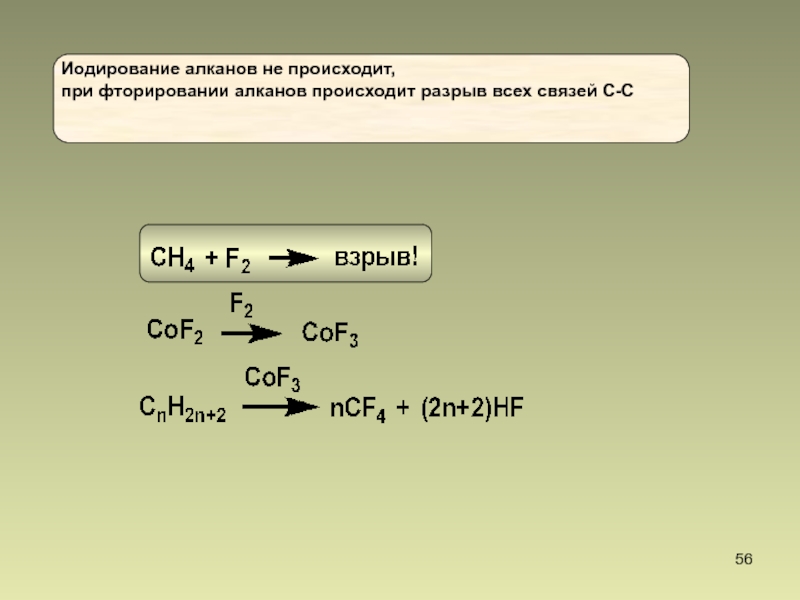
- 56. Слайд 56
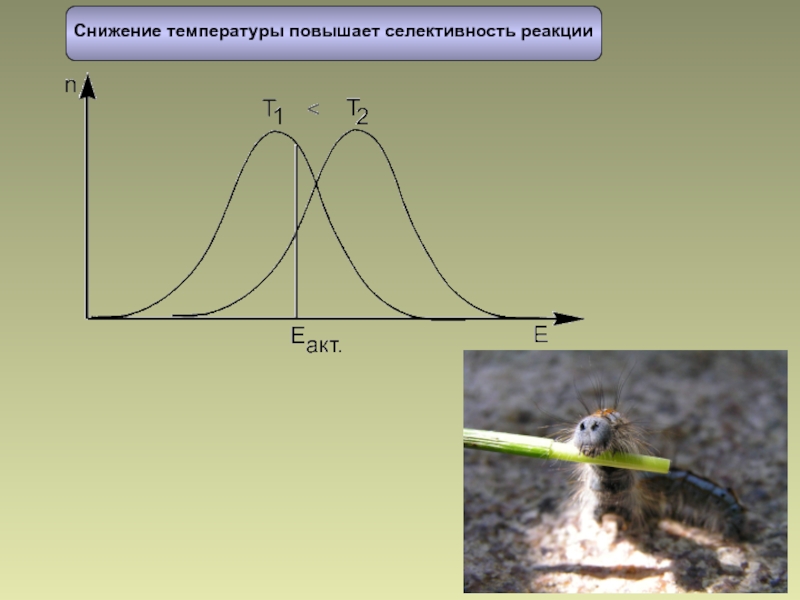
- 57. Снижение температуры повышает селективность реакции
- 58. Пример расчета состава продуктов хлорирования н-бутана.Общая активность
- 59. Алканы. Химические свойстваСульфохлорирование С10H22 + SO2 +
- 60. Алканы. Химические свойстваСульфоокисление В реакциях сульфоокисления и
- 61. Алканы. Химические свойстваНитрование Реакция М.И. КоноваловаЖидкофазное нитрование:
- 62. Алканы. Химические свойстваКоноваловМихаил Иванович1858 - 1906
- 63. Алканы. Химические свойстваОкисление
- 64. Алканы. Химические свойстваОкисление CH4 + H2O →
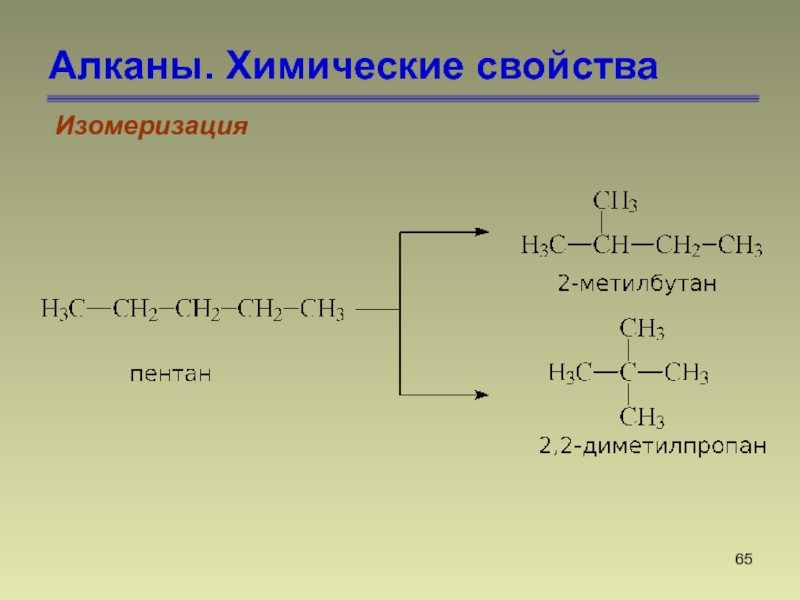
- 65. Алканы. Химические свойстваИзомеризация
- 66. Алканы. Химические свойстваТермическое разложение (Крекинг)В.Г. Шухов (1891)Температура – 470—650°С;Давление – 7 МПа
- 67. Алканы. Химические свойстваКаталитический крекинг Катализаторы – АlСl3,
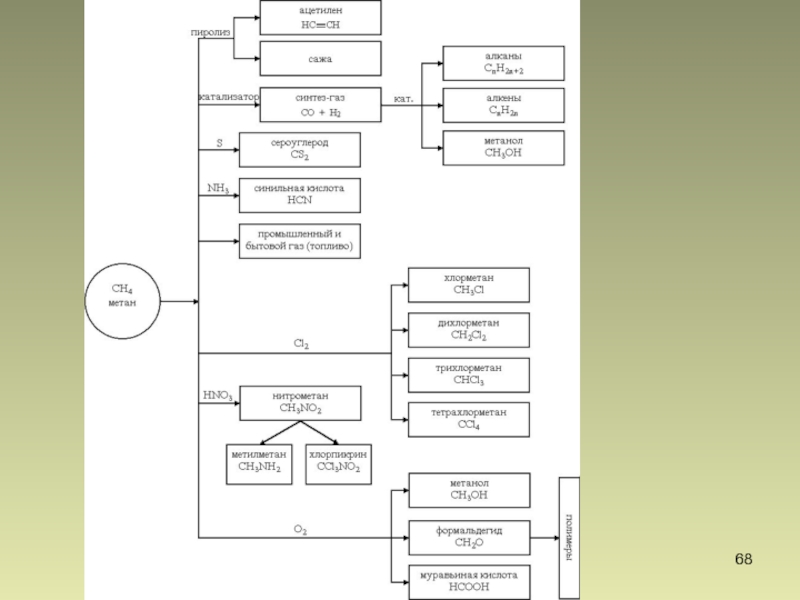
- 68. Слайд 68
- 69. Алканы. Природные источники
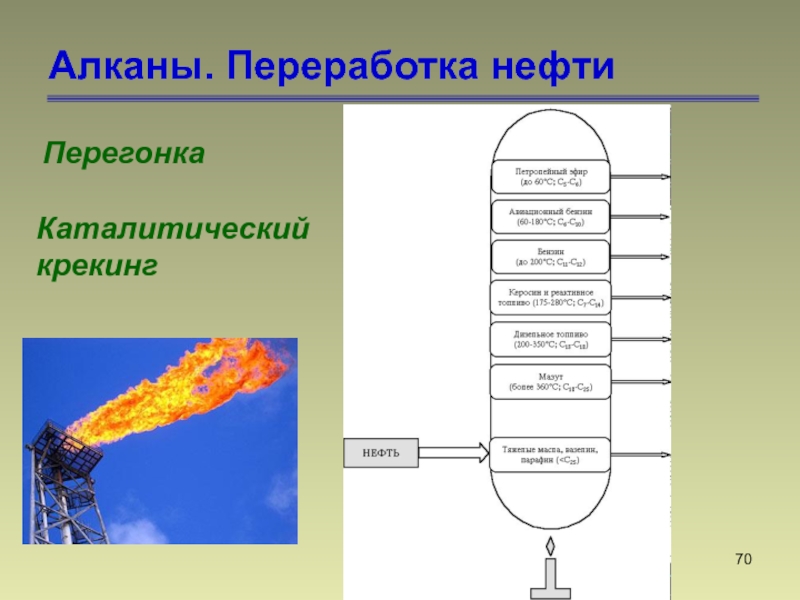
- 70. Алканы. Переработка нефтиПерегонка Каталитическийкрекинг
- 71. Алканы. Способы полученияГазофикация угля (Бертло, 1869) Сжижение угля
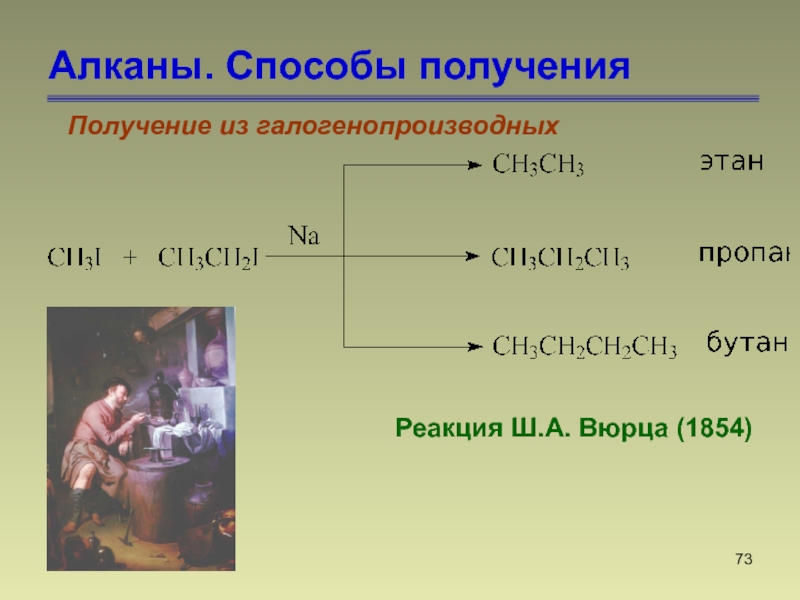
- 72. Алканы. Способы полученияПолучение из галогенопроизводных Реакция Ш.А. Вюрца (1854)
- 73. Алканы. Способы полученияРеакция Ш.А. Вюрца (1854) Получение из галогенопроизводных
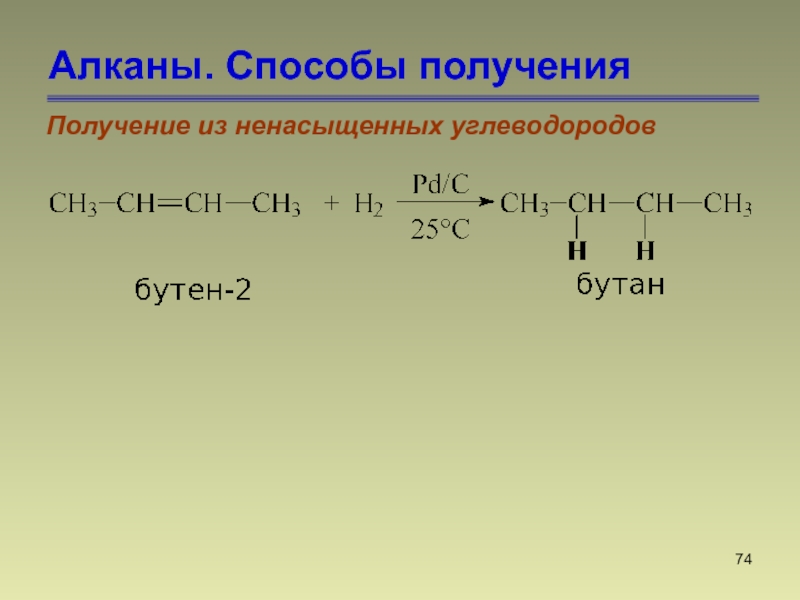
- 74. Алканы. Способы полученияПолучение из ненасыщенных углеводородов
- 75. Алканы. Способы полученияВосстановление галогеналканов
- 76. Алканы. Способы полученияЭлектролиз солей щелочных металлов и карбоновыхкислот (реакция Кольбе)
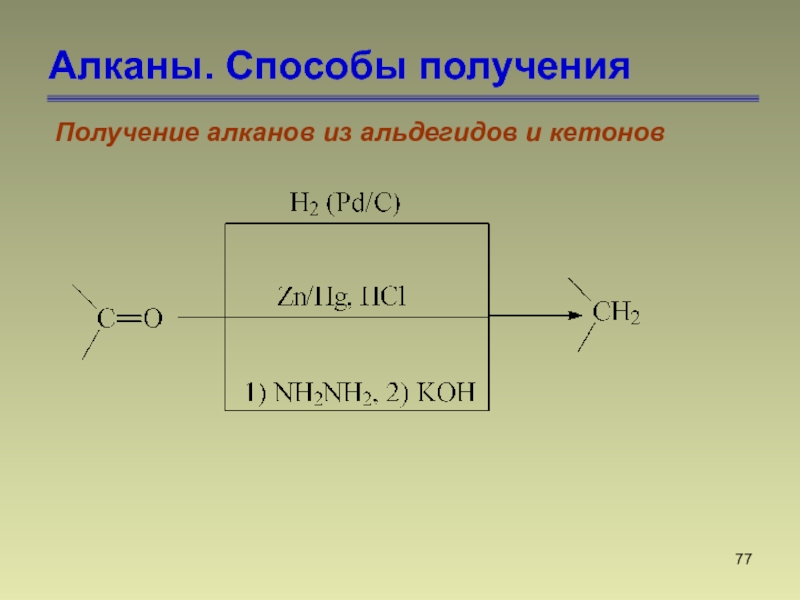
- 77. Алканы. Способы полученияПолучение алканов из альдегидов и кетонов
- 78. Скачать презентанцию
Слайды и текст этой презентации
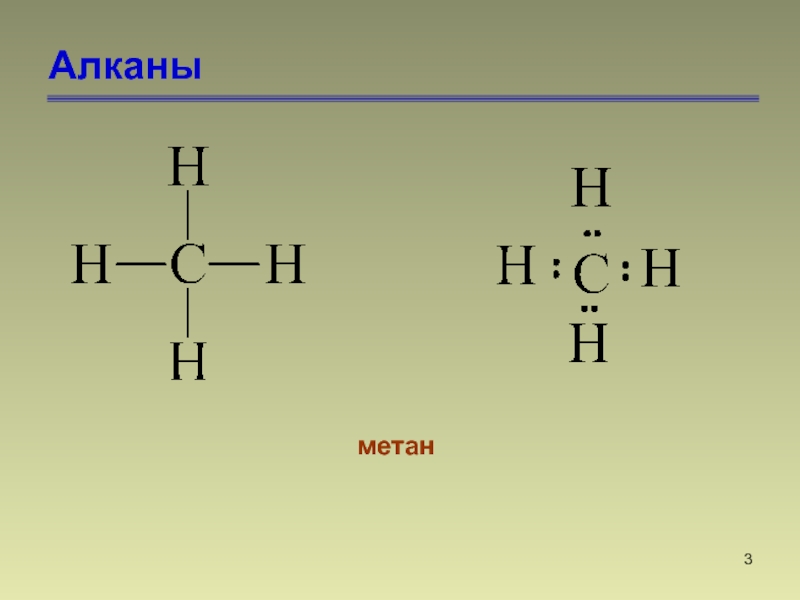
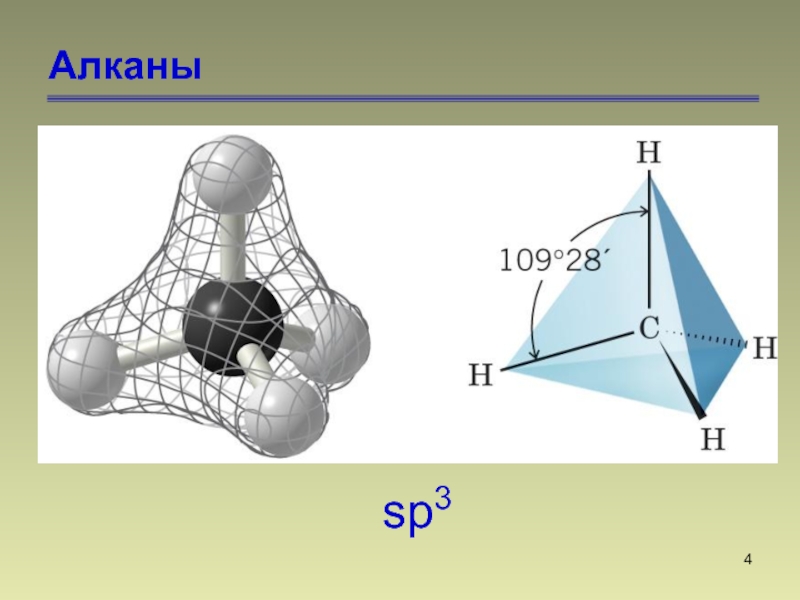
Слайд 2Алканы
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода
и водорода, связанных между собой только σ-связями.
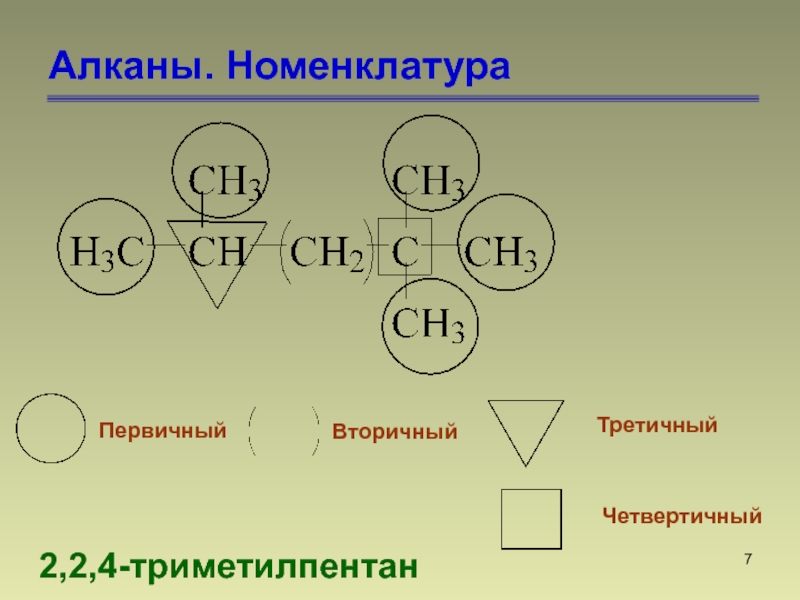
Слайд 10Алканы. Номенклатура
1) определяют самую длинную цепь атомов углерода. Число атомов
углерода в этой цепи служит основой названия;
2) нумеруют главную цепь
с того конца, ближе к которому находится заместитель (углеводородный радикал);3) перед основой названия указывают цифровой номер того атома углерода в главной цепи, у которого находится заместитель, а затем в виде префикса называют этот заместитель;
Систематическая номенклатура ИЮПАК
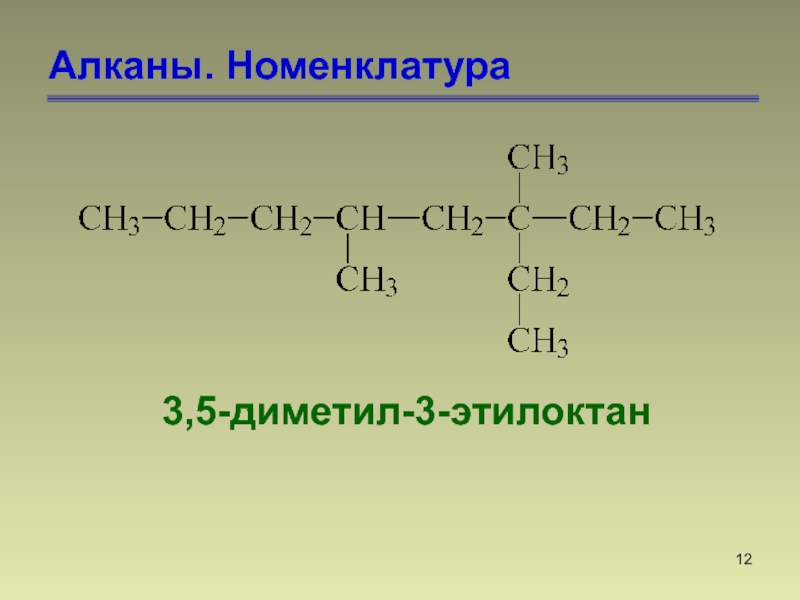
Слайд 11Алканы. Номенклатура
4) при наличии двух и более заместителей нумерацию цепи
производят так, чтобы заместители получили наименьшие номера. В названии алкана
радикалы перечисляются в алфавитном порядке. Перед названием каждого радикала ставят цифру, обозначающую его положение в главной углеродной цепи. Если заместители одинаковые, то к их названию добавляют умножительные приставки ди-, три-, тетра-, пента- и т. д.5) если в главной цепи на равном расстоянии от концов стоят одинаковые радикалы, то нумерацию производят таким образом, чтобы радикалы получили наименьшие номера.
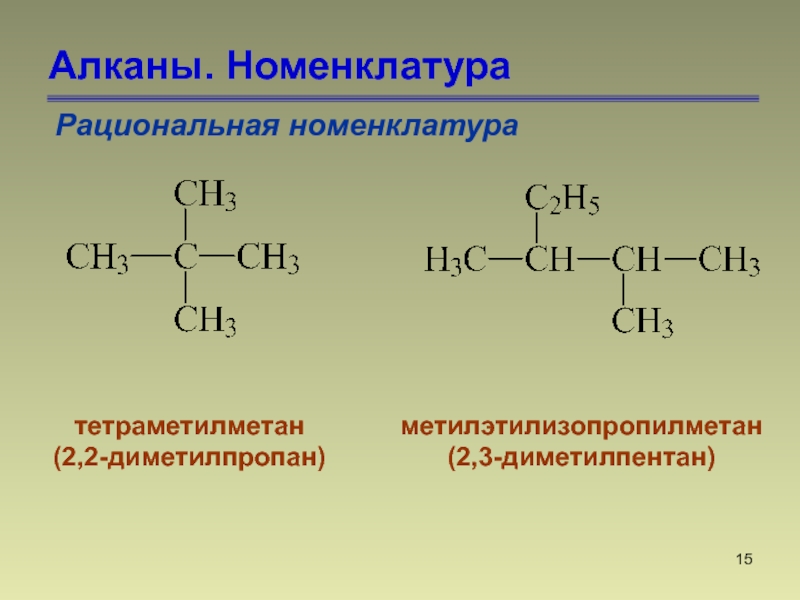
Слайд 15Алканы. Номенклатура
Рациональная номенклатура
тетраметилметан
(2,2-диметилпропан)
метилэтилизопропилметан
(2,3-диметилпентан)
Слайд 18Алканы. Номенклатура
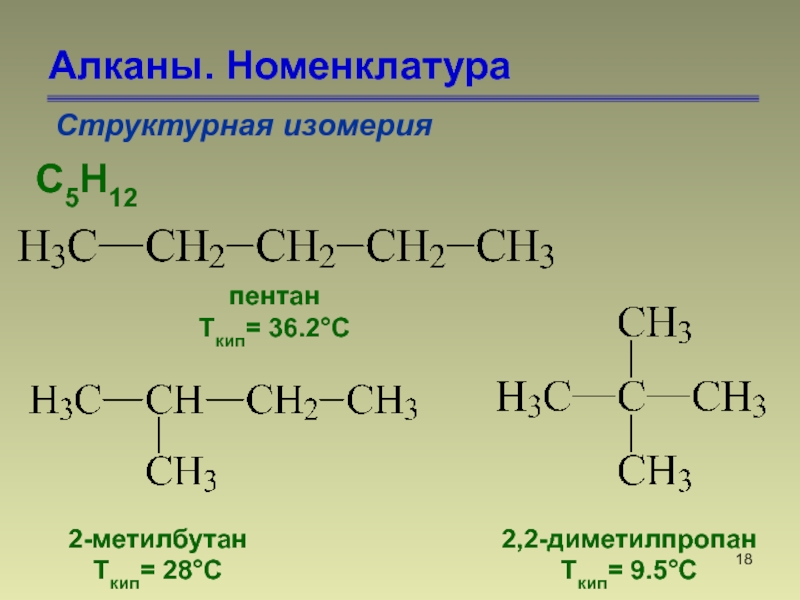
Структурная изомерия
С5Н12
пентан
Ткип= 36.2°С
2-метилбутан
Ткип= 28°С
2,2-диметилпропан
Ткип= 9.5°С
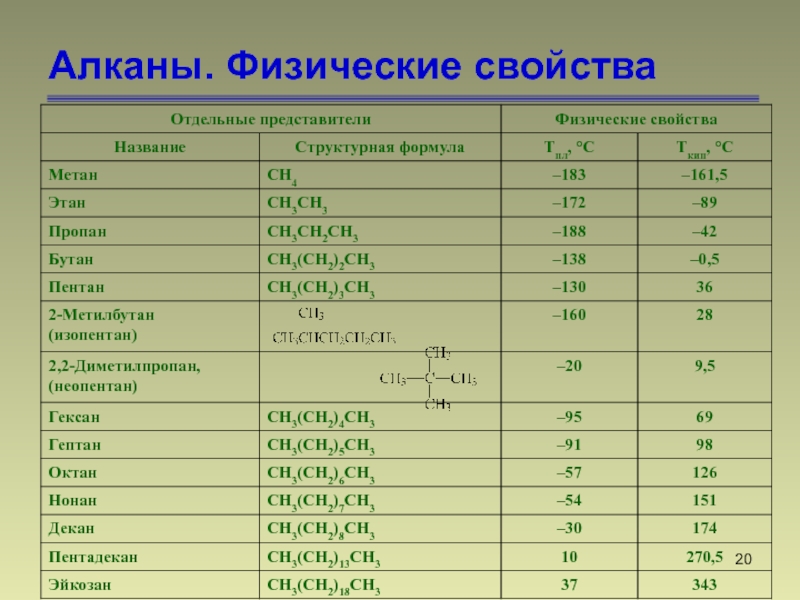
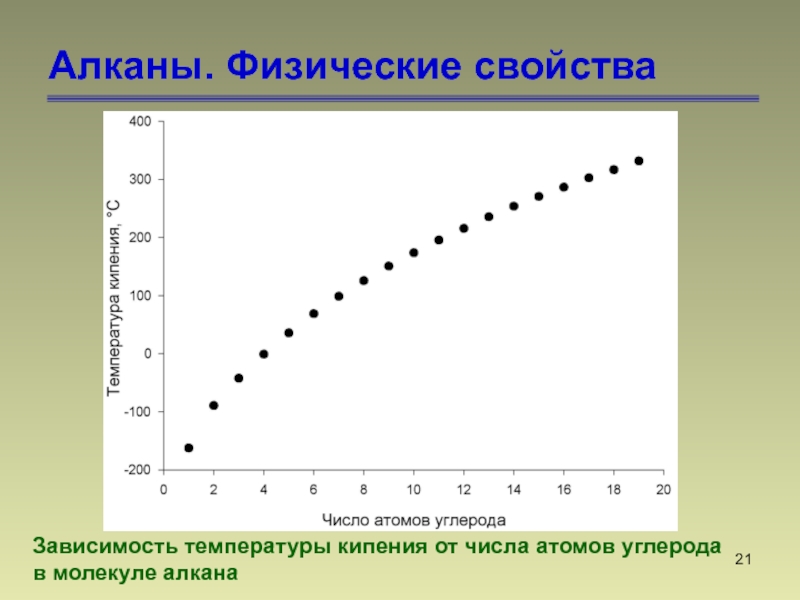
Слайд 21Алканы. Физические свойства
Зависимость температуры кипения от числа атомов углерода
в
молекуле алкана
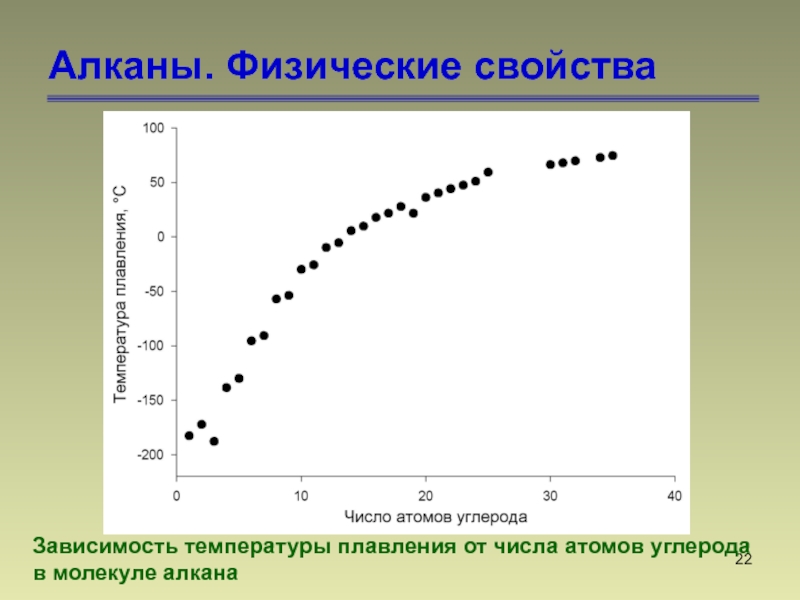
Слайд 22Алканы. Физические свойства
Зависимость температуры плавления от числа атомов углерода
в
молекуле алкана
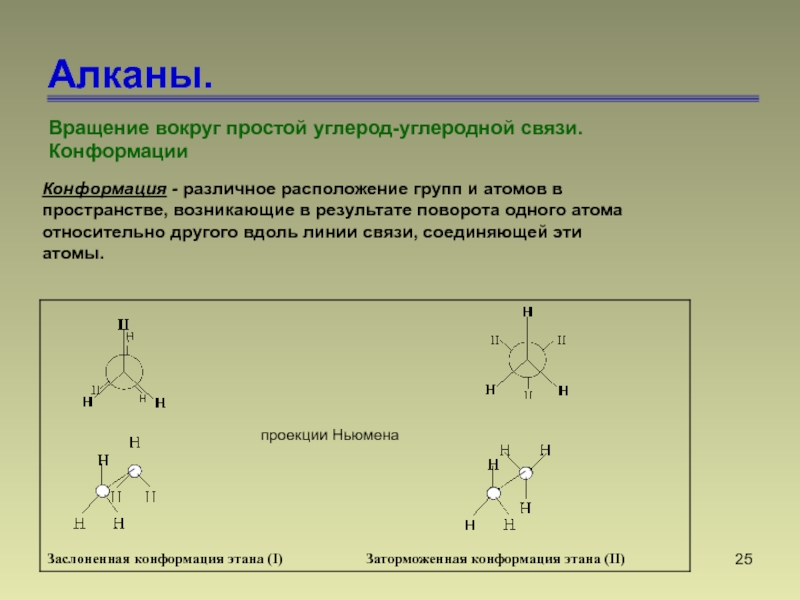
Слайд 25Алканы.
Вращение вокруг простой углерод-углеродной связи.
Конформации
Конформация - различное расположение
групп и атомов в
пространстве, возникающие в результате поворота одного
атома относительно другого вдоль линии связи, соединяющей эти
атомы.
Слайд 30Алканы. Химические свойства
Алканы – малополярные и слабополяризуемые соединения
Гетеролитический (а) и
гомолитический (б) разрыв связей С–Н в метане:
а) СН4 → СН3+
+ Н− + ΔНº ΔНº = 1313 кДж/моль б) СН4 → СН3∙ + Н∙ + ΔНº ΔНº = 435 кДж/моль
в) H3C-CH3 → СН3∙ + ∙СН3 + ΔНº ΔНº = 365 кДж/моль
Характерными реакциями алканов является свободнорадикальное замещение SR незаряженного атома водорода при действии незаряженных свободнорадикальных реагентов: атомов хлора и брома при галогенировании, NO2∙ при нитровании и т.д.
Слайд 36Алканы. Химические свойства
Галогенирование (Механизм реакции)
Скорость цепной реакции сильно снижается в
присутствии соединений, которые взаимодействуют с радикалами и превращают их в
малореакционноспособные частицы. Такие вещества называют ингибиторами. Например, кислород действует как ингибитор. РадикалСН3-О-О∙ значительно менее реакционноспособен, чем радикал Н3C∙ , и не может продолжать цепь.
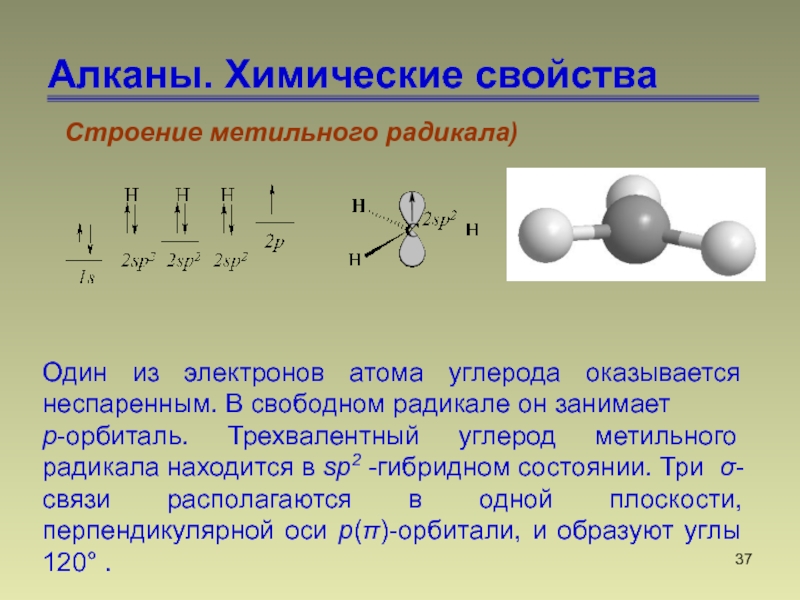
Слайд 37Алканы. Химические свойства
Строение метильного радикала)
Один из электронов атома углерода оказывается
неспаренным. В свободном радикале он занимает
р-орбиталь. Трехвалентный углерод метильного
радикала находится в sр2 -гибридном состоянии. Три σ-связи располагаются в одной плоскости, перпендикулярной оси р(π)-орбитали, и образуют углы 120° .Слайд 38Алканы. Химические свойства
Галогенирование (Механизм реакции)
1.Галогенирование начинается только под действием инициатора
радикальных реакций (УФ-свет, радикальные реагенты, нагревание).
2. Реакционная способность в ряду
галогенов уменьшается в ряду:F2 > Cl2 > Br2 > I2
3. Галогенирование под действием фтора может выйти из под контроля и приобрести взрывной характер.
Слайд 39Алканы. Химические свойства
Галогенирование (Механизм реакции)
Изменение энергии в ходе реакции
Реакция
хлорирования метана
Реакция бромирования метана
Слайд 40Алканы. Химические свойства
Галогенирование (Механизм реакции SR )
Реакция хлорирования – обе
стадии экзотермичны,
бромирование – стадия 2 эндотермична, стадия 3 –
экзотермична Экэотермические реакции сопровождаются выделением тепла.
Эндотерми́ческие реакции — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH > 0, ΔЕ > 0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
Слайд 41Алканы. Химические свойства
Энергетическая диаграмма реакции. Связь энергии активации с экзотермичностью.
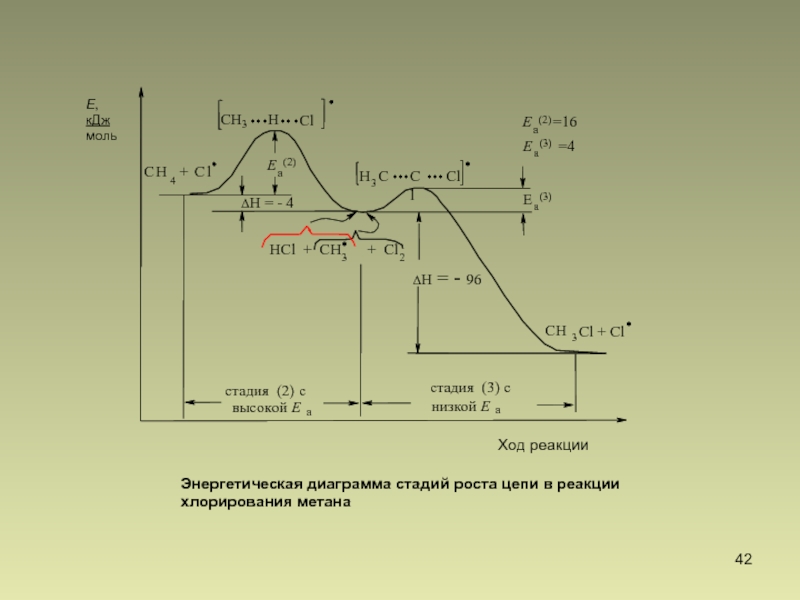
Слайд 42
.
C
H
4
+
C
l
.
E
a
(2)
H
.
.
3
Cl
.
.
.
E
a
(2)
=16
E
a
(3)
=4
E
a
(3)
ΔH = - 4
HCl + CH
3
+
Cl
2
.
ΔH = - 96
стадия (2) с
высокой Е
а
стадия (3) с
низкой Е
а
CH
3
Cl + Cl
.
.
H
3
C
Cl
Cl
.
.
.
.
.
.
CH
.
Е,
кДж
моль
Ход реакции
Энергетическая диаграмма стадий роста цепи в реакции
хлорирования метана
Слайд 43Алканы. Химические свойства
Галогенирование (Механизм реакции SR )
В свободнорадикальных процессах, протекающих
без участия заряженных частиц, фактором, определяющим легкость протекания реакции, является
различие в энергии разрываемых и образующихся связей.В свободнорадикальных реакциях углеводородов энергия активации уменьшается с увеличением экзотермичности.
Сравните энергии активации и тепловые эффекты медленных реакций в процессах хлорирования и бромирования.
Слайд 44Алканы. Химические свойства
Галогенирование (Механизм реакции)
Следовательно, различие в значениях тепловых эффектов
ΔН обусловлено различием в энергиях связей галоген-водород. Реакционная способность галогена
по отношению к метану зависит от энергии связи галоген-водород.Слайд 45Алканы. Химические свойства
Галогенирование
Зависимость реакционной способности галогенов от энергии связи
H–Hal
Слайд 46Алканы. Химические свойства
Галогенирование высших алканов
Хлорирование изо-бутана
Бромирование изо-бутана
Слайд 48Алканы. Химические свойства
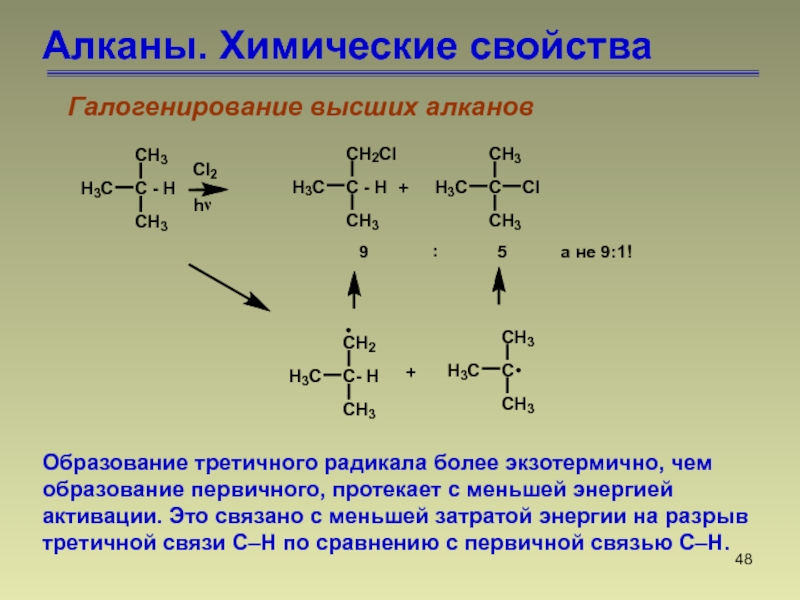
Галогенирование высших алканов
Образование третичного радикала более экзотермично, чем
образование первичного, протекает с меньшей энергией активации. Это связано с
меньшей затратой энергии на разрыв третичной связи C–H по сравнению с первичной связью C–H.Слайд 49Алканы. Химические свойства
Галогенирование высших алканов
Ряд легкости образования радикалов:
третичный >
вторичный > первичный > Н3С ∙
Образование третичного радикала более
экзотермичо, протекает с меньшей энергией активации , меньше затрачивается энергии на разрыв третичной связиСлайд 51Алканы. Химические свойства
Галогенирование высших алканов
Ряд устойчивости радикалов:
третичный > вторичный >
первичный > СН3∙.
Чем устойчивее радикал, тем легче он образуется.
Региоселективными называются такие реакции, в ходе которых
различные положения в молекуле подвергаются химическим превращениям с различными скоростями.
Слайд 52Алканы. Химические свойства
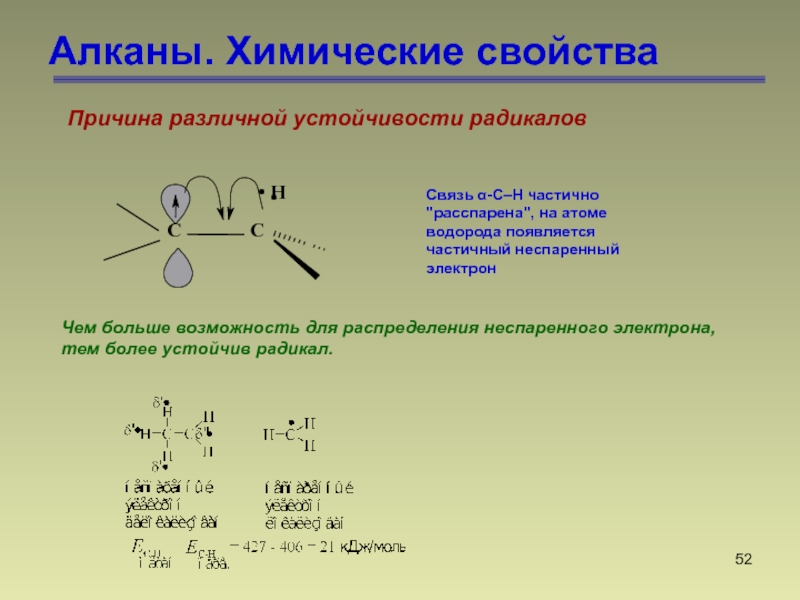
Причина различной устойчивости радикалов
Связь α-C–H частично "расспарена",
на атоме водорода появляется частичный неспаренный электрон
Чем больше возможность для
распределения неспаренного электрона, тем более устойчив радикал.
Слайд 53Алканы. Химические свойства
Галогенирование высших алканов
Во всех случаях, когда в молекуле
присутствует «нештатное» количество электронов: радикал, катион, анион – молекула тем
более устойчива, чемв большей степени эта «нештатность» распределена (делокалазована)!
Слайд 54Алканы. Химические свойства
Селективность в реакциях хлорирования и бромирования
Энергия активации медленной
стадии реакции (SR) RH + Х• → R•+HX
Чем меньше реакционная
способность реагента, тем больше его избирательность (селективность). Слайд 55Алканы. Химические свойства
Реакционная способность первичной, вторичной, третичной связей С–Н в
алканах:
в реакции хлорирования 1: 3,8 : 5,0 (25 0С)
в реакции
бромирования 1 : 82 : 1600 (127 ОС) При температуре около 300 ºС соотношение скоростей реакций различных С–Н связей с хлором приближается к 1:1:1, т.е. состав продуктов монохлорирования будет соответствовать
статистическому распределению.)
Увеличение устойчивости радикала приводит к снижению величины энергии
активации и, как следствие, к увеличению скорости реакции!
Слайд 58Пример расчета состава продуктов хлорирования н-бутана.
Общая активность шести первичных связей
С–Н молекулы бутана равна
6 х 1 = 6, а
четырех вторичных связей 4 х 3,8 = 15,2. Активность всех химических связей 6 + 15,2 = 21,2 - принимается за 100 %. Массовая доля 1-хлорбутана в продуктах реакции составляет (6:21,2) х100 = 28,3 %, остальные (15,2:21,2) х 100 = 71,7 % приходятся на долю 2-хлорбутана.Алканы. Химические свойства
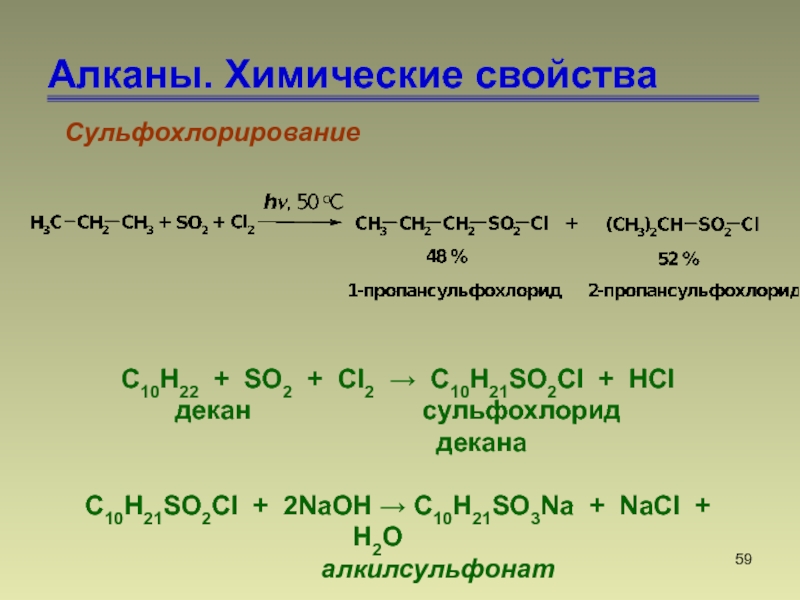
Слайд 59Алканы. Химические свойства
Сульфохлорирование
С10H22 + SO2 + Cl2 → C10H21SO2Cl
+ HCl
декан сульфохлорид
декана
C10H21SO2Cl
+ 2NaOH → C10H21SO3Na + NaCl + H2Oалкилсульфонат
Слайд 60Алканы. Химические свойства
Сульфоокисление
В реакциях сульфоокисления и сульфохлорирования замещению не
подвергаются атомы водорода при третичном углероде из-за пространственных затруднений для
подхода реагента с большим объемом.Слайд 61Алканы. Химические свойства
Нитрование
Реакция М.И. Коновалова
Жидкофазное нитрование: 10-20%-ная HNO3, 150
ОС (М.И.Коновалов, 1888г.)
Парофазное нитрование: HNO3(конц.), 420-430 ОС (Хесс, 1936г.)
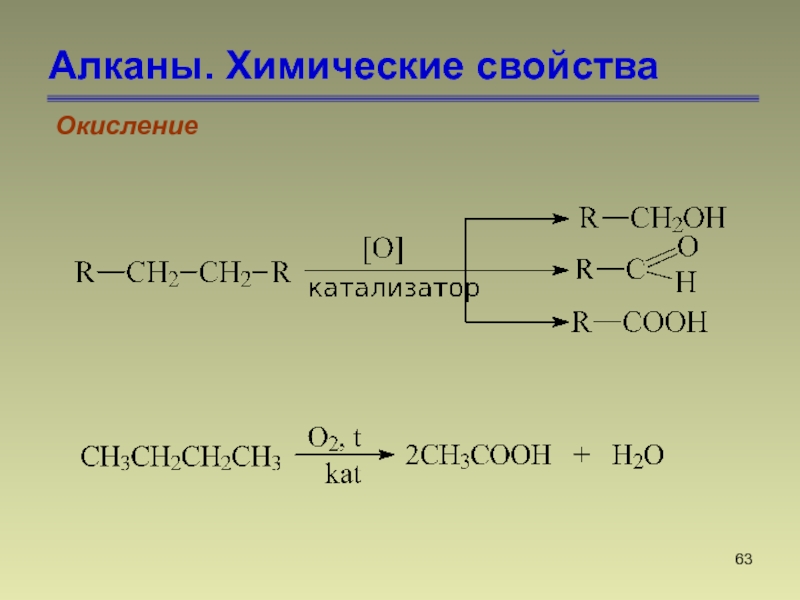
Слайд 64Алканы. Химические свойства
Окисление
CH4 + H2O → CO + 3H2
CH4
+ ½O2 → CO + H2
CH4 + CO2 → 2CO
+ 2H2CH4 + 2O2 → CO2 + H2O + 890 кДж/моль