Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аминокислоты. Пептиды
Содержание
- 1. Аминокислоты. Пептиды
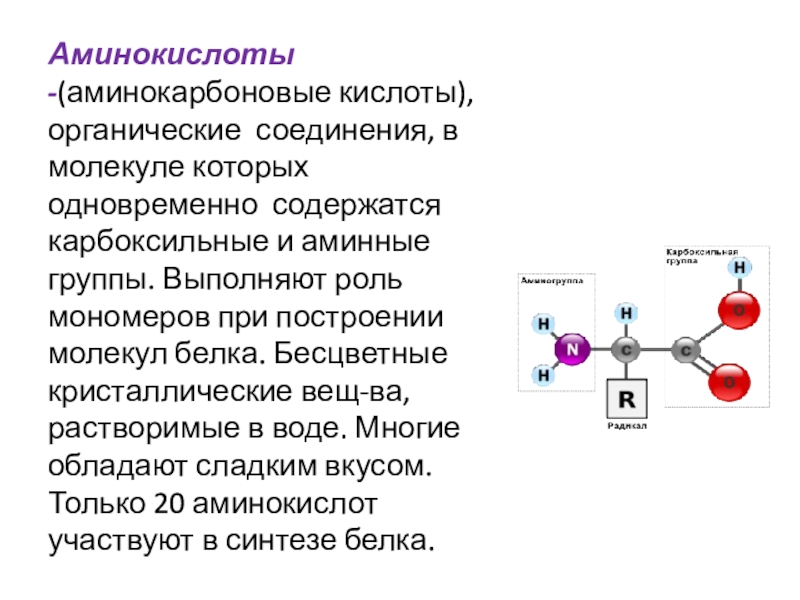
- 2. Аминокислоты -(аминокарбоновые кислоты), органические соединения, в молекуле
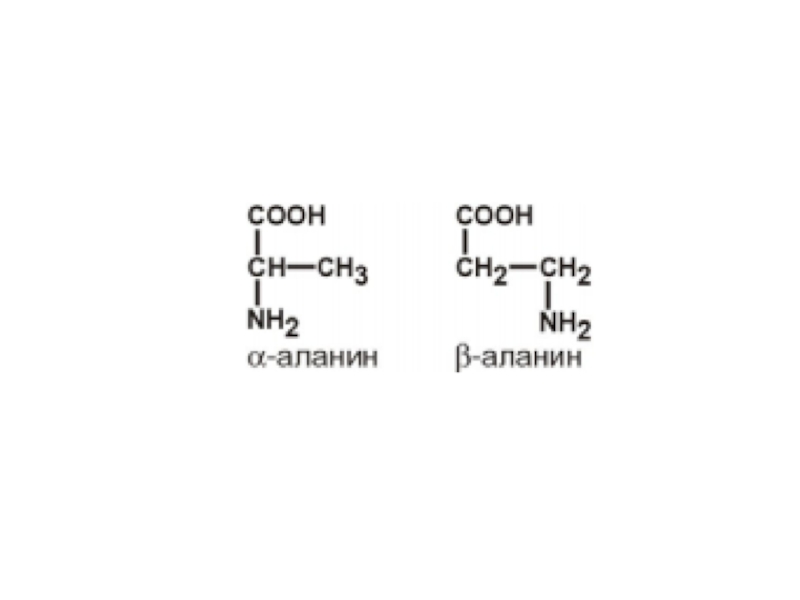
- 3. Слайд 3
- 4. Варианты классификации аминокислот:
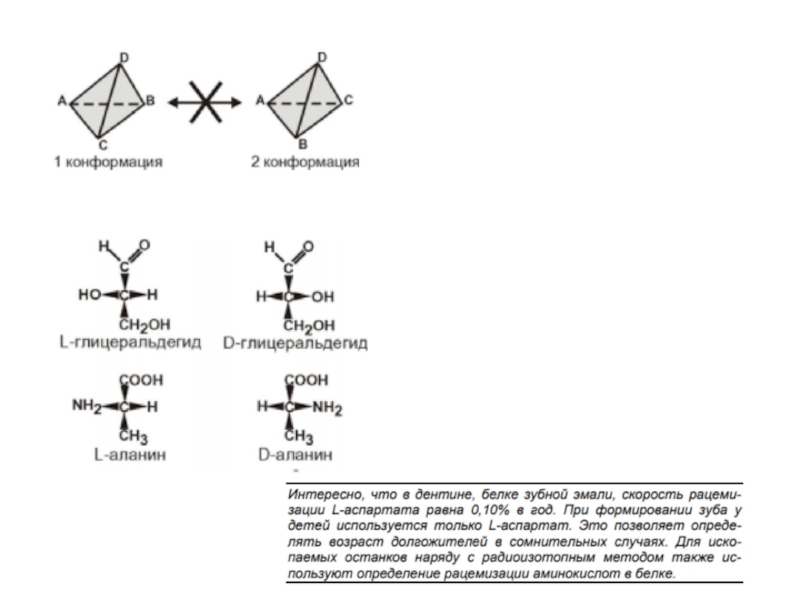
- 5. Слайд 5
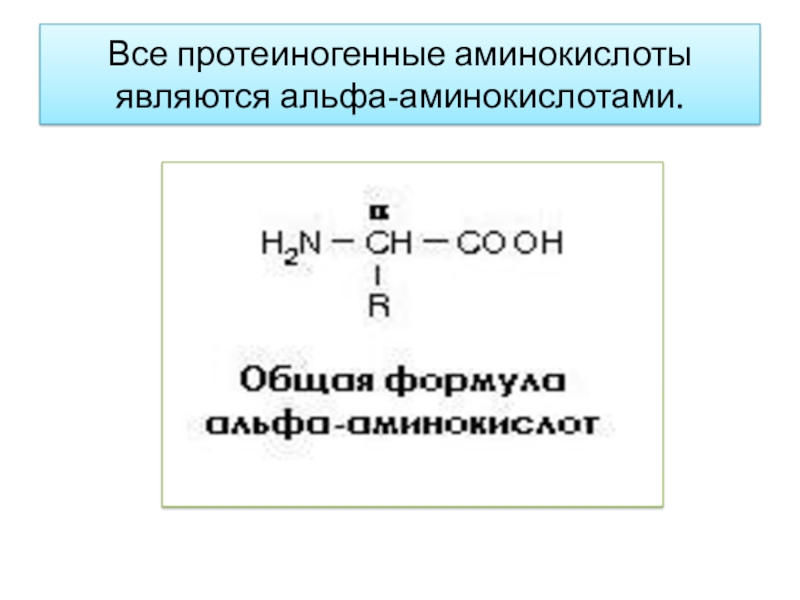
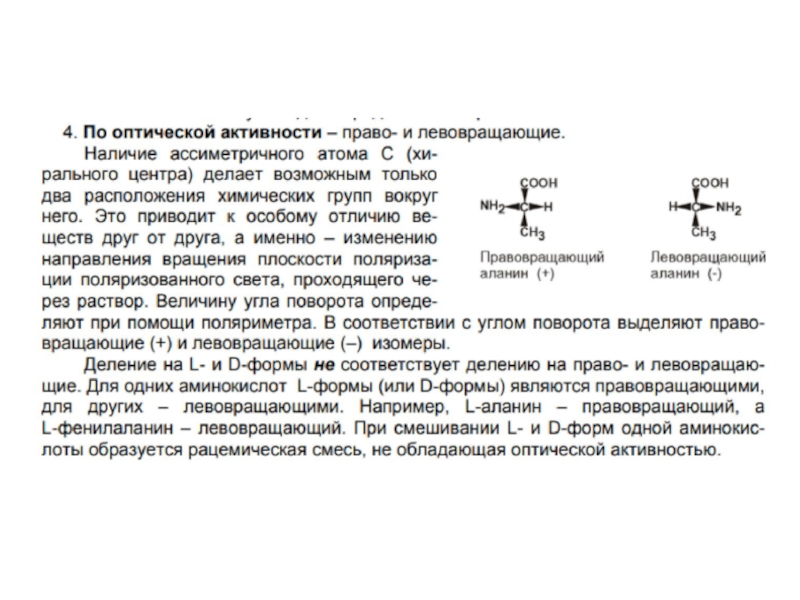
- 6. Все протеиногенные аминокислоты являются альфа-аминокислотами.
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
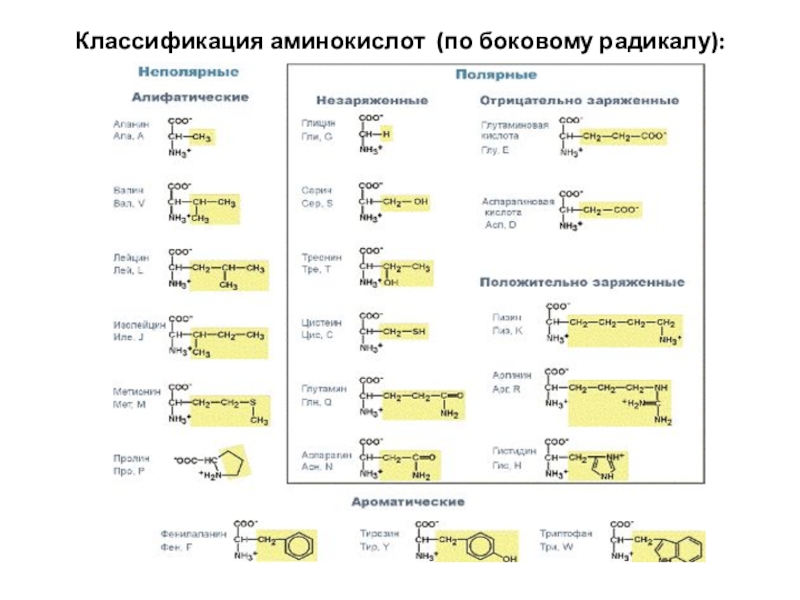
- 10. Классификация аминокислот (по боковому радикалу):
- 11. Незаменимые: лейцин (ЛЕЙ, L), изолейцин
- 12. Валин: зерновые, бобовые, мясо, грибы, молочные продукты,
- 13. Отдельные представители аминокислот и их свойства. Алифатические:
- 14. Серосодержащие: Цистеин (ЦИС) -благодаря активной группе
- 15. Содержащие -ОН группу (гидроксиаминокислоты) Группа
- 16. Отдельно рассматривается пролин (ПРО)Не соответствует общей формуле
- 17. Слайд 17
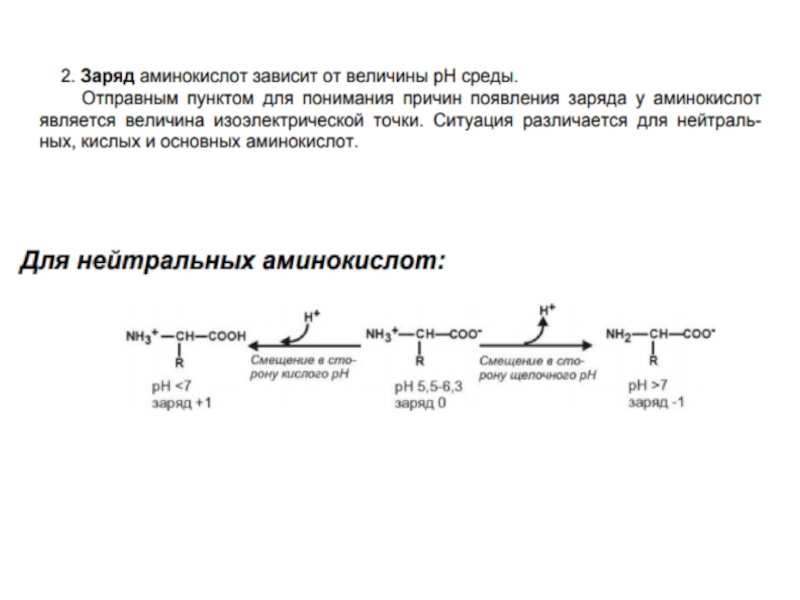
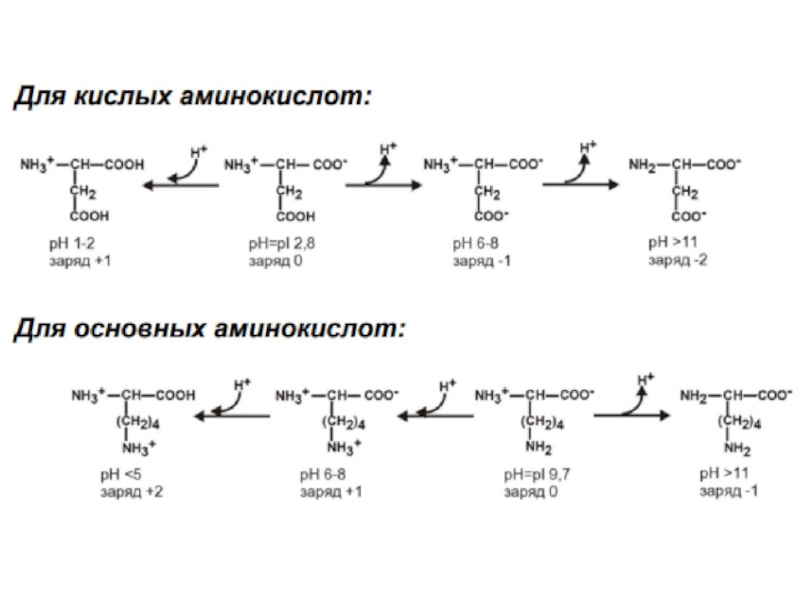
- 18. Общие свойства аминокислот.Кислотноосновные свойства аминокислот определяют многие
- 19. Слайд 19
- 20. Реакция поликонденсации с образованием пептидной связи.
- 21. Получают аминокислоты гидролизом белков или с помощью химических реакций в присутствии катализатора.
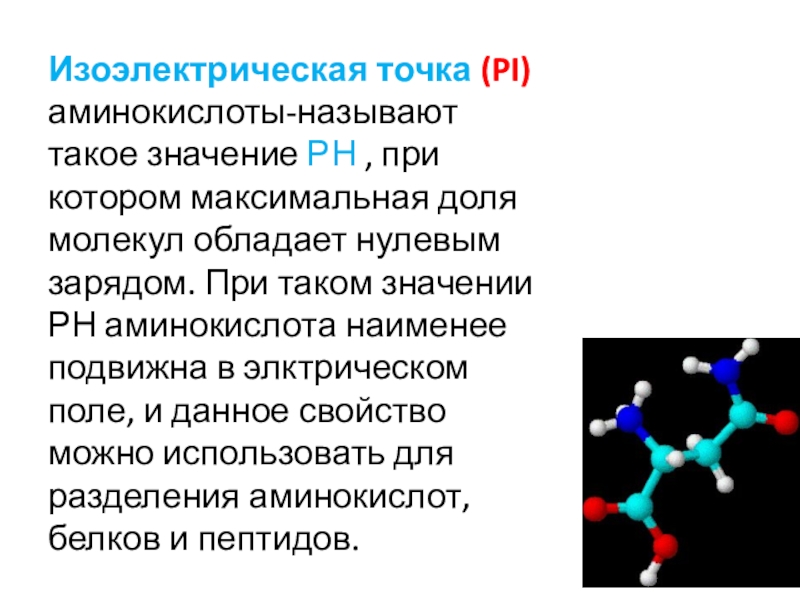
- 22. Изоэлектрическая точка (PI) аминокислоты-называют такое значение РН
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Биологическое значение аминокислот. Входят в состав белков
- 27. Слайд 27
- 28. Слайд 28
- 29. Пептиды (от греч. “питательный”) – семейство веществ,
- 30. На сегодняшний день известно >
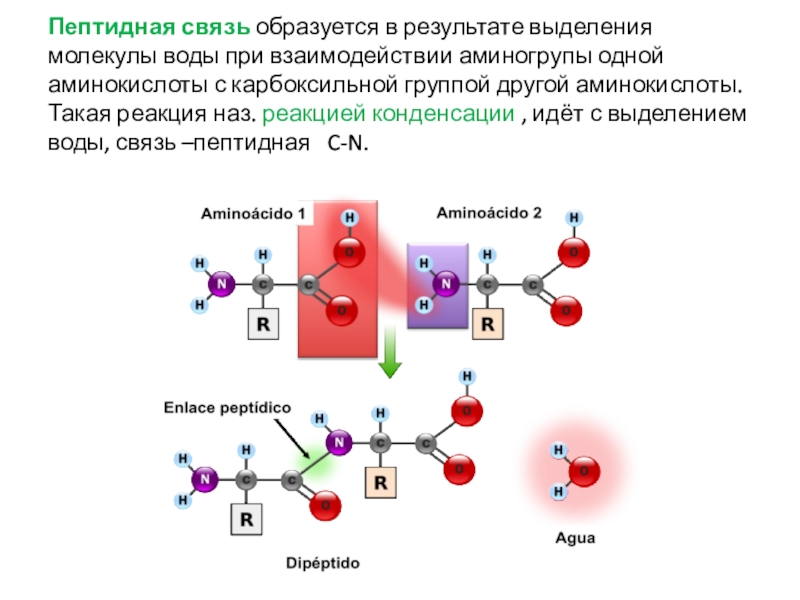
- 31. Пептидная связь образуется в результате выделения молекулы
- 32. Классификация пептидов. Их биологическая роль.Группа пептидов, содержащих
- 33. 5. Пептиды-нейромедиаторы-существуют группы нейронов, связанных между собой
- 34. ХроматографияПри всех хроматографических методах разделения молекулы распределяются между стационарной
- 35. С помощью распределительной хроматографии легко осуществляется разделение аминокислот и определение их
- 36. Скачать презентанцию
Аминокислоты -(аминокарбоновые кислоты), органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Выполняют роль мономеров при построении молекул белка. Бесцветные кристаллические вещ-ва, растворимые в воде. Многие обладают сладким вкусом.
Слайды и текст этой презентации
Слайд 2Аминокислоты -(аминокарбоновые кислоты), органические соединения, в молекуле которых одновременно содержатся
Слайд 11Незаменимые: лейцин (ЛЕЙ, L),
изолейцин (ИЛЕ, J),
валин (ВАЛ,V), фенилаланин (ФЕН, F), триптофан (ТРИ, W), треонин
(ТРЕ, Т), лизин (ЛИЗ, К),метионин (МЕТ,М).
К заменимым относятся такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен получить аминогруппу с образованием аминокислоты.
Условно заменимые. Их синтез идёт, не в достаточном кол-ве, особенно у детей.
Слайд 12Валин: зерновые, бобовые, мясо, грибы, молочные продукты, арахис.
Изолейцин: миндаль, кешью,
куриное мясо, турецкий горох (нут), яйца, рыба, чечевица, печень, мясо,
рожь, большинство семян, соя.Лейцин: мясо, рыба, чечевица, орехи, большинство семян, курица, яйца, овёс, бурый (неочищенный) рис.
Лизин: рыба, мясо, молочные продукты, пшеница, орехи, амарант.
Метионин: молоко, мясо, рыба, яйца, бобы, фасоль, чечевица и соя.
Треонин: молочные продукты, яйца, орехи, бобы.
Триптофан: бобовые, овёс, бананы, сушёные финики, арахис, кунжут, кедровые орехи, молоко, йогурт, творог, рыба, курица, индейка, мясо.
Фенилаланин: бобовые, орехи, говядина, куриное мясо, рыба, яйца, творог, молоко. Также образуется в организме при распаде синтетического сахарозаменителя — аспартама, активно используемого в пищевой промышленности.
Аргинин (условно-незаменимая аминокислота): семена тыквы, свинина, говядина, арахис, кунжут, йогурт, швейцарский сыр.
Гистидин: тунец, лосось, свиная вырезка, говяжье филе, куриные грудки, соевые бобы, арахис, чечевица.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Слайд 13Отдельные представители аминокислот и их свойства.
Алифатические:
Глицин(ГЛИ), или гликокол,
аминоуксусная кислота. Единственная оптически неактивная. Участвует в синтезе белка. Его
атомы входят в состав нуклеотидов, гема и в состав трипептида-глютатиона.Аланин (АЛА), аминокапроновая к-та. Используется для синтеза глюкозы.
Валин (ВАЛ), лейцин (ЛЕЙ), изолейцин (ИЛЕ) - играют важную роль в формировании белковой молекулы благодаря выраженным гидрофобным свойствам.
Слайд 14Серосодержащие:
Цистеин (ЦИС) -благодаря активной группе –SH легко вступает
в окислительно-восстановительные реакции, защищая клетку от действия окислителей, участвует в
образовании дисульфидных мостиков, стабилизирующих структуру белка.Метионин(МЕТ) -выполняет функцию донора подвижной метильной группы, необходимой для синтеза биол. активных соединений (холина, нуклеотидов)
Слайд 15Содержащие -ОН группу (гидроксиаминокислоты)
Группа -ОН легко взаимодействует
с фосфорной кислотой , что бывает необходимо для изменения функциональной
активности белков. Серин (СЕР), треонин (ТРЕ).Дикарбоновые (содержащие дополн. группу –СООН.) Глутаминовая (ГЛУ), аспарагиновая(АСП). Благодаря -СООН эти кислоты способствуют ионному взаимодействию, придают заряд белковой молекуле, могут образовывать амиды.
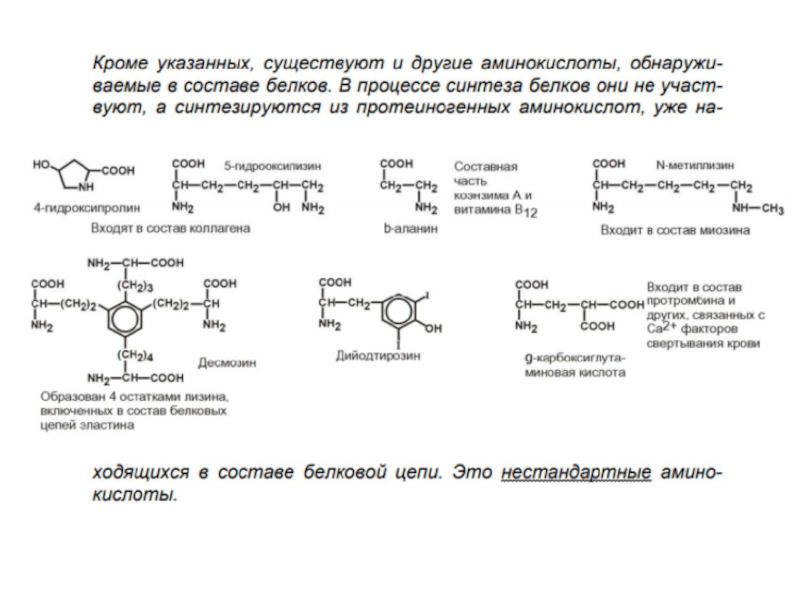
Амиды дикарбоновых кислот –глутамин (ГЛИ), аспарагин(АСН), лизин (ЛИЗ), аргинин(АРГ) -участвуют в обезвреживании и транспорте аммиака.
Циклические имеют в своём радикале кольцо. Фенилаланин (ФЕН), тирозин (ТИР)-участвуют в образовании адреналина и тироксина. Триптофан (ТРИ) -используется для синтеза витамина РР, сероторнина, гормонов эпифиза. Гистидин(ГИС) -участвует в образовании гистамина, регулирующего проницаемость капилляров, проявляет своё действие при аллергии.
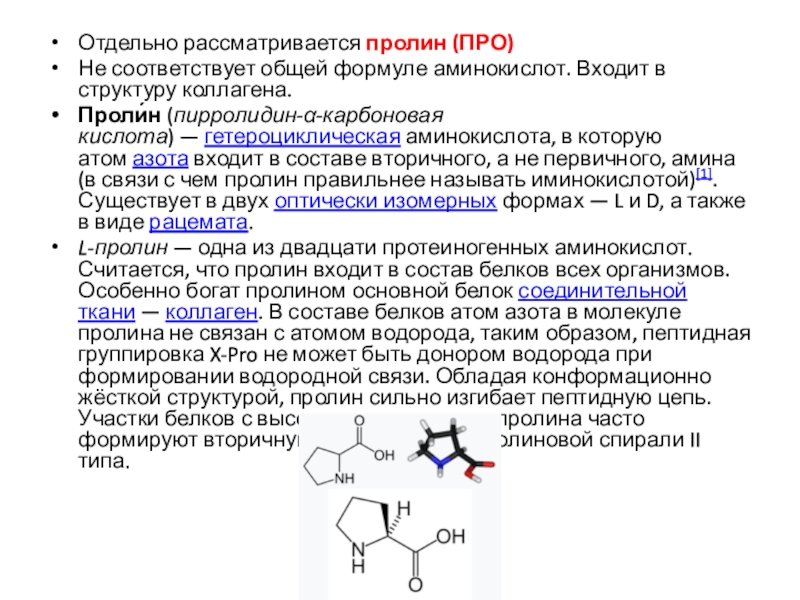
Слайд 16Отдельно рассматривается пролин (ПРО)
Не соответствует общей формуле аминокислот. Входит в
структуру коллагена.
Проли́н (пирролидин-α-карбоновая кислота) — гетероциклическая аминокислота, в которую атом азота входит в составе вторичного, а
не первичного, амина (в связи с чем пролин правильнее называть иминокислотой)[1]. Существует в двух оптически изомерных формах — L и D, а также в виде рацемата.L-пролин — одна из двадцати протеиногенных аминокислот. Считается, что пролин входит в состав белков всех организмов. Особенно богат пролином основной белок соединительной ткани — коллаген. В составе белков атом азота в молекуле пролина не связан с атомом водорода, таким образом, пептидная группировка X-Pro не может быть донором водорода при формировании водородной связи. Обладая конформационно жёсткой структурой, пролин сильно изгибает пептидную цепь. Участки белков с высоким содержанием пролина часто формируют вторичную структуру полипролиновой спирали II типа.
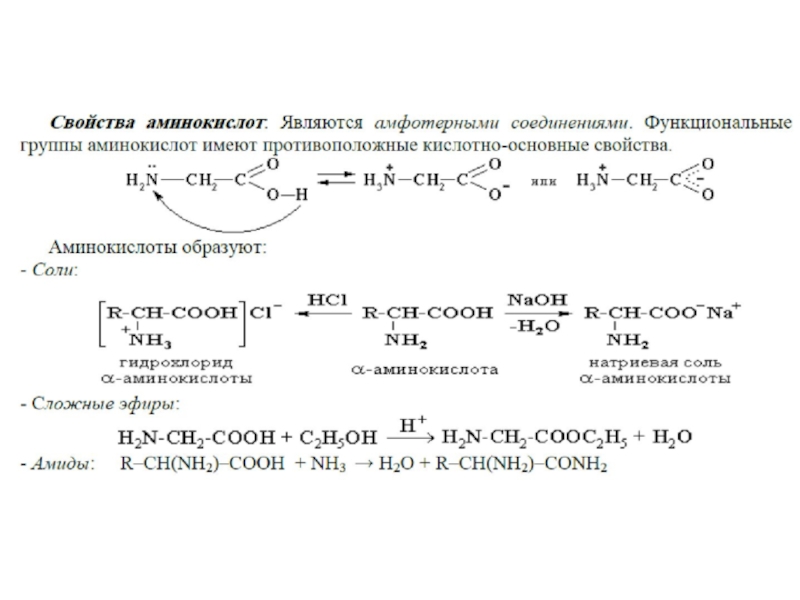
Слайд 18Общие свойства аминокислот.
Кислотноосновные свойства аминокислот определяют многие свойства белков.Все аминокислоты-амфотерные
соединения , они могут проявлять кислотные свойства, обусловленные карбоксильной группой,
и основные, обусловленные аминогруппой.Растворы аминокислот обладают свойствами буферных растворов.
Вступают в реакцию этерификации (на примере глицина).
Слайд 21Получают аминокислоты гидролизом белков или с помощью химических реакций в
присутствии катализатора.
Слайд 22Изоэлектрическая точка (PI) аминокислоты-называют такое значение РН , при котором
максимальная доля молекул обладает нулевым зарядом. При таком значении РН
аминокислота наименее подвижна в элктрическом поле, и данное свойство можно использовать для разделения аминокислот, белков и пептидов.Слайд 26Биологическое значение аминокислот. Входят в состав белков и пептидов. Образуют биол. активные
вещества (биогенные амины). Часть гормонов-аминокислоты. Предшественники азотистых оснований, входящих в состав нуклеиновых
кислот и сложных липидов. Предшественники порфиринов, идущих на синтез ГЕМА. Участвуют в биосинтезе медиаторов нервной системы (ацетилхолин, дофамин, серотонин, норадреналин и др.)Слайд 29Пептиды (от греч. “питательный”) – семейство веществ, молекулы которых построены
из остатков альфа-аминокислот, соединённых в цепь пептидными (амидными) связями –С(О)NH-.
2-аминокислоты
-дипептид3-аминокислоты-трипептид
до 10 аминокислот-олигопептид
>50 аминокислот -полипептиды или белки
Термин “пептид” предложен нем. химиком Германом Фишером. Пептиды впервые выделены из гидролизата белков, полученных с помощью ферментирования. В 1905 г. Г.Фишер разработал метод синтеза пептидов. В 1953 г. Дю Виньо – синтезировал окситоцин (первый полипептидный гормон). Позже был получен синтетический инсулин и некоторые ферменты.
Слайд 30 На сегодняшний день известно > 1500 видов пептидов.
Пептиды постоянно синтезируются во всех живых организмах. Свойства пептидов зависят
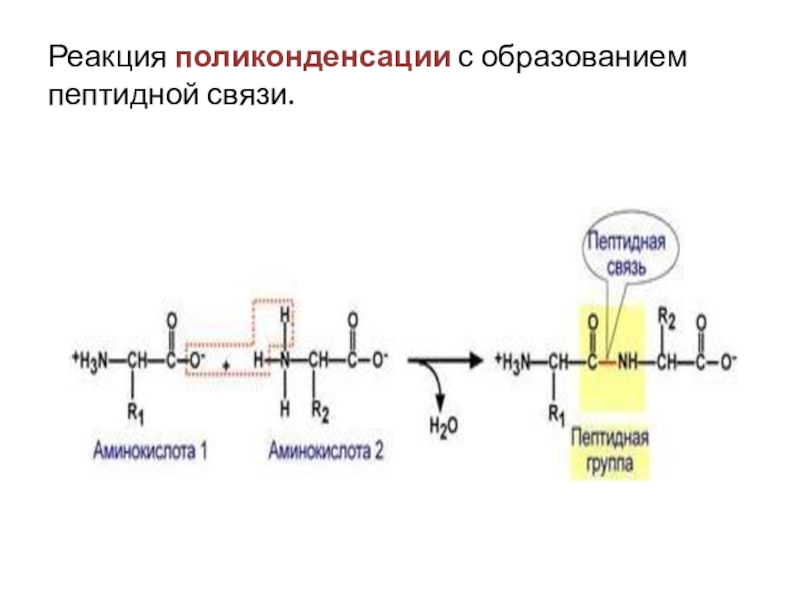
от их первичной структуры – последовательности аминокислот, а также от строения молеклы и её конфигурации в пространстве.Слайд 31Пептидная связь образуется в результате выделения молекулы воды при взаимодействии
аминогрупы одной аминокислоты с карбоксильной группой другой аминокислоты. Такая реакция
наз. реакцией конденсации , идёт с выделением воды, связь –пептидная C-N.Слайд 32Классификация пептидов. Их биологическая роль.
Группа пептидов, содержащих глутаминовую кислоту, образующих
пептидную связь своей гамма-карбоксильной группой. Это гамма-глутаминилпептиды. К ним относится
глутатион-трипептид, участвующий в окислительно-восстановительных реакциях. Обладают антиоксидантными свойствами.Пептиды-кинины. Регуляторы тонуса сосудов. Представители ангиотензины I и II.
Пептиды-регуляторы функций гипофиза –либерины и статины. Посредники между гипоталамусом и эндокринной системой.
Пептиды-гормоны-продукты секреци желез внутренней секреции (инсулин, глюкагон)
Слайд 335. Пептиды-нейромедиаторы-существуют группы нейронов, связанных между собой молекулами-посредниками пептидной природы
(“субстанция Р”).
6. Нейропептиды –секретируются нервными клетками, оказывают
обезболивающий эффект (энкефалины, эндорфины). Пептид-скотофобин, вызывает у животных чувство страха от темноты.7. Пептиды –антибиотики -вырабатываются микроорганизмами. Используются как регуляторы синтеза белка, проницаемости мембран.
8. Пептиды-токсины –выделены из растений, грибов и т.д. Вызывают отравления (бледная поганка, яды насекомых).
Слайд 34Хроматография
При всех хроматографических методах разделения молекулы распределяются между стационарной и подвижной фазами
(табл. 3.6). Разделение зависит от относительной способности содержащихся в смеси
молекул к более прочной ассоциации с одной или другой фазой.Здесь мы рассмотрим в основном методы разделения аминокислот, однако применение этих методов ни в коей мере не ограничивается данными молекулами.
Хроматография на бумаге
Сейчас этот метод в значительной мере вытеснен более совершенными методами, однако он все же применяется для разделения аминокислот. Образцы наносят на бумагу в заранее отмеченную точку, отступив примерно 5 см от верхнего края полоски фильтровальной бумаги. Затем полоску подвешивают в закрытом сосуде, на дно которого налита смесь растворителей (рис. 3.9).
Для разделения аминокислот используют полярные растворители в виде бинарных, тройных и более сложных смесей воды, спиртов, кислот и оснований. Более полярные компоненты растворителя ассоциируются с целлюлозой и образуют стационарную