Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аналитическая химия (качественный анализ) курс лекций
Содержание
- 1. Аналитическая химия (качественный анализ) курс лекций
- 2. Список литературы:Васильев В.П. Аналитическая химия. Кн.1.Титриметрический и
- 3. Аналитическая химия - наука о методах определения
- 4. Качественный анализ позволяет установить
- 5. Аналитическая (или качественная) реакция — это химическая
- 6. Наименьшее содержание определяемого компонента (Сх), при котором
- 7. Аналитическая реакция тем чувствительнее, чем ниже предел
- 8. Классификация аналитических реакций:1. Специфические реакции – это
- 9. 3. Реакции с использованием групповых реагентов –
- 10. Техника выполнения аналитических реакций По технике выполнения
- 11. 2) Капельные реакции выполняются на маленьком листочке
- 12. 3) Микрокристаллоскопические реакции (мкс) выполняются на предметном
- 13. Условия выполнения аналитических реакций Четкий
- 14. Проверить среду или значение
- 15. Более подробную информацию дает
- 16. 2) Температура раствора. Многие реакции идут при
- 17. 3) Количество добавляемого реагента. В отношении количества
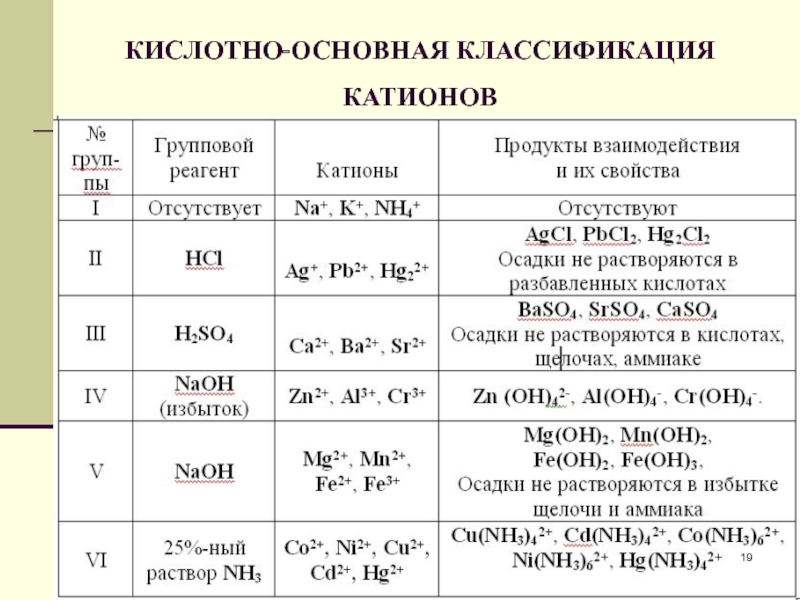
- 18. Аналитическая классификация катионов В настоящее время существуют
- 19. КИСЛОТНО-ОСНОВНАЯ КЛАССИФИКАЦИЯ КАТИОНОВ
- 20. Достоинства кислотно-основной классификации:1) Использует основные свойства элементов
- 21. Основные типы реакций в растворе1. Кислотно-основного взаимодействия;2. Осаждения и растворения малорастворимых соединений;3. Комплексообразования;4. Окисления-восстановления.
- 22. Реакции кислотно-основного взаимодействия Содержание понятий «кислота» и
- 23. Протолитическая теория Бренстеда-Лоури, разработанная
- 24. Каждое соединение, обладающее кислотно-основными
- 25. Тогда реакцию кислотно-основного взаимодействия в общем виде
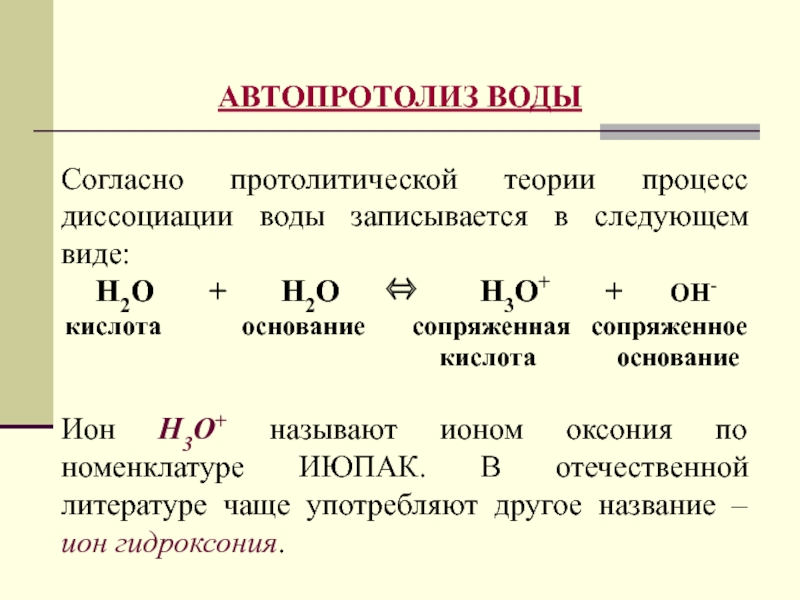
- 26. АВТОПРОТОЛИЗ ВОДЫСогласно протолитической теории процесс диссоциации воды
- 27. Обозначив ион гидроксония через Н+, записываем схему
- 28. где - коэффициент активности. При температуре
- 29. Используя понятия показателя константы автопротолиза воды (рК=-lgKw),
- 30. СИЛЬНЫЕ КИСЛОТЫ И ОСНОВАНИЯСильные кислоты и основания
- 31. Следовательно, концентрация ионов водорода в таких растворах
- 32. Сильными основаниями являются водные растворы гидроксидов щелочных
- 33. Пример 1.Вычислить [H+], [OH-] и рН 0,05
- 34. Пример 2.Вычислить [H+], [OH-], рОН и рН
- 35. СЛАБЫЕ КИСЛОТЫ И ОСНОВАНИЯ Слабые кислоты и
- 36. В разбавленных растворах коэффициенты активности близки к единице. Для приближенных расчетов принимаем КНА КНА.
- 37. При расчете равновесий в
- 38. Т.к. для слабой кислоты КНА1, обозначаем за
- 39. Если КНА 10-4 и СНА >>
- 40. Процесс диссоциации кислоты характеризуется степенью диссоциации, представляющей
- 41. Равновесие в растворе слабого основанияB + Н2О
- 42. Если КbB 10-4 и
- 43. Пример 1. Вычислить концентрацию [Н+], рН и
- 44. Пример 2. Вычислить концентрацию ОН- и рН
- 45. Пример 3. Вычислить [СH3COO-] и рН 0,1
- 46. Учитывая, что x0,1, можно упростить уравнение.x =
- 47. Выводы:1) Концентрация ацетат-ионов в присутствии сильной кислоты
- 48. МНОГООСНОВНЫЕ СЛАБЫЕ КИСЛОТЫ Многоосновные слабые кислоты диссоциируют
- 49. Если первая константа диссоциации значительно больше второй
- 50. Пример 1. Вычислить концентрацию ионов Н+, Н2PO4-,
- 51. по третьей ступени НPO42- Н+
- 52. Концентрация аниона, образующегося в результате диссоциации фосфорной
- 53. СОЛИ СЛАБЫХ КИСЛОТ И ОСНОВАНИЙДля сопряженного основания:А-
- 54. Для сопряженной кислоты:
- 55. Пример 1. Вычислить рН и степень
- 56. Пример 2. Вычислить рН 0,01 М раствора
- 57. АМФОЛИТЫК амфолитам относятся вещества, которые в растворе
- 58. НСО3– + Н2О Н2СО3 +
- 59. По уравнению (1) [Н+]=[СО32-], по уравнению (2)
- 60. Подставляем в уравнение (3) концентрации ионов СО32- и Н2СО3:
- 61. Если Ка1
- 62. БУФЕРНЫЕ РАСТВОРЫРастворы, содержащие либо слабую кислоту и
- 63. CH3COO– + Н+ CH3COOH
- 64. 1. Рассчитаем рН ацетатного буферного раствора:
- 65. 2. Рассчитаем рН аммонийного буферного раствора:NH3 +
- 66. Способность буферного раствора поддерживать постоянное значение рН
- 67. dCx – концентрация введенной сильной кислоты или
- 68. находится в пределах от 10 до 0.1,
- 69. Пример 1. Вычислить рН раствора, состоящего из
- 70. Кислотно-основные индикаторыКислотно-основные индикаторы – это органические соединения
- 71. Особенность человеческого глаза такова, что он перестает
- 72. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Аналитическая химия
(качественный анализ)
курс лекций
Горболетова Г.Г., Березина Н.М., Базанов М.И.
ФГБОУ ВПО
«Ивановский государственный
Слайд 2Список литературы:
Васильев В.П. Аналитическая химия. Кн.1.Титриметрический и гравиметрический методы анализа.
- М., Дрофа, 2002.
Золотов Ю.А. Основы аналитической химии. М. Высшая
школа. 2004. ч.1,2.Алексеев В.Н. Курс качественного химического полумикроанализа –М.: Химия. 1973.
Крешков А.П. Основы аналитической химии. М.:Химия. 1976. кн.1.
Пилипенко Л.Т., Пятницкий И.В. Аналитическая химия. Кн. 1. –М.: Химия. 1990. 845 с.
Слайд 3Аналитическая химия - наука о методах определения химического состава вещества
и его структуры.
Основные разделы аналитической химии:
Качественный анализ;
Количественный анализ;
Физико-химические методы
анализа.Предметом аналитической химии являются разработка методов анализа и их практическое выполнение, а также широкое исследование теоретических основ аналитических методов.
Слайд 4 Качественный анализ позволяет установить из каких элементов
или ионов состоит вещество.
Количественный анализ служит для
определения содержания отдельных компонентов в пробе в граммах, % и т.д. Для современных физико-химических методов характерно использование оптических, электрохимических и других измерительных приборов.
Многие практические аналитические приемы известны с глубокой древности. Они применялись для определения чистоты (пробы) драгоценных металлов – золота и серебра и выполнялись без растворения пробы.
Основы современного качественного анализа путем проведения реакций в растворе разработал Роберт Бойль в середине XVII века.
Слайд 5Аналитическая (или качественная) реакция — это химическая реакция, с помощью
которой обнаруживают (открывают или идентифицируют) тот или иной ион в
растворе. Следовательно, такая реакция должна сопровождаться каким-либо внешним, видимым эффектом:1. Образование малорастворимых соединений;
2. Изменение окраски раствора;
3. Образование и выделением газов.
Слайд 6Наименьшее содержание определяемого компонента (Сх), при котором его можно обнаружить
данным методом с заданной доверительной вероятностью (Р), называют пределом обнаружения.
Пусть предел обнаружения равен 10-4 г при доверительной вероятности Р = 0,95. Это означает, что при содержании 10-4 г определяемого компонента в анализируемой пробе в 95 опытах из 100 получают правильный результат, т.е. обнаруживают искомый компонент. Если Сх > 10-4 г, то вероятность обнаружения становится выше. Если содержание вещества в пробе меньше предела обнаружения, то его нельзя обнаружить данным методом.
Слайд 7Аналитическая реакция тем чувствительнее, чем ниже предел обнаружения.
Предел обнаружения
зависит от:
- концентрации реагентов;
- присутствия посторонних ионов;
- электролитов или
мешающих веществ, среды; - температуры растворов.
Слайд 8Классификация аналитических реакций:
1. Специфические реакции – это реакции, которые позволяют
обнаруживать данный ион в присутствии других ионов. Например, реакция обнаружения
иона аммония NH4+ действием щелочи при нагревании:NH4+ + OH- NH3 + H2O
2. Селективные или избирательные реакции дают сходный эффект с ограниченным числом ионов. Например, рубеановодородная кислота:
Cu2+ + H2(SCNH)2 Cu(SCNН)2 + 2H+
темно-зеленое или черное пятно
Co2+ + H2(SCNH)2 Co(SCNН)2 + 2H+
бурое окрашивание
Ni2+ + H2(SCNH)2 Ni(SCNН)2 + 2H+
синее или фиолетовое окрашивание
Слайд 93. Реакции с использованием групповых реагентов – реактивов, дающих одинаковую
реакцию с большой группой ионов.
Например, ионы щелочно-земельных металлов –
Са2+, Sr2+, Ва2+ - образуют осадки белого цвета с серной кислотой - CaSO4, SrSO4, BaSO4.Слайд 10Техника выполнения аналитических реакций
По технике выполнения анализа все реакции
обнаружения можно разделить на три группы: пробирочные, капельные и микрокристаллоскопические.
1)
Пробирочные реакции выполняются путем смешивания анализируемого раствора с реагентами в пробирке. При этом объемы растворов обычно составляют 1-3 капли. Приливать растворы в пробирку следует пипеткой (вакуумным капилляром), не касаясь стенок пробирки во избежание возможных загрязнений реактива. Растворы необходимо перемешивать стеклянной палочкой. Слайд 112) Капельные реакции выполняются на маленьком листочке фильтровальной бумаги, имеющем
треугольную форму. На кусочек бумаги наносят каплю исследуемого раствора. Затем
рядом с нанесенной каплей, на расстоянии 1-1,5 мм наносят каплю реактива. В месте перекрывания двух капель наблюдают окраску образующегося соединения и делают соответствующий вывод.Слайд 123) Микрокристаллоскопические реакции (мкс) выполняются на предметном стекле, которое должно
быть тщательно вымыто, ополоснуто дистиллированной водой и насухо вытерто фильтровальной
бумагой. Из капилляра-пипетки выдавливают небольшую каплю исследуемого раствора. Рядом с ней на расстоянии 2-3 мм помещают такую же каплю реагента. Затем с помощью чистой стеклянной палочки соединяют обе капли и помещают стекло на предметный столик микроскопа так, чтобы место слияния капель оказалось под объективом. Отмечают форму и цвет кристаллов, поскольку именно это служит основанием для заключения о присутствии или отсутствии иона.Слайд 13Условия выполнения аналитических реакций
Четкий и однозначный
результат анализа может быть получен только при соблюдении строго обозначенных
условий проведения реакции.1. Кислотность раствора.
Многие реакции требуют определенной среды раствора, выражаемой значением рН.
Ca2+ + C2O42- CaC2O4 - осадок белого цвета.
В кислой среде осадок не образуется:
C2O42- + H+ НC2O4-
Ag+ + Cl- AgCl - в кислой среде осадок белого цвета.
В щелочной среде: AgOH → AgO
Слайд 14 Проверить среду или значение рН можно с
помощью индикаторных бумаг.
Лакмусовая индикаторная бумага бывает красной
и синей. При нанесении капли испытуемого раствора на красную лакмусовую бумагу она окрашивается в синий цвет, если среда раствора щелочная, и остается красной в кислой среде. Синий лакмус, наоборот, краснеет в кислой среде.
Слайд 15 Более подробную информацию дает бумага, пропитанная универсальным
индикатором (УИ). При смачивании ее анализируемым раствором она окрашивается в
разные цвета, которые обозначены на шкале стандартов, прилагаемой к упаковке универсального индикатора.Сравнивая цвет пятна на бумаге со шкалой, можно определить не только среду раствора, но и примерное значение рН в пределах от 1 до 12. Сравнение со стандартной шкалой УИ необходимо проводить сразу, иначе цвет пятна со временем может измениться.
Слайд 162) Температура раствора.
Многие реакции идут при нагревании, о чем
обязательно говорится в руководстве. Нагревания требуют все реакции растворения осадков,
часто - окислительно-восстановительные реакции, реакции с выделением газов и другие.Pb2+ + 2Cl- PbCl2
осадок белого цвета, растворяется в горячей воде.
Нагревание проводят в пробирках, помещаемых в водяную баню, при перемешивании.
Слайд 173) Количество добавляемого реагента.
В отношении количества реактивов надо строго
придерживаться прописи.
Hg2+ + 2I-
HgI2 осадок красного цвета, растворяется в избытке KI.
HgI2 + 2I- HgI42- - бесцветный раствор.
Нужно прибавлять разбавленный раствор KI по каплям.
Слайд 18Аналитическая классификация катионов
В настоящее время существуют пять методов классификации
ионов. Это сероводородный, аммиачно-фосфатный, дифталатный, тиоацетамидный и кислотно-основной методы.
Сероводородный
метод основан на различной растворимости сульфидов, хлоридов и карбонатов. В дифталатном методе для разделения групп ионов используют дифталат калия с гидроксидом калия или натрия.
Тиоацетамидный метод основан на применении в качестве группового реагента тиоацетамида, хлороводородной кислоты и карбоната аммония.
В кислотно-основном методе основными реагентами являются кислоты HCl и H2SO4, гидроксиды калия и натрия и водный раствор аммиака.
Слайд 20Достоинства кислотно-основной классификации:
1) Использует основные свойства элементов – отношение к
кислотам и щелочам, способность к комплексообразованию, амфотерность гидроксидов.
2) Аналитические группы
в этой классификации ближе совпадают с группами периодической системы.3) Метод более экспрессный по сравнению с сероводородным и менее токсичный.
Слайд 21Основные типы реакций в растворе
1. Кислотно-основного взаимодействия;
2. Осаждения и растворения
малорастворимых соединений;
3. Комплексообразования;
4. Окисления-восстановления.
Слайд 22Реакции кислотно-основного взаимодействия
Содержание понятий «кислота» и «основание» существенно менялось
в процессе развития химической науки. По теории Аррениуса кислотами назывались
вещества, которые диссоциировали в воде с образованием ионов водорода Н+, а основаниями– вещества, которые диссоциировали с образованием ионов OHˉ. Однако, классическая теория кислот и оcнований не могла объяснить ряд явлений, происходящих в водных и неводных растворителях.Например, в бензольных растворах HCl не было обнаружено ионов водорода, но металлы в этом растворе растворялись с образованием газообразного водорода, кислотно-основные индикаторы изменяли свой цвет. В водных растворах соли слабых кислот (Na2CO3, KCN, Na3PO4 и т.д.) проявляли свойства оснований, а кислые соли многоосновных кислот (Na2НPO4, KHSO4 и т.д.) выступали как кислоты.
Слайд 23 Протолитическая теория Бренстеда-Лоури, разработанная в 1923 году,
дает более общие представления о кислотах и основаниях по сравнению
с классической теорией электролитической диссоциации Аррениуса.Согласно протолитической теории кислот и оснований Бренстеда-Лоури к кислотам относятся вещества, способные отдавать протон; к основаниям – вещества, способные принимать протон.
По этой теории кислотами являются, например, HCl, HNO3, NH4+, НСN, а основаниями – ОНˉ, СО32-, РО43-, SCNˉ.
Реакции кислотно-основного взаимодействия – это реакции обратимого переноса протона от кислоты к основанию.
Слайд 24 Каждое соединение, обладающее кислотно-основными свойствами, можно рассматривать
как сопряженную протолитическую пару, т. е. каждой кислоте соответствует свое
основание, образующееся при отщеплении протона:НА Н+ + А -
кислота cопряженное
основание
Слайд 25Тогда реакцию кислотно-основного взаимодействия в общем виде можно представить так:
НА
+ В НВ + + А - кислота основание сопряженная сопряженное кислота основание
Например:
НCl + OH- Н2O + Cl -
кислота основание сопряженная сопряженное
кислота основание
Соединения, которые могут как присоединять, так и отдавать протон, т.е. являются одновременно и кислотами, и основаниями, называются амфолитами.
Например, H2O, HCO3-, Н2РО4-, НРО42- и т.п.
Слайд 26АВТОПРОТОЛИЗ ВОДЫ
Согласно протолитической теории процесс диссоциации воды записывается в следующем
виде:
Н2О + Н2О
Н3О+ + ОН-кислота основание сопряженная сопряженное кислота основание
Ион Н3О+ называют ионом оксония по номенклатуре ИЮПАК. В отечественной литературе чаще употребляют другое название – ион гидроксония.
Слайд 27Обозначив ион гидроксония через Н+, записываем схему диссоциации воды упрощенно:
Н2О
Н+ + ОН-
Константа этого равновесия может быть записана как
где а - активность участников реакции.
Поскольку активность воды при данной температуре постоянна, то произведение
также будет постоянным. Его называют ионным произведением воды и обозначают символом Кw.
Слайд 28где - коэффициент активности.
При температуре 298,15 К значение
Кw=1,0 10-14
В разбавленных растворах коэффициенты активности близки к единице, следовательно,
можно записать:В химически чистой воде:
Слайд 29Используя понятия показателя константы автопротолиза воды (рК=-lgKw), водородного (рН=-lg[H+]) и
гидроксидного (рН=-lg[OH-]) показателей, можно записать:
pКw = рН + рОН = 14,0В нейтральной среде рН = рОН = 7,0
В кислой среде рН 7 рОН 7
В щелочной среде рН 7 рОН 7
Процесс диссоциации воды эндотермичен (ΔНw = 56,070 кДж/моль), поэтому с ростом температуры Кw увеличивается.
Слайд 30СИЛЬНЫЕ КИСЛОТЫ И ОСНОВАНИЯ
Сильные кислоты и основания при всех концентрациях
в растворе диссоциированы практически нацело.
К сильным кислотам относятся все галогеноводородные
кислоты за исключением HF, хлорная (HClO4), азотная (HNO3) кислоты, серная кислота (H2SO4) по первой ступени диссоциации и др. В растворах сильных кислот происходит полная ионизация кислоты по схеме:
НА + H2O Н3O + + А -
Слайд 31Следовательно, концентрация ионов водорода в таких растворах равна концентрации кислоты
(в единицах молярности).
[H+]=CНА; pH=-lg CНА; pOH=14-(-lg CНА)
Например, в 0,1
М растворе HCl концентрация ионов водорода равна 0,1 моль/л и рН=1,0.Слайд 32Сильными основаниями являются водные растворы гидроксидов щелочных и щелочно-земельных металлов
(КОН, NaOH, Ba(OH)2 и др.). В растворах сильных оснований концентрация
гидроксид-ионов вследствие полной ионизации основания в воде равна его общей концентрации.[OH-]=CB; pOH=-lg CB; pH=14-(-lg CB)
Например, в 0,1 М растворе NaOH концентрация ОН--ионов равна 0,1 моль/л и рOН=1,0; рН=13,0.
Слайд 33Пример 1.
Вычислить [H+], [OH-] и рН 0,05 М раствора HNO3.
HNO3
H+ + NO3-
[H+]= C(HNO3) =0,05 моль/л; pH=-lg 0,05 =
1,30;Слайд 34Пример 2.
Вычислить [H+], [OH-], рОН и рН 0,003 М раствора
КОН.
КОН ОHˉ + К+
[ОHˉ]=C( КОН)=0,003 моль/л;
pОH =-lg0,003 =
2,52;рН = -lg 3,33∙10-12 = 11,48.
Слайд 35СЛАБЫЕ КИСЛОТЫ И ОСНОВАНИЯ
Слабые кислоты и основания диссоциированы в
водном растворе неполностью. В водном растворе слабой кислоты существует равновесие:
НА
+ Н2О Н3О+ + А– или упрощенно НА Н+ + А -
которое характеризуется термодинамической константой диссоциации:
где а – активность участников реакции; - коэффициенты активности; КНА – концентрационная константа кислотной диссоциации.
Слайд 36В разбавленных растворах коэффициенты активности близки к единице. Для приближенных
расчетов принимаем КНА КНА.
Слайд 37 При расчете равновесий в растворах рекомендуется соблюдать
следующую последовательность: 1) Написать уравнение химической реакции
(равновесия) в ионной форме; 2) Записать выражение константы равновесия и найти ее численное значение; 3) С учетом величины константы равновесия обозначить равновесные концентрации реагирующих частиц (через х рекомендуется обозначать наименьшую равновесную концентрацию); 4) Подставить равновесные концентрации в выражение для константы равновесия и сделать возможные упрощения; 5) Выполнить расчет относительно х.Правила расчета ионных равновесий
Слайд 38Т.к. для слабой кислоты КНА1, обозначаем за х равновесные концентрации
продуктов диссоциации: [Н+] = х; [А–] = х.
Равновесная концентрация
недиссоциированных молекул кислоты равна: [НА] = СНА – [Н+] = СНА – х.
Подставляем х и СНА – х в выражение для константы диссоциации:
и решаем квадратное уравнение относительно х:
х2 + КНА х – КНА СНА = 0;
Слайд 40Процесс диссоциации кислоты характеризуется степенью диссоциации, представляющей собой отношение концентрации
диссоциированных молекул кислоты к исходной концентрации кислоты:
Слайд 41Равновесие в растворе слабого основания
B + Н2О BН+ +
OH–
характеризуется константой основной диссоциации:
Обозначаем равновесные концентрации частиц в
уравнении: [НB+] = х; [OH–] = х; [B] = СB – х и подставляем в выражение для константы диссоциации:
Отсюда:
Слайд 42Если КbB 10-4 и СB >> КbB,
Концентрация
ионов водорода будет равна:
Например, муравьиная кислота (КаНСООН=1,810–4) сильнее, чем
уксусная (Слайд 43Пример 1. Вычислить концентрацию [Н+], рН и степень диссоциации 0,1
М раствора уксусной кислоты.
СН3СООН СН3СОО– + Н+
0,1 – х х хТак как КаНА 10-4, х << 0,1 моль/л, можно принять, что 0,1 – х 0,1.
Тогда:
рН =-lg[H+] = -lg 1,3310 -3 = 2,88
Слайд 44Пример 2.
Вычислить концентрацию ОН- и рН 0,1 М раствора
аммиака.
NH3 + H2O
NH4+ + OH-0,1 – х х х
Так как Кb(NH3)10-4, х << 0,1 моль/л, то 0,1– х 0,1.
рН =-lg[H+] = -lg 7,5210-12 = 11,12.
Слайд 45Пример 3. Вычислить [СH3COO-] и рН 0,1 М раствора уксусной
кислоты в присутствии 0,1 М раствора НCl.
В растворе смеси сильной
и слабой кислот существуют следующие равновесия:СН3СООН СН3СОО– + Н+
0,1 – х х х
HCl Сl– + Н+
0,1 0,1 0,1
Суммарная равновесная концентрация ионов Н+ в смеси двух кислот равна х + 0,1.
Слайд 46Учитывая, что x0,1, можно упростить уравнение.
x = [СН3СОО–] = 1,7410-5
моль/л.
[H+] = C°(НСl) = 0,1 моль/л; pH=-lg 0,1 =
1.Слайд 47Выводы:
1) Концентрация ацетат-ионов в присутствии сильной кислоты резко уменьшилась (в
100 раз). Следовательно, рН является мощным регулятором концентрации аниона слабой
кислоты.2) Концентрация ионов водорода в смеси сильной и слабой кислот практически полностью определяется концентрацией сильной кислоты.
Слайд 48МНОГООСНОВНЫЕ СЛАБЫЕ КИСЛОТЫ
Многоосновные слабые кислоты диссоциируют в несколько ступеней,
каждая из которых характеризуется константой ступенчатой диссоциации:
Н2А Н+ + HА
С0Н2А – х х х
НА- Н+ + А2-
x - y x+y y
где x, y – концентрация ионов водорода при диссоциации кислоты по I и II ступеням диссоциации соответственно.
Слайд 49Если первая константа диссоциации значительно больше второй
,
то (x + y) x, (x – y) x;
Концентрация ионов водорода в растворе многоосновной кислоты, ступенчатые константы диссоциации которой различаются на четыре и более порядка, определяется диссоциацией кислоты по первой ступени.
[Н+] =
Слайд 50Пример 1. Вычислить концентрацию ионов Н+, Н2PO4-, НPO42-, PO43- в
0,1М растворе Н3PO4.
Диссоциация фосфорной кислоты происходит по трем ступеням:
по первой
ступени Н3PO4 Н+ + Н2PO4- X x
по второй ступени Н2PO4- Н+ + НPO42-
Слайд 51по третьей ступени НPO42- Н+ + PO43-
Поскольку Ка1
> 10-4 решаем квадратное уравнение:
х2 + 7,610–3 х – 7,610–4
= 0Слайд 52Концентрация аниона, образующегося в результате диссоциации фосфорной кислоты по второй
ступени, численно равна Ка2.
[НPO42-] = Ка2 = 6,210–8 моль/л.
Подставляя рассчитанные
значения [Н+] и [НPO42-] в уравнение диссоциации Н3PO4 по третьей ступени, находим концентрацию иона PO43-: Слайд 53СОЛИ СЛАБЫХ КИСЛОТ И ОСНОВАНИЙ
Для сопряженного основания:
А- + HOH
HА + OH-
Чем больше константа кислотной диссоциации кислоты, тем слабее
сопряженное с ней основание. Cопряженное с муравьиной кислотой основание – формиат-ион НСОО–
Слайд 54Для сопряженной кислоты:
BH+ + HOH B + Н3O+
где [Н+]=[H3O+].
Чем больше константа основной диссоциации основания, тем слабее сопряженная с ним кислота.
Cопряженная с аммиаком кислота – аммоний-катион NH4+ (
) слабее кислоты – иона С2Н5NH3+
Слайд 55Пример 1. Вычислить рН и степень основной диссоциации ацетат-иона
в 0,1 М СН3СООNa.
СН3СОО– + Н2О = СН3СООН +
ОН– 0,1 – х х х
Так как << 10-4:
рОН = -lg 7,5810–6 = 5,12 и рН = 8,88.
Степень основной диссоциации иона СН3СОО– :
Слайд 56Пример 2. Вычислить рН 0,01 М раствора СH3CH2NH3Сl.
СН3СН2NH3+ + Н2О
= СН3СН2NH2 + Н3О+
0,01-x
x xрН = 6,34.
Слайд 57АМФОЛИТЫ
К амфолитам относятся вещества, которые в растворе могут быть как
донорами, так и акцепторами протонов. К ним относятся Н2О, НСО3–,
НС2О4–, Н2РО4– и др.Например, ион НСО3– может как отдавать, так и принимать протоны:
НСО 3– Н + + СО32- (1)
Слайд 58НСО3– + Н2О Н2СО3 + ОН –
(2)
Гидроксил-ионы, выделяющиеся в процессе (2), взаимодействуют с ионами водорода, образующимися
по схеме (1):Н+ + ОН- Н2О
Kw = [Н+][OН-]
Слайд 59По уравнению (1) [Н+]=[СО32-],
по уравнению (2) [ОНˉ]=[Н2СО3], следовательно, равновесная
концентрация ионов водорода равна:
[Н+]=[СО32-]– [Н2СО3]
(3)Выразим концентрацию ионов СО32- и Н2СО3 из уравнений констант равновесий процессов (1) и (2):
Слайд 61Если Ка1
то величиной Ка1 в знаменателе можно пренебречь.
Тогда
рН раствора NaHCO3
равен:Для Na2HРO4 соответственно:
Слайд 62БУФЕРНЫЕ РАСТВОРЫ
Растворы, содержащие либо слабую кислоту и ее соль, либо
слабое основание и его соль, называются буферными.
Сущность буферного действия
заключается в том, что один из компонентов буферной системы может связывать ионы водорода, а другой - гидроксил-ионы в молекулы слабой кислоты, слабого основания и воды. Слайд 63 CH3COO– + Н+ CH3COOH
CH3COOH +
ОН– CH3COO– + Н2О
NH3 + H+ NH4+
NH4+ + ОН- NH3 + Н2О
Буферные системы характеризуются двумя параметрами: значением создаваемого рН и буферной емкостью.
Ацетатный буфер (СН3СООН + СН3СООNa);
Аммонийный буфер (NH4OH + NH4Cl).
Слайд 641. Рассчитаем рН ацетатного буферного раствора:
CH3COOH CH3COO– + Н+
Ск -x х хCH3COONa CH3COO– + Na+
Сc Сc Сc
где Ск – концентрация кислоты; Сс – концентрация соли.
Поскольку х << С к и х << Cс , С с+ х С с , а С к - х С к, тогда
Слайд 652. Рассчитаем рН аммонийного буферного раствора:
NH3 + HOН NH4+
+ OH
Сосн - x
x xNH4Cl NH4+ + Cl–
Сс Сс Сс
Слайд 66Способность буферного раствора поддерживать постоянное значение рН определяется его буферной
емкостью.
Буферная емкость характеризуется количеством вещества (моль) сильной кислоты или
сильного основания, которое требуется ввести в 1 л буферного раствора, чтобы изменить его рН на единицу. Математически буферная емкость равна производной:
где dx – концентрация сильной кислоты или сильного основания, введенных в буферную смесь.
Слайд 67dCx – концентрация введенной сильной кислоты или сильного основания, равная
изменению концентрации соответствующего компонента буферного раствора.
Учитывая равновесия, возникающие в кислотном
буферном растворе при введении в него сильного основания, и проведя соответствующие математические преобразования, можно получить уравнение:+ HCl:
+ NaOH:
где KHA – константа диссоциации кислоты; С – общая концентрация буферного раствора ([HA]+[A-]).
Слайд 68находится в пределах от 10 до 0.1, что
соответствует двум единицам рН, т.е.
рН = рК 1Максимальная буферная емкость реализуется при одинаковой концентрации компонентов буферного раствора. Расчеты показывают, что величина рН буферных систем остается практически постоянной, если отношение концентраций компонентов
или
Слайд 69Пример 1. Вычислить рН раствора, состоящего из 0,2 М CH3COOH
и 0,15 M CH3COOК.
CH3COOH CH3COO– + Н+ Ск -x х х
CH3COONa CH3COO– + Na+
Сc Сc Сc
В буферном растворе х << 0,15 и 0,15 + х 0,15, а также 0,20 + х 0,20
рН = 4,63.
Слайд 70Кислотно-основные индикаторы
Кислотно-основные индикаторы – это органические соединения сложной структуры, которые
изменяют свою окраску в зависимости от рН раствора. Согласно ионной
теории кислотно-основные индикаторы – слабые кислоты или основания, недиссоциированные молекулы которых и анионы имеют различную окраску.Метиловый оранжевый:
HInd H+ + Ind-
кр желт


























![Аналитическая химия (качественный анализ) курс лекций Используя понятия показателя константы автопротолиза воды (рК=-lgKw), водородного (рН=-lg[H+]) и гидроксидного Используя понятия показателя константы автопротолиза воды (рК=-lgKw), водородного (рН=-lg[H+]) и гидроксидного (рН=-lg[OH-]) показателей, можно записать:](/img/tmb/4/317623/f6a9b835be6d000c21a14a32a51a4e55-800x.jpg)

![Аналитическая химия (качественный анализ) курс лекций Следовательно, концентрация ионов водорода в таких растворах равна концентрации кислоты (в Следовательно, концентрация ионов водорода в таких растворах равна концентрации кислоты (в единицах молярности).[H+]=CНА; pH=-lg CНА; pOH=14-(-lg](/img/thumbs/4fbb0b5d79b48ccba33d557f191fbd27-800x.jpg)

![Аналитическая химия (качественный анализ) курс лекций Пример 1.Вычислить [H+], [OH-] и рН 0,05 М раствора HNO3.HNO3 Пример 1.Вычислить [H+], [OH-] и рН 0,05 М раствора HNO3.HNO3 H+ + NO3-[H+]= C(HNO3) =0,05 моль/л;](/img/thumbs/0c9ec46e4e0cf4a4d8f620f2c917a560-800x.jpg)
![Аналитическая химия (качественный анализ) курс лекций Пример 2.Вычислить [H+], [OH-], рОН и рН 0,003 М раствора КОН.КОН Пример 2.Вычислить [H+], [OH-], рОН и рН 0,003 М раствора КОН.КОН ОHˉ + К+[ОHˉ]=C( КОН)=0,003 моль/л;](/img/thumbs/309b642e684c73cb6b55f1beb193288d-800x.jpg)



![Аналитическая химия (качественный анализ) курс лекций Т.к. для слабой кислоты КНА1, обозначаем за х равновесные концентрации продуктов Т.к. для слабой кислоты КНА1, обозначаем за х равновесные концентрации продуктов диссоциации: [Н+] = х; [А–] =](/img/tmb/4/317623/cfa902f29f40723dbbcb3e34296f2285-800x.jpg)
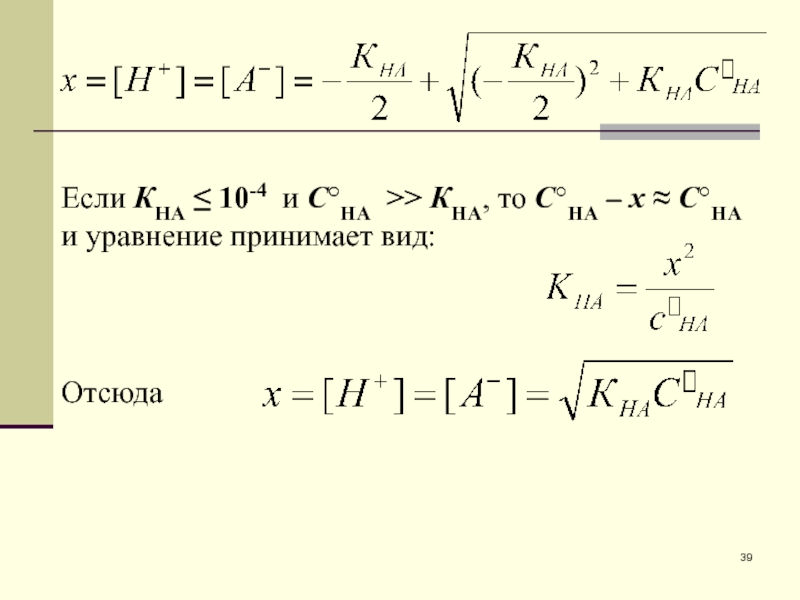



![Аналитическая химия (качественный анализ) курс лекций Пример 1. Вычислить концентрацию [Н+], рН и степень диссоциации 0,1 М Пример 1. Вычислить концентрацию [Н+], рН и степень диссоциации 0,1 М раствора уксусной кислоты.СН3СООН СН3СОО– +](/img/thumbs/3af12af2b64c23a607e06c7708703d04-800x.jpg)

![Аналитическая химия (качественный анализ) курс лекций Пример 3. Вычислить [СH3COO-] и рН 0,1 М раствора уксусной кислоты Пример 3. Вычислить [СH3COO-] и рН 0,1 М раствора уксусной кислоты в присутствии 0,1 М раствора НCl.В](/img/tmb/4/317623/c0d16324be7169b52a27c0527270c418-800x.jpg)
![Аналитическая химия (качественный анализ) курс лекций Учитывая, что x0,1, можно упростить уравнение.x = [СН3СОО–] = 1,7410-5 моль/л.[H+] Учитывая, что x0,1, можно упростить уравнение.x = [СН3СОО–] = 1,7410-5 моль/л.[H+] = C°(НСl) = 0,1 моль/л;](/img/thumbs/1d685d1e5104544045feb1c9bfadba3a-800x.jpg)





![Аналитическая химия (качественный анализ) курс лекций Концентрация аниона, образующегося в результате диссоциации фосфорной кислоты по второй ступени, Концентрация аниона, образующегося в результате диссоциации фосфорной кислоты по второй ступени, численно равна Ка2.[НPO42-] = Ка2 =](/img/tmb/4/317623/65b707ada45b0ea0829c54d16536ae53-800x.jpg)






![Аналитическая химия (качественный анализ) курс лекций По уравнению (1) [Н+]=[СО32-], по уравнению (2) [ОНˉ]=[Н2СО3], следовательно, равновесная концентрация По уравнению (1) [Н+]=[СО32-], по уравнению (2) [ОНˉ]=[Н2СО3], следовательно, равновесная концентрация ионов водорода равна:[Н+]=[СО32-]– [Н2СО3]](/img/tmb/4/317623/54eef4de9487d079196d5575633155d5-800x.jpg)