Слайд 2Азот.
Порядковый номер 7.
2 период
5 группа, главная подгруппа.
Слайд 3Строение азота
Символ: N
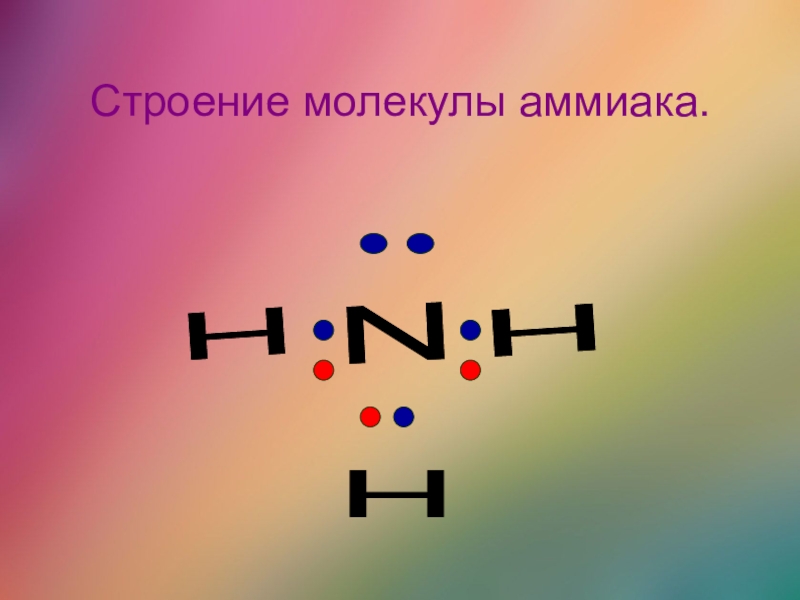
Строение атома и молекулы азота:
Элемент II периода группы
VA.
Заряд ядра +7, в ядре 7 протонов и 7 нейтронов.
Электронная
конфигурация: 1s22s22p3
Молекула состоит из двух атомов.
Связь ковалентная неполярная.
Электронная формула :NºN:
Степени окисления: от -3 до +5
Наиболее устойчивая степень окисления 0.
Слайд 4Нахождение в природе.
В природе существуют два стабильных изотопа азота: с
массовым числом 14 (99,635%) и 15 (0,365%)
В основном в свободном
состоянии в атмосфере – 78% по объему.
Входит в состав живых организмов (белки, нуклеиновые кислоты).
Небольшие количества в почве.
Слайд 5Характерные степени окисления.
Слайд 6Физические свойства азота.
При обычных условиях газ, без цвета, запаха, вкуса.
Плотность
по воздуху: Dвоздух(N2) = 28/29
Растворимость в воде 23 мл/л при
0° C и 1 атм.
Температура плавления –209,96 °С
Температура кипения –195,8°С
Слайд 7Химические свойства N2.
Химически инертен, так как трудно разорвать тройную связь
между атомами азота.
1. + кислород ( под воздействием тока)
2. +
водород
3. + металлы (активные)
Слайд 8Химические свойства азота.
Очень инертен. Вступает в химические реакции в жестких
условиях.
1)
При обычных условиях реагирует только с литием:
6Li + N2 =
2Li3N
2) с металлами при высоких температурах:
3Ca + N2 = Ca3N2
3) с водородом при высоком давлении и температуре в присутствии катализатора (Fe):
3H2 + N2 = NH3
4) при температуре вольтовой дуги реагирует с кислородом:
O2 + N2 = 2NO
Слайд 13Получение аммиака.
В промышленности
Из атмосферного азота
N2 + 3H2 2NH3
В лаборатории
Взаимодействием солей
аммония с щелочами
NH4Cl+NaOH
NH3 + NaCl + H2O
Слайд 14Химические свойства аммиака.
Проявляет основные свойства:
1. + кислота
2. каталитическое окисление (катализатор-
платина)
3. неполное окисление
4. термическое разложение
5. + вода
Слайд 20Соли аммония-
Соли, в состав которых входит ион NH4+
Обладают свойством разлагаться
при нагревании
Слайд 27Оксид азота (I) N2O.
Закись азота, «веселящий газ».
Бесцветный газ со
слабым запахом, растворим в воде.
Безразличный (несолеобразующий) оксид.
Применяется в медицине
как слабое средство для наркоза, а также в пищевой промышленности.
Слайд 28Оксид азота (II) NO.
Бесцветный газ, незначительно растворим в воде, ядовит.
Безразличный
(несолеобразующий) оксид.
Реагирует с кислородом с образованием NO2.
Слайд 29Оксид азота (III) N2O3.
Газ, очень токсичен, вызывает ожоги кожи.
неустойчив при
обычных условиях
взаимодействует с водой, образуя азотистую кислоту HNO2.
Используется для производства
азотистой кислоты.
Слайд 30Оксид азота (IV) NO2.
Газ бурого цвета, тяжелее воздуха, ядовит.
Реагирует с
водой с образованием азотистой и азотной кислот.
Используется для производства азотной
и серной кислот
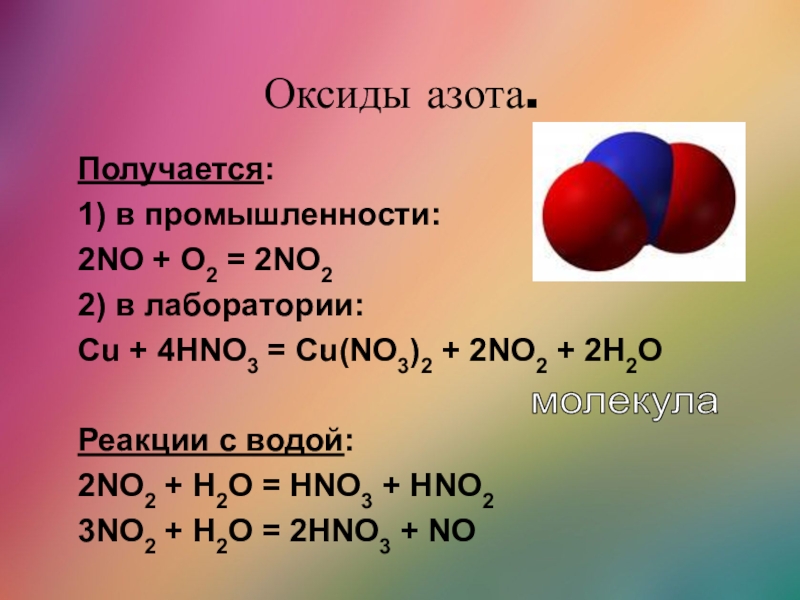
Слайд 31Оксиды азота.
Получается:
1) в промышленности:
2NO + O2 = 2NO2
2) в лаборатории:
Cu
+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Реакции с водой:
2NO2
+ H2O = HNO3 + HNO2
3NO2 + H2O = 2HNO3 + NO
молекула
Слайд 32Оксиды азота.
Получение концентрированной азотной кислоты:
4NO2 + 2H2O + O2
= 4HNO3
NO2 обладает сильными окислительными свойствами:
1) SO2 + NO2 =
SO3 + NO
2) 2C + 2NO2 = 2CO2 + N2 - горение
Слайд 35Оксид азота (V) N2O5.
Кристаллическое вещество, крайне неустойчиво, ядовито.
Обладает свойствами кислотного
оксида.
Слайд 36Азотистая кислота HNO2.
Очень слабая кислота, легко разлагается.
Соли- нитриты.
Слайд 37Азотная кислота HNO3.
Бесцветная жидкость, при хранении приобретает желтоватый оттенок.
Дымит на
воздухе
Гигроскопична. Смешивается с водой в любых отношениях
Очень сильная кислота
Реагирует с
металлами после водорода
При взаимодействии с металлами НИКОГДА не выделяется водород!
На свету разлагается:
4HNO3(K) = 4NO2 + O2 + 2H2O
Слайд 38Получение
В лабораториях азотную кислоту можно получить действием концентрированной серной кислоты
на нитраты:
В промышленности азотная кислота получается каталитическим окислением аммиака.
Слайд 39Химические свойства
I. Разбавленная азотная кислота проявляет свойства, общие для всех
кислот:
Диссоциация в водном растворе:
HNO3 → H+ + NO3-
Реакция
с основаниями:
NaOH + HNO3 = NaNO3 + H2O
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Реакция с основными оксидами:
СaO + 2HNO3 = Ca(NO3)2 + H2O
Реакция с солями:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
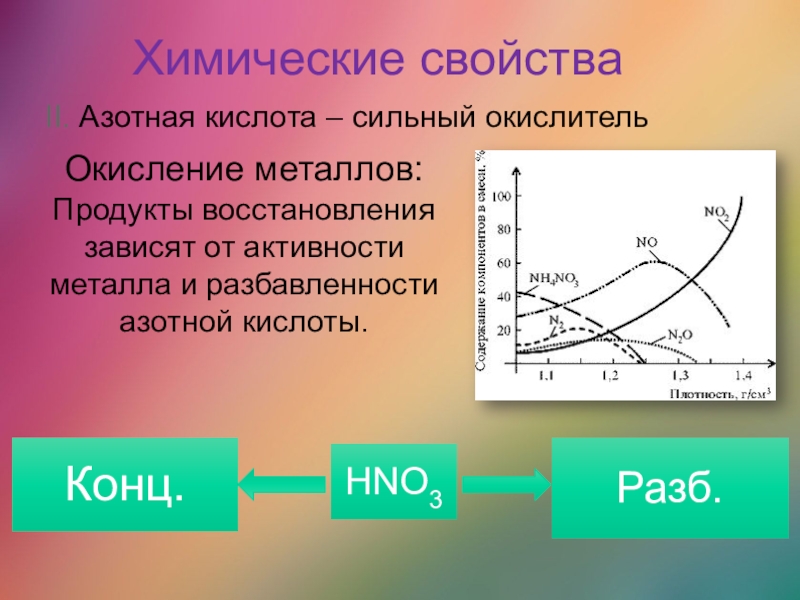
Слайд 40Химические свойства
II. Азотная кислота – сильный окислитель
Окисление металлов:
Продукты восстановления
зависят от
активности металла и разбавленности азотной кислоты.
Слайд 41Концентрированная HNO3 + металл.
Слайд 44Нитраты – соли азотной
кислоты (cелитры)
Получаются при взаимодействии азотной кислоты с
металлами, оксидами металлов, основаниями,
аммиаком и некоторыми солями.
Физические свойства. Это
твердые кристаллические вещества, хорошо растворимые в воде.
Слайд 45NaNO3 = Na+ + NO3-
Cu(NO3)2 + 2KOH = Cu(OH)2↓ +
2KNO3
AgNO3 + NaCl = AgCl↓ + NaNO3
Pb(NO3)2 + Zn =
Pb + Zn(NO3)2
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
Химические свойства. Сильные электролиты, проявляют все свойства солей.
Слайд 46Разложение нитратов при нагревании.