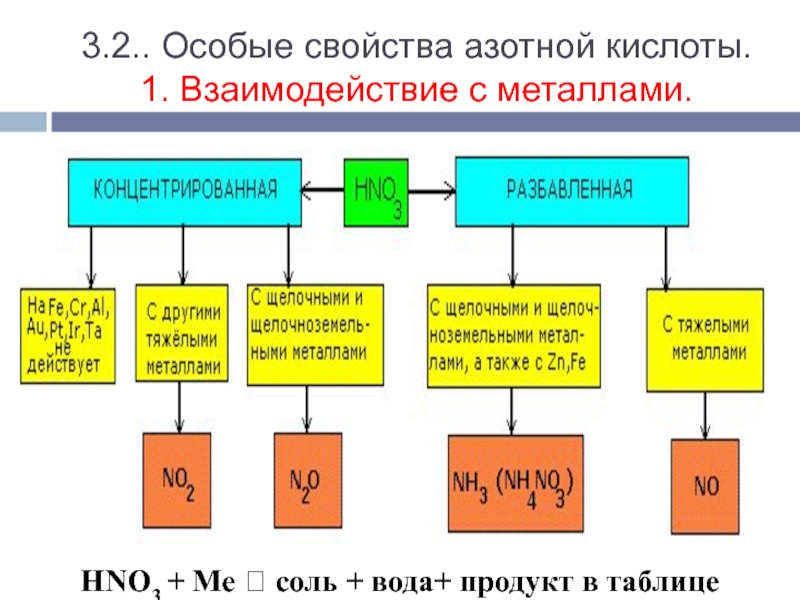
(разложение нитратов), круговорот азота в природе пересказ
№1. Назвать соли: KNO3,
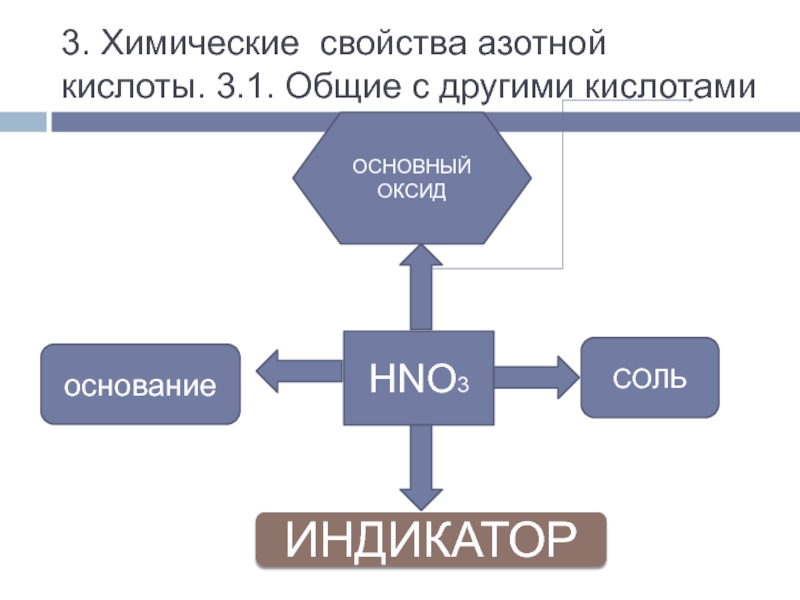
Al(NO3)3, Fe(NO3)3, Cu(NO3)2, CuSO4, Na2S, K2SO3.№2. Написать уравнения реакций в молекулярном и ионном виде между азотной кислотой и а) гидроксидом натрия, б) карбонатом натрия, в) оксидом меди (II).
№3. Написать уравнения реакций разложения: NaNO3, Fe(NO3)3, Hg(NO3)2