Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биокинетика
Содержание
- 1. Биокинетика
- 2. Гл. 1. Введение в биокинетикуУстановление количественных
- 3. простые (элементарные)
- 4. химическая кинетика - наука о скоростях и
- 5. Скорость химической реакции V = const Элементарная
- 6. Закон действующих масс константа скорости порядок реакции
- 7. Q - тепловой эффект реакции Eреагентыпродуктыэкзоэргическая эндоэргическаяэндотермическаяэкзотермическаяколебательный уровень:
- 8. Закон действующих масс с учетом микроскопических состояний
- 9. Влияние pH на скорость химической реакции
- 10. Метод графов при анализе кинетических схемГраф –
- 11. принцип независимости элементарных стадий: обратимые реакцииравновесие:константа равновесияТеория активированного (переходного) комплекса позволяет рассчитать константу скорости:
- 12. Теория активированного (переходного) комплексаСтатистические суммы:
- 13. Кинетический эксперимент Теорема Найквиста: источники ошибок:
- 14. Гл. 2.Ферментативный катализ Схема Михаэлиса-Ментен: ферментсубстраткомплексконстанта Михаэлисамаксимальная скоростьстационарная скорость
- 15. Некоторые кинетические схемы, приводящие к уравнению Михаэлиса
- 16. Определение параметров Wm и Km из экспериментальных данных Метод двойных обратных координат2) Метод Скэтчарда (Иди-Хофсти)
- 17. Определение концентрации активных центров: По содержанию белка(если
- 18. Типичные зависимости начальной стационарной скорости реакции от
- 19. Ингибирование и активация избытком субстрата >
- 20. Аллостерический эффект – изменение конформации и каталитической
- 21. Многосубстратные реакции Механизм тройного комплекса“Пинг-понг” механизм
- 22. Нестационарная кинетика ферментативных реакцийПредстационарная кинетика многостадийной реакции
- 23. Релаксационная кинетика При быстром внешнем воздействии на
- 24. Ингибирование ферментативных реакций обратимые ингибиторы(пестициды, зарин, зоман,
- 25. 1. Простейшая кинетическая схема инактивации с равновесием
- 26. 4. Диссоциативный механизм инактивации: 5. Инактивация в процессе реакции:
- 27. Методы дискриминации механизмов инактивации и определения кинетических
- 28. Полиферментные системы. Сопряженные ферментные реакции избыток S1 :V2m>>W1 :S2/K2m
- 29. Рассмотрим общий случай в условиях бимолекулярного режима (Si
- 30. Кинетика действия ферментов в открытых системах обмен
- 31. Реактор идеального вытеснения в стационаре:Реактор идеального перемешивания
- 32. Гл. 3. Молекулярная рецепцияРецепторы – химические соединения
- 33. рецепторы- белки, различающиеся разными участками или третичной
- 34. Лиганды:Агонисты – связываясь с рецепторами, активно вызывают
- 35. Вторичные мессенджеры – внутриклеточные молекулы, осуществляющие сопряжение
- 36. G-белок сопряженные рецепторы - семь раз пронизывает
- 37. Схема функционирования G-сопряженного рецептора:10-100 G-белков 10-100 молекул цАМФ усиление в 100-10000 раз! хцАМФв 104-108 раз!!
- 38. Слайд 38
- 39. Механизмы внутриклеточного проведения и усиления рецепторного сигнала
- 40. Инактивация рецепторного сигнала I. Уменьшение концентрации LR
- 41. Дискриминация моделей1) Ингибиторование рецепторов (использование конкурентных антагонистов).2)
- 42. Диффузия рецепторовтрехмерная - внутриклеточныедвухмерная -поверхностныеСвязываение нескольких молекул
- 43. Координаты Хилла Тангенс угла наклона () связан
- 44. 1) Конкуренция за места связывания: а)
- 45. Феномен колебаний рецепторного связывания 1991 г. -
- 46. Учет функции распределения клеток по количеству рецепторов на мембране
- 47. Слайд 47
- 48. метод характеристик:(функция остается самоподобной)
- 49. Учет функции распределения по константам реакции число рецепторов с афинностью K на клетке
- 50. Гл. 4.Клеточный ростКлеточный цикл:1 час (эмбриональные и микробные клетки)~10 лет (гепатоциты, нейроны).
- 51. Культивирование клеток -> изучение клеточного цикла in
- 52. Экспоненциальная фаза роста Предположим, что скорость роста
- 53. Многосубстратные процессы пример (M. thermoautotrophicum): возможные механизмы:тройной комплекс пинг-понг
- 54. Ингибирование и активация клеточного роста
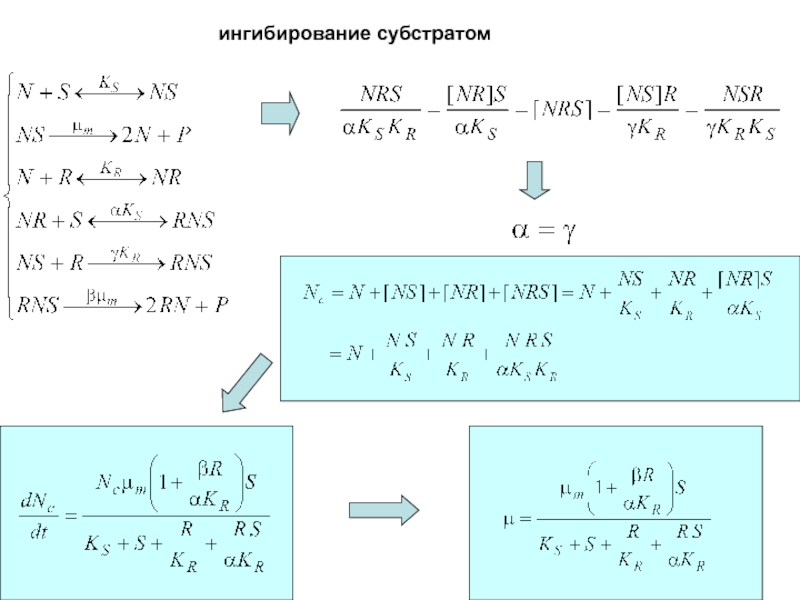
- 55. ингибирование субстратом
- 56. Влияние pH - на субстрат (аминокислоты);- на
- 57. Замедление скорости роста Лимитирование по субстрату (линейная связь) предел роста: - интегральное уравнение Моно
- 58. Ингибирование избытком субстрата
- 59. Ингибирование субстратом в условиях истощения по субстрату
- 60. Ингибирование продуктами
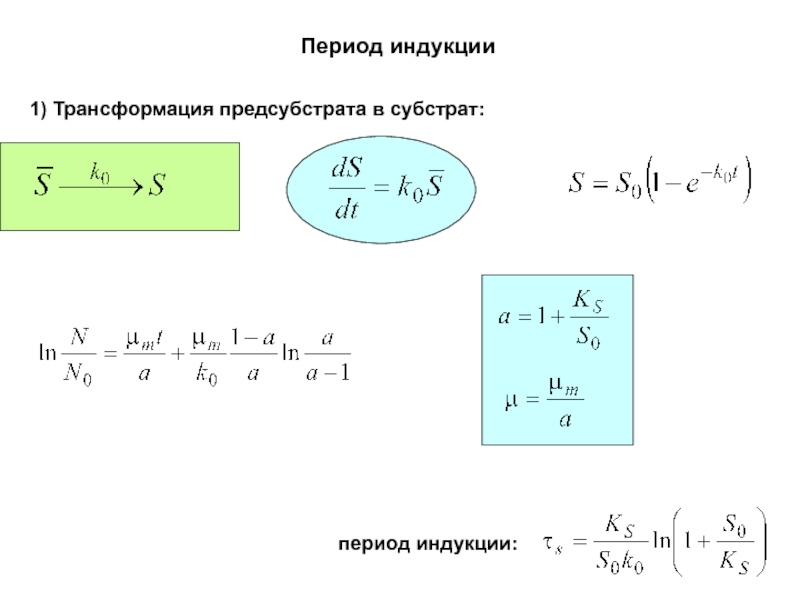
- 61. Период индукции 1) Трансформация предсубстрата в субстрат: период индукции:
- 62. 2) Адаптация:период индукции:
- 63. 3) Расход ингибитора роста:период индукции:
- 64. Старение клеток и апоптоз Апоптоз – “программируемое”
- 65. Удельная скорость клеточного роста в экспоненциальной фазе
- 66. Многостадийность клеточного цикла время репликации нахождения в других фазах клеточного цикла время удвоения: уравнение Моно Микробы:Многоклеточные:
- 67. Старение клетки в процессе роста Инактивация ключевых
- 68. Кинетические модели апоптоза 1) Прогрессирующая некомпетентность: способные
- 69. 1) начальный период: 2) режим истощения субстрата (на больших временах):
- 70. 2) Запрограммируемый отказ - потеря чувствительности клеток
- 71. Модель “хищник-жертва”жертва хищник Существует стационарное состояние: Фазовый
- 72. Ассоциации микроорганизмов симбиоза до антагонизма Пример: ассоциация двух микроорганизмов M1 и M2
- 73. Гл. 5.Мембранный транспортМембраны: - kлеточные
- 74. Слайд 74
- 75. Пассивный транспорт число Фарадея заряд (целое число,
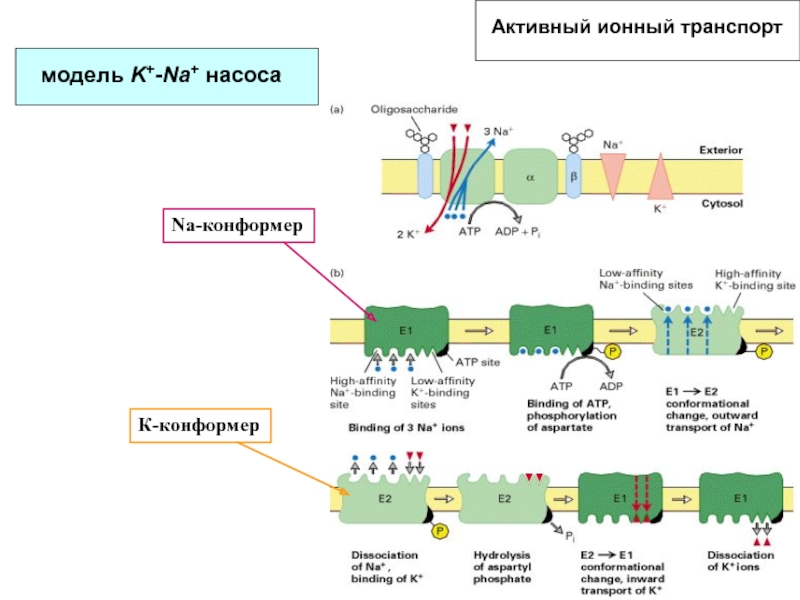
- 76. Активный ионный транспорт модель K+-Na+ насоса Na-конформерК-конформер
- 77. Реакционная схема(учитывая кооперативный эффект и наличие пассивной диффузии)
- 78. модель Ca2+ насоса Напишите реакционную схему(учитывая кооперативный эффект и наличие пассивной диффузии)
- 79. Высокая селективность ионных каналов к определенному типу ионов натриевый канал: калиевый канал:
- 80. Гл. 6.ЭндоцитозРанняя эндосомаПузырек с гидролазамиПоздняя эндосомализосомаВозврат рецепторав плазмалеммуВозврат рецептора м-6-ф в АГ
- 81. - распознавание целевой мембраны транспортным пузырьком
- 82. Слайд 82
- 83. Слайд 83
- 84. Пиноцитоз Фагоцитоз первичная лизосома вторичная лизосома остаточное тельце:- внутри клетки- снаружи клеткиаппарат Гольджи
- 85. Слайд 85
- 86. Сообщество микробных популяций в реакторе идеального перемешиванияПопуляции микробовКонтролирующие рост факторыСуществует стационарное состояние:
- 87. Распределение микробов по скорости роста и возрасту s01с точностью до обозначенийэквивалентно:роствозраст
- 88. Матричный анализ стационарного состояния - размера [n
- 89. Гемолиз в изотоническом хлориде аммонияH2O+NH4ClОсмотические и буферныесвойства эритроцитаМембранный транспортДинамика разрушения мембраныпри ее растяженииСоставные части общей модели:++
- 90. Механизм проникновения NH4Cl в эритроцитNH3H+NH+4Cl-NH3NH+4H+OH-H2OBand 3NH4ClHbHb-Band 3HCO-3Cl-CO2CO2H2CO3Изменение pHin+ Цикл Якобса-Стюарта (Jacobs-Stewart cycle)
- 91. Пинг-понг механизм работы band 3Лимитирующая стадия – транслокация band 3
- 92. Три стадии гемолизаБыстрое увеличение (на ~20%) начального
- 93. Функция распределения эритроцитовПараметры:Функция распределения:где логнормальная функция:Время сферизацииВремя жизни сферыМонте-Карло алгоритммоделирования динамики функций распределениясферизованныхэритроцитов
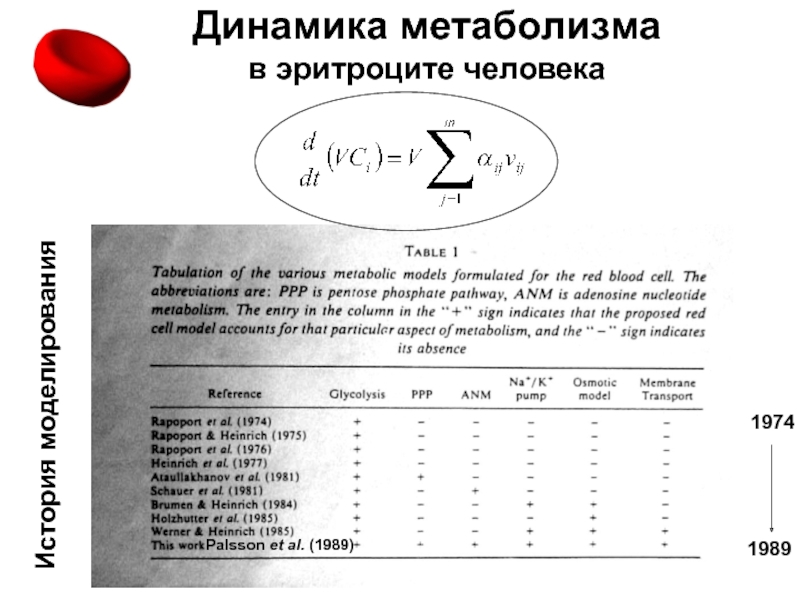
- 94. Динамика метаболизмав эритроците человекаИстория моделирования19891974Palsson et al. (1989)
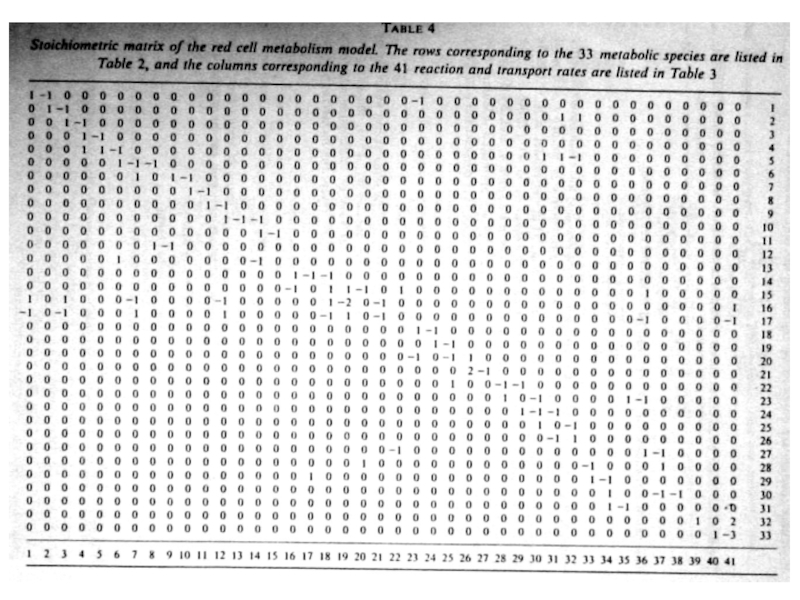
- 95. Аббревиатура метаболитов эритроцита
- 96. Аббревиатура метаболитов эритроцита
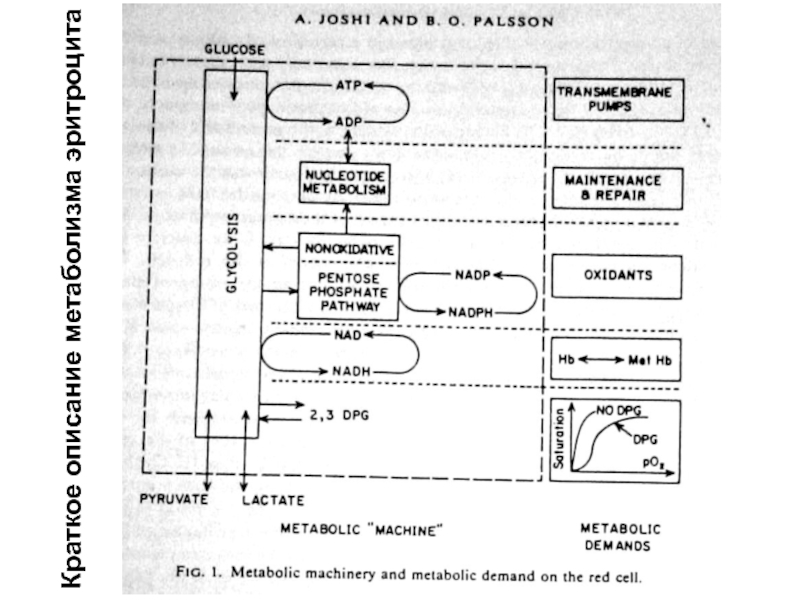
- 97. Краткое описание метаболизма эритроцита
- 98. Слайд 98
- 99. Слайд 99
- 100. Основные ограничения:1) Электронейтральность2) Баланс осмотического давления(буферные свойства)
- 101. Слайд 101
- 102. Слайд 102
- 103. Трансмебранный K+/Na+ обмен
- 104. Трансмебранный Cl-/HCO3- обмен
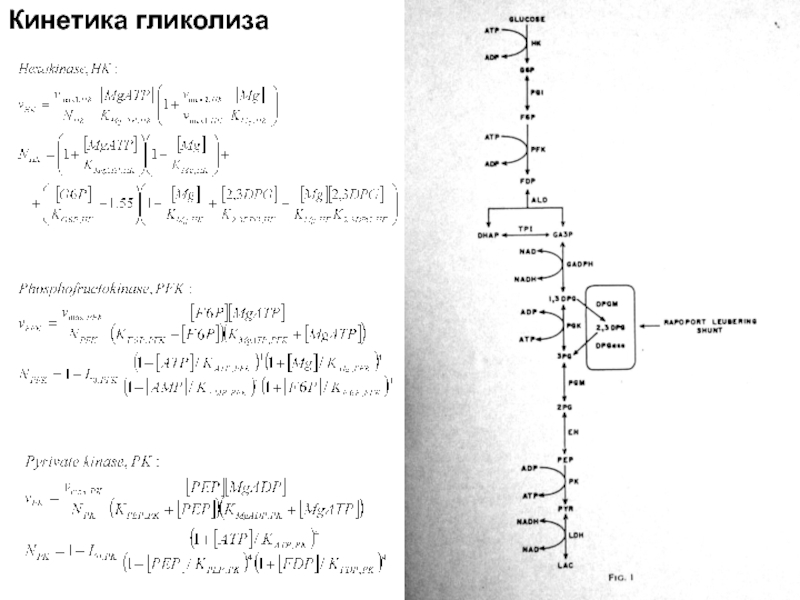
- 105. Кинетика гликолиза
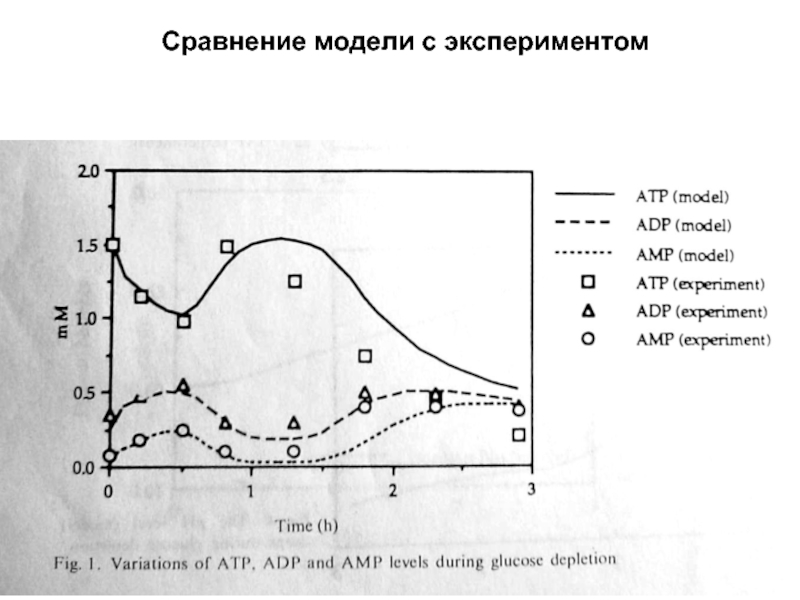
- 106. Сравнение модели с экспериментом
- 107. Сравнение модели с экспериментом
- 108. Предсказания модели
- 109. Слайд 109
- 110. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Биокинетика
Чернышев Андрей Витальевич, к.ф.-м.н. (лекции)
Некрасов Вячеслав Михайлович, асп. (семинары)
Лаборатория лазерной
фотохимии
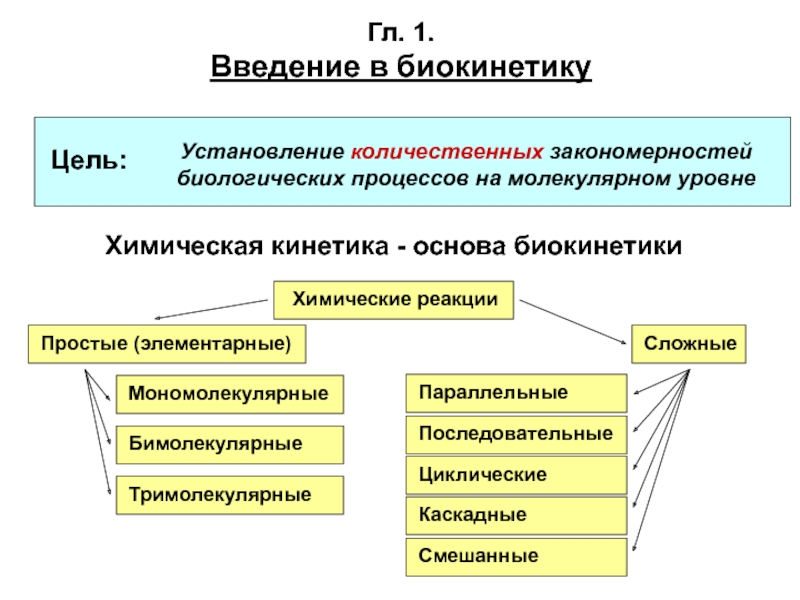
Слайд 2Гл. 1.
Введение в биокинетику
Установление количественных закономерностей биологических процессов на
молекулярном уровне
Химическая кинетика - основа биокинетики
Цель:
Химические реакции
Простые (элементарные)
Сложные
Мономолекулярные
Бимолекулярные
Тримолекулярные
Параллельные
Последовательные
Циклические
Смешанные
Каскадные
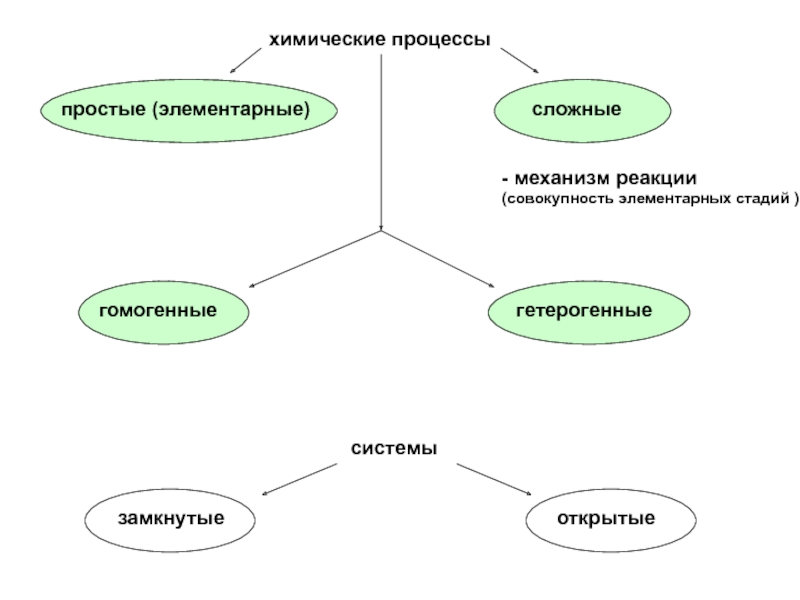
Слайд 3простые (элементарные)
сложные
химические процессы
- механизм реакции
(совокупность элементарных стадий )
гомогенные гетерогенные
замкнутые открытые
системы
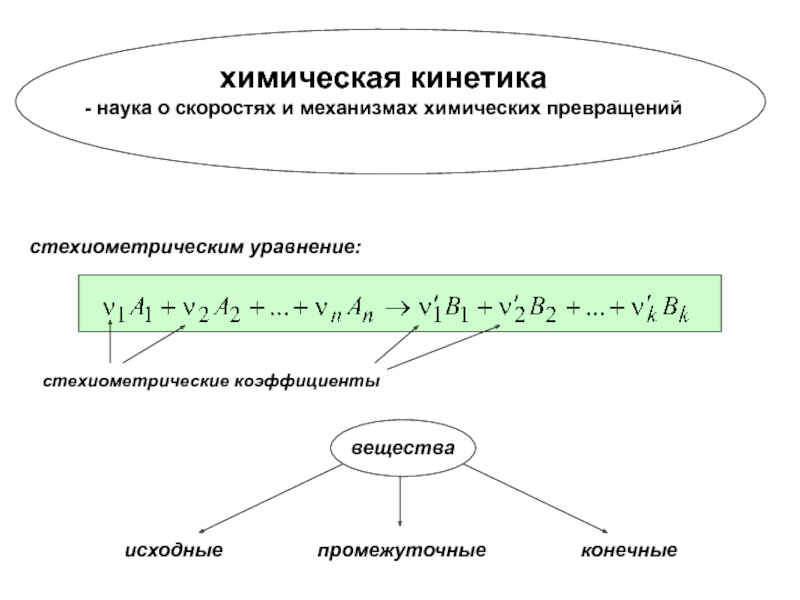
Слайд 4химическая кинетика
- наука о скоростях и механизмах химических превращений
стехиометрическим уравнение:
стехиометрические коэффициенты
исходные
промежуточные конечныевещества
Слайд 5Скорость химической реакции
V = const
Элементарная реакция: w =
число элементарных актов реакции
в единице объема в
единицу времени.Сложная реакция: может быть введено понятие единой скорости процесса,
когда концентрации промежуточных веществ пренебрежимо малы по сравнению с концентрациями реагентов и продуктов реакции
(иначе - скорость реакции по конкретному веществу).
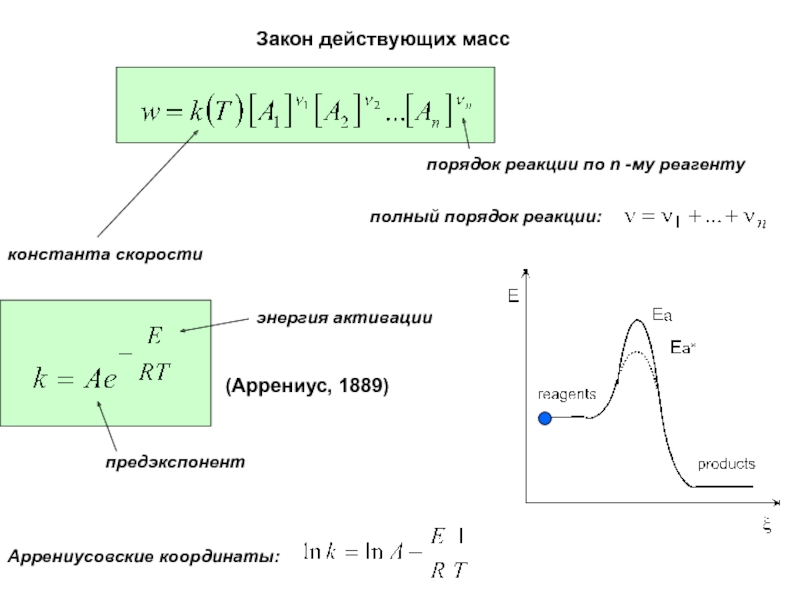
Слайд 6Закон действующих масс
константа скорости
порядок реакции по n -му
реагенту
полный порядок реакции:
(Аррениус, 1889)
энергия активации
предэкспонент
Аррениусовские
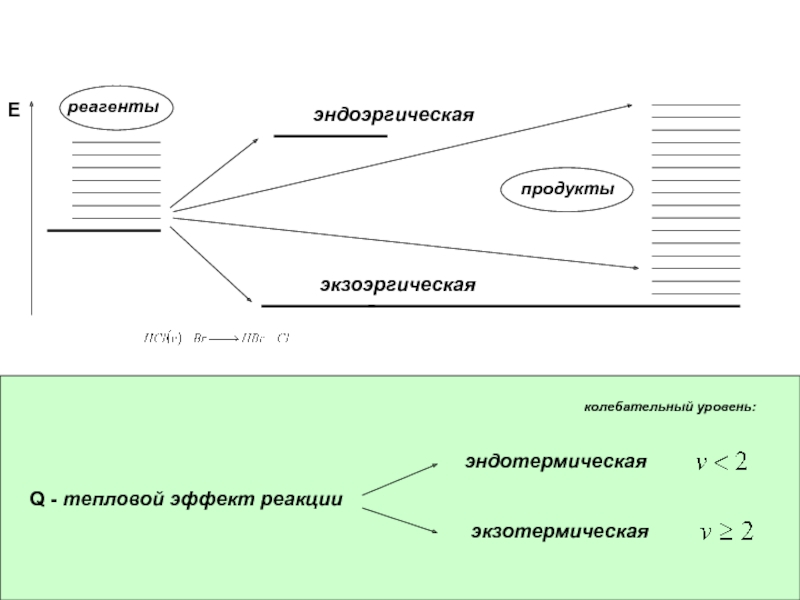
координаты: Слайд 7Q - тепловой эффект реакции
E
реагенты
продукты
экзоэргическая
эндоэргическая
эндотермическая
экзотермическая
колебательный уровень:
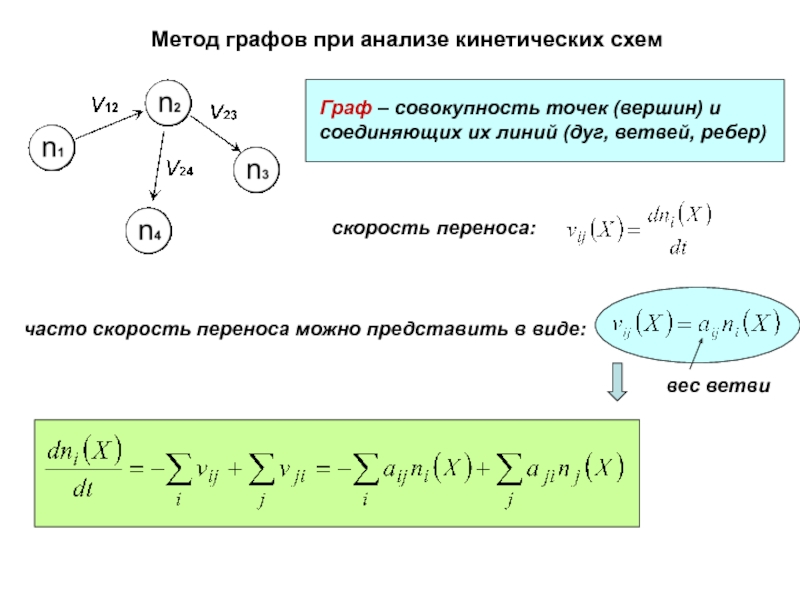
Слайд 10Метод графов при анализе кинетических схем
Граф – совокупность точек (вершин)
и соединяющих их линий (дуг, ветвей, ребер)
часто скорость переноса
можно представить в виде:скорость переноса:
вес ветви
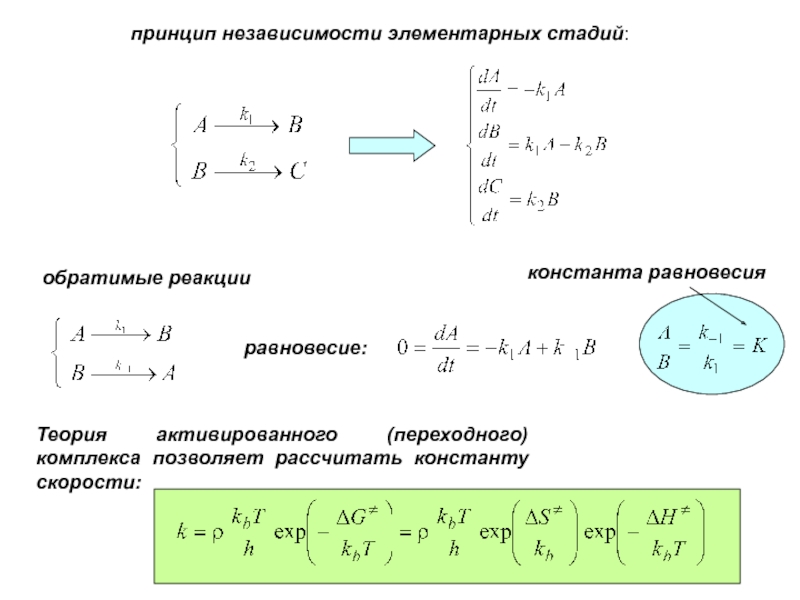
Слайд 11принцип независимости элементарных стадий:
обратимые реакции
равновесие:
константа равновесия
Теория активированного (переходного) комплекса
позволяет рассчитать константу скорости:
Слайд 14Гл. 2.
Ферментативный катализ
Схема Михаэлиса-Ментен:
фермент
субстрат
комплекс
константа Михаэлиса
максимальная скорость
стационарная скорость
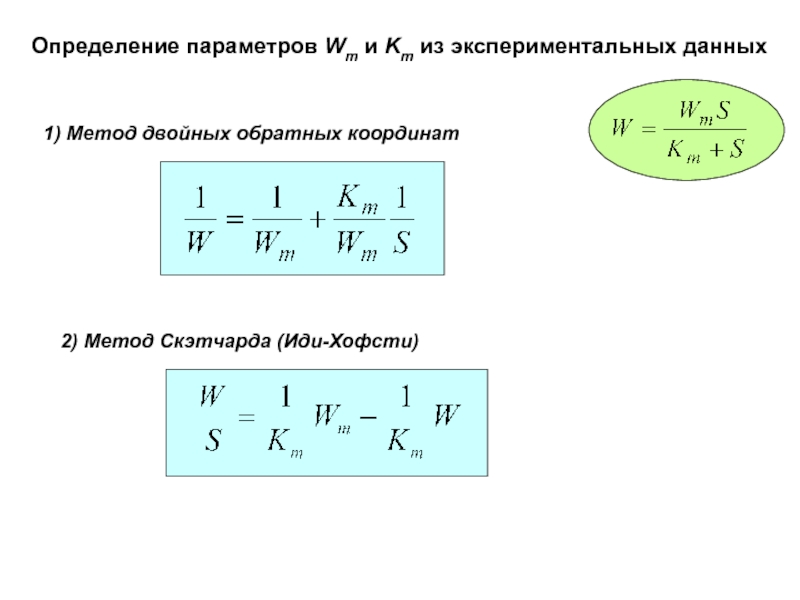
Слайд 16Определение параметров Wm и Km из экспериментальных данных
Метод двойных
обратных координат
2) Метод Скэтчарда (Иди-Хофсти)
Слайд 17Определение концентрации активных центров:
По содержанию белка
(если один активный центр)
Путем
необратимого ингибирования
1.
2.
Определение имитирующей стадии:
Измерение нестационарной кинетики
Использование субстратов с
различной структурой и различной реакционной способностью1.
2.
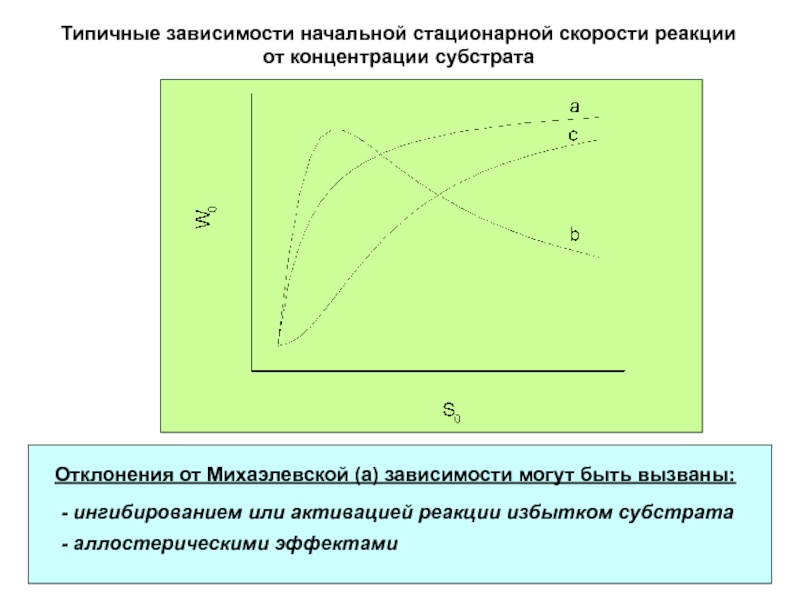
Слайд 18Типичные зависимости начальной стационарной скорости реакции от концентрации субстрата
-
аллостерическими эффектами
- ингибированием или активацией реакции избытком субстрата
Отклонения от
Михаэлевской (а) зависимости могут быть вызваны: Слайд 19Ингибирование и активация избытком субстрата
> 1
– активация субстратом
< 1 – ингибирование субстратом
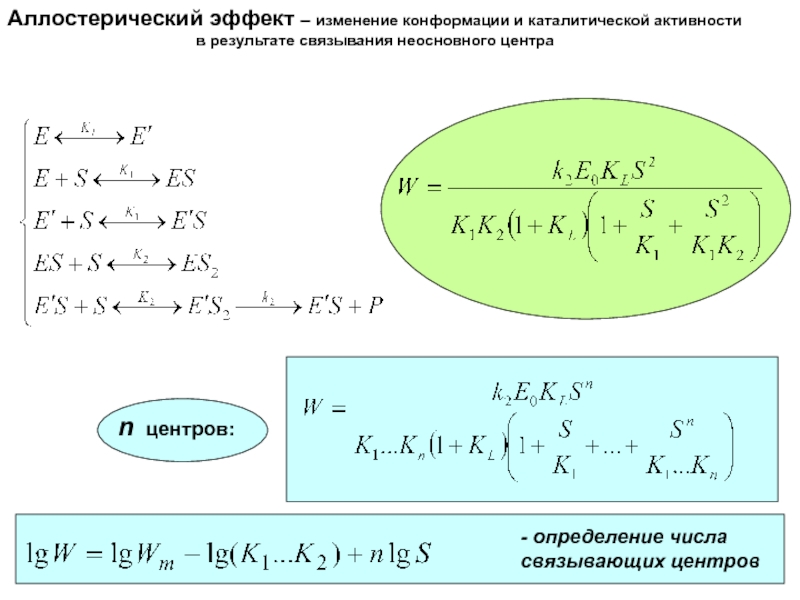
Слайд 20Аллостерический эффект – изменение конформации и каталитической активности
в результате связывания неосновного центра
n центров:
- определение числа
связывающих центров
Слайд 22Нестационарная кинетика ферментативных реакций
Предстационарная кинетика многостадийной реакции
li – собственные
значения матрицы Bij Aij и A0 – константы
Слайд 23Релаксационная кинетика
При быстром внешнем воздействии на систему (изменение температуры,
давления, пр.) время, которое нужно системе для достижения нового равновесия
(или стационарного состояния), зависит от скорости химической реакции (и иногда от скорости диффузии реагентов).резко меняется температура: T →T0 + T
меняется константа равновесия: K → K0 + K
Кинетика перехода в новое
равновесное состояние:
Если отклонение от равновесия невелико:
- время релаксации
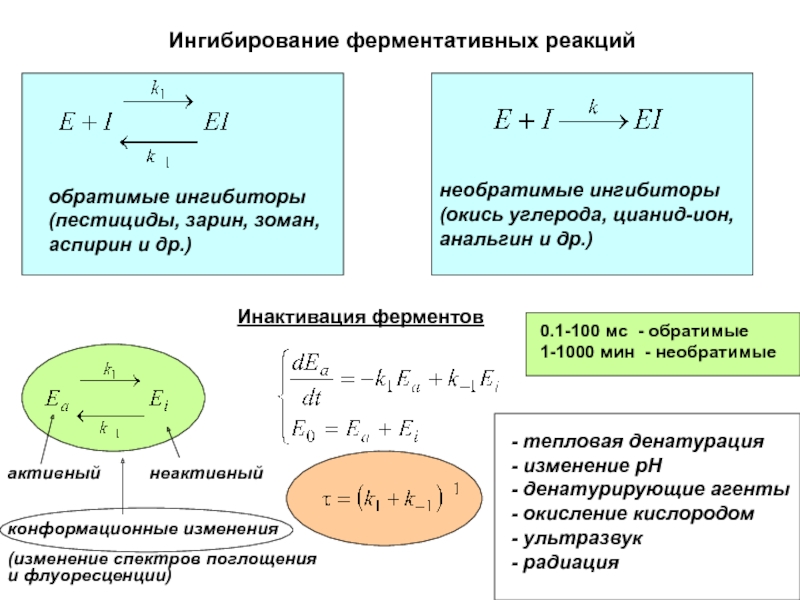
Слайд 24Ингибирование ферментативных реакций
обратимые ингибиторы
(пестициды, зарин, зоман, аспирин и др.)
необратимые ингибиторы
(окись углерода, цианид-ион, анальгин и др.)
Инактивация ферментов
активный
неактивный
- тепловая денатурация
- изменение pH
- денатурирующие агенты
- окисление кислородом
- ультразвук
- радиация
конформационные изменения
(изменение спектров поглощения и флуоресценции)
0.1-100 мс - обратимые
1-1000 мин - необратимые
Слайд 251. Простейшая кинетическая схема инактивации с равновесием конформеров:
2. Инактивации
подвержены оба конформера:
3. Более общий случай для системы с участием
n конформеров:Слайд 27Методы дискриминации механизмов инактивации и определения кинетических характеристик реакции:
- анализ
зависимости выхода продукта от концентрации фермента;
- зависимость степени конверсии субстрата
от степени инактивированности фермента;- проведение реакции при низких степенях конверсии субстрата и низких концентрациях фермента;
- проведение реакции при больших концентрациях фермента;
- предынкубация фермента с компонентами реакции;
- использование интегральных уравнений реакции.
Слайд 29Рассмотрим общий случай
в условиях бимолекулярного режима (Si
и малой степени конверсии субстрата в конечный продукт (P
S1+S2+…+Sn):стационар:
бимолекулярный режим (Si << Kim):
Тогда при малой степени конверсии субстрата в конечный продукт (P << S1+S2+…+Sn):
лимитирующая стадия: наибольшее (лимитирующее) влияние на общую скорость процесса
оказывают ферменты, имеющие наименьший параметр Vim/Kim.
Слайд 30Кинетика действия ферментов в открытых системах
обмен компонента с окружающей
средой:
все живые организмы;
технологических процессы в промышленности.
Типы открытых систем:
по субстрату
по продуктам
Типы реакторов:
идеального перемешивания
идеального вытеснения
мембранный
D – коэффициент диффузии
v – скорость ламинарного потока
Слайд 32Гл. 3.
Молекулярная рецепция
Рецепторы – химические соединения на поверхности или
внутри клеток, посредством которых происходит распознавание веществ (лигандов) и формирование
клеточного ответа.Лиганды – химические вещества, способные реагировать с рецепторами.
Если L >> R:
- изотерма Ленгмюра (сорбции)
- уравнение Скэтчарда
Слайд 33рецепторы
- белки, различающиеся разными участками или третичной структурой;
- трансмембранные белки;
-
образуют четвертичную структуру с углеводами, гликопротеидами, фосфолипидами мембран;
- в
процессе функционирования может меняться третичная и четвертичная структуры (конформация рецептора, структура и состав связанных с ним молекул) и сам рецептор (фосфорилирование и дефосфорилировать и др.);- центры связывания лигандов: COOH-группы дикарбоновых кислот, NH2-группы диаминовых кослот, OH-группы гидроксиаминокислот, SH-группы цистеина, гидрофобные участки аминокислот и др.;
- участвует несколько активных участков связывающего центра;
- большая степень сродства к лигандам, чем у ферментов к субстратам.
лиганды
- различное химическое строение (белковые, пептидные и др.)
Слайд 34Лиганды:
Агонисты – связываясь с рецепторами, активно вызывают биологический ответ
клетки (стимулируют клеточные функции).
Антагонисты – не вызывают активного клеточного ответа, препятствуют связыванию агонистов с рецепторами (угнетают кл. функции).
Принцип структурной комплиментарности (“ключ-замок”)
Проведение и усиление рецепторного сигнала:
- максимальный биологический ответ клетки наблюдался даже тогда, когда лишь незначительная часть рецепторов связана с лигандами;
- кривая зависимости биологического ответа клетки от концентрации добавленного лиганда во многих случаях имеет сложный колоколообразный вид;
- различие механизма действия агонистов и антагонистов рецепторов одного типа.
Слайд 35Вторичные мессенджеры – внутриклеточные молекулы, осуществляющие сопряжение рецепторов с внутриклеточными
эфферентными системами (ферментами, ионными каналами, геномом и т.д.).
Первичными мессенджерами
раньше называли лиганды, так как многие из лигандов осуществляют сопряжение эндокринных желез с эфферентными клетками.Классификация рецепторов по их сопряжению со вторичными мессенджерами:
- рецепторы-ионные каналы (несколько глобул интегральных белков на мембране, в неактивном состоянии рецептора ионный канал закрыт);
- рецепторы, сопряженные с ферментами (одна из глобул белка-рецептора обладает каталитической активностью, образование лиганд-рецепторного комплекса приводит к изменению каталитической активности);
- рецепторы сопряженные с G-белками (рецепторная молекула сопряжена в с внутриклеточной стороны с особым ГТФ-связывающим белком, - G-белком, - через G-белок рецепторы могут менять активность внутриклеточных ферментативных систем и вызывать открытие ионных каналов).
Слайд 36G-белок сопряженные рецепторы
- семь раз пронизывает цитоплазматическую мембрану;
- NH2-конец
располагается внеклеточно;
- три внутриклеточных и три внеклеточных “петли”;
- лиганды обычно
связывает вторая внеклеточная петля;- оканчивается внутри клетки гидрофильным COOH-концом;
- третья внутриклеточная петля и COOH-конец осуществляют сопряжение с G-белком.
- состоит из двух субъединиц: и ;
- -субъединица связывает ГТФ;
- - субъединица осуществляет крепление G-белка к цитолазматической мембране;
- -субъединица связывается с COOH концом и третьей петлей рецептора;
- - субъединица связывается только с COOH-концом.
G-белок
1) Gs-белки (s-субъединица, стимулируют АТФ→цАМФ, ингибируют Ca2+ каналы);
2) Gi-белки (ингибируют АТФ→цАМФ);
3) Go-белки (угнетают потенциал-зависимые Ca2+ каналы, стимулируют К+ каналы);
4) др.
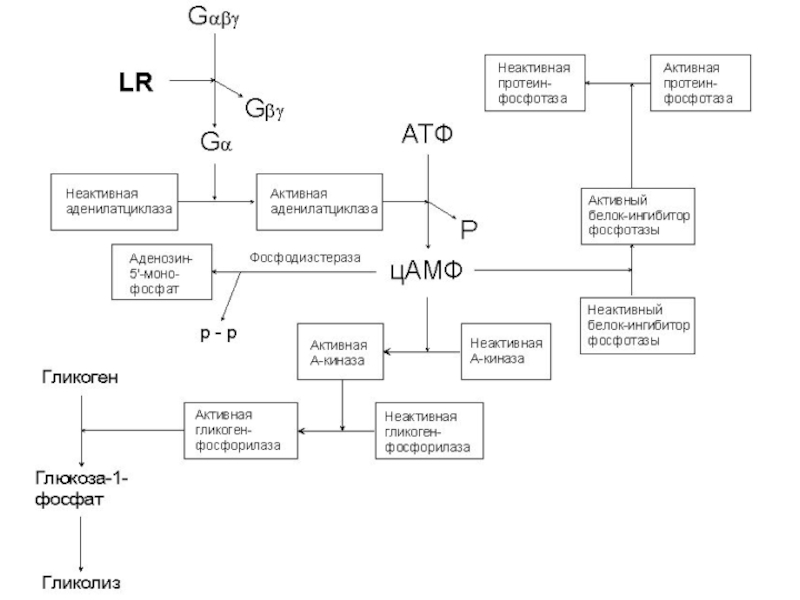
Слайд 37Схема функционирования G-сопряженного рецептора:
10-100 G-белков
10-100 молекул цАМФ
усиление в
100-10000 раз!
х
цАМФ
в 104-108 раз!!
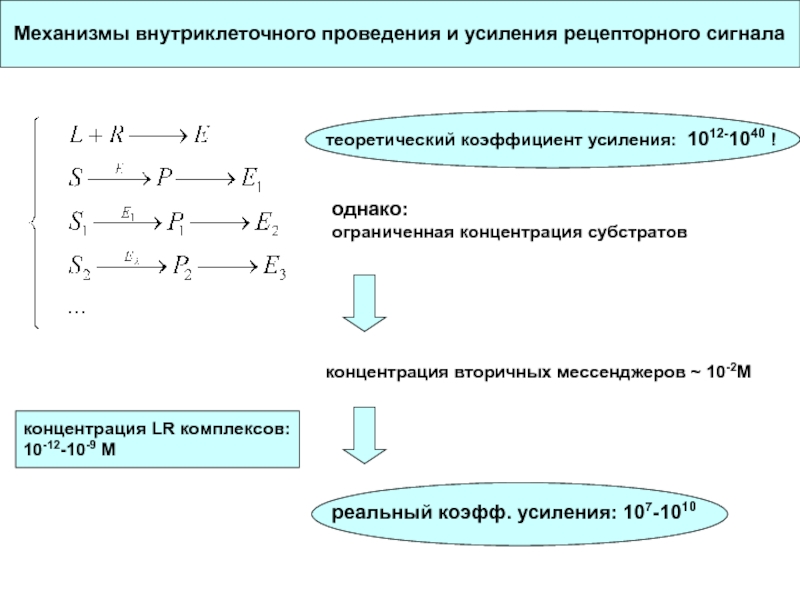
Слайд 39Механизмы внутриклеточного проведения и усиления рецепторного сигнала
теоретический коэффициент усиления:
1012-1040 !
однако:
ограниченная концентрация субстратов
концентрация вторичных мессенджеров ~ 10-2M
концентрация LR
комплексов: 10-12-10-9 М реальный коэфф. усиления: 107-1010
Слайд 40Инактивация рецепторного сигнала
I. Уменьшение концентрации LR комплексов:
а) Диссоциация LR
(напр. из-за уменьшения концентрации лигандов в растворе вследствии разрушения лиганда
ферментами).б) Повышение константы скорости диссоциации лиганд-рецепторного комплекса (активация рецептора).
в) Изменение концентрации свободных или связанных рецепторов на мембране (эндоцитоз и экзоцитоз).
II. Инактивация сопряжения LR комплеска с ферментами:
а) Самоинактивация -субъединицы G-белка (ГТФ-азная активность -субъединицы).
б) Десенситизация ферментной системы (процессы фосфорилирования-дефосфорилирования, метилирования-деметилирования рецептора, G-белков, ферментов и т.д.).
III. Инактивация фермента, синтезирующего ключевые регуляторы клеточного ответа (напр. инактивация вторичным мессенджером – арахидоновой кислотой – ферментов синтеза эйкозаноидов (простагландинов, тромбоксанов, липоксинов)
IV. Взаимодействие лиганда с различными типами рецепторов: 1) стимулирует 2) ингибирует 3) не влияет
Слайд 41Дискриминация моделей
1) Ингибиторование рецепторов (использование конкурентных антагонистов).
2) Ингибирование мембранного транспорта
(разрушение клеток).
3) Уменьшение мембранного транспорта пептидных фрагментов.
4) Уменьшение эндоцитоза (мембранные
стабилизаторы).5) Увеличение проницаемости мембран (пермиолизаторы).
6) Использование димеров лигандов (димеры труднее диффундируют).
7) Использование ингибиторов макроэргов (уменьшение скорости энергозависимых процессов транспорта и деградации ферментов).
8) Ингибирование ферментов (уменьшение скорости деградации лигандов).
9) Добавление ионов металлов (меняют аффинность рецепторов).
10) Изменение pH, ионной силы, температуры (транспорт, деградация, связывание и пр.).
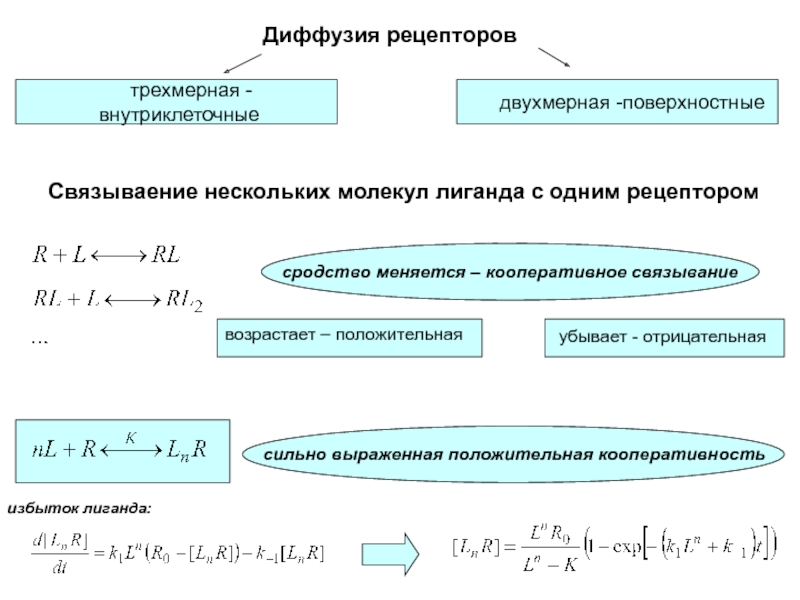
Слайд 42Диффузия рецепторов
трехмерная - внутриклеточные
двухмерная -поверхностные
Связываение нескольких молекул лиганда с одним
рецептором
сродство меняется – кооперативное связывание
возрастает – положительная
убывает -
отрицательная сильно выраженная положительная кооперативность
избыток лиганда:
Слайд 43Координаты Хилла
Тангенс угла наклона () связан со степенью коопретивности:
> 1 положительная кооперативность,
< 1 отрицательная коперативность,
= 1 отсутствие кооперативности.
Координаты Бьеррума
Число перегибов равно числу типов мест связывания.
Абцисса точки перегиба равна логарифму константы диссоциации.
степень насыщения
Слайд 441) Конкуренция за места связывания:
а) неконкурентное (разные места
связывания);
б) конкурентное (одно место связывания);
в) бесконкурентное
(лиганд L2 связывается с L1R комплексом). 2) Изменение аффинности рецепторов:
а) без изменения аффинности (L1R и R имеют одинаковую аффинность к L2);
б) с изменением аффинности.
3) Наличие взаимодействия между лигандами:
а) без взаимодействия L1 и L2;
б) с взаимодействием.
Слайд 45Феномен колебаний рецепторного связывания
1991 г.
- периодические (период порядка
10 минут)
- апериодические
модулятор
[RL] (t)
Возможным источником колебаний может быть соотношение
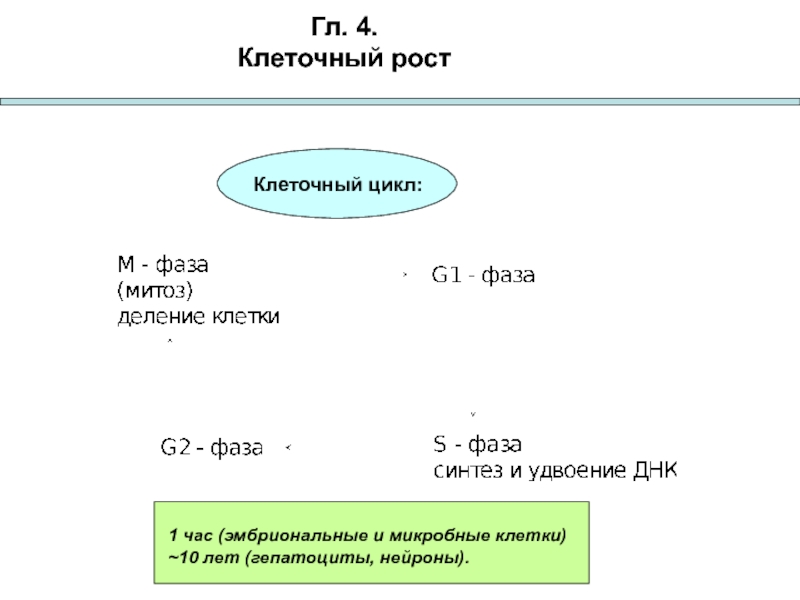
ГТФ / ГДФ, возникающее при гликолитических колебаниях. Слайд 50Гл. 4.
Клеточный рост
Клеточный цикл:
1 час (эмбриональные и микробные клетки)
~10 лет
(гепатоциты, нейроны).
Слайд 51Культивирование клеток -> изучение клеточного цикла in vitro
(культуры, линии клеток).
Фазы
роста:
1) индукционный (лаг-фаза) – адаптация клеток к среде,
перестройка
их метаболизма;2) экспоненциальный рост (много митозов);
3) линейный рост (мало митозов);
4) замедление роста;
5) стационарная фаза;
6) отмирание культуры.
Причины замедления роста – истощение субстрата,
накопление токсических продуктов и др.
Слайд 52Экспоненциальная фаза роста
Предположим, что скорость роста лимитируется одним субстратом
S:
удельная скорость роста:
(уравнение Моно)
Типичные значения: m ~ 10-2
÷ 10-5 c-1,KS ~ 10-2 ÷ 10-8 M.
Слайд 53Многосубстратные процессы
пример (M. thermoautotrophicum):
возможные механизмы:
тройной комплекс
пинг-понг
Слайд 54Ингибирование и активация клеточного роста
Классификация:
По
“мишени”:
а) ингибиторы, действующие на ДНК (налидиксоновая кислота),
б) ингибиторы, действующие на
РНК (актиномицин),в) ингибиторы синтеза белка (хлорамфеникол, эритромицин, тетрациклин),
г) ингибиторы синтеза клеточной стенки (пенициллин),
д) мембраноактивные вещества (толуол, хлороформ),
е) ингибиторы энергетических процессов (2,4 - динитрофенол),
ж) ингибиторы лимитирующего фермента.
По кинетике действия:
а) необратимые,
б) обратимые.
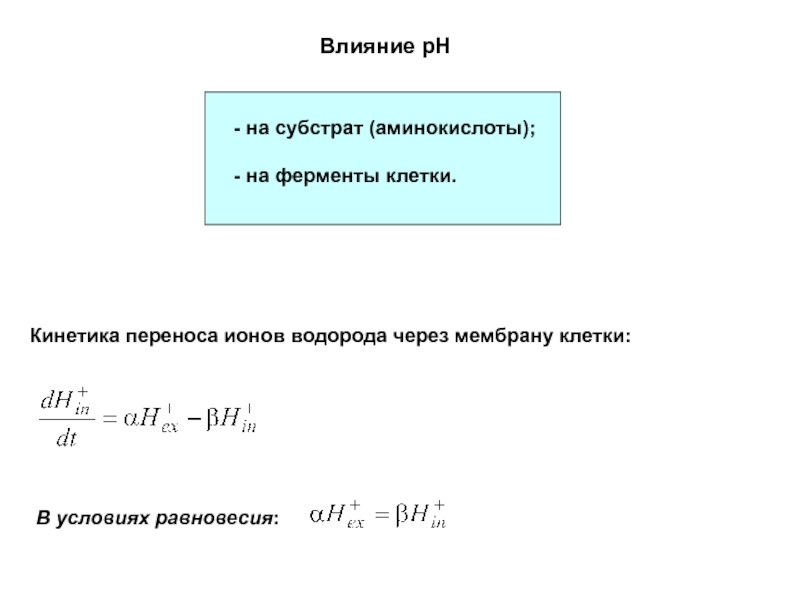
Слайд 56Влияние pH
- на субстрат (аминокислоты);
- на ферменты клетки.
Кинетика переноса
ионов водорода через мембрану клетки:
В условиях равновесия:
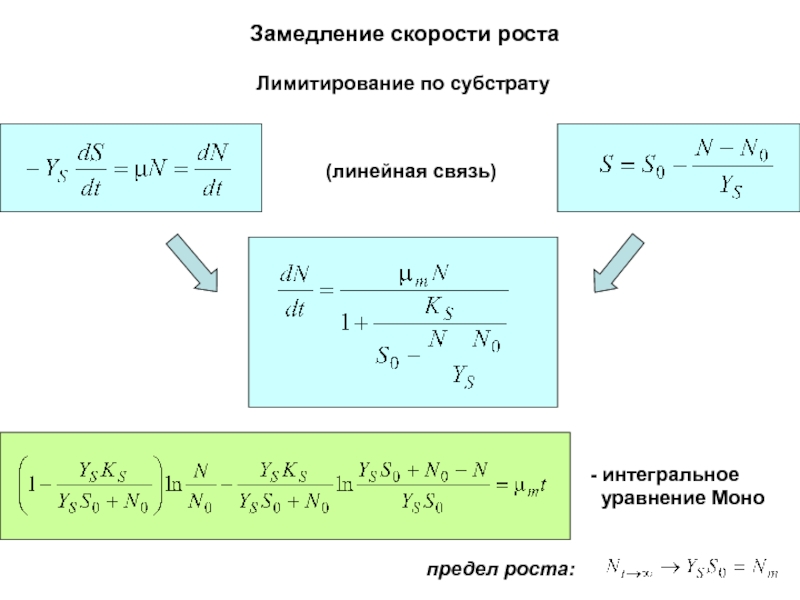
Слайд 57Замедление скорости роста
Лимитирование по субстрату
(линейная связь)
предел роста:
- интегральное
уравнение Моно
Слайд 64Старение клеток и апоптоз
Апоптоз – “программируемое” старение и гибель
клеток.
Некроз – гибель случайная или под действием внешних токсинов.
1961 г.,
Л. Хейфлик: предел клеточного деления для фибробластов человека (50 делений).
- бактериальные клетки и клетки одноклеточных организмов делятся бесконечно;
- клетки многоклеточных организмов имеют предел деления.
Концепция “программируемого” старения:
ДНК полимераза не способна реплицировать “хвосты” 3’ конца матрицы ДНК (несколько нуклеотидов на 3’ конце). Для предотвращения укорачивания ДНК фермент теломераза синтезирует на концах ядерной ДНК многократно повторяемый гексануклеотид TTAGGG (теломера). Таким образом, для преодоления укорачивания генома и старения клетка должна активировать теромеразный ген и экспрессировать большое количество теломеразы.
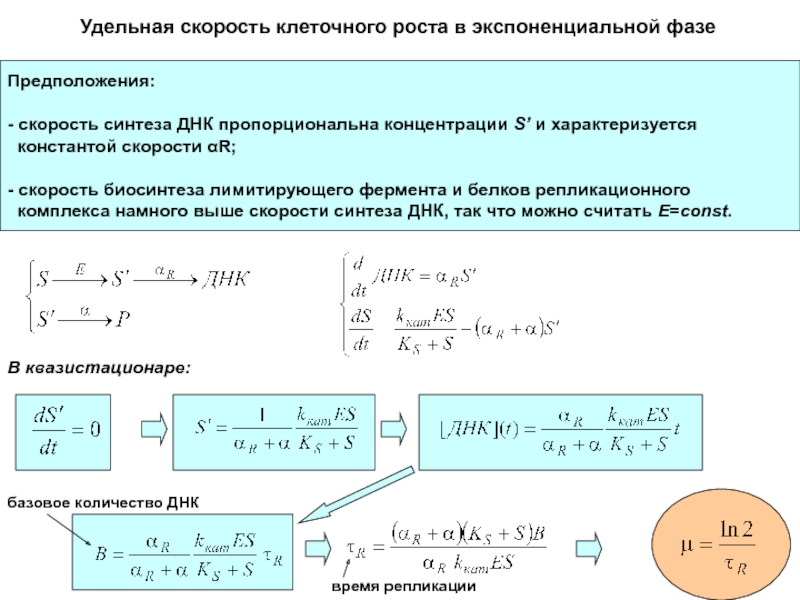
Слайд 65Удельная скорость клеточного роста в экспоненциальной фазе
Предположения:
- скорость синтеза
ДНК пропорциональна концентрации S’ и характеризуется
константой скорости R;
- скорость
биосинтеза лимитирующего фермента и белков репликационногокомплекса намного выше скорости синтеза ДНК, так что можно считать E=const.
В квазистационаре:
время репликации
базовое количество ДНК
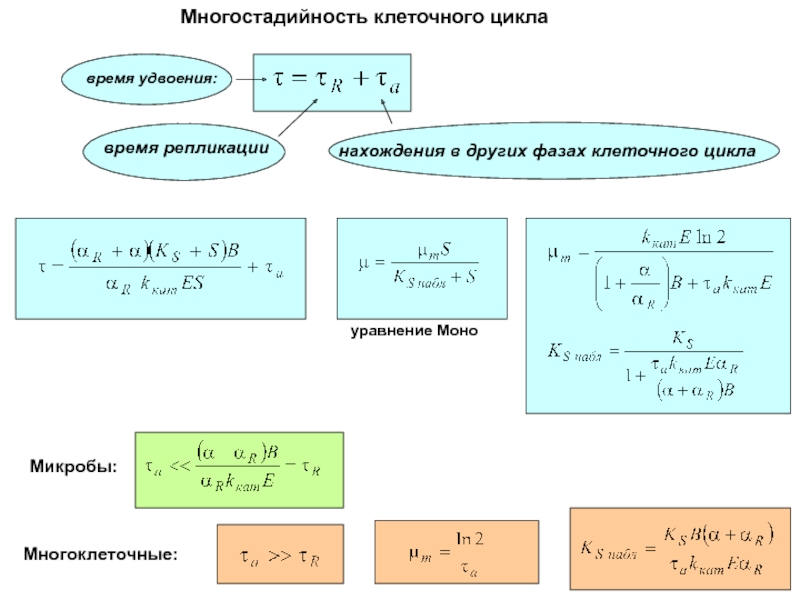
Слайд 66Многостадийность клеточного цикла
время репликации
нахождения в других фазах клеточного
цикла
время удвоения:
уравнение Моно
Микробы:
Многоклеточные:
Слайд 67Старение клетки в процессе роста
Инактивация ключевых ферментативных систем:
- репликационного
комплекса,
- лимитирующего фермента.
В квазистационаре:
пороговая концентрация S
Слайд 68Кинетические модели апоптоза
1) Прогрессирующая некомпетентность:
способные к делению клетки
Возможна ситуация:
(максимальное количество некомпетентных клеток)
Если a дается уравнением Моно,
то: tm - время достижения максимума по Na
Слайд 702) Запрограммируемый отказ
- потеря чувствительности клеток к ростовым факторам
среды
(т.е. уменьшением числа рецепторов R на клетке)
Предположим, что
скорость деления клеток пропорциональна числу рецепторов на мембране:Если >>
Слайд 71Модель “хищник-жертва”
жертва
хищник
Существует стационарное состояние:
Фазовый портрет (связь между
N1 и N2):
фазовый портрет
колебательной траектории
Средняя численность популяции равна
стационарной численности Слайд 72Ассоциации микроорганизмов
симбиоза до антагонизма
Пример: ассоциация двух микроорганизмов M1
и M2
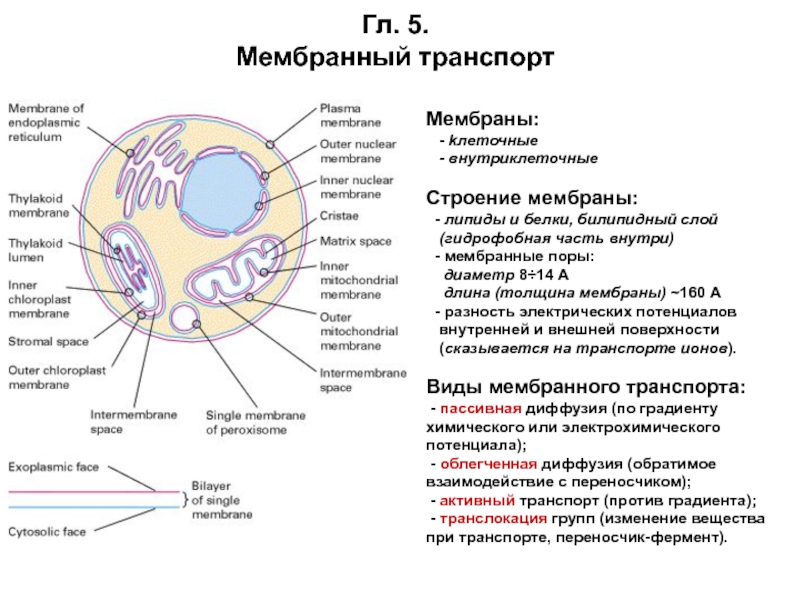
Слайд 73Гл. 5.
Мембранный транспорт
Мембраны:
- kлеточные
- внутриклеточные
Строение мембраны:
- липиды и белки, билипидный слой
(гидрофобная часть внутри)
- мембранные поры: диаметр 8÷14 А
длина (толщина мембраны) ~160 А
- разность электрических потенциалов
внутренней и внешней поверхности
(сказывается на транспорте ионов).
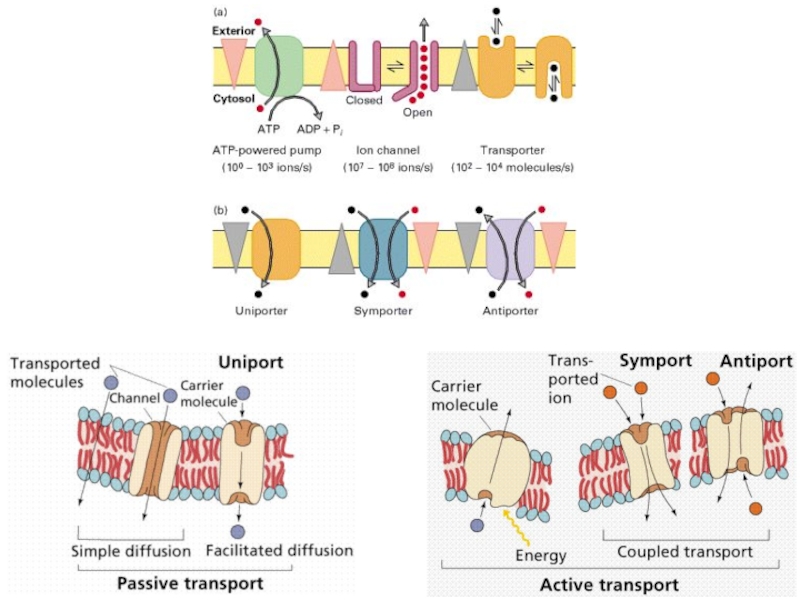
Виды мембранного транспорта:
- пассивная диффузия (по градиенту химического или электрохимического потенциала);
- облегченная диффузия (обратимое взаимодействие с переносчиком);
- активный транспорт (против градиента);
- транслокация групп (изменение вещества при транспорте, переносчик-фермент).
Слайд 75Пассивный транспорт
число Фарадея
заряд (целое число, в единицах электронов)
i-го иона
потенциал электрического поля в мембране
Одномерный случай:
в линейном
приближении:
Коэффициент
проницаемости: подвижность
Если молекула не заряжена:
В равновесии (J = 0):
(уравнение Нерста)
Доннаново равновесие
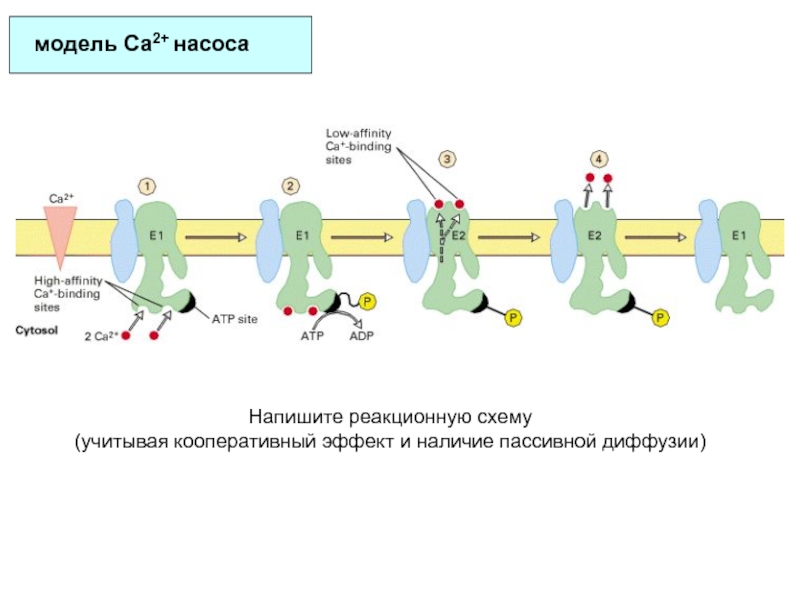
Слайд 78модель Ca2+ насоса
Напишите реакционную схему
(учитывая кооперативный эффект и наличие
пассивной диффузии)
Слайд 79Высокая селективность ионных каналов к определенному типу ионов
натриевый канал:
калиевый канал:
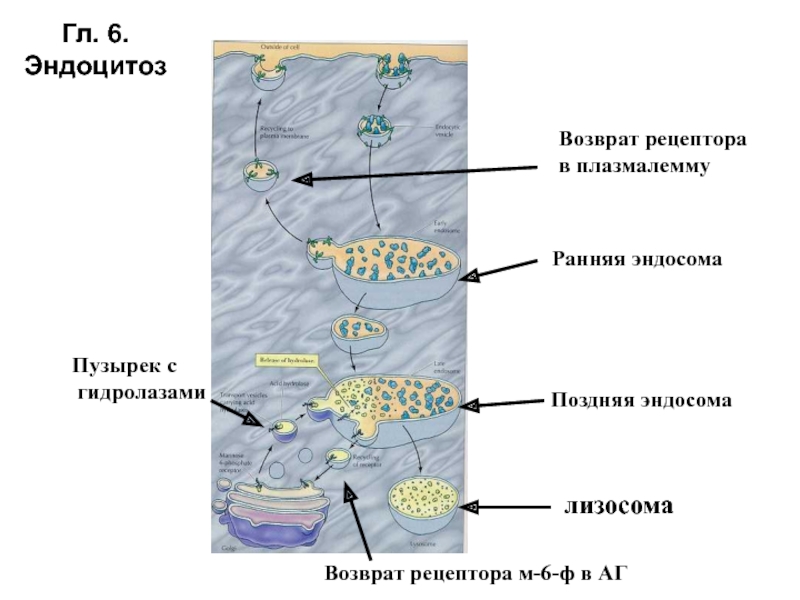
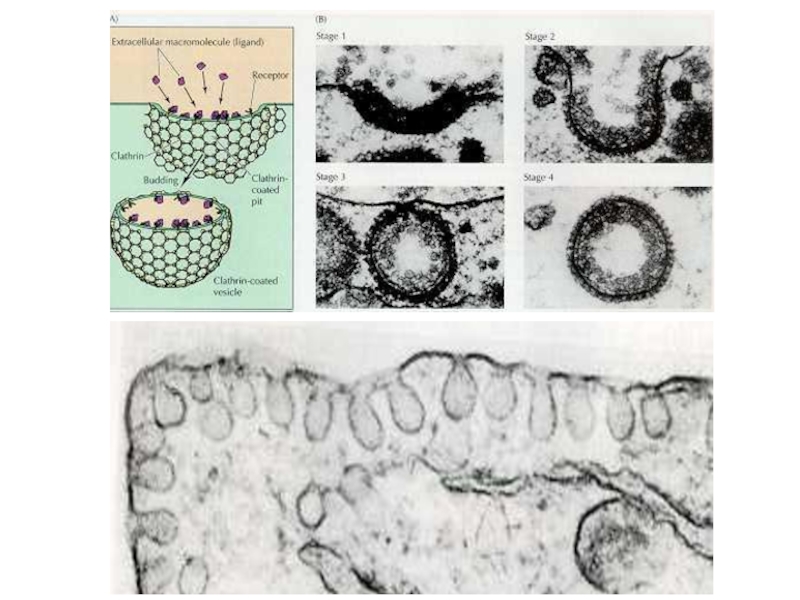
Слайд 80Гл. 6.
Эндоцитоз
Ранняя эндосома
Пузырек с
гидролазами
Поздняя эндосома
лизосома
Возврат рецептора
в плазмалемму
Возврат рецептора м-6-ф
в АГ
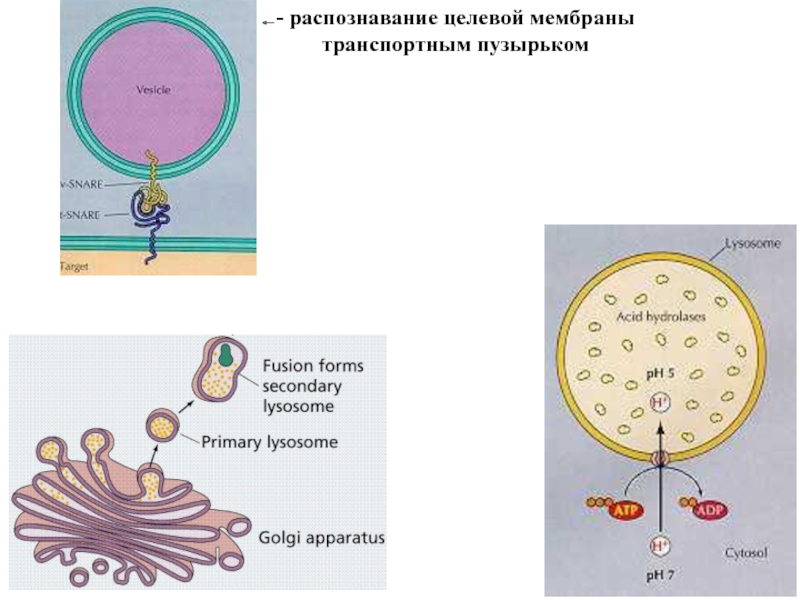
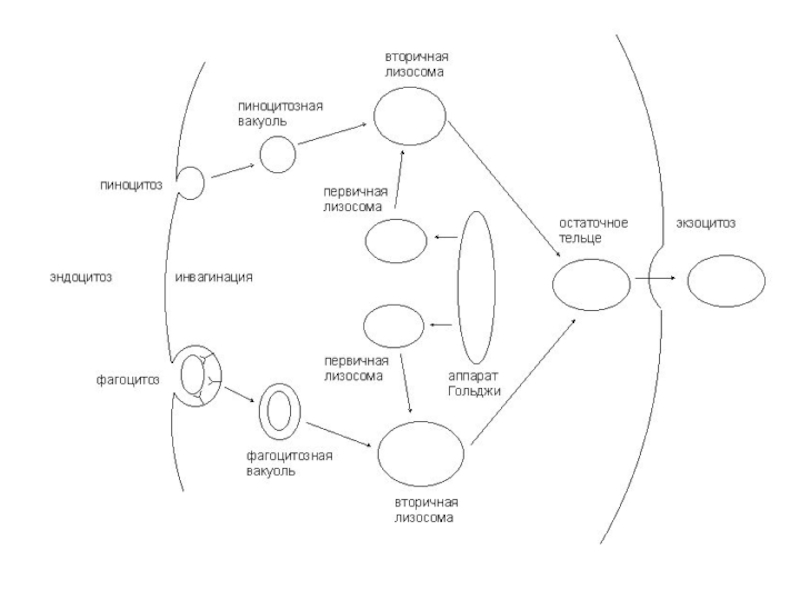
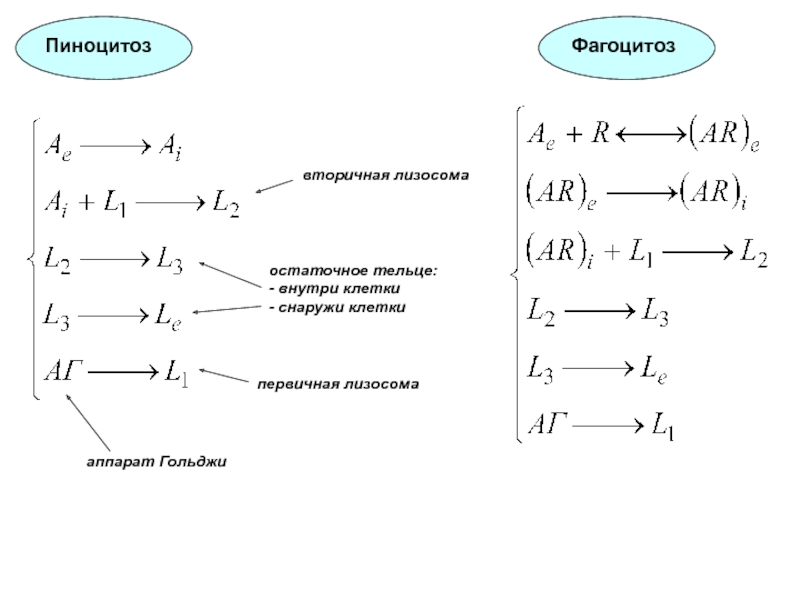
Слайд 84Пиноцитоз
Фагоцитоз
первичная лизосома
вторичная лизосома
остаточное тельце:
- внутри клетки
-
снаружи клетки
аппарат Гольджи
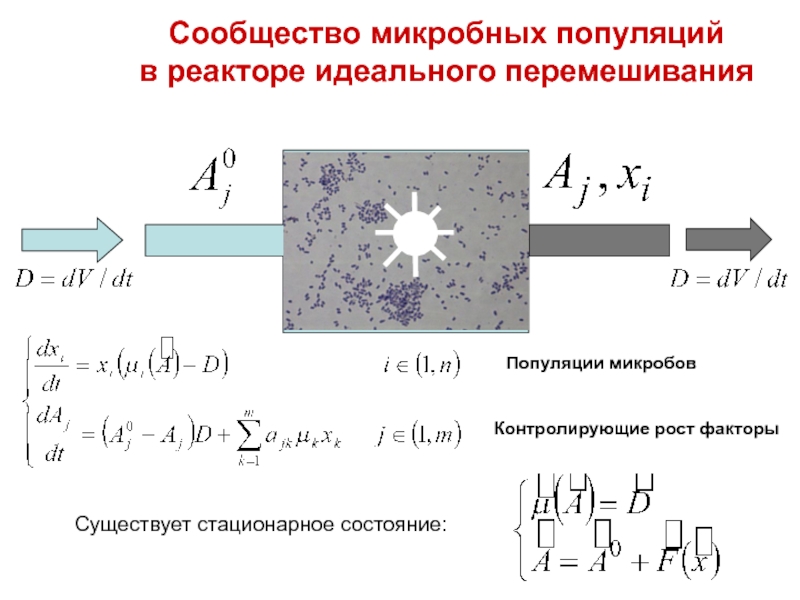
Слайд 86Сообщество микробных популяций
в реакторе идеального перемешивания
Популяции микробов
Контролирующие рост факторы
Существует стационарное
состояние:
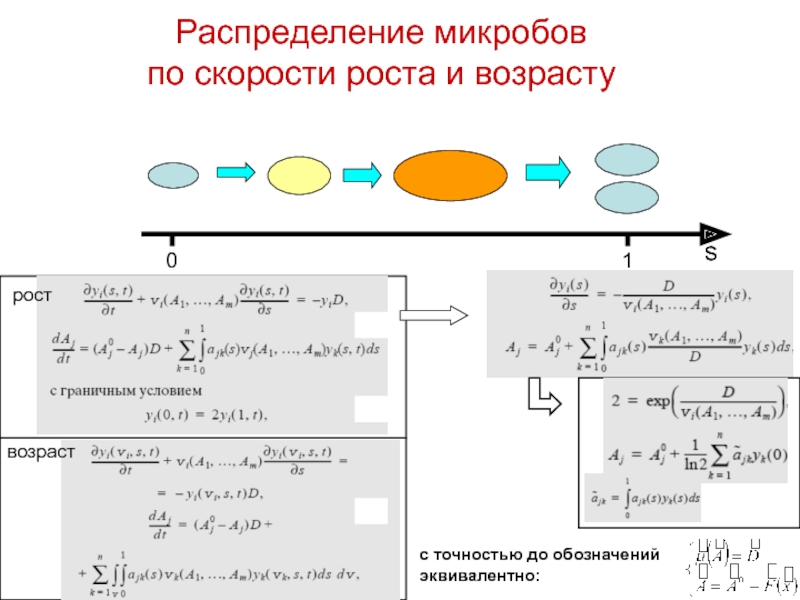
Слайд 87Распределение микробов
по скорости роста и возрасту
s
0
1
с точностью до обозначений
эквивалентно:
рост
возраст
Слайд 88Матричный анализ стационарного состояния
- размера [n × m]
- размера [m × n]
размера [m × m]
Квантование
!следствие
популяций
факторов
Слайд 89Гемолиз в изотоническом хлориде аммония
H2O+NH4Cl
Осмотические и буферные
свойства эритроцита
Мембранный транспорт
Динамика разрушения
мембраны
при ее растяжении
Составные части общей модели:
+
+
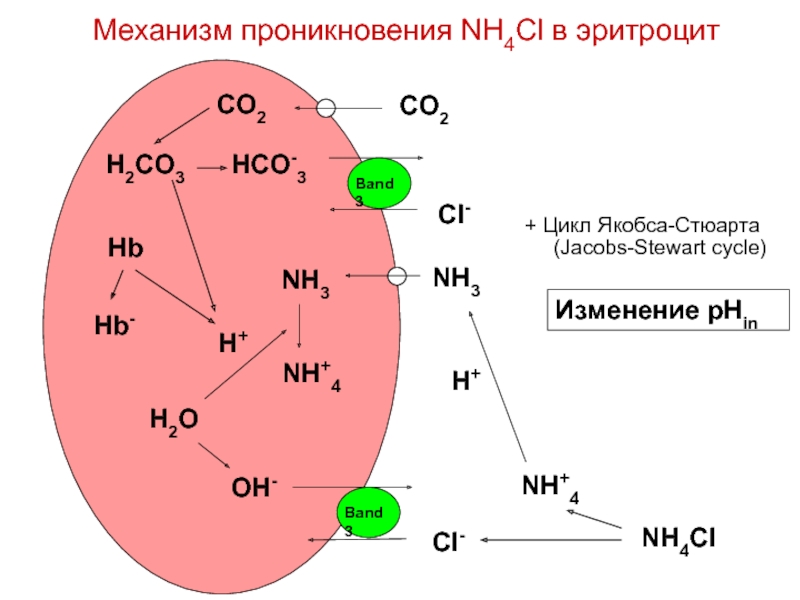
Слайд 90Механизм проникновения NH4Cl в эритроцит
NH3
H+
NH+4
Cl-
NH3
NH+4
H+
OH-
H2O
Band 3
NH4Cl
Hb
Hb-
Band 3
HCO-3
Cl-
CO2
CO2
H2CO3
Изменение pHin
+ Цикл Якобса-Стюарта
(Jacobs-Stewart cycle)
Слайд 92Три стадии гемолиза
Быстрое увеличение (на ~20%) начального объема (< 0.2
сек)
- релаксация клетки в новой среде:
2.
Медленное дальнейшее увеличение объема до сферы (> 10 сек):3. Растяжение сферической клетки со спонтанным разрывом (> 10 сек):
напряженность мембраны
время жизни мембраны
концентрация клеток





























![Биокинетика Феномен колебаний рецепторного связывания 1991 г. - периодические (период порядка 10 Феномен колебаний рецепторного связывания 1991 г. - периодические (период порядка 10 минут)- апериодические модулятор[RL] (t)Возможным источником колебаний](/img/thumbs/1411d3ddde630f9a83326a10b79c9022-800x.jpg)
























![Биокинетика Матричный анализ стационарного состояния - размера [n × m] - размера Матричный анализ стационарного состояния - размера [n × m] - размера [m × n] размера [m ×](/img/thumbs/e5d5dbdbb06c6abcb68cf86279f8d0fd-800x.jpg)