Слайд 1Благородные газы He, Ne, Ar, Kr, Xe, Rn
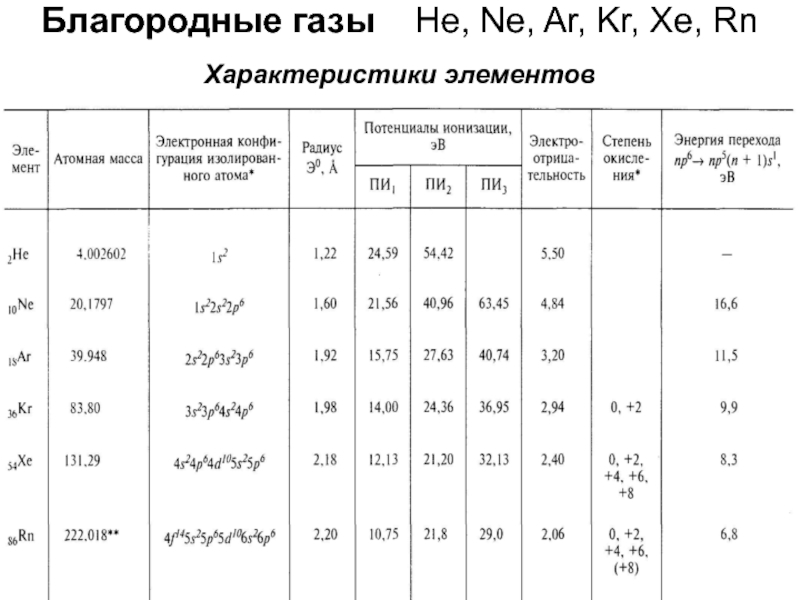
Характеристики элементов
Слайд 2Последствия завершенности электронных оболочек:
1) Молекулы одноатомны
2) Высокие значения Еи, следовательно,
высокая прочность электронных оболочек и значит низкая реакционная способность. (Но
с ростом порядкового номера Еи существенно уменьшается и увеличивается вероятность образования хим. соединений).
Нахождение в природе
Атмосфера (%) Ar –0,9; Ne –103; Нe, Kr –104; Xe – 105
Гелий сопутствует природному газу и нефти (т.к. является продуктом радиоактивного распада).
Огромные количества гелия на Солнце и в звездах (2-й элемент вселенной)
Rn содержится в урановых минералах и природных водах (т.к. является продуктом радиоактивного распада). Т1/2=3,8 суток (самый долгоживущий изотоп)
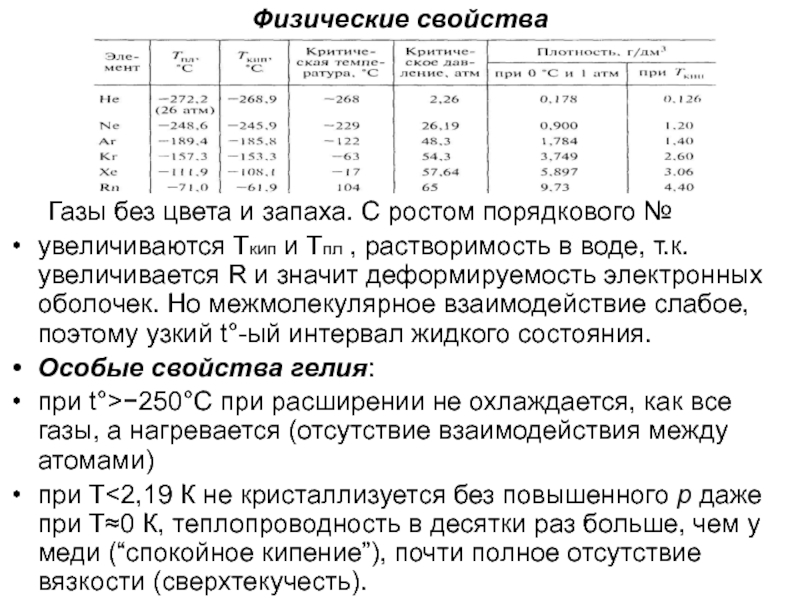
Слайд 3Физические свойства
Газы без цвета и запаха. С ростом порядкового №
увеличиваются Ткип и Тпл , растворимость в воде, т.к. увеличивается
R и значит деформируемость электронных оболочек. Но межмолекулярное взаимодействие слабое, поэтому узкий t°-ый интервал жидкого состояния.
Особые свойства гелия:
при t°>250°С при расширении не охлаждается, как все газы, а нагревается (отсутствие взаимодействия между атомами)
при Т2,19 К не кристаллизуется без повышенного p даже при Т0 К, теплопроводность в десятки раз больше, чем у меди (“спокойное кипение”), почти полное отсутствие вязкости (сверхтекучесть).
.
Слайд 4Получение
В больших количествах Ar и He.
Все ректификацией жидкого воздуха. Гелий
–глубоким охлаждением природного газа.
Соединения благородных газов
Клатраты благородных газов
Клатраты – соединения
образующиеся в результате включения атомов одного вещества “гостя”, в пустоты кристаллических решеток другого “хозяина”.
Известны гидраты благородных газов Ar, Kr, Xe, Rn состава Э·5,75 H2O или, правильнее [Э8(H2O)46].
Известны клатраты с фенолом, гидрохиноном и др.
Ne и He клатратов не образуют, т.к. малые размеры атомов не позволяют им удерживаться в пустотах.
Слайд 5Химические соединения
Известны для Kr, Xe, Rn наиболее изучены для Xe.
Должно
быть много соединений Rn, но их исследованию мешает радиоактивность.
1962 г.
Бартлетт (США). PtF6 (очень сильный окислитель) окисляет O2 до O2[PtF6],
но Еи(O2)= 12,06 эВ Еи(Хе)= 12,13 эВ, значит должен окислять и Хе!
Синтез первого истинного хим. соединения благородных газов: Xe + PtF6 = Xe[PtF6]
Затем относительно быстро были получены многие соединения. Сейчас для Хе около 200 соединений, несколько для Кr и Rn
Слайд 7Фториды Xe (Kr)
Получение Xe + F2 = XeF2 ( XeF4,
XeF6)
Различный режим р и Т для разных фторидов ( для
XeF4
р – атмосферное).
Фториды Xe бесцветные кристаллы, легкоплавкие (ТПЛ°С 140 XeF2, 117 XeF4, 49 XeF6), легколетучие.
XeF2 молекула линейная.
Хорошо растворим в воде, но растворы неустойчивы
2XeF2 + 2H2O = 2Xe + 4HF+ O2
Водные растворы XeF2 сильные окислители (в кислой среде φ= 2,64 В, поэтому например, окисляет BrO3 в BrO4 и т.д.)
Удобный фторирующий агент: мягче, чем F2 (возможно избирательное замещение Н на F во фторируемых органических молекулах), менее агрессивен, чем F2, легче дозировать (взвешиванием).
Слайд 8XeF4 молекула квадратная,
XeF6 молекула пятиугольная пирамида.
XeF4, XeF6 активно гидролизуются:
6XeF4
+ 12H2O = 2XeO3 + 4Xe + 3O2 + 24HF
XeF6
+ 3H2O = XeO3 + 6HF
XeF4 более сильный окислитель, чем XeF2.
Мгновенно окисляет Mn2+ в MnO4, Hg в HgF2, Pt в PtF4, SF4 в SF6 и т.д. Органические вещества при соприкосновении с твердым XeF4 воспламеняются, часть - взрывается.
XeF6 ещё более активен, с ним нельзя работать в стеклянной и кварцевой посуде, т.к. реагирует ступенчато с SiO2, с образованием взрывчатого XeO3
2XeF6 + SiO2 = 2XeOF4 + SiF4
2XeOF4 + SiO2 = 2XeO2F2 + SiF4
2XeO2F2 + SiO2 = 2XeO3+ SiF4
Итого : 2XeF6 + 3SiO2 = 2XeO3 + 3SiF4
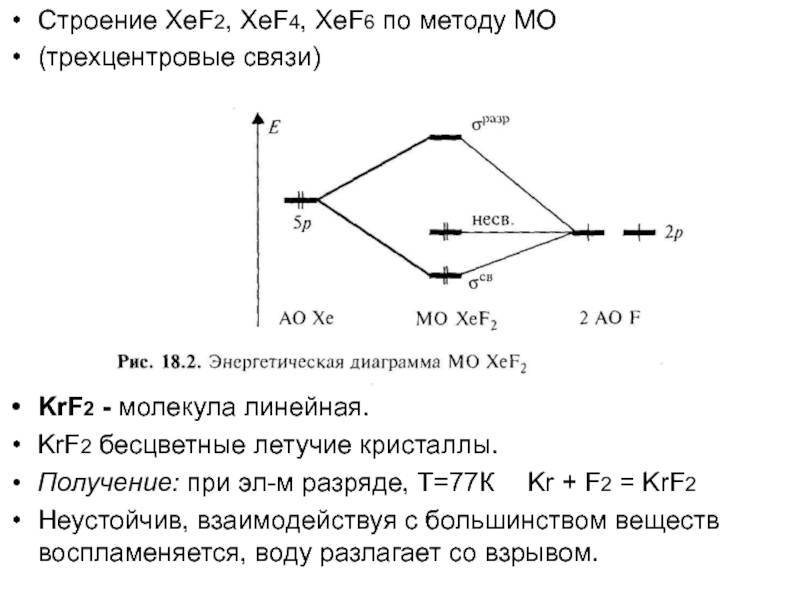
Слайд 9Строение XeF2, XeF4, XeF6 по методу МО
(трехцентровые связи)
KrF2 -
молекула линейная.
KrF2 бесцветные летучие кристаллы.
Получение: при эл-м разряде, Т=77К Kr +
F2 = KrF2
Неустойчив, взаимодействуя с большинством веществ воспламеняется, воду разлагает со взрывом.
Слайд 10Реакции с участием фторидов Xe
1) Фториды Xe проявляют свойства кислот
и оснований Льюиса (реакции присоединения):
Кислотные свойства: XeF6+ CsF= Cs[XeF]7
Основные
свойства: XeF6 + SbF5 = [XeF5][SbF6]
2) Разложение и диспропорционирование при нагревании:
3XeF6 =XeF2 + 2XeF8 2XeF2 =XeF4 + Xe
3) Гидролиз и диспропорционирование при контакте с водой:
XeF6 + H2O = XeOF4 +2HF
XeOF4+ H2O = XeO2F2 +2HF
XeO2F2 + H2O = XeO3+ 2HF
Итого : XeF6 + 3H2O = XeO3 + 6HF
6XeF4 + 12H2O = 2XeO3 + 4Xe + 3O2 + 24HF
XeF4 + 2H2O = Xe + O2 + 4HF
3XeF4 = 2XeF6 + Xe (при контакте с H2O)
2XeF2 + 2H2O = 2Xe + 4HF+ O2
Состав продуктов определяется условиями проведения реакции (t°, пропорции реагентов).
Слайд 11Кислородсодержащие соединения Хе
XeO3 - триоксид Хе - бесцветные кристаллы, легко
и мощно взрывающиеся (взрыв происходит при массе >20 мг).
Получение –
низкотемпературный гидролиз XeF4, XeF6.
Хорошо растворим в воде, где предполагают образование ксеноновой кислоты Н2XeО4
Водные растворы XeO3 не проводят эл-й ток, поэтому до сих пор не ясно, есть в растворе Н2XeО4 (Н6XeО6) или нет.
Предполагают существование равновесия:
XeO3 +H2O ↔ Н2XeО4 ↔ Н+ + НXeО4
которое в нейтральной среде сильно смещено влево,
в сильнощелочной вправо, с образованием ксенатов состава: М+НXeО4 , М2+XeО4, М2+XeО4, известен плохо растворимый Ва3XeО6
XeO3 +КОH = КНXeО4
XeO3 +Ва(ОH)2 = ВаXeО4+ H2O (или Ва3XeО6)
Ксенаты – бесцветные кристаллы, устойчивые до t° 150° С (Ва3XeО6 до t > 250° С)
Слайд 12Все кислородсодержащие соединения Хе+6 сильные окислители, особенно в кислой среде,
например:
5XeO3 + 6MnSO4 + 9H2O = 5Xe
+ 6HMnO4 + 6Н2SО4
XeO3 + 6FeSO4 + 3Н2SО4 = Xe + 3Fe2(SО4)3 + 3H2O
Но с более сильными окислителями (например, O3) XeO3 проявляет восстановительные свойства.
XeО4 - тетраоксид Хе - Светло-желтый взрывчатый газ
Получение:
при t°=5°С: Bа2XeО6+2Н2SО4(к)=2BaSО4↓+XeО4↑+2H2O
Неустойчив, при t°=0°С разлагается:
3XeО4=2XeO3+Хе+3O2
При растворении в воде образуется перксеноновая кислота Н4XeО6
К1=10-2, К2=10-6, К3=10-11 (достаточно сильная по сравнению с кислотами “соседей” Хе по периоду (Н5IО6 и Н6ТeО6)
В индивидуальном состоянии не выделена; разлагается с выделением O2 : 2Н4XeО6 = 2XeO3+O2+4H2O
Получены соли Н4XeО6 - перксенаты состава М+НXeО6 , М2+XeО6, М2+XeО6 (М: K, Rb, Cs – растворимы в воде, Li, Na, Ba, Ag, Zn, Pb, La, Th – нерастворимы)
Слайд 13Способы получения перксенатов:
1) окисление ксенатов озоном,
3XeO3 +12NaОH + O3= 3Nа4XeО6+6H2O
или
XeO3+4NaОH + O3= Nа4XeО6+ O2+2H2O
Ва3XeО6+ O3= Ва2XeО6 (Ва3XeО5)+ O2
2) щелочной гидролиз XeF6
2XeF6+ 16NaОH = Nа4XeО6+12NaF +Xe + 3O2+8H2O
4XeF6 + 18Ва(ОH)2 = 3Ba2XeО6+12BaF2 +Xe + 18H2O
3) диспропорционирование XeO3 в щелочной среде
2XeO3+4NaОH = Nа4XeО6+ Xe + 3O2+2H2O
медленно протекает диспропорционирование ксенатов в растворе: КНXeО4+2KОH= K4XeО6+ Xe + 3O2 +2H2O
Перксенаты (обычно кристаллогидраты) довольно устойчивы. При нагревании перксенаты разлагаются, например: Li4XeО6 =Li2О+ Xe + 2O2
Кислородсодержащие соединения Хе+8 очень сильные окислители (в кислой среде более сильные (φ= 2,3-3,0 В), чем в щелочной (φ= 0,9 В)). Окисляют Mn2+ в MnO4, IO3 в IO4 и т.д.
Слайд 14Применение благородных газов и их соединений
Не, Кr, Xe - электровакуумная
техника (лампы); Не – метеорологические зонды; Не, Аr – создание
инертной атмосферы; смесь гелия и кислорода – газ для дыхания водолазов (не вызывает кессонной болезни).
Соединения Хе, Кr – окислители, фторирующие агенты.
Биологическая роль
Заметной биол. активности нет, кроме радона. “Радоновые ванны” помогают излечить некоторые болезни. В больших дозах радон опасен из-за радиоактивности (больше, чем уран и радий вместе).
Проблема: присутствие радона в горных породах, грунтовых водах и, особенно, во всех строительных материалах приводит к его накоплению в помещениях и необходимости снижения его концентрации.
При работе АЭС с реакторами на уране и плутонии распад ядерного топлива дает радионуклиды Хе, трудно поглощаемые обычными сорбентами, что приводит к выбросу их в атмосферу. Для поглощения используют поглотители O2[SbF6], которые связывают Хе и Rn в твердые комплексы, например [ХеF] [Sb2F11].