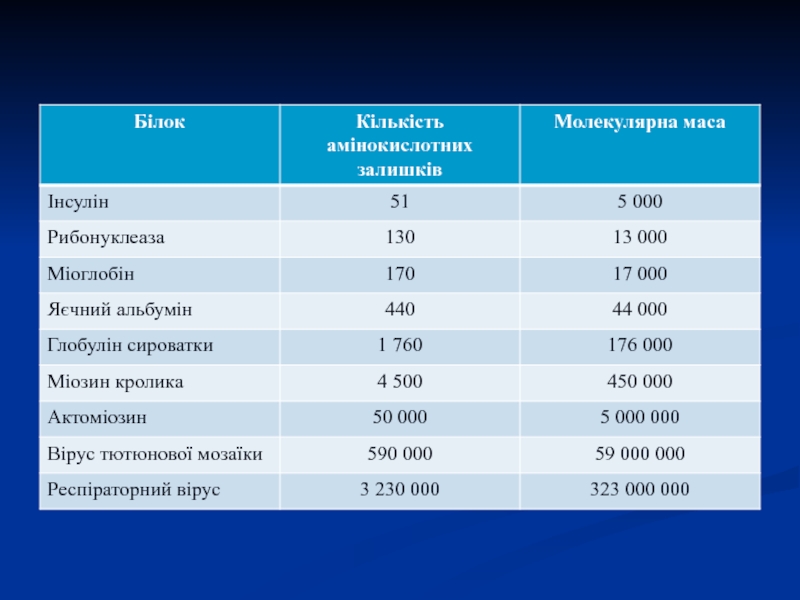
Слайд 1Білки (протеїни)
Білки – біологічні полімерні молекули, мономерами яких є амінокислоти,
сполучені пептидними зв'язками.
Індивідуальність білкових молекул визначається порядком чергування амінокислот
і їх кількістю.
Білки мають м.м. від 5 тис. Д і більше.
Слайд 2Функції білків
Каталітична – ферменти
Пластична – структурні білки
Регуляторна – гормони, ферменти
Скорочувальна
– білки м'язів і цитоскелету
Захисна – імуноглобуліни
Енергетична
Рецепторна – деякі білки
мембран
Транспортна – білки крові, білки мембран
Гістосумісність – деякі білки мембран
В організмі тварин білків - 18-21%,
у рослин – 0,01-15%
Слайд 3Вміст білків у тканинах, %
Тварини
Організм – 18-21
М'язи
– 19-23
Печінка – 18-19
Нирки – 16-18
Головний мозок – 8-10
Кістки – 8-9
Рослини
Зерна – 10-16
Стебла – 1,5-3
Листя – 1,2-3
Слайд 4Елементарний склад білків, %
Карбон – 49-55
Оксиген – 21-23
Нітроген – 16,5
Гідроген
– 6-8
Сульфур – 0,2-3
Фосфор – 1-2
Мікроелементи (Cu, Mn, Zn, J,
Fe та ін. - 0,00001-0,2)
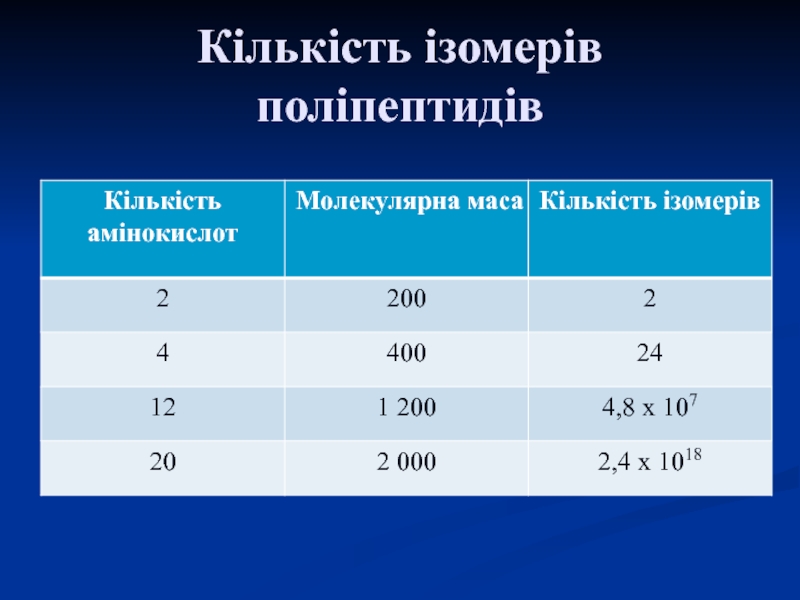
Слайд 6Кількість ізомерів поліпептидів
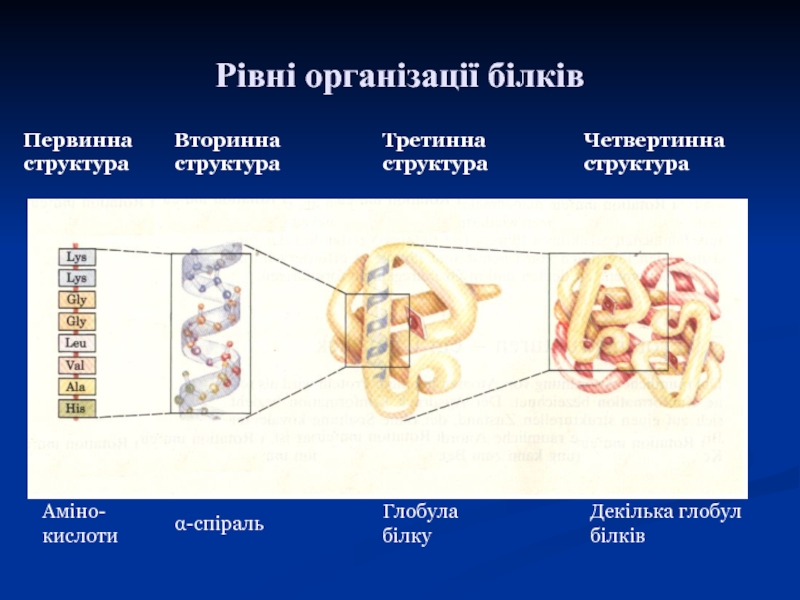
Слайд 7Структура білків
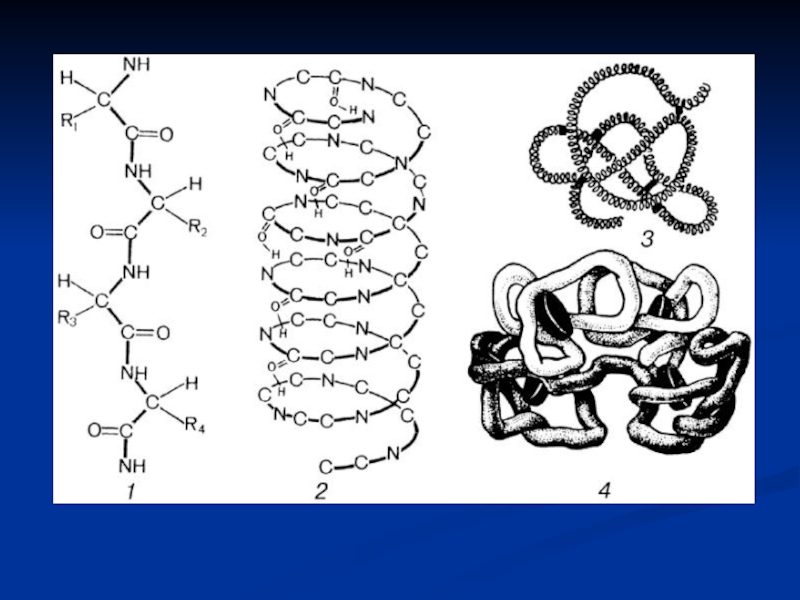
Пептидні ланцюги містять десятки, сотні та тисячі амінокислотних залишків,
з'єднаних міцними пептидними зв'язками. За рахунок внутрішньомолекулярних взаємодій білки утворюють
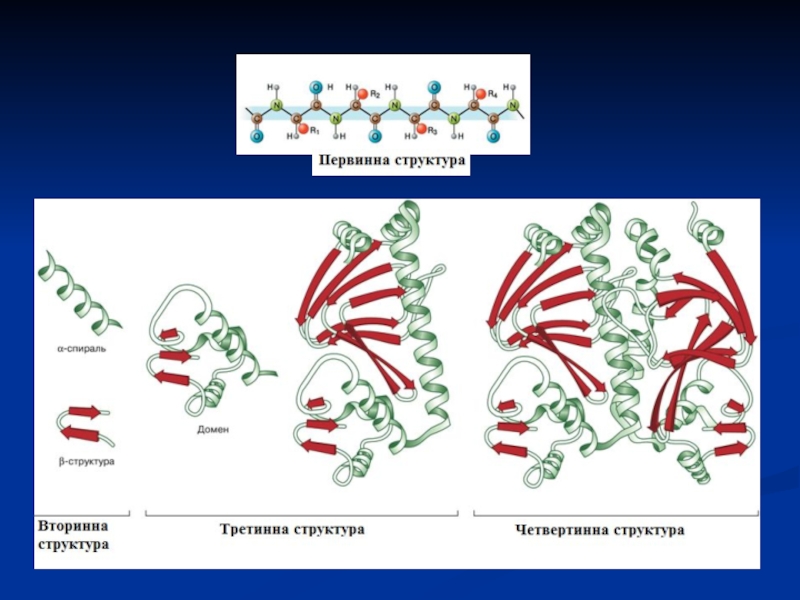
певну просторову структуру, що називається «конформація білків». Лінійна послідовність амінокислот в білку містить інформацію про побудову тривимірної просторової структури. Розрізняють 4 рівні структурної організації білків: первинна, вторинна, третинна і четвертинна. Але, в останні роки виділяють ще і надвторинні і доменні структури (проміжні).
Слайд 8Первинна структура
Вторинна структура
Аміно-
кислоти
α-спіраль
Третинна структура
Четвертинна структура
Глобула білку
Декілька глобул білків
Рівні організації білків
Слайд 9
• Первинна структура: порядок розташування амінокислот у поліпептидному ланцюзі білка
(зв'язки – ковалентні пептидні).
• Вторинна структура: поліпептидний ланцюг впорядкований у
просторі або у вигляді α-спіралі або β-складчастої структури (водневі зв'язки, дисульфідні).
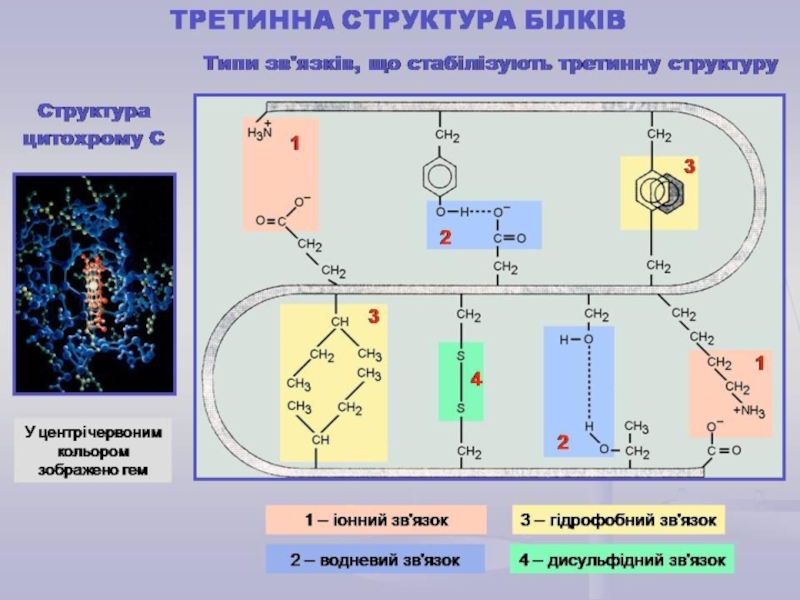
• Третинна структура: повна впорядкованість у просторі вторинної структури з формуванням шароподібної форми (глобули) або витягнутої форми (фібрили) (водневі, гідрофобні взаємодії, дисульфідні, естерні).
• Четвертинна структура: об'єднання декількох субодиниць (однакових або різних) у просторі в одну макромолекулу (олігомерний білок)
Рівні просторової
організації біополімерів:
Слайд 11 Первинна структура білків
Класифікація амінокислот:
1. Структурна.
- циклічні:
а) гетероциклічні
б)
ароматичні
- ациклічні:
а) моноаміномонокарбонові – гліцин, аланін, лейцин, валін, ізолейцин та
ін.
б) диаміномонокарбонові – лізин, аргінін, орнітин
в) моноамінодикарбонові – глутамінова та аспарагінова кислоти
2. Біологічна.
- замінні
- незамінні
Слайд 12На даний час у природі виявлено більше 300 різних АК.
В організмі людини і тварин міститься близько 60 АК і
їх похідних, але не всі вони входять до складу білків. Серед них виділено групу з 20 найважливіших АК, які постійно зустрічаються в білкових сполуках. АК, що входять до складу білків, одержали назву протеїногенних. Так звані непротеїногенні білки знаходяться в клітині або у вільному стані, або входять до складу інших небілкових сполук.
Назви АК будуються за замінною номенклатурою органічних кислот, але, як правило, використовуються їх тривіальні назви, які часто пов'язані із джерелом виділення АК або будь-якими іншими ознаками. Н-д: гліцин має солодкий смак (від грец. glycos – солодкий), серин входить до складу білка фіброїну шовку (від лат. serius – шовковистий), тирозин виділений із сиру (грец. tyros – сир), аспарагінова кислота – із паростків спаржі (лат. asparagus – спаржа) тощо.
Слайд 13Амінокислоти
Замінні
Гліцин
Аланін
Серин
Цистеїн
Аспарагінова кислота
Глутамінова кислота
Тирозин
Пролін
Аспарагін
Глутамін
Незамінні
Треонін
Метіонін
Валін
Лейцин
Ізолейцин
Лізин
Фенілаланін
Триптофан
Аргінін
Гістидин
Слайд 14
Вторинна структура білків
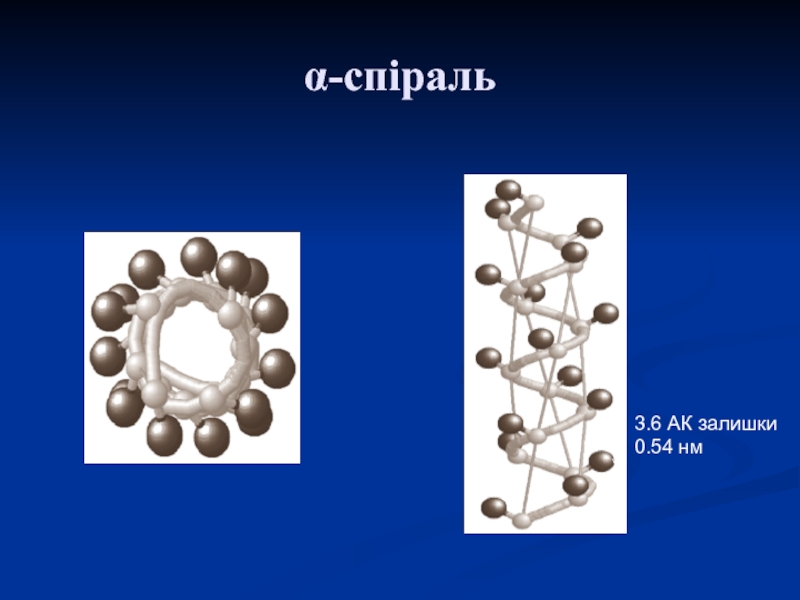
α-спіраль
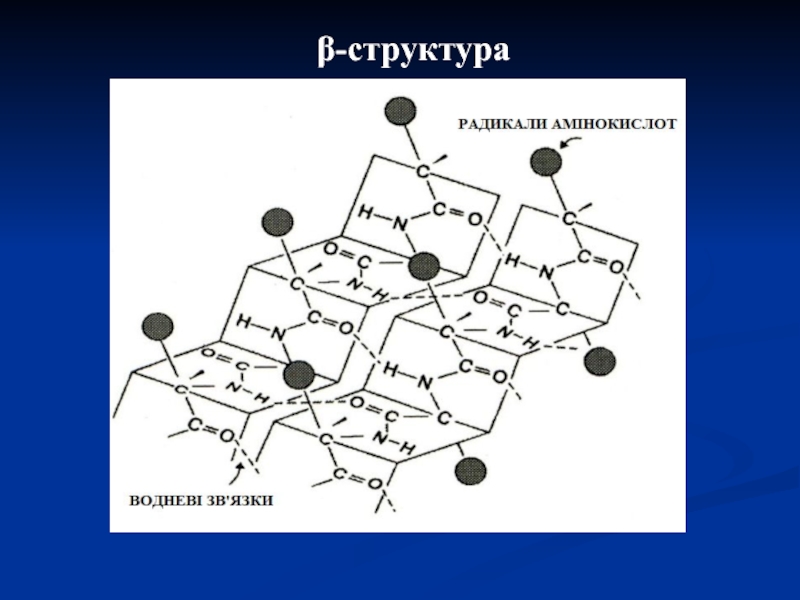
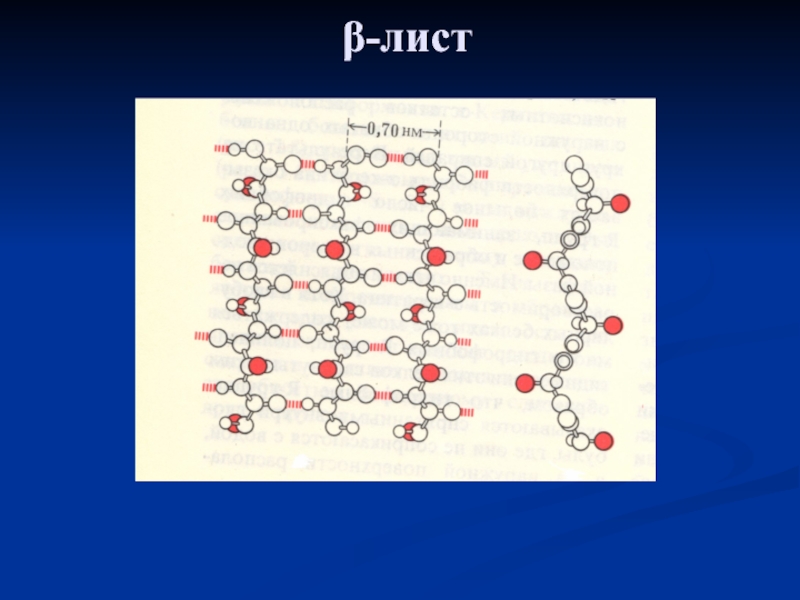
β-структура (складчастий шар або лист)
β-вигин
Отже, вторинна структура –
це форма і ступінь спіралізації поліпептидного ланцюга в просторі (спіральна
конформація) і утворення ділянок β-структур в одному ланцюзі або, в основному, між ланцюгами (шарувато-складчаста конформація).
Слайд 16Американські вчені Л. Полінг та Р. Корі (1950 р.) установили,
що для пептидів найвигіднішою конформацією є певна спіральнозакручена структура, яку
вони назвали α-спіраллю. ЇЇ можна уявити як закручену ліворуч або праворуч гвинтову драбину, в якій сходинками служать радикали АК. У природних білках виявлено тільки праві α-спіралі. Зовні α-спіраль має вигляд правильної спіралі, яка йде поверхнею уявного циліндра.
Під час формування α-спіралі водневі зв'язки утворюються в поліпептидному ланцюзі між кожною карбонільною групою і четвертою за ходом ланцюга ‒NH-групою.
Слайд 18Цей різновид вторинної структури має слабко вигнуту конфігурацію поліпептидного ланцюга.
Вона формується за допомогою міжпептидних водневих зв'язків у межах окремих
ділянок одного ланцюга, де водневі зв'язки будуть всередині поліпептидного ланцюга.
У більшості випадків складчасті шари містять не більше 6-ти поліпептидних ланцюгів.
Залежно від взаємної орієнтації ланцюгів розрізняють паралельні і антипаралельні β-структури.
У білках можливі переходи α-структур у β-структури і навпаки внаслідок перебудови водневих зв'язків. Такий перехід виявлено в кератині – білку волосся.
Слайд 19
α-спіраль
3.6 АК залишки
0.54 нм
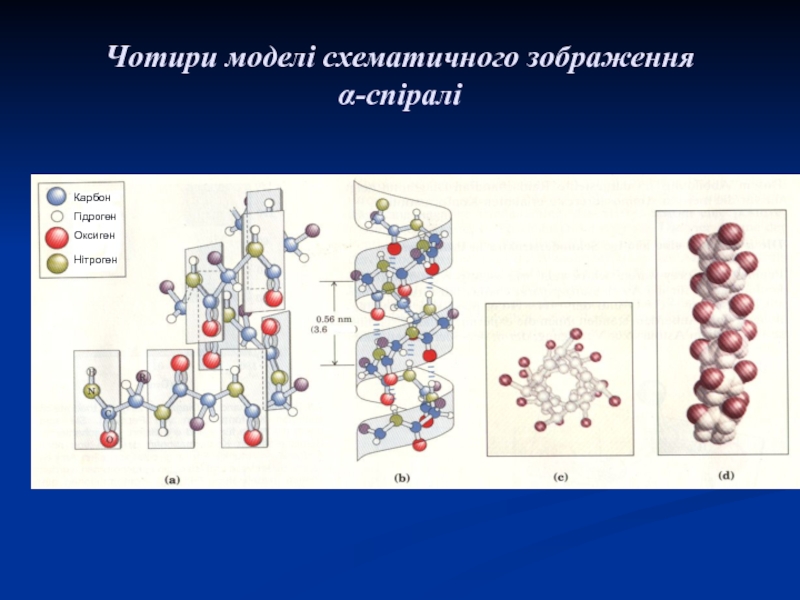
Слайд 20Чотири моделі схематичного зображення α-спіралі
Карбон
Гідроген
Оксиген
Нітроген
Слайд 22Надвторинна структура і
доменні білки
Методом рентгеноструктурного аналізу доведене існування ще
двох рівней організації білкової молекули: надвторинна структура і доменні білки
– проміжні між вторинними і третинними структурами.
Надвторинна структура зумовлена наявністю ансамблів взаємодіючих між собою вторинних структур. Це агрегати, у яких α-спіральні і β-структурні ділянки в білках взаємодіють одна з одною і між собою.
Надвторинною структурою є суперспіралізована α-спіраль, у якій два α-спіральні поліпептидні ланцюги скручуються між собою, створюючи ліву суперспіраль.
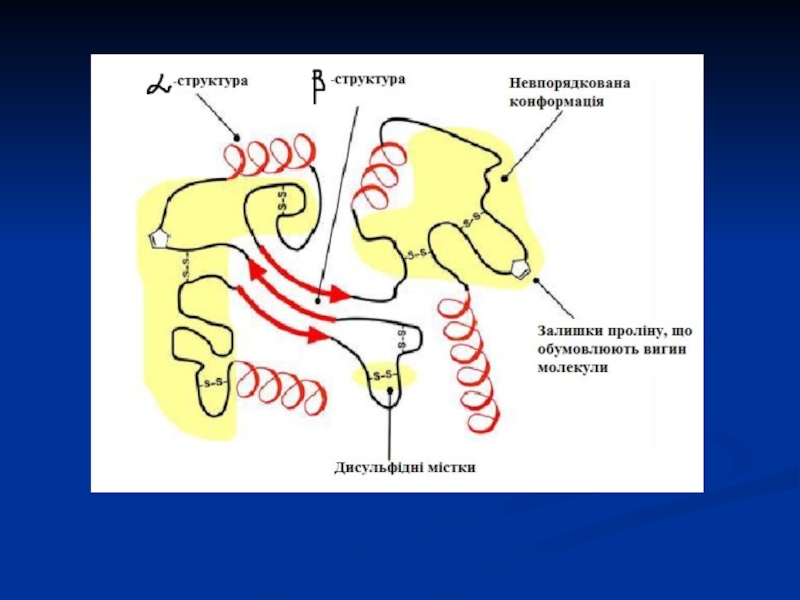
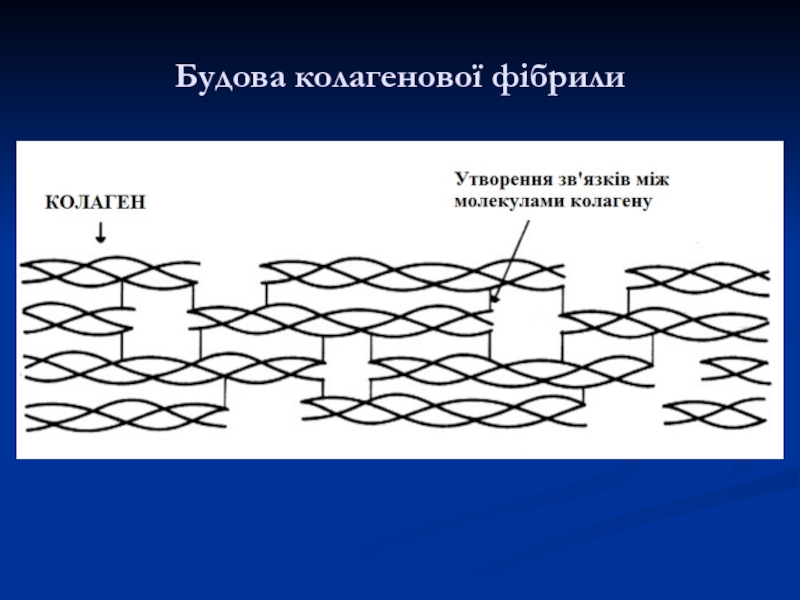
Слайд 23Плоскі кільця проліну і гідроксипроліну, які регулярно чергуються вздовж ланцюга,
як і міжланцюгові зв'язки між α-ланцюгами тропоколагену, надають їй жорстокості,
тому колаген стійкий до розтягування.
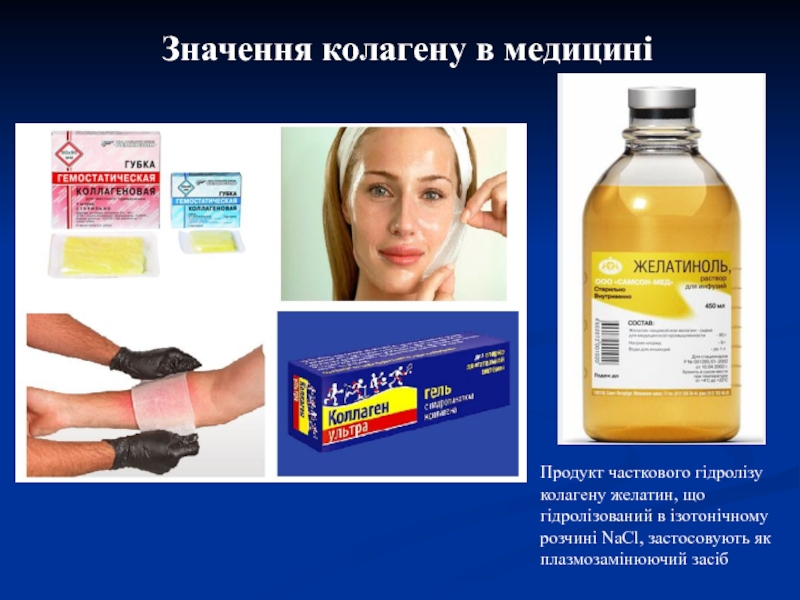
Слайд 24Значення колагену в медицині
Продукт часткового гідролізу колагену желатин, що гідролізований
в ізотонічному розчині NaCl, застосовують як плазмозамінюючий засіб
Слайд 25Доменні білки
У молекулі доменних білків ділянки, що містять фрагменти вторинної
структури (α-спіралі, β-структури
та їх сполучення), утворені одним і тим же поліпептидним ланцюгом і з'єднані між собою ніби короткими перемичками цього ж ланцюга.
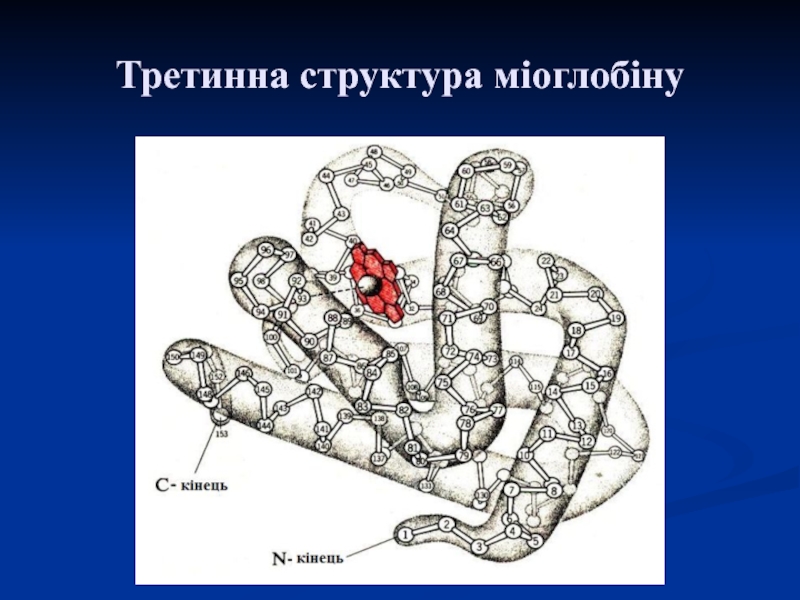
Слайд 26Третинна структура білків
Це спосіб укладання поліпептидного ланцюга з елементами вторинної
структури у просторі, який досягається за рахунок взаємодії між радикалами
залишків АК.
Визначає форму білкової молекули, утворюючи або глобулу (глобулярні білки) або достатньо витягнуті волокна (фібрилярні білки).
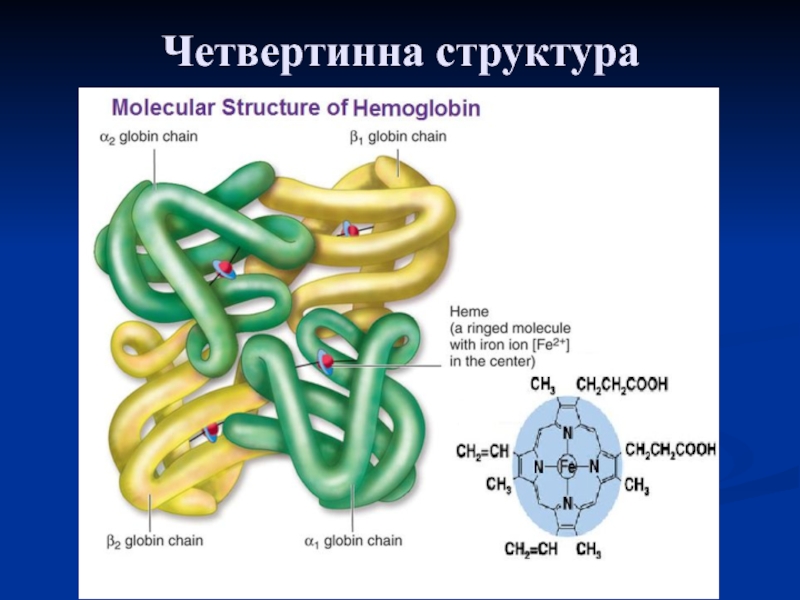
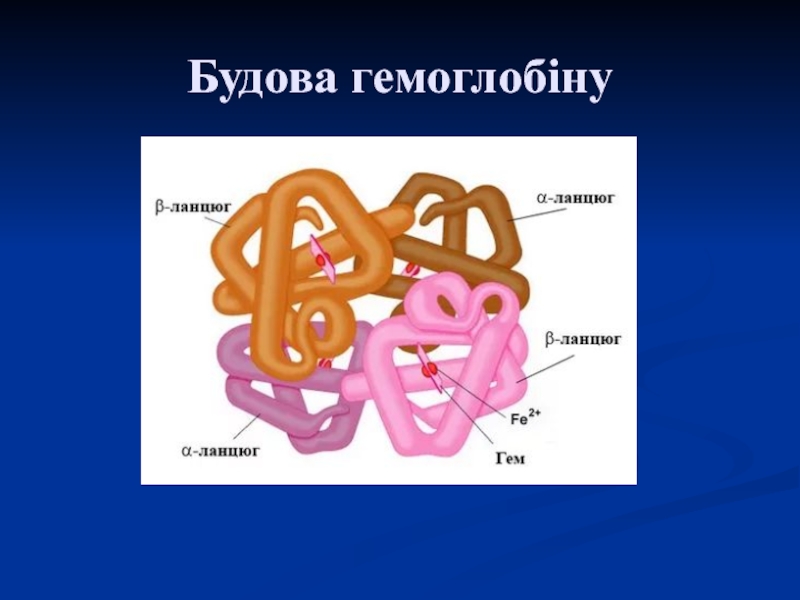
Слайд 31Класичним прикладом білків із четвертинною структурою є гемоглобін, молекула якого
побудована з 4 субодиниць: двох α- і двох β-поліпептидних ланцюгів.
Гемоглобін має 4 групи і являє собою унікальний зразок взаємовідношень між молекулярною структурою і функцією білка, яка полягає в перенесенні кисню з легенів у тканини.
Слайд 34Альбуміни
Молекулярна маса – 35-70 тис. Да
ІЕТ – 4,7 (кислі)
Багато лейцину
(15%), мало амінокислоти гліцину.
Добре розчинні у воді (гідрофільні), мають еліпсоїдну
форму.
Осаджуються – при 100% насиченні розчину нейтральними солями, наприклад (NH4)2SO4
Складають біля 50% усіх білків плазми.
Під час електрофорезу переміщуються першими.
Основні функції: регуляція осмотичних процесів і транспорт (напр. транспорт ліпідів).
Різновиди: сироватковий (сероальбумін), молочний (лактальбумін), яєчний (овоальбумін).
Слайд 35Глобуліни
Молекулярна маса – 0,9-1,5 млн. Да
ІЕТ - 5,5 – 7,3
Містять
більше гліцину (≈ 5%), ніж альбуміни.
Нерозчинні у воді, але розчинні
в слабких сольових розчинах.
Осаджуються при 50%-ному насиченні розчину (NH4)2SO4
Різновиди: сироватковий, яєчний, молочний та ін.
Під час електрофорезу йдуть одразу за альбумінами і розділяються на фракції α-, β- і γ- (антитіла).
Слайд 36Гістони
Білки ядра.
Маса – 12 – 30 тис. Да
ІЕТ – 8
– 9 (основні, містять 20-30% лужних АК)
Розчиняються у слабких кислотах,
осаджуються спиртом.
Входять до складу хромосом ядер клітин, в природі з'єднані з ДНК і відіграють важливу роль у її стабілізації, регуляції генів.
Співвідношення в хроматині виражається ДНК:гістони як 1:1
Слайд 37Протаміни
Молекулярна маса – до 12 тис. Да
Вміст диаміномонокарбонових кислот (аргінін,
лізин) близько 80%, розчиняються в слабких кислотах, не осаджуються при
кип’ятінні.
ІЕТ – 9,0-12,0
Містяться в статевих клітинах, регулюють швидкість біосинтезу білків.
Слайд 38
Білки рослинного походження
Глютеліни
Білки зерен.
ІЕТ - 6-8
До їх складу входить
велика кількість глутамінової кислоти і лізину.
Добре розчинні в лужних розчинах (0,2-2% NaOH).
Глютелін пшениці, орізенін рису, зеїн кукурудзи, гордеїн ячменю та ін.
Слайд 39
Проламіни
Білки зерен злаків.
Маса – 28 -50 тис. Да.
ІЕТ
– 4-5.
До складу входить багато проліну, а також глутамінової кислоти.
Добре
розчинні в 60-80%-ному етиловому спирті.
Утворюють клейковину зерна.
Слайд 40Протеїноїди (склеропротеїни)
Білки опорних тканин (кістки, хрящі, сухожилля, шерсть, копита).
Нерозчинні у
воді, розчинах солей, кислот і лугів.
Багато сірковмісних АК (цистеїн, цистин).
Форма
– фібрилярні.
Представники: колаген, еластин, фіброїн, кератин.
Висока стійкість і еластичність.
Слабко розщеплюються ферментами кишкового тракту, тому погано засвоюються і сприяють процесам гниття в кишечнику.
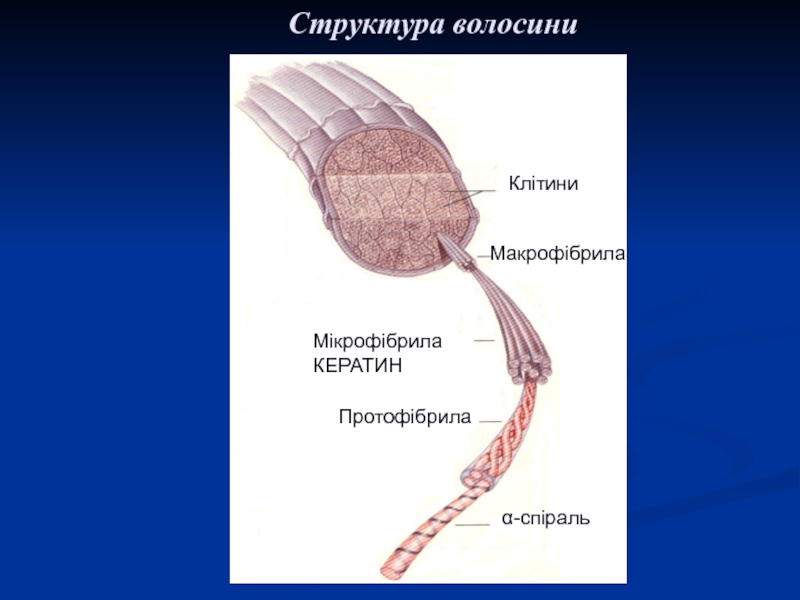
Слайд 41Клітини
Поперечный разрез волоса
Макрофібрила
Мікрофібрила
КЕРАТИН
Протофібрила
α-спіраль
Структура волосини
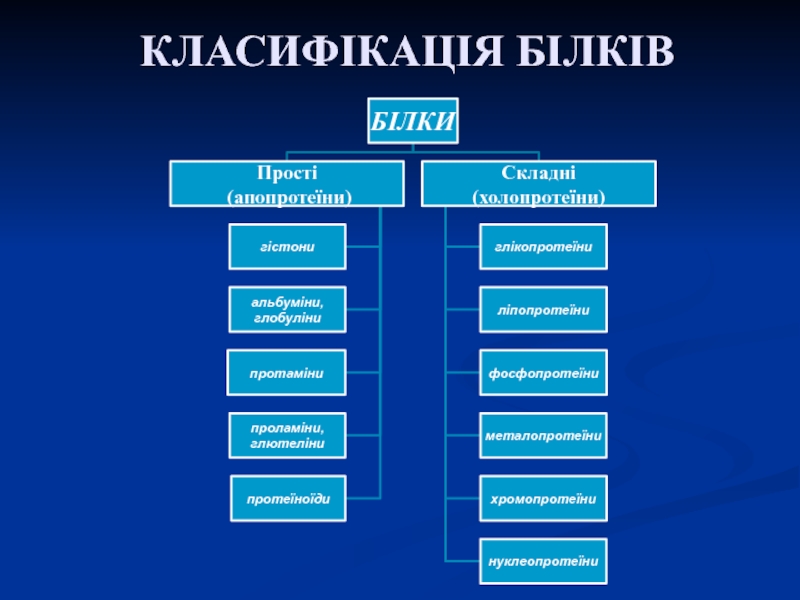
Слайд 43Складні протеїни
Простий білок + небілкова речовина (простетична
група)
а) нуклеопротеїни (простий білок + нуклеїнова кислота)
б) хромопротеїни (простий білок
+ забарвлена речовина)
в) фосфопротеїни (простий білок + фосфатна кислота)
г) глікопротеїни (простий білок + вуглевод)
д) ліпопротеїни (простий білок + ліпід)
е) металопротеїни (простий білок + метал)
Слайд 44
Нуклеопротеїни
↓ складаються з ↓
Протеїни
Нуклеїнові кислоти
гістони ДНК
негістонові білки (ДезоксирибоНуклеоПротеїни – ДНП)
протаміни РНК (РибоНуклеоПротеїни ‒ РНП)
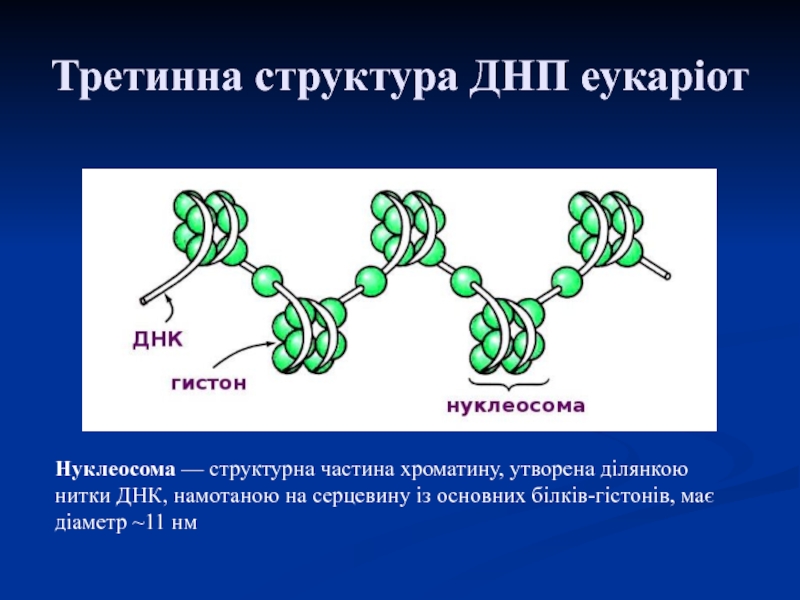
Слайд 45Третинна структура ДНП еукаріот
Нуклеосома — структурна частина хроматину, утворена ділянкою нитки ДНК, намотаною
на серцевину із основних білків-гістонів, має діаметр ~11 нм
↓
Протеїн Небілкова речовина,
що надає забарвлення
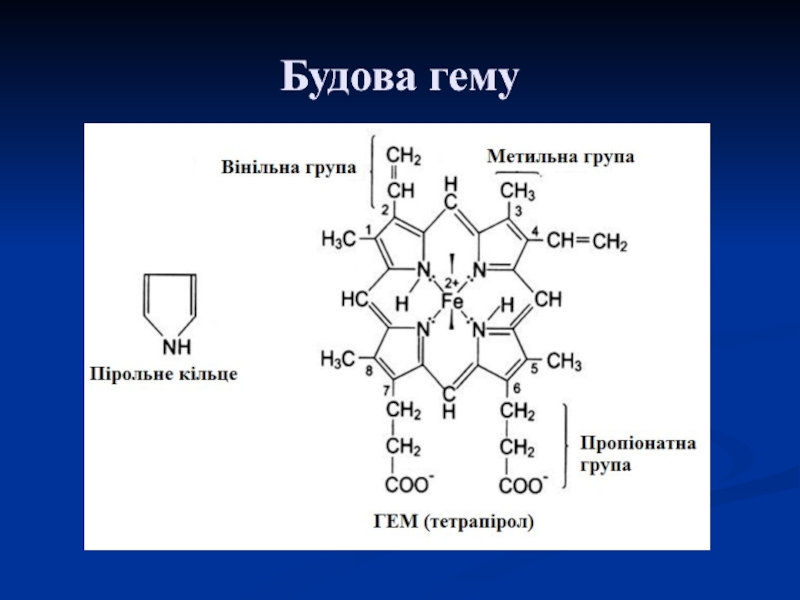
а) гемвмісні
- гемоглобін
- міоглобін - цитохроми
- каталаза
- пероксидаза
б) флавовмісні (віт. В2)
(флавопротеїни)
в) ретинолвмісні (віт. А)
- родопсин
Слайд 48Гемоглобін
Структура розшифрована Дж. Кендрью і М. Перутц (Нобелевська премія 1962р.)
Маса
– 67 - 70 тис. Да
96 % білку і 4
% гему від молекулярної маси.
Складається з 4 субодиниць:
2 α ланцюги зі 141 АК залишків
2 β ланцюги зі 146 АК залишків
Молекула гемоглобіну містить 4 геми. Кожний гем «обернений» одним поліпептидним ланцюгом.
Слайд 50Види гемоглобіну
HbО2 - оксигемоглобін (Fe2+);
HbСО2 - карбгемоглобін (Fe2+);
HbСО
- карбоксигемоглобін (Fe3+);
HbF3+ - метгемоглобін (Fe3+);
СО2 приєднується не до
гему, а до NH2 групи глобіну.
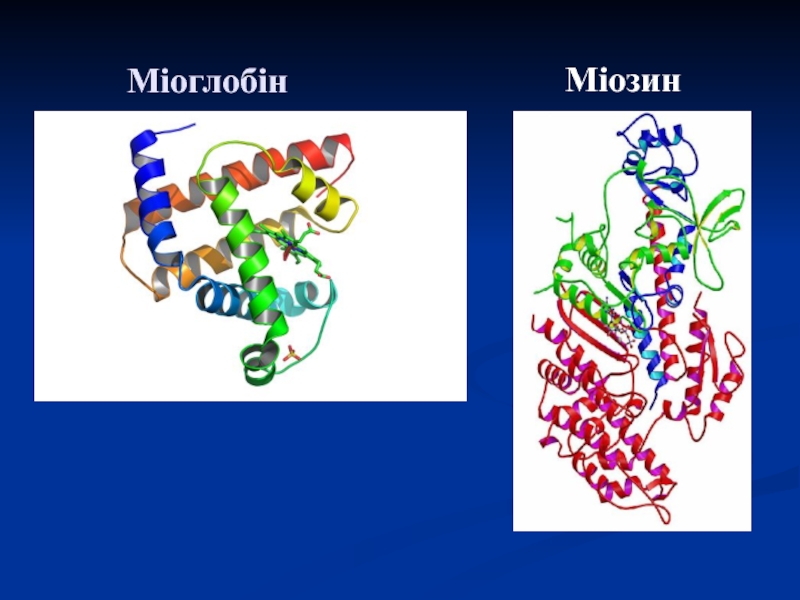
Слайд 51Міоглобін
Велика кількість міститься в червоних скелетних м'язах та міокарді.
Маса 17
тис., складається з одного поліпептидного ланцюга, що містить 153 АК
залишки, і пов'язаного з ним гему.
75% утворюють 8 правих α – спіралей.
Поліпептидний ланцюг має характерне глобулярне укладання в просторі.
Середній вміст міоглобіну становить 0,3% від маси тіла і підвищується під час тривалих фізичних навантажень.
Слайд 53Гемвмісні ферменти
Цитохроми
Переносники електронів у дихальному ланцюгу мітохондрій.
Розрізняють сімейства (групи): а,
b, с, а в них – різновиди: а1, а3 і
т.д.
Вони відрізняються величиною окисно-відновного потенціалу.
Слайд 54Цитохромоксидаза
(цитохром а3)
Кінцевий компонент дихального ланцюгу.
Переносить електрони на кисень.
Маса –
12 -14 тис.
Містить Fe і Cu.
Слайд 55Фосфопротеїни
(Білок + залишок фосфатної кислоти)
Представники:
- Казеїн (молока)
- Ововітелін жовтка
- Фосвітин
-
Пепсин та ін. білки-ферменти
- Іхтулін ікри риб
Слайд 56Глікопротеїни
(простий білок + вуглевод)
Білкова частина складає 80 - 90% від
м.м. молекул
Вуглеводний компонент представлений окремими моно- або олігосахаридними залишками, які
мають лінійну або розгалужену структуру.
Представники:
- фібриноген (згортання крові)
- муцини (структура слизових, захист їх від самопереварювання)
- мукоїди (змащувальні речовини суглобової рідини) та ін.
Слайд 57Функції глікопротеїнів
Фактори згортання крові – протромбін, фібриноген.
Змащувальні та захисні речовини
– муцини, слизові секрети.
Транспорт вітамінів, ліпідів, мінералів.
Імунітет – імуноглобуліни, інтерферони.
Ферменти
– холінестераза, рибонуклеаза В.
Клітинні контакти.
Рецептори.
Гормони – гонадотропін, кортикотропін.
Слайд 58Протеоглікани
Якщо білкова частина складає менше 50% маси молекули, а вуглеводна
частина більше 50% - це протеоглікани.
Слайд 59Протеоглікани
Протеоглікани (мукополісахариди, глікозаміноглікани) – високомолекулярні вуглеводно-білкові сполуки. Утворюють основну масу
міжклітинного матриксу сполучної тканини. Складають до 30% сухої маси.
Лінійні
полімери, які побудовані з дисахаридних одиниць, що повторюються. Завжди зв'язані з білками.
Складаються із залишків глюкозаміну (або галактозаміну) та залишків D-глюкуронової (або L-ідуронової) кислот. Наприклад, гіалуронова кислота (утворення гелю), хондроітинсульфат, дерматансульфат, кератинсульфат, гепарин та ін.
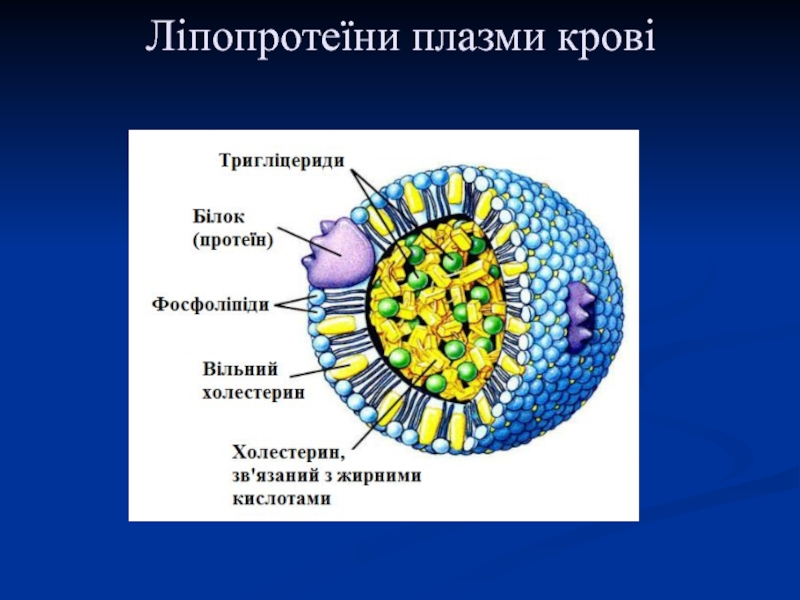
Слайд 60Ліпопротеїни
(простий білок + ліпід)
Ліпіди у водному середовищі (а значить, і
в крові) нерозчинні, тому для транспорту ліпідів кров'ю в організмі
утворюються комплекси ліпідів з білками ‒ ліпопротеїни.
Всі типи ліпопротеїнів мають подібну будову ‒ гідрофобне ядро і гідрофільний шар на поверхні. Гідрофільний шар утворений білками, які називають апопротеїнами, і амфіфільними молекулами ліпідів ‒ фосфоліпідами і холестеролом. Гідрофільні групи цих молекул обернені до водної фази, а гідрофобні частини ‒ до гідрофобного ядра ліпопротеїну, в якому знаходяться ліпіди, що транспортуються.
Слайд 62Ліпопротеїни
В організмі синтезуються наступні типи ліпопротеїнів:
1. хіломікрони (ХМ),
2.
ліпопротеїни дуже низької щільності (ЛПДНЩ)
3. ліпопротеїни проміжної щільності (ЛППЩ)
4. ліпопротеїни низької щільності (ЛПНЩ)
5. ліпопротеїни високої щільності (ЛПВЩ).
Кожний з типів ЛП утворюється в різних тканинах і транспортує певні ліпіди. Наприклад, ХМ транспортують екзогенні (харчові) жири з кишечника в тканини, тому триацилгліцероли складають до 85% маси цих частин.
Слайд 63Металопротеїни
(Білок + метал)
Функції:
- Транспортна
- Депонуюча
- Забезпечують ферментативну активність
Представники:
- Церулоплазмін
– білок + Cu2+
- Карбоангідраза – білок + Zn2+
- Лактатдегідрогеназа
– білок + Zn2+
- Феритин – білок + Fe2+ (23% - депо заліза), маса 747 000 Да, містить 24 субодиниці. Зв'язує до 5 000 атомів Fe.
- Трансферин – білок + Fe2+ - резервний білок.