Слайд 1Біоеквівалентність як один з видів клінічних випробувань
Слайд 2У клінічній практиці вже давно відомо, що препарати, що мають
одні і ті ж активні речовини, лікарські форми і дозування,
але що випускаються різними фірмами-виробниками, так звані препарати-генерики, можуть розрізнятися як по терапевтичній ефективності, так і по частоті виникнення і вираженості побічних ефектів.
Однією з важливих причин таких відмінностей є біологічна доступність лікарської речовини з вживаної лікарської форми, тобто період його дії і ступінь всмоктування. На дію препарату і ступінь його надходження в організм людини може в значній мірі впливати характер вивільнення активної речовини, що міститься в лікарському засобі.
Слайд 3Біологічна доступність
Біодоступність - це швидкість і ступінь, з яким активна
субстанція накопичується в місці її передбачуваної дії. Для визначення біодоступності
визначають концентрацію активної речовини в цілісній крові, сироватці або плазмі крові.
Мінливість всмоктування лікарської речовини, що не враховується, може мати серйозні наслідки при його клінічному застосуванні. Відмінності у всмоктуваності інгредієнтів наявних в продажі препаратів різних фірм і різних виробничих серій, може привести до того, що в організм пацієнта поступить дуже велике або дуже мала кількість лікарської речовини, а це, у свою чергу може привести до терапевтичної невдачі в лікуванні пацієнтів, серйозним небажаним наслідкам або побічним реакціям.
Надходження лікарської речовини у велике коло кровообігу після прийому препарату зазвичай включає два послідовні процеси:
вивільнення лікарської речовини з лікарської
форми в розчин;
проходження розчиненої лікарської речовини через
біологічні мембрани і печінку.
Слайд 4Процес вивільнення лікарської речовини часто є чинником, лімітуючим швидкість всмоктування
в тих випадках, коли препарат призначають в твердій лікарській формі.
Вивільнення лікарської речовини з таблетки охоплює як процес розпаду, так і процес розчинення. На швидкість розчинення впливають певні характеристики властивості лікарської форми. Якщо швидкість вивільнення лікарської речовини з лікарської форми значно понижена, то воно всмоктуватиметься не повністю.
Головна мета вивчення біологічної доступності лікарських засобів полягає у визначенні ступеня всмоктування певних ліків в організмі пацієнта, якому воно необхідне для попередження або лікування хвороби. Метою подібних досліджень є розробка стандартів, які по можливості повинні забезпечувати таке положення, щоб імовірно еквівалентні лікарські препарати, що випускаються різними фірмами, і проведені серії одного і того ж лікарського препарату характеризувалися однаковою біологічною доступністю.
Слайд 5Препарат-генерик
В даний час дослідження біодоступності/біоеквівалентності лікарських засобів вважається основним видом
медико-біологічного контролю якості препаратів, особливо це стосується препаратів-генериків.
Препарат-генерик - це
лікарський препарат, термін дії патентного захисту якого вже закінчився, і він не є винятковою власністю фармацевтичної компанії, яка його розробила або володіла першою ліцензією на його продаж.
Слайд 6Біоеквівалентність – порівняльна біодоступність двох препаратів
Вимога ефективності і безпеки генеричних
лікарських препаратів, вироблюваних різними фірмами, привела до введення поняття біологічної
еквівалентності (біоеквівалентності), якому сьогодні відводиться важливе місце як показнику якості лікарських форм і терапевтичної ефективності.
Вивчення біоеквівалентності лікарських засобів є одним з видів клінічних випробувань, мета - порівняльна оцінка ефективності і безпеки двох лікарських засобів за однакових умов, в однакових молярних дозах лікарського засобу.
Слайд 7Біологічна нееквівалентність
Терміном біологічна нееквівалентність лікарських препаратів позначається невідповідність одних і
тих же препаратів, що випускаються в однакових лікарських формах різними
виробниками. Це поняття отримало широке розповсюдження в 70-і роки у зв'язку з клінічним підтвердженням наявності істотної відмінності терапевтичного ефекту і вмісту в біологічних рідинах ряду препаратів (дигоксину, преднізолону, ацетилсаліцилової кислоти, теофіліну і ін.), пацієнтам, що призначаються, в різних дозах у вигляді таблеток, що випускаються різними фірмами.
Нееквівалентність розглядається тоді, коли змінюється ефективність або безпека лікарського препарату. Зазвичай нееквівалентність лікарського препарату встановлюється клінічно, коли він замінює інший лікарський препарат, що містить те ж активна речовина. Зміна реакції організму на лікування може визначатися по зниженню ефективності (неефективності лікування), підвищенню ефективності лікування або появі побічних реакцій (токсичності).
Лікувальна і профілактична активність будь-якої лікарської речовини обумовлена його хімічною будовою і фізико-хімічними властивостями. Проте на лікувальну активність субстанції істотно впливають і «вторинні» властивості, які можуть виникнути в результаті зміни технологічного процесу при приготуванні лікарського препарату.

Слайд 8Значення досліджень по біоеквівалентності
Якщо неможливо встановити причину зміни реакції організму
на лікарський препарат, це може привести до неправильного лікування. Зазвичай
при появі побічних ефектів або якщо вони стали більш вираженими лікар схильний вважати можливою причиною їх виникнення лікарський препарат. З іншого боку, якщо спостерігається зниження терапевтичного ефекту або його відсутність, лікар може думати, що це пов'язано з неправильним дозуванням або прогресуванням захворювання і може не врахувати, що причиною відсутності ефекту від лікування є нееквівалентність лікарського препарату.
Проблема біоеквівалентності лікарських препаратів має велике клінічне, фармацевтичне і економічне значення, оскільки один і той же лікарський засіб випускається багатьма (іноді десятками) фірмами із застосуванням різних допоміжних речовин в різних кількостях і за різними технологіями. Ця ж проблема іноді виникає при порівнянні різних серій лікарського препарату одного і того ж виробника, а також і при аналізі однорідності лікарської форми по біодоступності усередині однієї і тієї ж серії, особливо для що погано всмоктуються, труднорозчинних і сильнодіючих речовин.

Слайд 9Регламент проведення досліджень по біоеквівалентності
У зв'язку з цим, в 1991
р. в Канаді і в 1994 р. в Гаазі (Нідерланди)
були проведені Інтернаціональні конференції при офіційній підтримці ВІЗ про розвиток широкомасштабних стандартів і вимог для регуляторної оцінки маркетингових дозволів і якісного контролю за різноманітними генеричними препаратами, що випускалися. На основі таких пропозицій ВІЗ провели три консультативні наради в 1993 і в 1994 р. в Женеві за участю представників фармацевтичної промисловості, включаючи промисловість, що випускає ге-неричние препарати, і представників уповноважених регуляторних органів.
Як результат цієї роботи були створені керівництво - Перше хороше керівництво за оцінкою якості генеричних препаратів, основна ідея якої полягає в тому, що генеричні препарати повинні відповідати таким же стандартам якості, ефективності і безпеці як вже вживані оригінальні (патентовані) препарати.
Для вирішення цієї проблеми в країнах ЄС були прийняті правила по проведенню біоеквівалентності «Державні правила по медичній продукції в Європейському Союзі», 1992, 2001 р., а в США- 1994, 1996 р.

Слайд 10Особливості препаратів-генериків
Генерічеськоє лікарський засіб містить активна лікарська речовина (активну субстанцію)
ідентичне активній речовині оригінального (патентованого) препарату, але відрізняється від нього
допоміжними речовинами (неактивними інгредієнтами, наповнювачами, консервантами, фарбниками і ін.). Крім того, відмінності спостерігаються і в самому процесі виробництва препаратів-генериків.
Широке застосування препаратів-генериків у всіх країнах пов'язане з істотною різницею у вартості між оригінальними і генеричними лікарськими препаратами. За умови біоеквівалентності генеричного препарату оригінальному, застосування генериків в медичній практиці дозволяє істотно понизити витрати на лікування хворих і, одночасно, зберігає високий рівень і якість лікування, що надається. Цим викликано швидке зростання виробництва генеричних препаратів в 90-х роках.
У 1991 р. в США частка генеричних препаратів із загальноприйнятими назвами на ринку лікарських засобів складала 14%, препаратів з оригінальною назвою - 86%, а в 1995 р. - 20% і 80% відповідно.
У державах Європейського Союзу (ЄС) в 1995 р. загальна вартість продажів генериків склала близько 6 млрд. доларів, а за статистичним прогнозом продаж генериків швидко перевищить 8-10 млрд. доларів. У таких країнах, як Великобританія, Німеччина, Данія, Нідерланди до 2000 р. частка генеричних препаратів на ринку рецептурних лікарських засобів склала 50-75%.

Слайд 11Генеричний лікарський препарат може розглядатися як взаємозамінний оригінального препарату тільки
в тому випадку, якщо він відповідає наступним загальноприйнятим вимогам:
містить те
ж активну речовину (або речовини), яка
містить оригінальний лікарський препарат;
ідентичний оригінальному лікарському препарату по силі дії;
має ту ж лікарську форму і той же шлях введення, що
і оригінальний лікарський препарат;
має ті ж показання до застосування;
на етикетці вказані ті ж запобіжні засоби та інші інструкції, які вказані на етикетці оригінального лікарського препарату;
має ту ж біоеквівалентність (т.е. після перорального прийому або аплікації трансдермального пластиру, та ж кількість лікарського засобу повинна мати таку ж статистично достовірну швидкість системного всмоктування, що
і оригінальний препарат).
Деякі оригінальні лікарські препарати можуть мати більше показань до застосування в порівнянні з їх генеричними аналогами в тих випадках, якщо дозвіл був отриманий на застосування за даними свідченнями і ще не закінчився термін права на виняткове застосування лікарського препарату по ним.
Слайд 12Вимоги до виробництва препаратів-генериків
Для генеричних препаратів необхідно:
при виробництві - дотримання
вимог належної виробничої практики (GMP);
для реєстрації - проведення досліджень по
біоеквівалентності.
Слайд 13Визначення біоеквівалентності
Біоеквівалентність - два лікарські препарати вважаються біоеквівалентними, якщо вони
фармацевтично еквівалентні і їх біодоступність (швидкість і ступінь абсорбції активної
речовини) після призначення в однаковій дозі є схожими, забезпечуючи належну ефективність і безпеку (ВОЗ, 1994, 1996).
Біоеквівалентність, базується на однаковій біодоступності генеричного і еталонного (оригінального) лікарського препарату для таблетованих лікарських форм, призначених для прийому всередину або трансдермального всмоктування, може бути встановлена тільки за допомогою проведення контрольованих перехресних клінічних досліджень.
Слайд 14Особливості при проведенні дослідження по біоеквівалентності
Необхідно підкреслити, що вивчення біоеквівалентності
- це клінічні випробування, де суб'єктом дослідження є людина. Тому
до таких досліджень пред'являються всі ті ж офіційні вимоги і положення, що і до всіх інших клінічних випробувань.
Вивчення біоеквівалентності повинне проводитися відповідно до принципів Належної клінічної практики (GCP) з метою гарантії якості даних, що представляються, і захисту має рацію, здоров'я і благополуччя досліджуваних. У зв'язку з цим при проведенні досліджень біоеквівалентності необхідно дуже ретельно підходити до підбору осіб, що беруть участь в клінічному випробуванні.
На фармакотерапевтичу дію препарату впливають багато чинників:
наявність супутніх захворювань у пацієнта;
порушення всмоктування препарату;
захворювання печінки і нирок;
порушення скріплення лікарських речовин з білками;
генетично обумовлені особливості метаболізму препаратів.
У подібних ситуаціях концентрація препарату може виявитися дуже низькою або дуже високою. У першому випадку знижується ефективність лікування, в другому - підвищується ризик появи побічних реакцій.

Слайд 15Вимоги до випробовуваних
Контингент досліджуваних для вивчення біоеквівалентності повинен бути
якомога одноріднішим, тому дослідження повинне проводитися в основному за участю
здорових добровольців, щоб понизити розкид отримуваних даних. Повинні бути представлені точні критерії включення/виключення випробовуваних.
Бажано, щоб в дослідження включалися чоловіки і жінки (проте, для жінок оцінка ризику повинна визначатися індивідуально).
Вік досліджуваних - 18-55 років. Вага тіла, що не виходить за межі вікової норми для даної статі.
Бажано, щоб випробовувані були некурящими. Інакше вони повинні бути ідентифіковані як такі.
Таких же принципів слід дотримуватися при відборі пацієнтів, які є перспективними в плані включення їх у випробування. Тобто, можливе формування банку добровольців і пацієнтів для участі в проведенні подібних досліджень або заміні вибулих з якихось причин учасників випробування (відмова від подальшої співпраці, поява побічних або небажаних реакцій при прийомі лікарського засобу, або недотримання умов протоколу дослідження, що проводиться).
Слайд 16Можливість пацієнтів (здорових добровольців) брати участь в дослідженні повинна підтверджуватися
даними, отриманими при використанні стандартних лабораторних тестів, збору анамнезу і
загальноклінічного обстеження. До випробування і в процесі його проведення можуть проводитися спеціальні медичні обстеження, залежні від особливостей фармакологічних властивостей препарату, що вивчається.
Особлива увага повинна приділятися дотриманню етичних вимог відповідно до декларації Хельсінкі (2000 р.). Бажано, щоб при лікувальній установі, де проводяться подібні дослідження, була Комісія з питань етики, яка підтверджувала б відповідність протоколу цих клінічних випробувань етичним вимогам відносно можливості наукових досліджень на людині. Випробовувані повинні добровільно дати свою згоду на участь в дослідженні, будучи повністю обізнаними про хід даного випробування і необхідності прийняти всі заходи для забезпечення безпеки і благополуччя цих осіб.
В деяких випадках коректніше включати в дослідження пацієнтів, а не здорових добровольців. Така ситуація може виникнути, якщо досліджуваний лікарський засіб володіє відомими побічними діями і здоров'ю добровольців може бути завданий серйозна шкода (наприклад, при вивченні лікарських препаратів, використовуваних в онкологічній практиці, для лікування ВІЛ-інфікованих пацієнтів). Створення комплексу умов, які зменшують внутрішньогрупові варіації, дозволить уникнути великого розкиду результатів дослідження.

Слайд 17Кількість випробовуваних для проведення дослідження
Мінімальне число випробовуваних, таких, що залучаються
до досліджень біоеквівалентності, складає 12 чоловік (зазвичай 12-24).
Слайд 18Особливості режиму для випробовуваних при проведенні дослідження
З метою мінімізації відмінностей,
що виникають під впливом чинників, що впливають на дослідження препарату,
умови випробування повинні бути стандартизованы. Необхідно, щоб випробовувані щонайменше протягом ночі (8-12 годин) перед дослідженням і призначенням препарату утрималися від прийому пищи. При цьому дослідженні встановлюється чітко певний годинник прийому пищи, а також об'єм рідини, що приймається.
Для випробовуваних повинні бути створені стандартні умови на період проведення дослідження, а саме:
харчовий і водний режим (стандартна дієта);
повне виключення або обмеження прийому інших лікарських засобів до і в період проведення дослідження;
руховий режим;
режим дня під час проведення досліджень;
виключення алкоголю, кофеїну, наркотичних засобів,
концентрированных соків;
час перебування в дослідницькому центрі;
час закінчення дослідження.
Протягом періоду узяття проб необхідно чітко встановити час прийому і склад їжі і рідини, що вживається після призначення досліджуваного препарату. Випробовувані не повинні приймати інші лікарські препарати протягом певного періоду до і під час випробувань і утримуватися від їжі і напоїв, які можуть зробити вплив на циркуляцію препарату, змінити функцію шлунково-кишкового тракту, печінки, нирок. Якщо біодоступність активної субстанції з дозованої форми залежить від часу проходження лікарської речовини по шлунково-кишковому тракту і регіонального кровообігу, то в таких випадках може знадобитися стандартизація фізичної активності випробовуваних.

Слайд 19Особливості дизайну випробування
Особливістю дизайну таких досліджень є те, що
кожний з випробовуваних отримує як стандартний препарат, так і тестований
по черзі. Віддається перевага перехресному методу з рандомізованим розподілом добровольців. Проте, при певних обставинах (фармакокінетика досліджуваного препарату) і умовах план дослідження і статистичний аналіз можуть бути змінені, як паралельний дизайн для дуже тривало існуючих субстанцій і дизайн, що повторюється (replicate), для субстанцій з високою варіабельністю розподілу.
Важливими методологічними підходами до вивчення біодоступності є:
дослідження біодоступності при введенні одноразової
дози досліджуваного препарату;
дослідження біодоступності досягши стабільного
стану (стабільній концентрації препарату в крові).
Слайд 20Фармкокінетичні параметри, які визначаються
для оцінки біодоступності і біоеквівалентності
При
вивченні біодоступності лікарських препаратів найбільш важливими є наступні фармакокінетичні параметри:
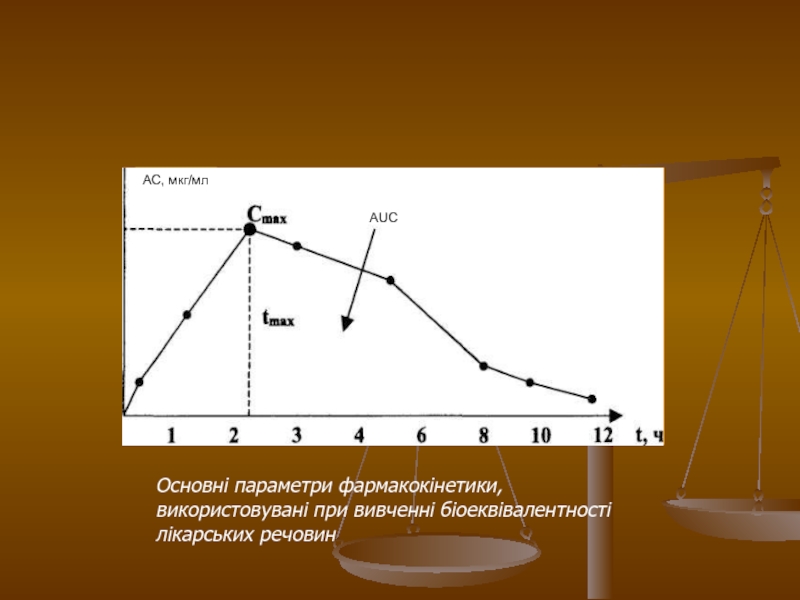
Сmax
- максимум або пік концентрації лікарської речовини в крові;
tmax - час досягнення максимальної концентрації речовини;
AUC - площа під фармакокінетичною кривою (зміна концентрації активної речовини в плазмі або сироватці крові в часі).
Слайд 21
АС, мкг/мл
Основні параметри фармакокінетики, використовувані при вивченні біоеквівалентності лікарських речовин
Слайд 22При вивченні біодоступності методом введення одноразової дози площа під кривою
«концентрація-час» визначається після одноразового введення лікарського препарату (біодоступність таких концентрацій
препарату, які до кінця виведення не визначаються аналітичними методами, оцінюють методом екстраполяції мінімально вимірюваних значень).
При вивченні біодоступності методом досягнення стабільного стану (стабільній концентрації) дозування лікарського препарату продовжують до тих пір, поки не буде досягнуто такий стан, при якому надходження препарату в організм не стане рівним швидкості його виведення. Після досягнення стабільного стану при введенні досліджуваного лікарського препарату площа під кривій «концентрація-час» вимірюють в перебігу всього дозового інтервалу (наприклад, при дозуванні 3 рази на добу - протягом 8 годин, при дозуванні 2 рази на добу - протягом 12 годин і т.д.) і потім порівнюють з відповідною площею під кривою «концентрація-час» еталонного препарату.
Слайд 23Час відбору проб для дослідження
Час узяття проб крові у
випробовуваних необхідно планувати так, щоб забезпечити адекватну оцінку фармакокінетичних показників
і охопити чималу ділянку кривої часу плазмової концентрації з метою надійної оцінки ступеня абсорбції.
Це досягається, головним чином, якщо AUC, отримана шляхом вимірювань, складає по меншій мірі 80% від AUC екстраполяції до нескінченності. Для порівняння концентрацій обох активних речовин в сироватці крові використовують статистичні методи. При цьому визначають, чи є відмінності між кривими результатом випадкових відхилень або ці відмінності статистично достовірні.
Методи, які використовуються при визначенні біодоступності і біоеквівалентності препаратів, повинні бути точними, надійними і відтворюваними.
Слайд 24Значення показника максимальної концентрації речовини можна пояснити за допомогою наступного
прикладу.
На малюнку 2 представлені фармакокінетичні криві двох лікарських препаратів.
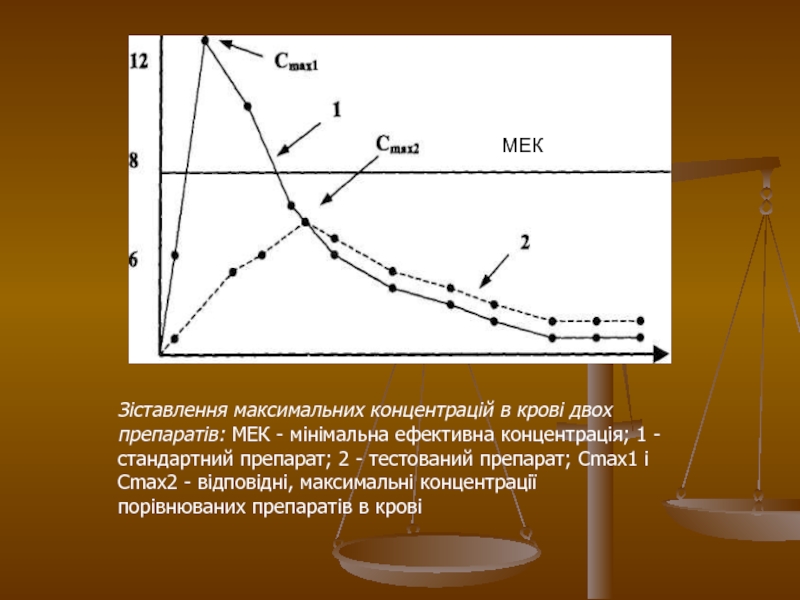
Слайд 25
Зіставлення максимальних концентрацій в крові двох препаратів: МЕК - мінімальна
ефективна концентрація; 1 - стандартний препарат; 2 - тестований препарат;
Cmax1 і Cmax2 - відповідні, максимальні концентрації порівнюваних препаратів в крові
Слайд 26Крива 1 характеризує концентрацію в крові стандартного препарату, а крива
2 - тестованого. Горизонтальною лінією відмічена мінімальна ефективна концентрація, при
якій дану речовину надає терапевтична дія. При цьому видно, що при застосуванні тестованого препарату (крива 2), його Сmax не досягає рівня мінімально ефективній концентрації і, отже, не надає терапевтичної дії.
Другий важливий параметр - час досягнення максимальної концентрації лікарської речовини. Цей показник відображає швидкість його всмоктування і швидкість настання терапевтичного ефекту.
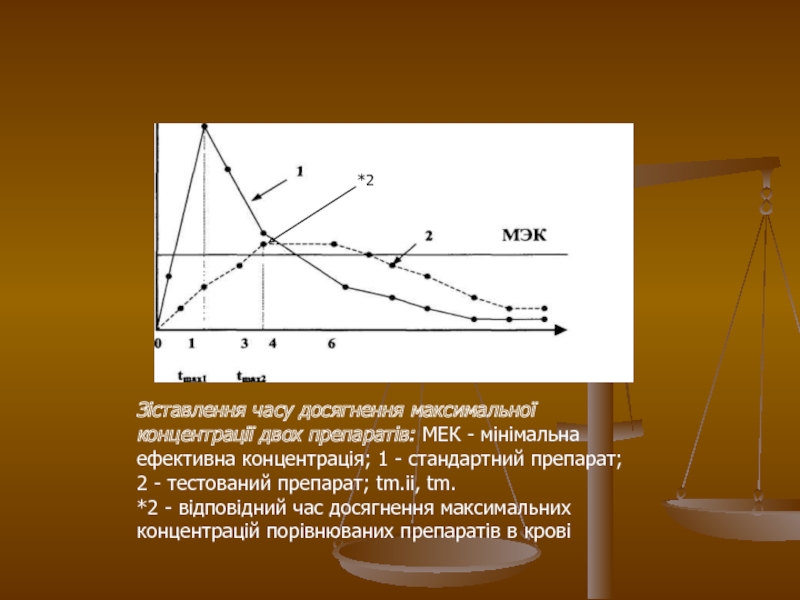
Слайд 27На малюнку 3 показано, що максимальна концентрація стандартного препарату (крива
1) досягається через 1 годину, а тестованого препарату (2) -
через 4 години. Така відмінність в часі досягнення максимальної концентрації препарату в крові може приводити до зміни клінічних свідчень для застосування препарату, що вивчається.
Третім важливим параметром біоеквівалентності є площа під кривій «концентрація - час», яка відображає кількість речовини, що поступила в кров після одноразового введення препарату.
На цьому ж малюнку показано, що дві криві мають різну форму, різні списи і неоднаковий час досягнення максимальної концентрації; але площі під цими кривими близькі по величині і, отже, обидва препарати забезпечують надходження в кров однакової кількості лікарської речовини.
Слайд 28Зіставлення часу досягнення максимальної концентрації двох препаратів: МЕК - мінімальна
ефективна концентрація; 1 - стандартний препарат; 2 - тестований препарат;
tm.ii, tm.
*2 - відповідний час досягнення максимальних концентрацій порівнюваних препаратів в крові
*2
Слайд 29На малюнку 4 представлений інший приклад співвідношення кривих, що відображають
кінетику двох порівнюваних препаратів.
Площа під кривою 1 практично в
два рази більша, ніж під кривою 2.
Звертає на себе увагу, що максимальна концентрація і час її досягнення схожі у стандартного і тестованого препаратів. Проте площа під фармакокінетичною кривою у тестованого препарату в 2 рази менша за рахунок швидшого виведення цього препарату з крові. В даному випадку можна чекати зменшення тривалості дії лікарського препарату і зниження його терапевтичного ефекту.
Слайд 30Зіставлення площ під фармакокинетичними кривими двох препаратів: 1 - стандартний
препарат; 2 - тестований препарат; AUC1, AUC2 - відповідні площі
під кривими «концентрація-час» порівнюваних препаратів
Слайд 31Таким чином, два препарати вважаються біоеквівалентними, якщо вони мають схожі
фармакокінетичні показники.
За регламентом ВОЗ (1994, 1996) і ЄС (1992)
їх відмінність не повинна перевищувати 20%.
Генеричний лікарський препарат може мати вищу біодоступність в порівнянні з еталонним препаратом за рахунок удосконалення складу лікарської форми.
Слайд 32Звіт про проведене випробування
Всі етапи проведення дослідження повинні ретельно фіксуватися,
аналізуватися, описуватися, відповідно до заздалегідь розробленого протоколу клінічного випробування і
стандартних операційних процедур по проведенню випробування і представлятися в докладному звіті.
Звіт про дослідження біодоступності або біоеквівалентності оформляється згідно вимогам GCP до звітів про клінічні випробування.
Всі результати повинні бути представлені в повному об'ємі. Необхідно включати дані про випробовуваних, які вибули з дослідження. Виключення і вибування випробовуваних повинно бути повністю документовано (описано). Повинен бути визначений спосіб розрахунку використовуваних характеристик з необроблених даних. Якщо результати випробувань розраховані з використанням фармакологічних моделей або моделей з використанням комп'ютерних програм, то ці дані і моделі повинні бути описані в звіті. Хроматограми отриманих даних повинні бути повністю представлені і охоплювати межі всіх концентрацій досліджуваного лікарського засобу. Статистичний звіт повинен бути достатньо докладний, щоб, при необхідності, була можливість повторити статистичний аналіз, наприклад, схема рандомізації, демографічні дані, оцінка фармакокінетичних параметрів для кожного випробовуваного.

Слайд 33Дослідження біоеквівалентності, як метод клінічного випробування, дозволить зробити обгрунтований висновок
про якість, ефективність і безпеку порівнюваних препаратів на підставі меншого
об'єму первинної інформації і в більш стислі терміни, чим при проведенні інших видів клінічних випробувань.
Необхідно відзначити, що в плануванні, проведенні дослідження по біоеквівалентності повинен брати участь цілий колектив фахівців різних профілів: клінічних фармакологів, лікарів-клініцистів, біохіміків, хіміків-аналітиків, біостатистиків.
В даний час в Україні достатньо широко використовуються високоефективні методи для визначення фармакокінетичних параметрів. Розширення вже наявної матеріально-технічної бази, розробка регламенту для проведення досліджень біоеквівалентності лікарських препаратів, підготовка фахівців в цій області дозволить вирішити актуальне завдання за оцінкою ефективності і безпеки генеричних препаратів вітчизняного і зарубіжного виробництва.