Слайд 1Часть 6
Кислород-, серо-, азот-содержащие соединения
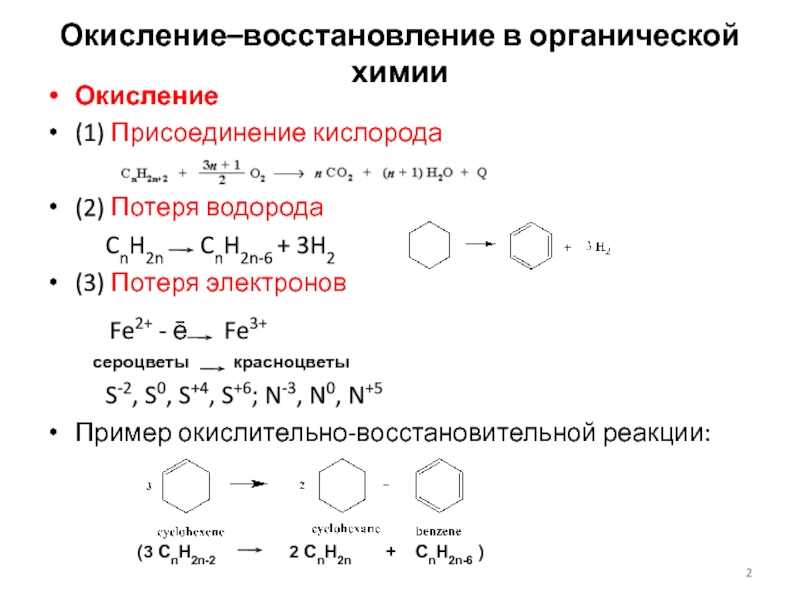
Слайд 2Окисление–восстановление в органической химии
Окисление
(1) Присоединение кислорода
(2) Потеря водорода
CnH2n CnH2n-6 + 3H2
(3) Потеря электронов
Fe2+ - ē Fe3+
сероцветы красноцветы
S-2, S0, S+4, S+6; N-3, N0, N+5
Пример окислительно-восстановительной реакции:
(3 CnH2n-2 2 CnH2n + CnH2n-6 )
Слайд 3Окисление–восстановление в органической химии
Примерные степени окисления углерода
Окисление:
Восстановление:
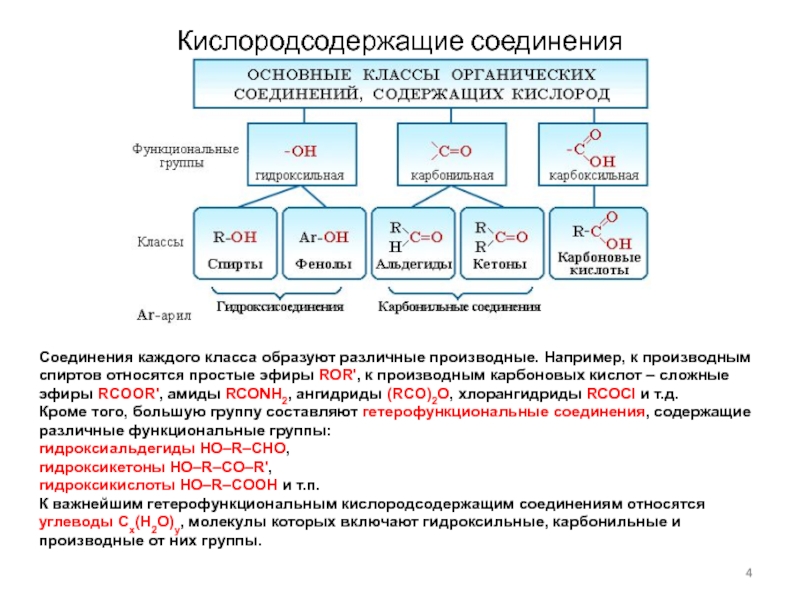
Слайд 4Кислородсодержащие соединения
Соединения каждого класса образуют различные производные. Например, к производным
спиртов относятся простые эфиры ROR', к производным карбоновых кислот –
сложные эфиры RCOOR', амиды RCONH2, ангидриды (RCO)2O, хлорангидриды RCOCl и т.д.
Кроме того, большую группу составляют гетерофункциональные соединения, содержащие различные функциональные группы:
гидроксиальдегиды HO–R–CHO,
гидроксикетоны HO–R–CO–R',
гидроксикислоты HO–R–COOH и т.п.
К важнейшим гетерофункциональным кислородсодержащим соединениям относятся углеводы Cx(H2O)y, молекулы которых включают гидроксильные, карбонильные и производные от них группы.
Слайд 5СПИРТЫ
Классификация спиртов
По числу гидроксильных групп спирты подразделяются на
- одноатомные (одна
группа -ОН),
- многоатомные (две и более групп -ОН).
Современное название
многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
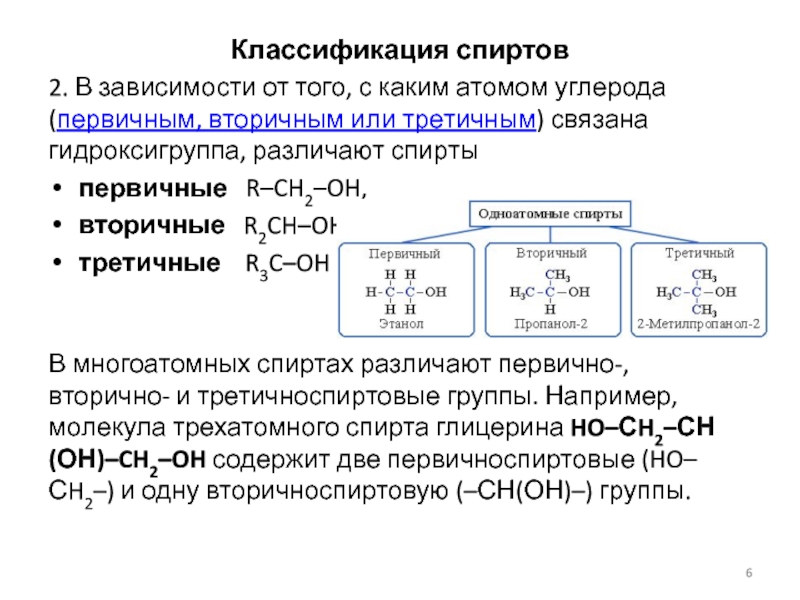
Слайд 6Классификация спиртов
2. В зависимости от того, с каким атомом углерода
(первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
первичные R–CH2–OH,
вторичные
R2CH–OH,
третичные R3C–OH
В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина HO–СH2–СН(ОН)–CH2–OH содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы.
Слайд 7Классификация спиртов
3. По строению радикалов, связанных с атомом кислорода, спирты
подразделяются на
предельные алифатические, или алканолы (например, СH3CH2–OH)
предельные
алициклические, или циклоалканолы (например, циклопентанол )
ароматические (C6H5CH2–OH, бензиловый спирт)
непредельные, или алкенолы и циклоалкенолы
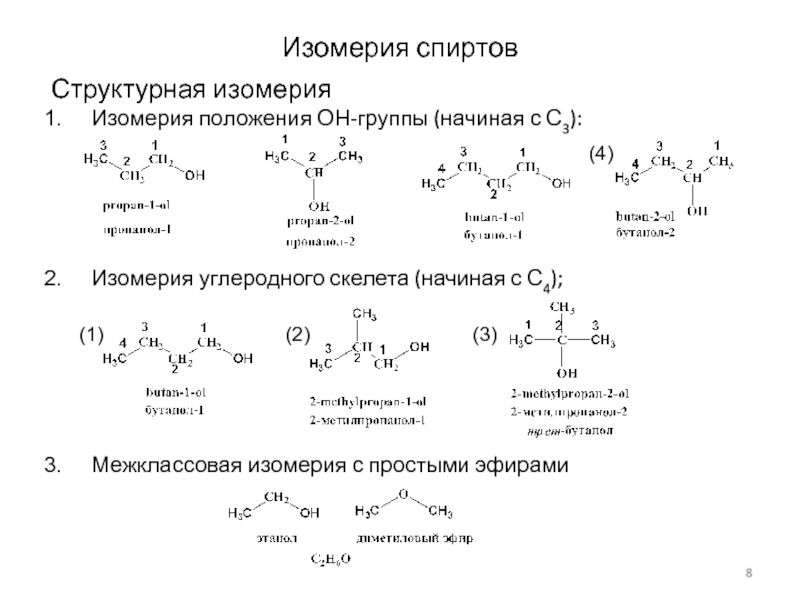
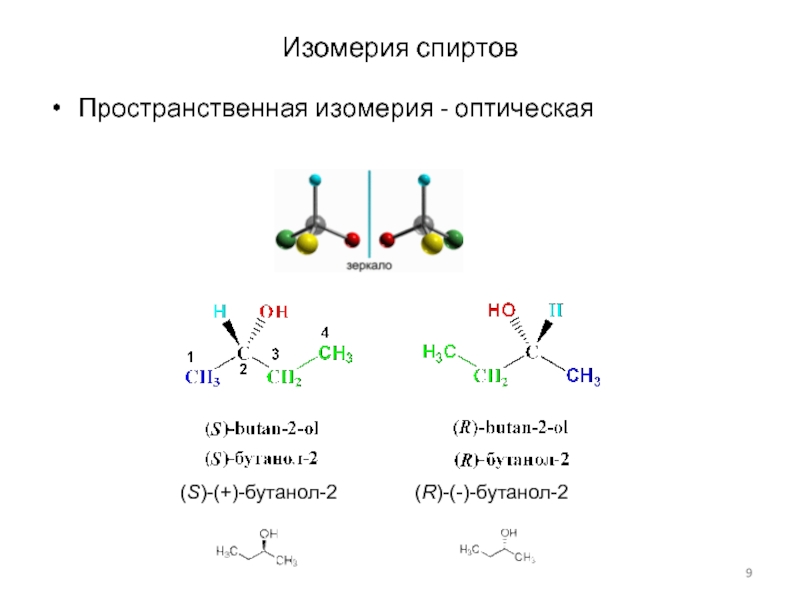
Слайд 8Изомерия спиртов
Структурная изомерия
Изомерия положения ОН-группы (начиная с С3):
Изомерия углеродного скелета
(начиная с С4);
Межклассовая изомерия с простыми эфирами
(1)
(4)
(2)
(3)
Слайд 9Изомерия спиртов
Пространственная изомерия - оптическая
(S)-(+)-бутанол-2
(R)-(-)-бутанол-2
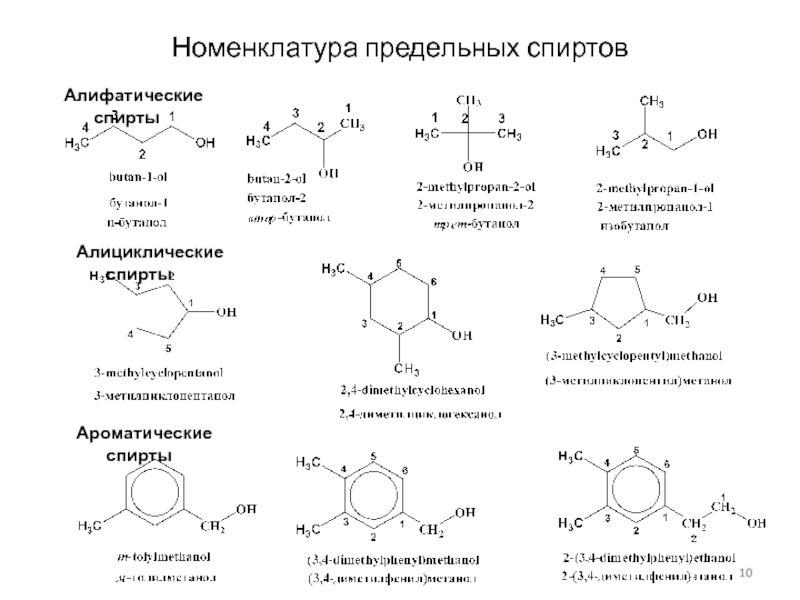
Слайд 10Номенклатура предельных спиртов
Алифатические спирты
Алициклические спирты
Ароматические спирты
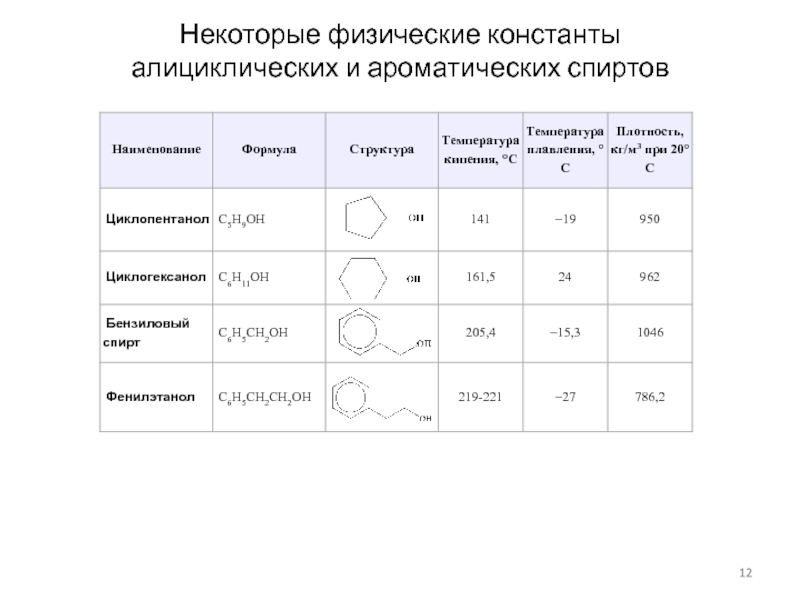
Слайд 11Некоторые физические константы
алифатических предельных спиртов (CnH2n+1OH)
[K3] Показатель измерен при
22°C
[K4] Показатель измерен при 40°C
Слайд 12Некоторые физические константы
алициклических и ароматических спиртов
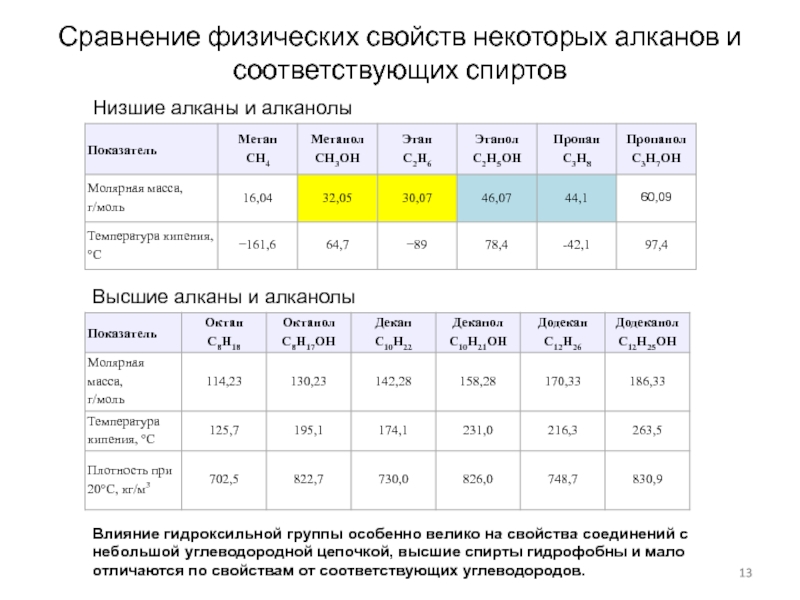
Слайд 13Сравнение физических свойств некоторых алканов и соответствующих спиртов
Низшие алканы и
алканолы
Высшие алканы и алканолы
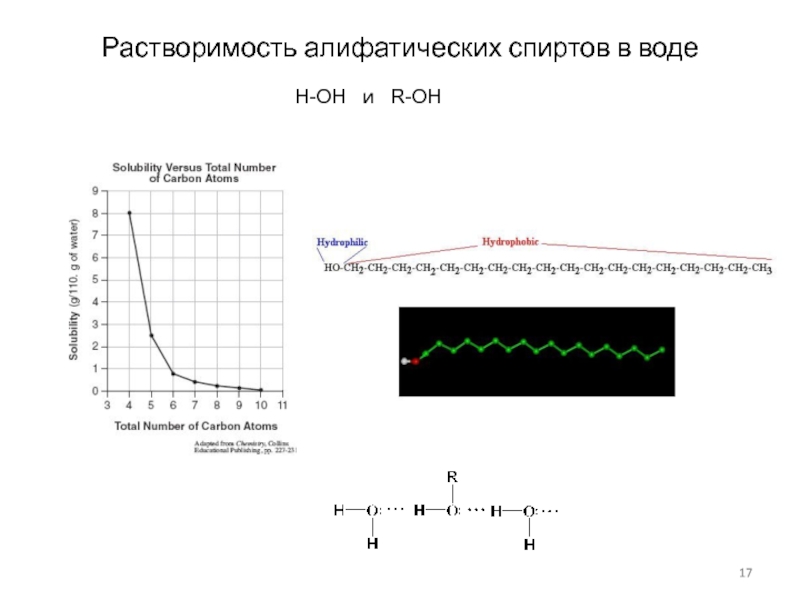
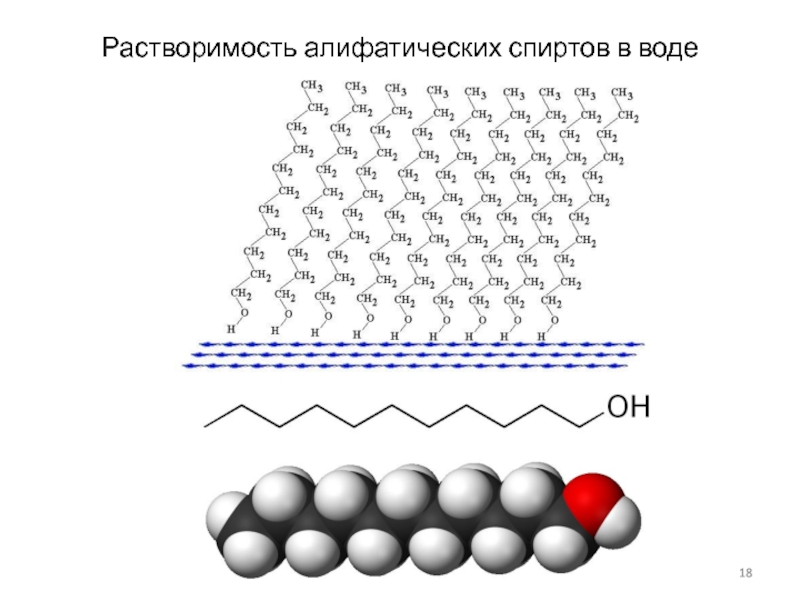
Влияние гидроксильной группы особенно велико на свойства
соединений с небольшой углеводородной цепочкой, высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов.
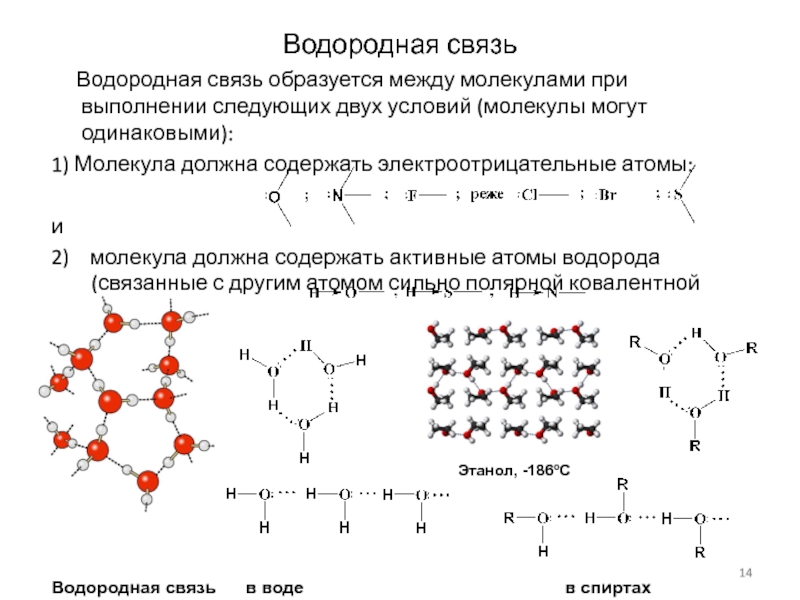
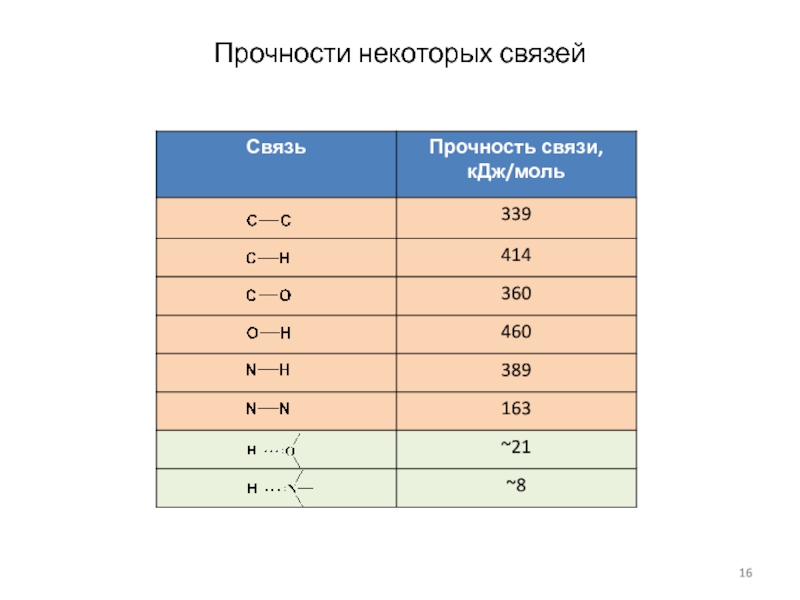
Слайд 14Водородная связь
Водородная связь образуется между молекулами при
выполнении следующих двух условий (молекулы могут одинаковыми):
1) Молекула должна содержать
электроотрицательные атомы:
и
2) молекула должна содержать активные атомы водорода (связанные с другим атомом сильно полярной ковалентной связью)
Водородная связь в воде в спиртах
Этанол, -186oС
Слайд 15Водородная связь
Если бы не было водородных связей, то температуры плавления
и кипения воды были бы существенно ниже, как это наблюдается
у других водородных соединений неметаллов
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Водородные связи являются причиной и другого уникального свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий.
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 oС. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
При замерзании вода расширяется и занимает больший объем. Плотность льда (0,92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.

Слайд 17Растворимость алифатических спиртов в воде
H-OH и R-OH
Слайд 18Растворимость алифатических спиртов в воде
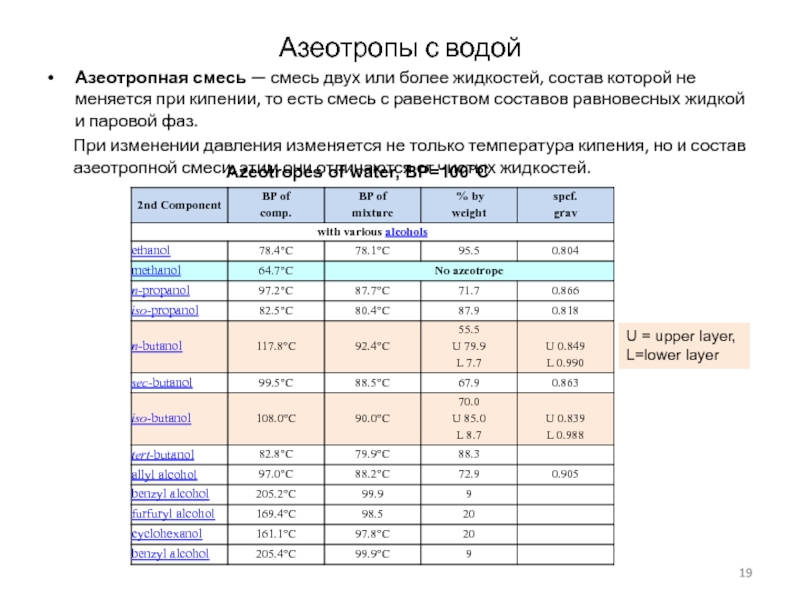
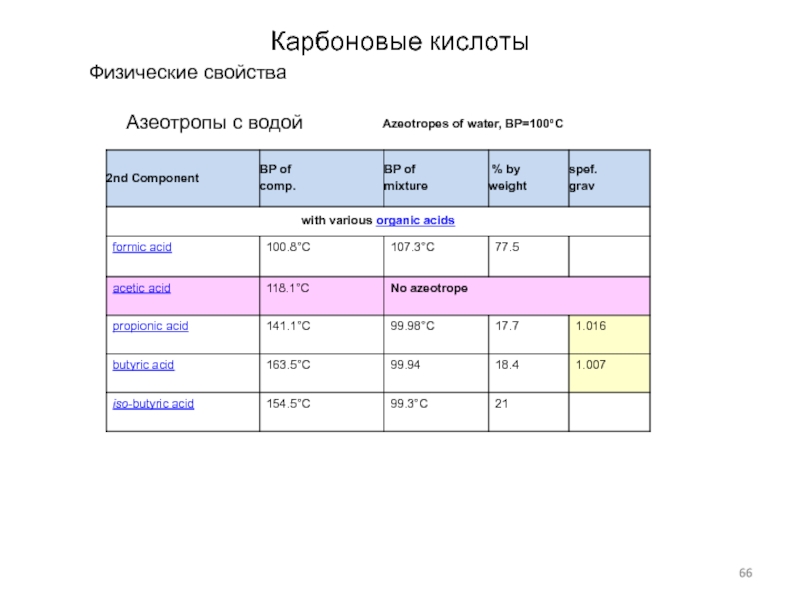
Слайд 19Азеотропы с водой
Азеотропная смесь — смесь двух или более жидкостей,
состав которой не меняется при кипении, то есть смесь с
равенством составов равновесных жидкой и паровой фаз.
При изменении давления изменяется не только температура кипения, но и состав азеотропной смеси, этим они отличаются от чистых жидкостей.
Azeotropes of water, BP=100°C
U = upper layer, L=lower layer
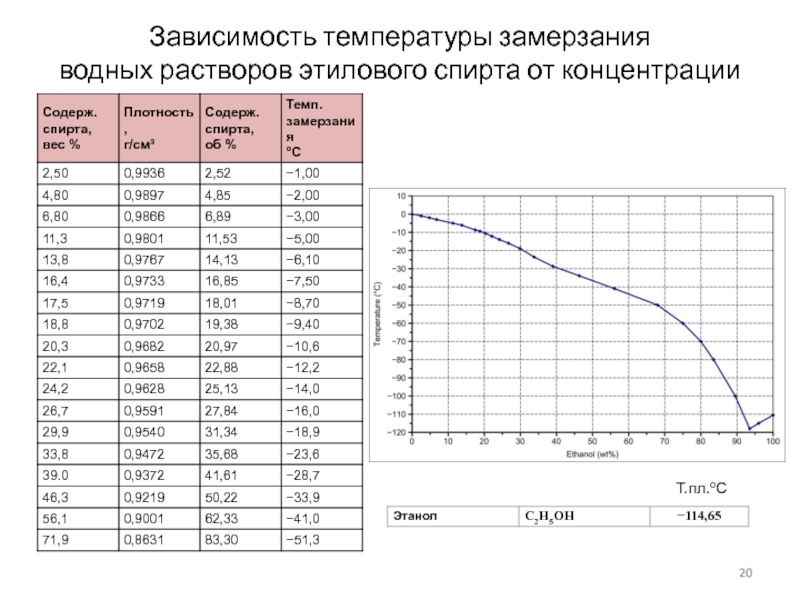
Слайд 20Зависимость температуры замерзания
водных растворов этилового спирта от концентрации
Т.пл.оС
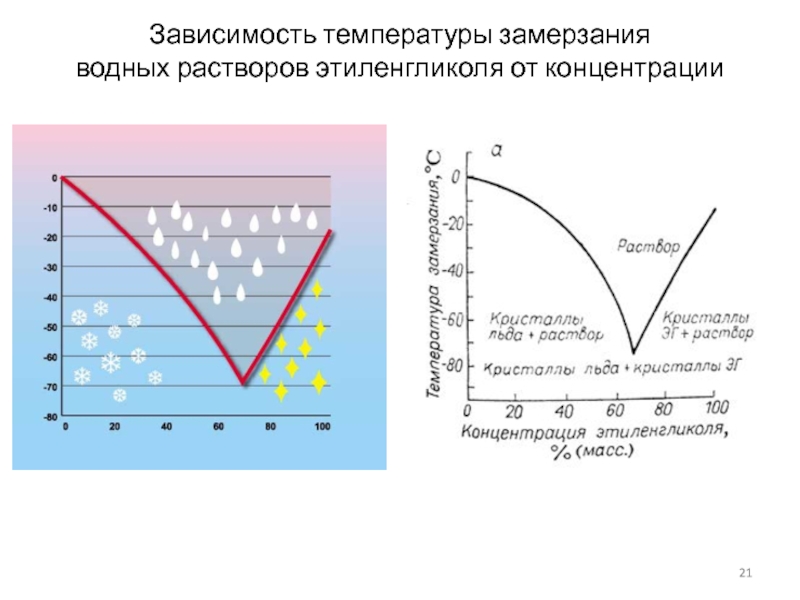
Слайд 21Зависимость температуры замерзания
водных растворов этиленгликоля от концентрации
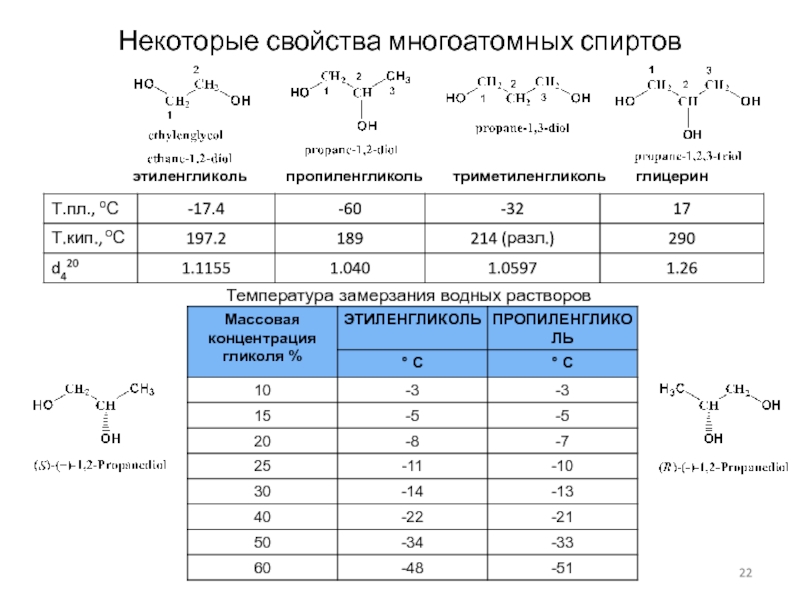
Слайд 22Некоторые свойства многоатомных спиртов
Температура замерзания водных растворов
этиленгликоль
пропиленгликоль триметиленгликоль
глицерин
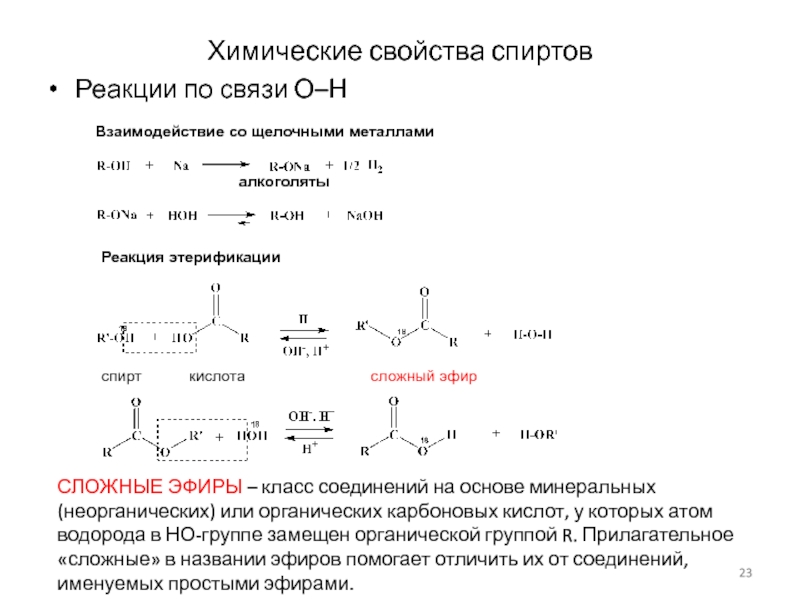
Слайд 23Химические свойства спиртов
Реакции по связи О–Н
алкоголяты
Взаимодействие со щелочными металлами
Реакция
этерификации
спирт кислота
сложный эфир
СЛОЖНЫЕ ЭФИРЫ – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Прилагательное «сложные» в названии эфиров помогает отличить их от соединений, именуемых простыми эфирами.
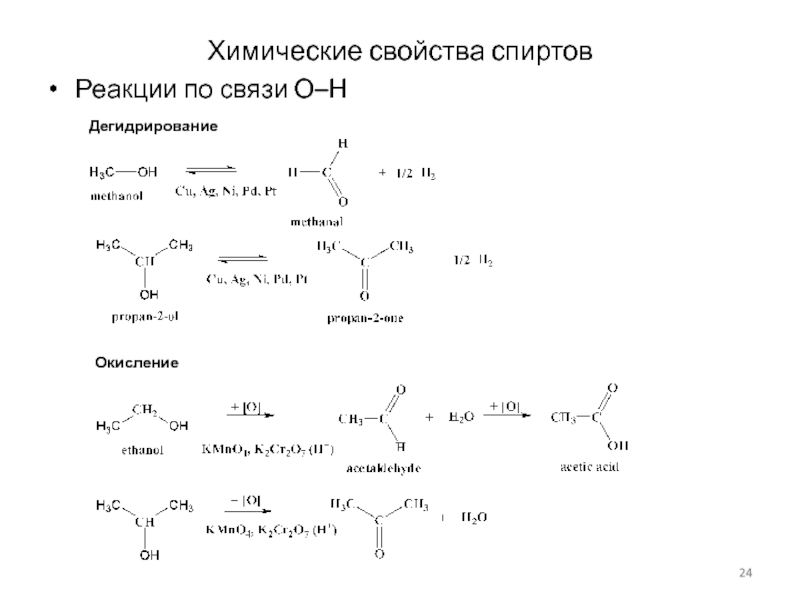
Слайд 24Химические свойства спиртов
Реакции по связи О–Н
Дегидрирование
Окисление
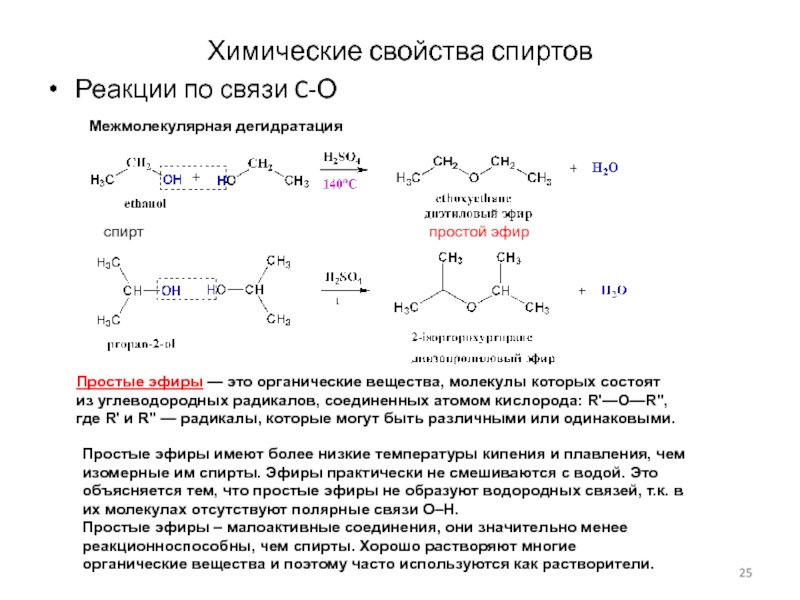
Слайд 25Химические свойства спиртов
Реакции по связи C-О
Межмолекулярная дегидратация
Простые эфиры —
это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных
атомом кислорода: R'—О—R", где R' и R" — радикалы, которые могут быть различными или одинаковыми.
спирт простой эфир
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н.
Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
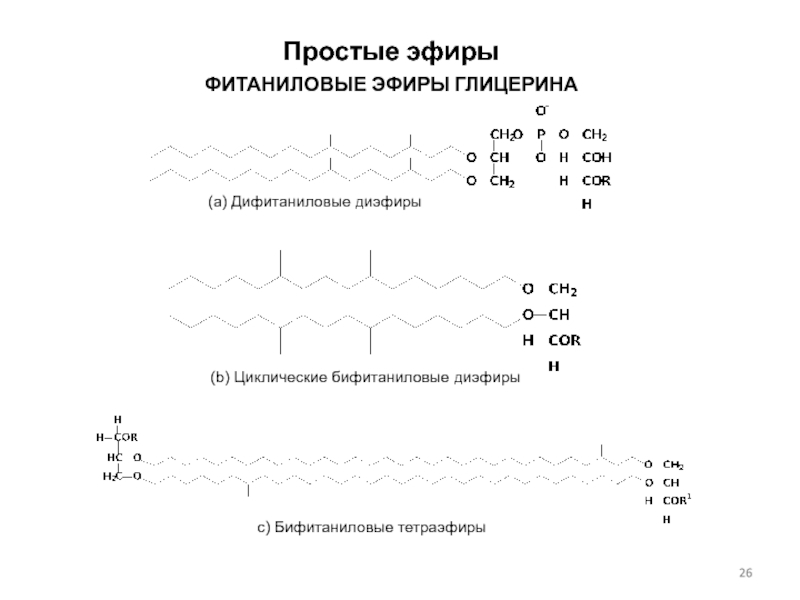
Слайд 26Простые эфиры
ФИТАНИЛОВЫЕ ЭФИРЫ ГЛИЦЕРИНА
(a) Дифитаниловые диэфиры
(b) Циклические
бифитаниловые диэфиры
c) Бифитаниловые тетраэфиры
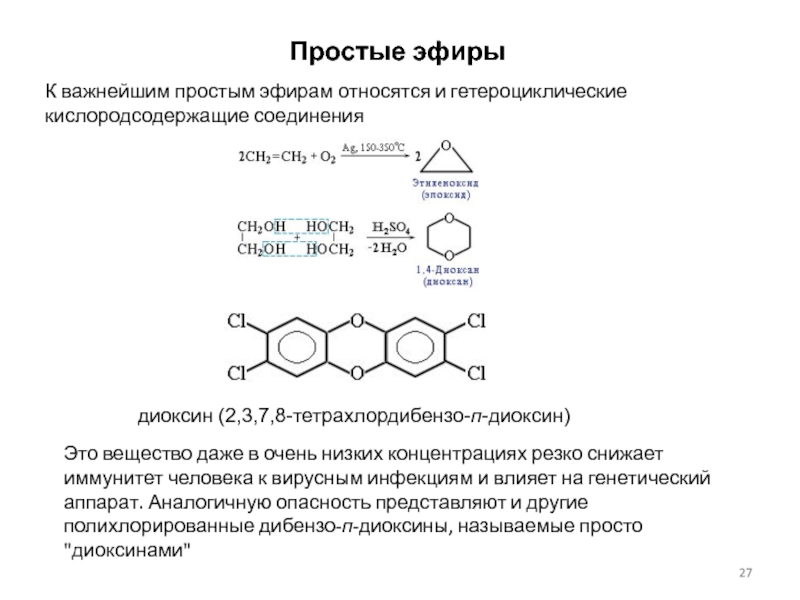
Слайд 27Простые эфиры
К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения
диоксин (2,3,7,8-тетрахлордибензо-п-диоксин)
Это вещество даже в очень низких концентрациях резко снижает
иммунитет человека к вирусным инфекциям и влияет на генетический аппарат. Аналогичную опасность представляют и другие полихлорированные дибензо-п-диоксины, называемые просто "диоксинами"
Слайд 28Химические свойства спиртов
Реакции по связи C-О
Внутримолекулярная дегидратация (правило Зайцева)
спирт
алкен
Правило Зайцева — Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
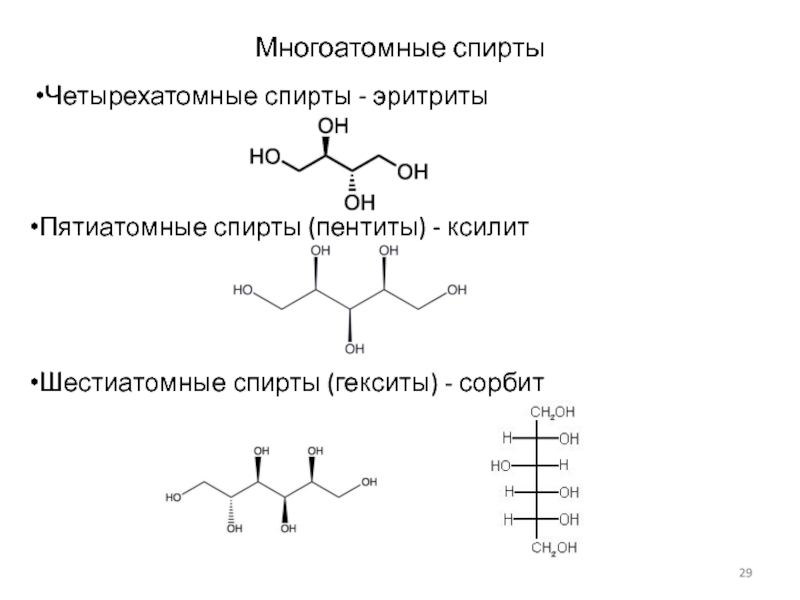
Слайд 29Многоатомные спирты
Четырехатомные спирты - эритриты
Пятиатомные спирты (пентиты) - ксилит
Шестиатомные спирты
(гекситы) - сорбит
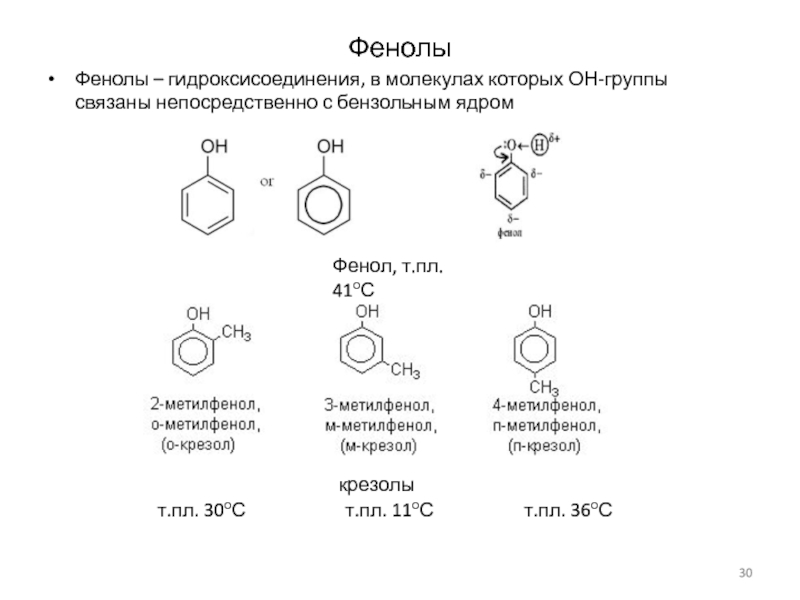
Слайд 30Фенолы
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с
бензольным ядром
Фенол, т.пл. 41оС
крезолы
т.пл. 30оС
т.пл. 11оС т.пл. 36оС
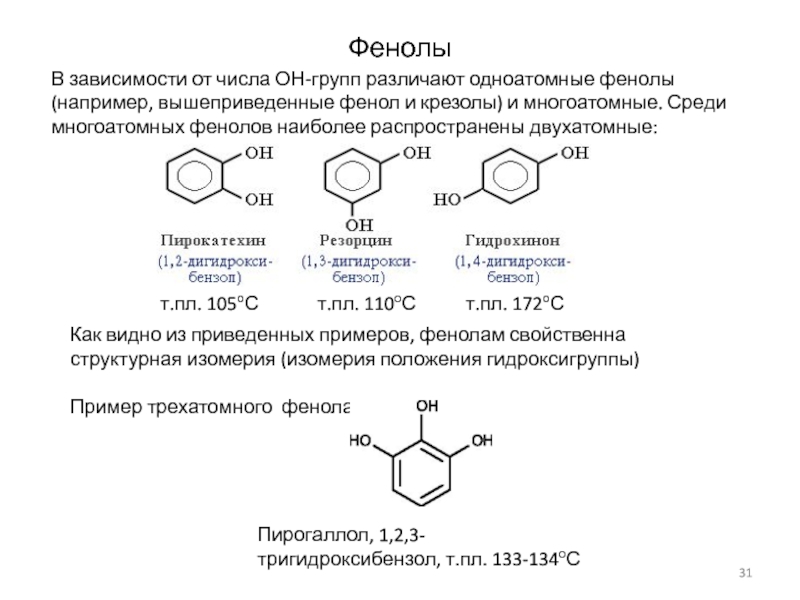
Слайд 31Фенолы
В зависимости от числа ОН-групп различают одноатомные фенолы (например,
вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее
распространены двухатомные:
Как видно из приведенных примеров, фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы)
Пример трехатомного фенола:
Пирогаллол, 1,2,3-тригидроксибензол, т.пл. 133-134оС
т.пл. 105оС т.пл. 110оС т.пл. 172оС
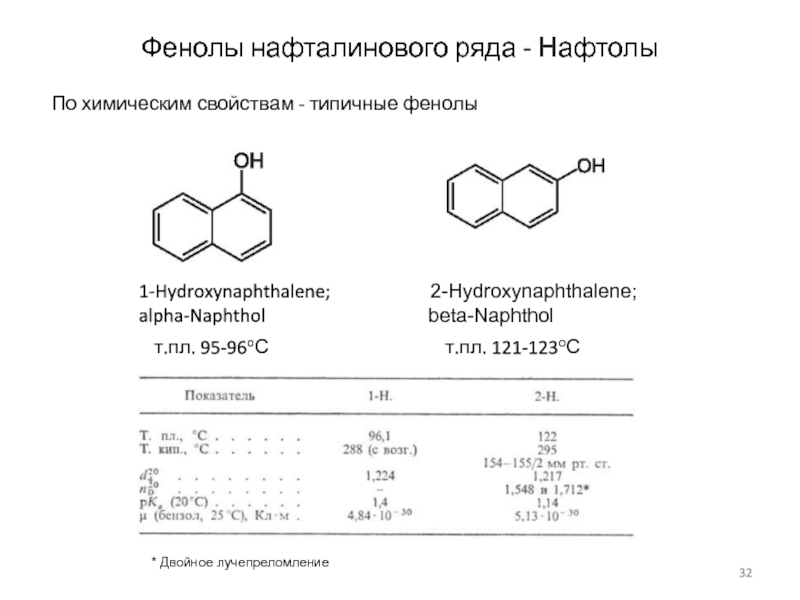
Слайд 32Фенолы нафталинового ряда - Нафтолы
По химическим свойствам - типичные
фенолы
т.пл. 95-96оС
т.пл. 121-123оС
1-Hydroxynaphthalene; 2-Hydroxynaphthalene;
alpha-Naphthol beta-Naphthol
* Двойное лучепреломление
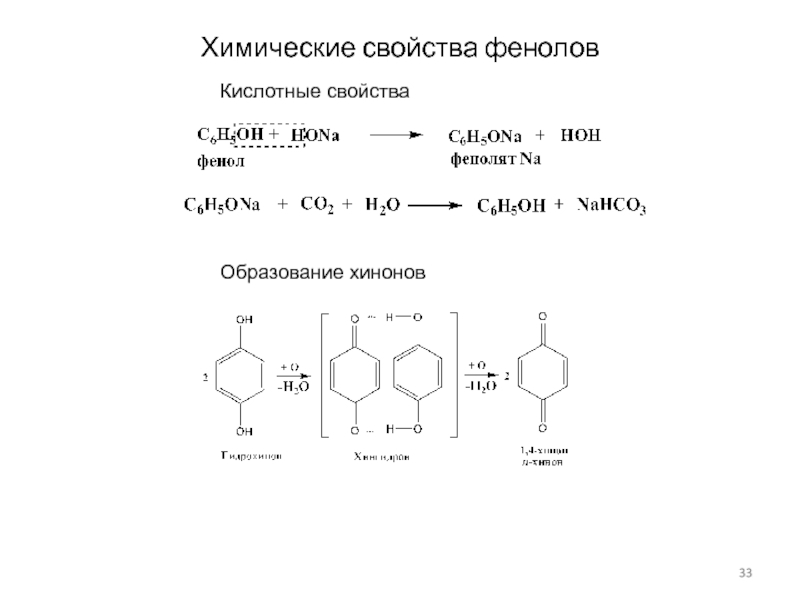
Слайд 33Химические свойства фенолов
Кислотные свойства
Образование хинонов
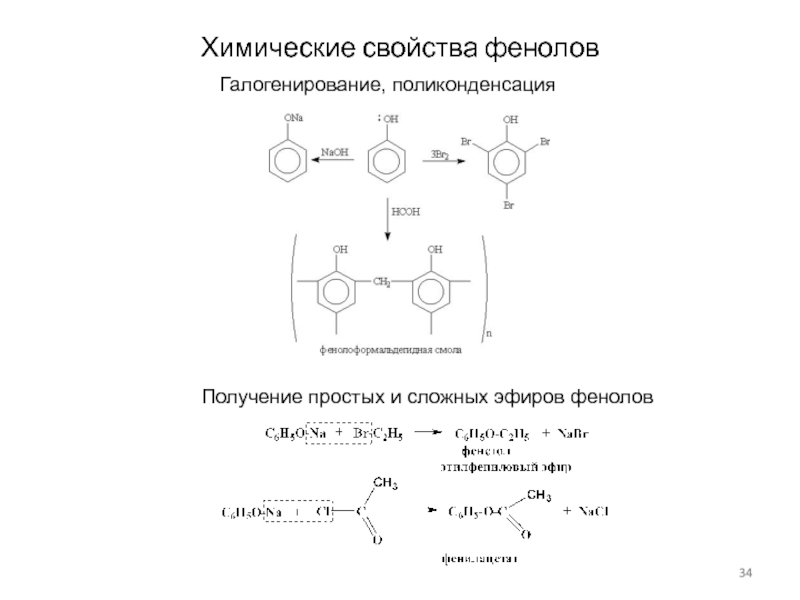
Слайд 34Химические свойства фенолов
Галогенирование, поликонденсация
Получение простых и сложных эфиров фенолов
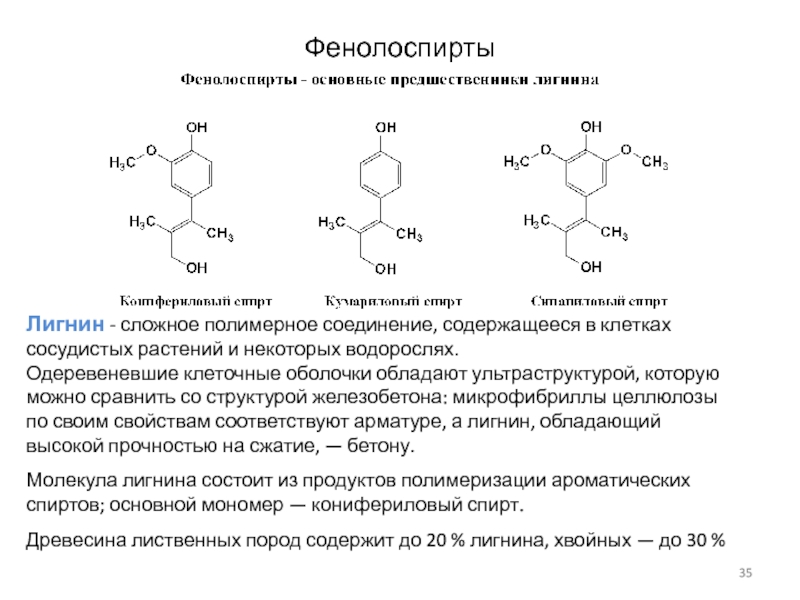
Слайд 35Фенолоспирты
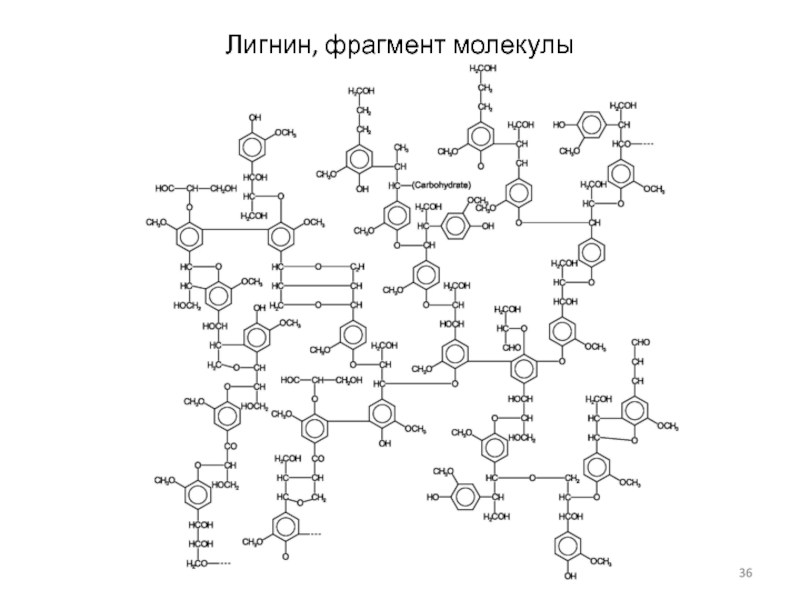
Лигнин - сложное полимерное соединение, содержащееся в клетках сосудистых
растений и некоторых водорослях.
Одеревеневшие клеточные оболочки обладают ультраструктурой, которую можно
сравнить со структурой железобетона: микрофибриллы целлюлозы по своим свойствам соответствуют арматуре, а лигнин, обладающий высокой прочностью на сжатие, — бетону.
Молекула лигнина состоит из продуктов полимеризации ароматических спиртов; основной мономер — конифериловый спирт.
Древесина лиственных пород содержит до 20 % лигнина, хвойных — до 30 %
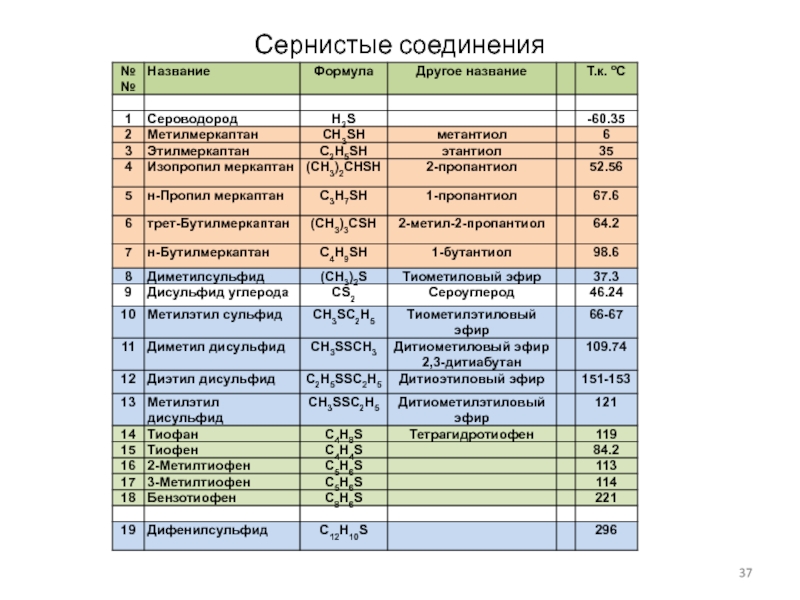
Слайд 38Сернистые соединения
Некоторые реакции меркаптанов
Кислотные свойства
Дегидросульфирование
Окисление-восстановление
Присоединение олефинов
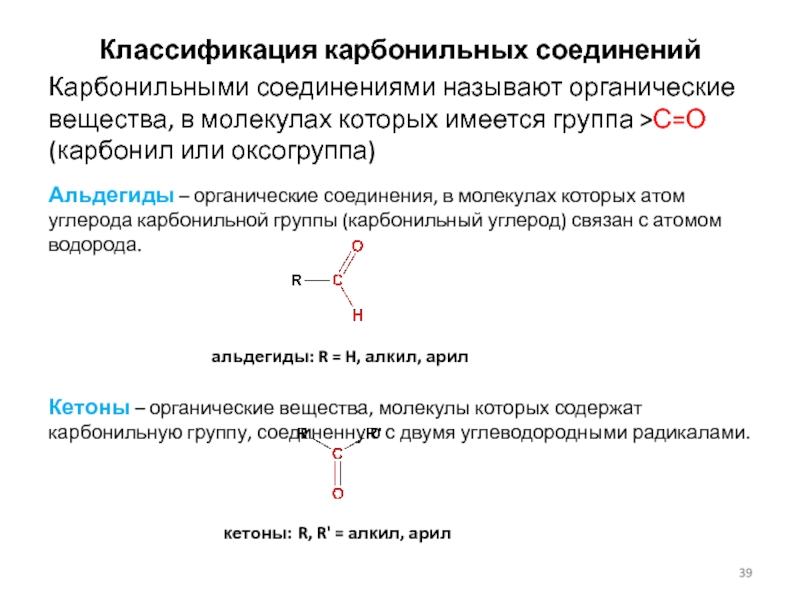
Слайд 39Классификация карбонильных соединений
Карбонильными соединениями называют органические вещества, в молекулах которых
имеется группа >С=О (карбонил или оксогруппа)
Альдегиды – органические соединения, в
молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода.
альдегиды: R = H, алкил, арил
Кетоны – органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
кетоны: R, R' = алкил, арил
Слайд 40Классификация карбонильных соединений
По строению радикалов, связанных с карбонильной группой (углеродному
скелету), карбонильные соединения подразделяются на
предельные алифатические (например, СH3CH=O
– уксусный альдегид; CH3COCH3 - ацетон)
предельные алициклические (например, циклопентанкарбальдегид
циклопентанон )
ароматические (например, C6H5CH=O - бензальдегид, C6H5COCH3- ацетофенон)
непредельные
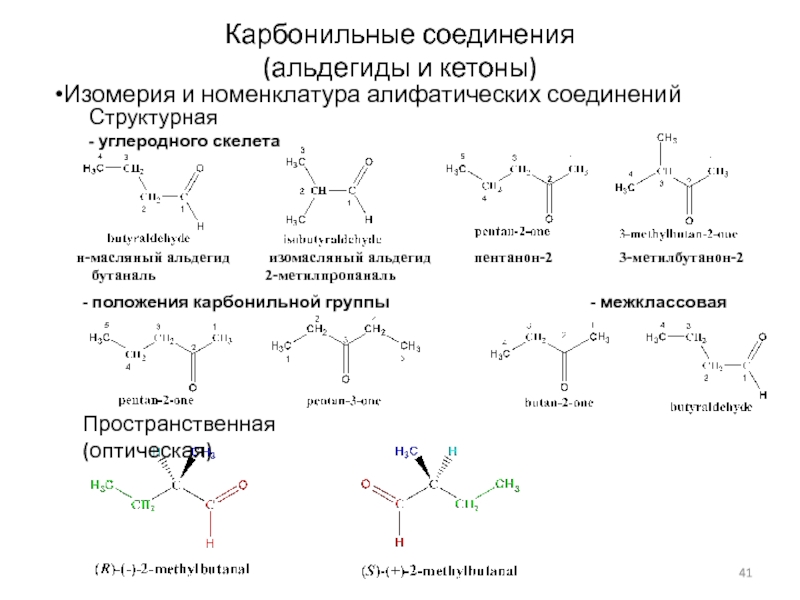
Слайд 41Карбонильные соединения
(альдегиды и кетоны)
Изомерия и номенклатура алифатических соединений
н-масляный альдегид
изомасляный альдегид
пентанон-2 3-метилбутанон-2
бутаналь 2-метилпропаналь
Структурная
- углеродного скелета
Пространственная (оптическая)
- положения карбонильной группы - межклассовая
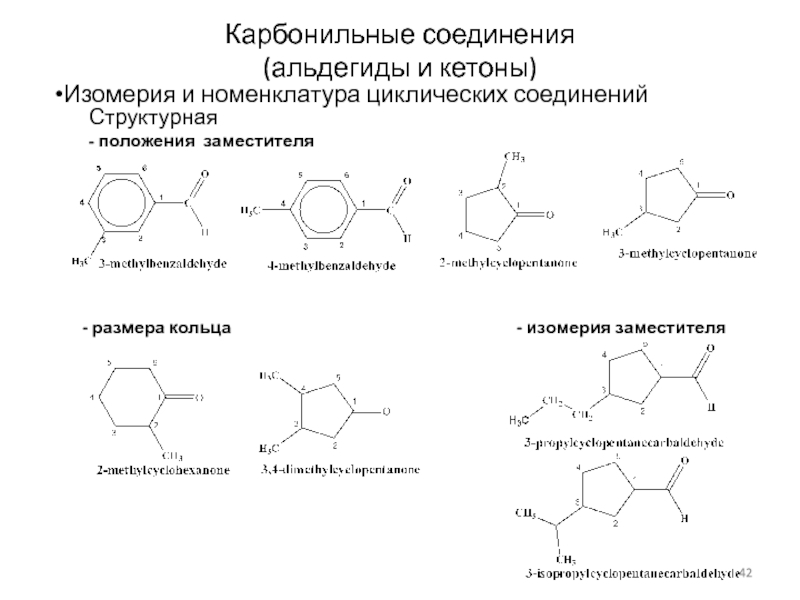
Слайд 42Карбонильные соединения
(альдегиды и кетоны)
Изомерия и номенклатура циклических соединений
Структурная
- положения заместителя
- размера кольца
- изомерия заместителя
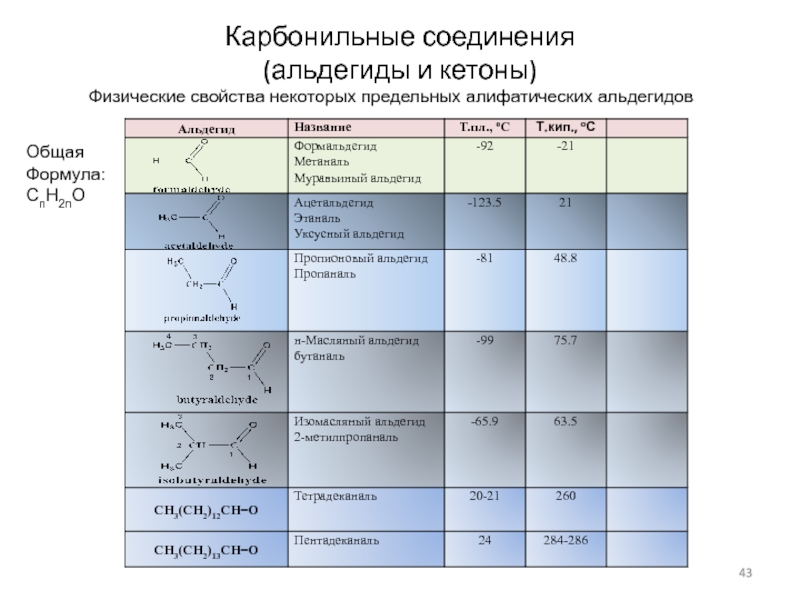
Слайд 43Карбонильные соединения
(альдегиды и кетоны)
Физические свойства некоторых предельных алифатических альдегидов
Общая
Формула:
CnH2nO
Слайд 44Карбонильные соединения
(альдегиды и кетоны)
Физические свойства некоторых циклических альдегидов
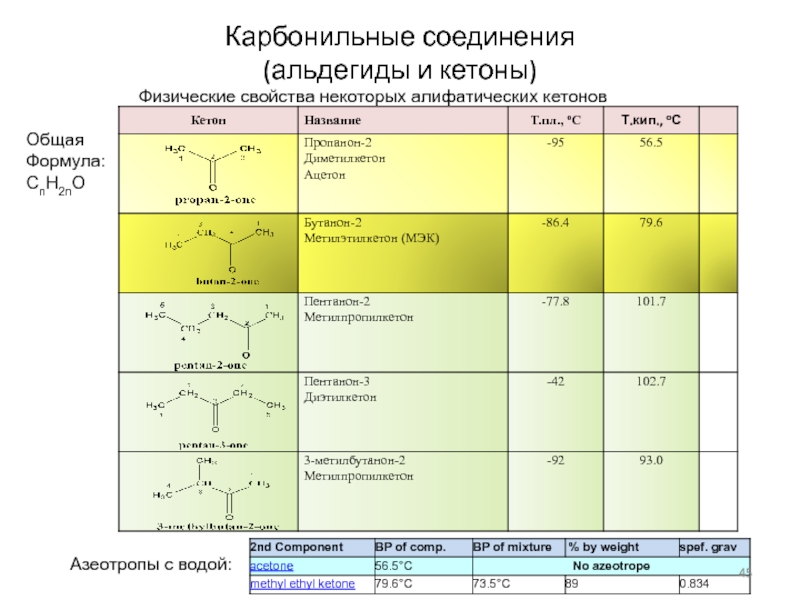
Слайд 45Карбонильные соединения
(альдегиды и кетоны)
Физические свойства некоторых алифатических кетонов
Общая
Формула:
CnH2nO
Азеотропы с водой:
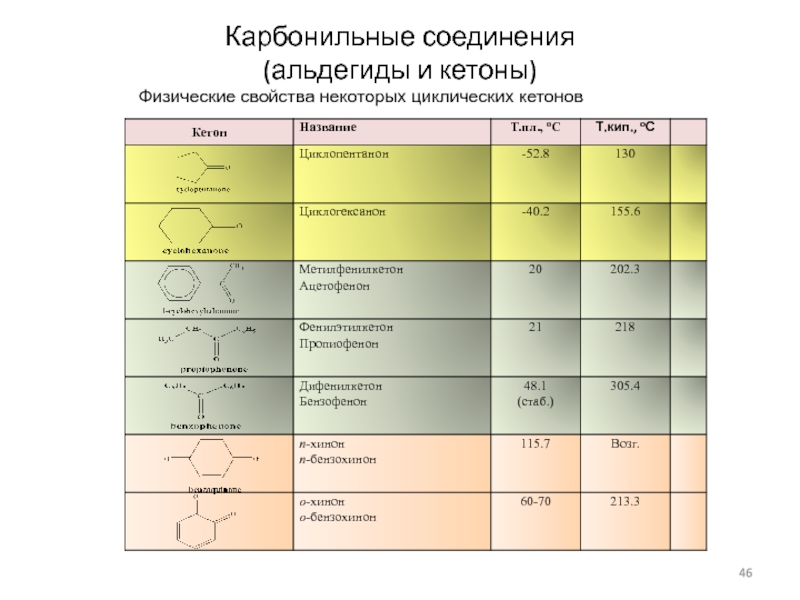
Слайд 46Карбонильные соединения
(альдегиды и кетоны)
Физические свойства некоторых циклических кетонов
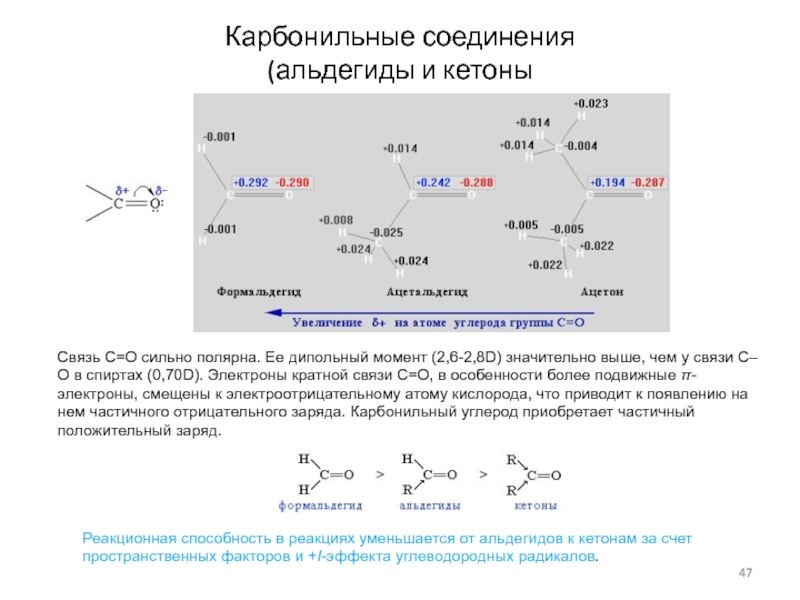
Слайд 47Карбонильные соединения
(альдегиды и кетоны
Связь С=О сильно полярна. Ее дипольный момент
(2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D).
Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
Реакционная способность в реакциях уменьшается от альдегидов к кетонам за счет пространственных факторов и +I-эффекта углеводородных радикалов.
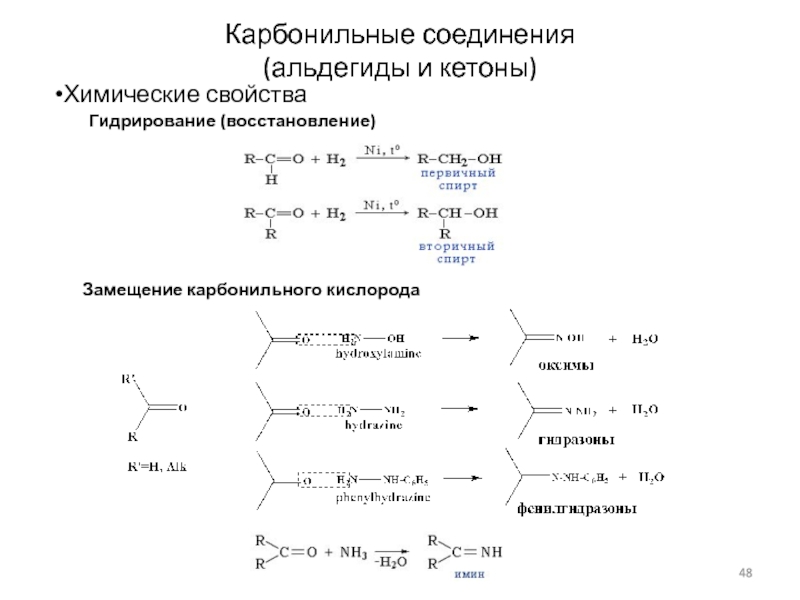
Слайд 48Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Гидрирование (восстановление)
Замещение карбонильного кислорода
Слайд 49Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Образование меланоидинов
Образование оснований Шиффа
Замещение карбонильного кислорода
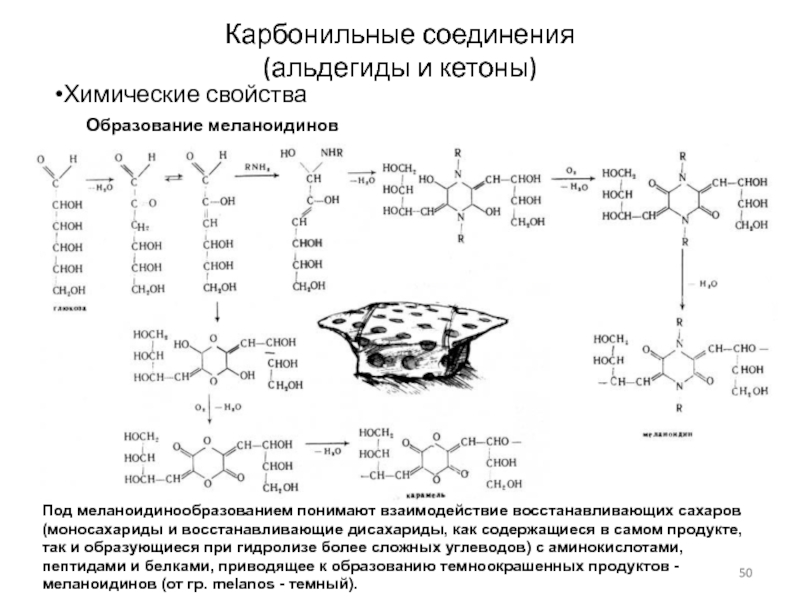
Слайд 50Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Образование меланоидинов
Под меланоидинообразованием понимают взаимодействие восстанавливающих
сахаров (моносахариды и восстанавливающие дисахариды, как содержащиеся в самом продукте,
так и образующиеся при гидролизе более сложных углеводов) с аминокислотами, пептидами и белками, приводящее к образованию темноокрашенных продуктов - меланоидинов (от гр. melanos - темный).
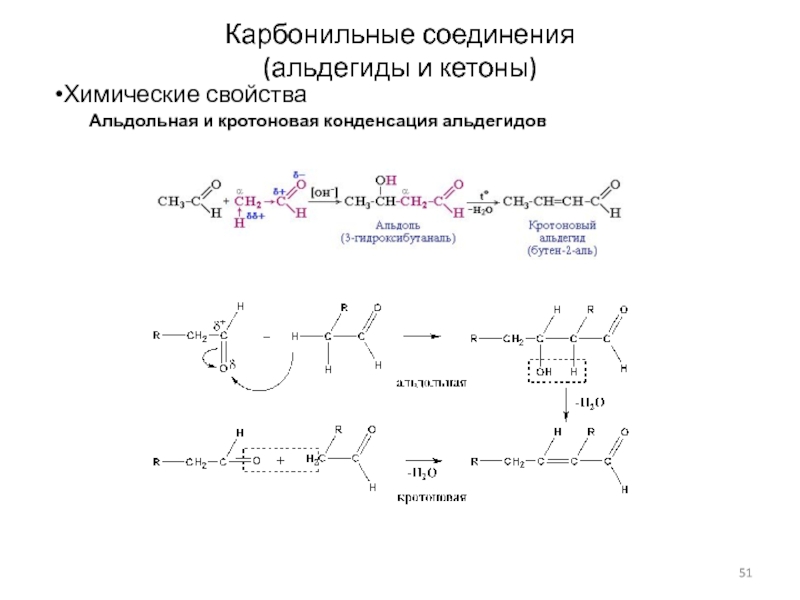
Слайд 51Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Альдольная и кротоновая конденсация альдегидов
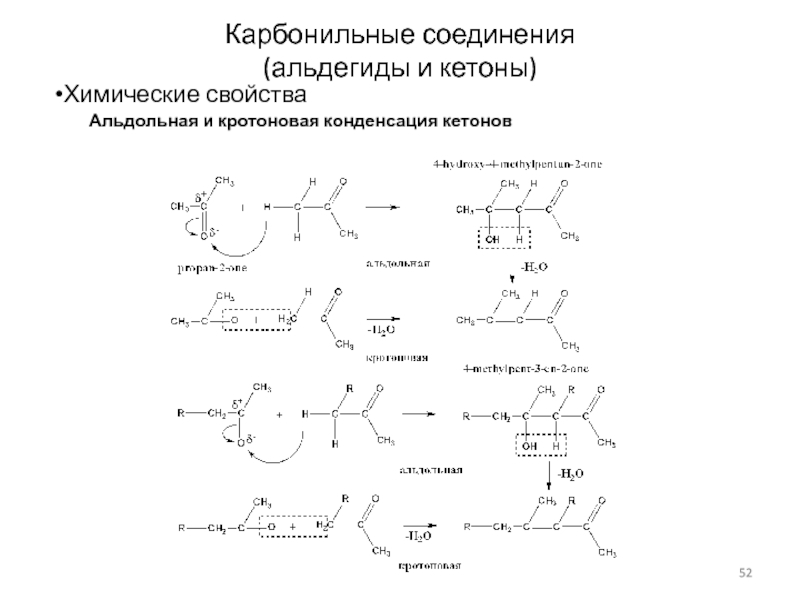
Слайд 52Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Альдольная и кротоновая конденсация кетонов
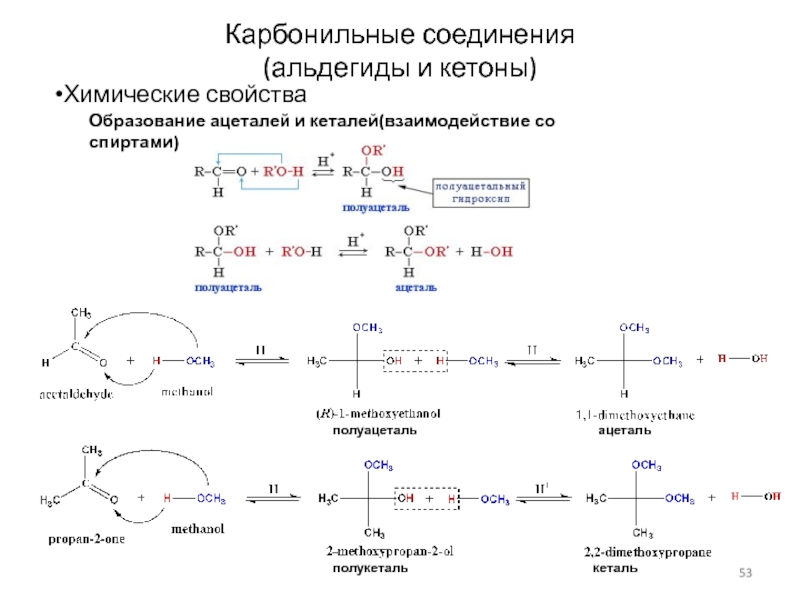
Слайд 53Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Образование ацеталей и кеталей(взаимодействие со спиртами)
полуацеталь
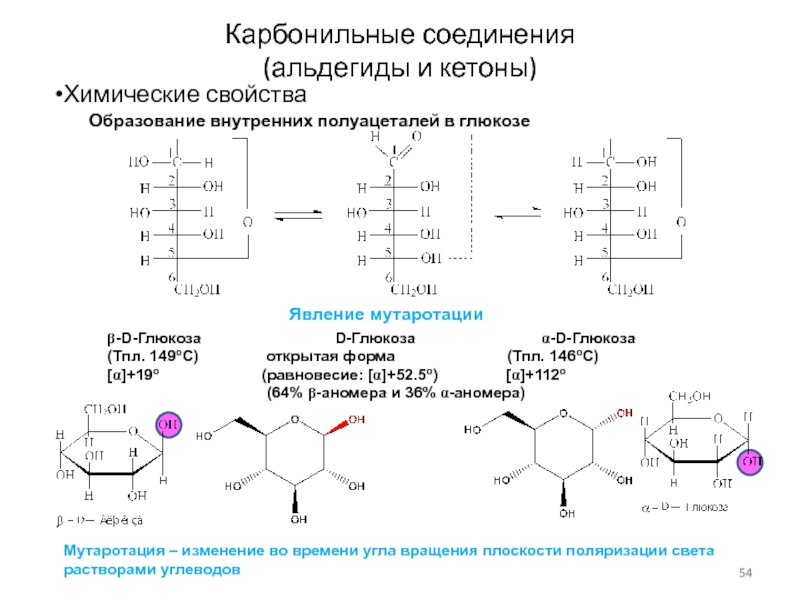
Слайд 54Карбонильные соединения
(альдегиды и кетоны)
Химические свойства
Образование внутренних полуацеталей в глюкозе
b-D-Глюкоза
D-Глюкоза a-D-Глюкоза
(Тпл. 149oC) открытая форма (Тпл. 146oC)
[a]+19o (равновесие: [a]+52.5o) [a]+112o
(64% b-аномера и 36% a-аномера)
Явление мутаротации
Мутаротация – изменение во времени угла вращения плоскости поляризации света
растворами углеводов
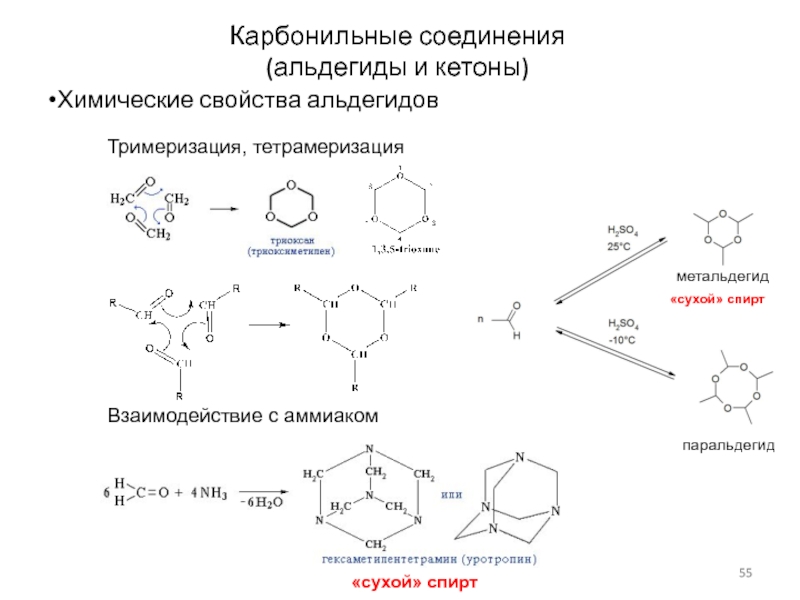
Слайд 55Карбонильные соединения
(альдегиды и кетоны)
Химические свойства альдегидов
Тримеризация, тетрамеризация
«сухой» спирт
Взаимодействие с
аммиаком
метальдегид
паральдегид
«сухой» спирт
Слайд 56Карбонильные соединения
(альдегиды и кетоны)
Химические свойства альдегидов
Окисление
Реакция "серебряного зеркала" – окисление
аммиачным раствором оксида серебра (реактив Толленса):
R–CH=O + 2[Ag(NH3)2]OH
RCOOH + 2Ag↓ + 4NH3 + H2O
Окисление гидроксидом меди (II):
а) в виде свежеприготовленного осадка Cu(OH)2 при нагревании,
б) в форме комплекса с аммиаком [Cu(NH3)4](OH)2,
в) в составе комплекса с солью винной кислоты (реактив Фелинга)
R-CH=О + 2Cu(OH)2 RCOOH + Cu2O↓ + H2О
R–CH=O + 2[Cu(NH3)4](OH)2 RCOOH + Cu2O↓ + 4NH3 + 2H2O
R–CH=O + 2Cu(OH)2/(Na/K соль винной кислоты) RCOOH + Cu2O↓ + 2H2O
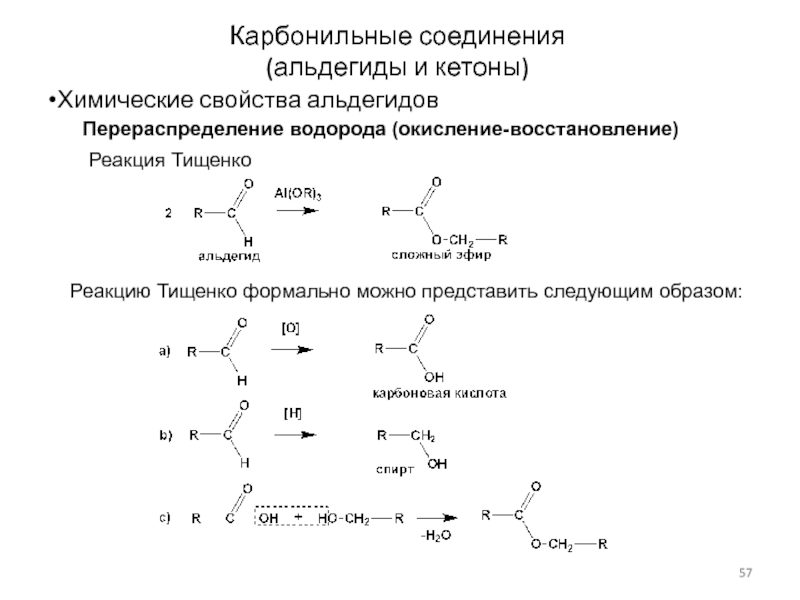
Слайд 57Карбонильные соединения
(альдегиды и кетоны)
Химические свойства альдегидов
Перераспределение водорода (окисление-восстановление)
Реакция Тищенко
Реакцию Тищенко
формально можно представить следующим образом:
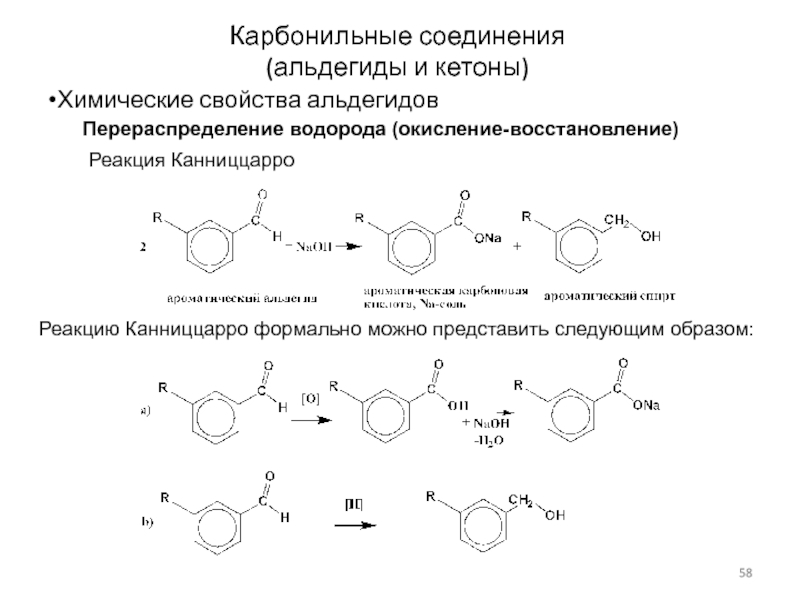
Слайд 58Карбонильные соединения
(альдегиды и кетоны)
Химические свойства альдегидов
Перераспределение водорода (окисление-восстановление)
Реакция Канниццарро
Реакцию Канниццарро
формально можно представить следующим образом:
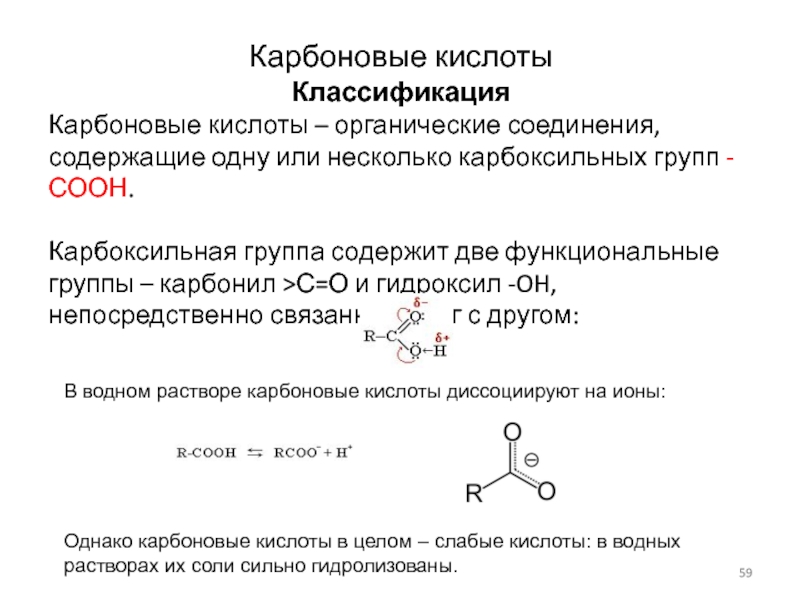
Слайд 59Карбоновые кислоты
Классификация
Карбоновые кислоты – органические соединения, содержащие одну или
несколько карбоксильных групп -СООН.
Карбоксильная группа содержит две функциональные группы –
карбонил >С=О и гидроксил -OH, непосредственно связанные друг с другом:
В водном растворе карбоновые кислоты диссоциируют на ионы:
Однако карбоновые кислоты в целом – слабые кислоты: в водных растворах их соли сильно гидролизованы.
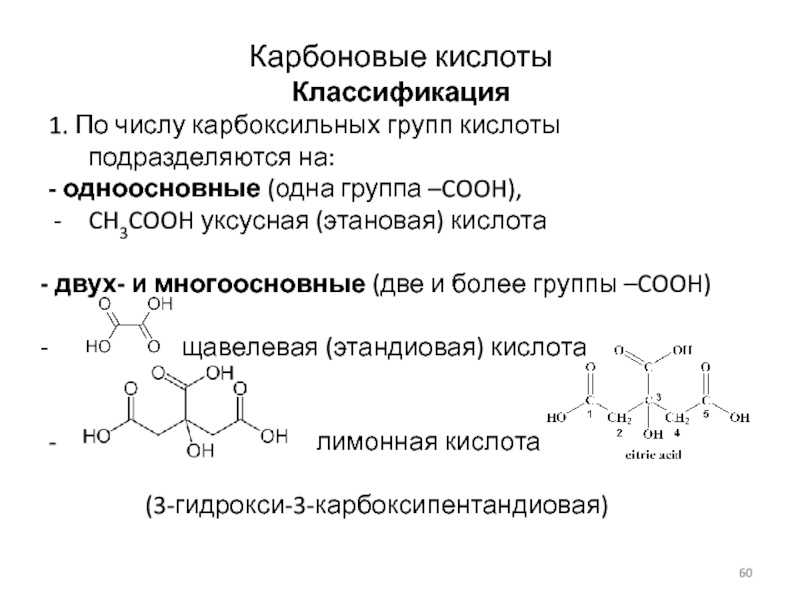
Слайд 60Карбоновые кислоты
Классификация
1. По числу карбоксильных групп кислоты подразделяются на:
-
одноосновные (одна группа –COOH),
CH3COOH уксусная (этановая) кислота
двух- и
многоосновные (две и более группы –COOH)
щавелевая (этандиовая) кислота
- лимонная кислота
(3-гидрокси-3-карбоксипентандиовая)
Слайд 61Карбоновые кислоты
Классификация
2. По строению радикалов, связанных с карбоксильной группой,
карбоновые кислоты подразделяются на:
предельные алифатические, или жирные кислоты (например,
CH3CH2COOH - пропионовая кислота)
предельные алициклические (нафтеновые для содержащих пяти- и шестичленные кольца)
(например, циклопентанкарбоновая кислота)
ароматические (C6H5COOH, бензойная кислота)
непредельные
(напр., олеиновая, линолевая, линоленовая)
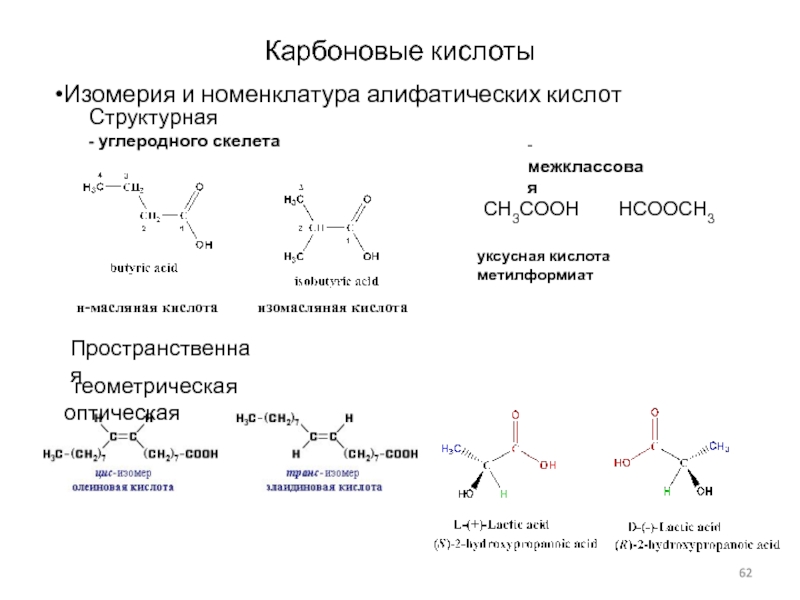
Слайд 62Карбоновые кислоты
Изомерия и номенклатура алифатических кислот
н-масляная кислота
изомасляная кислота
Структурная
- углеродного скелета
Пространственная
геометрическая
оптическая
- межклассовая
CH3COOH HCOOCH3
уксусная кислота метилформиат
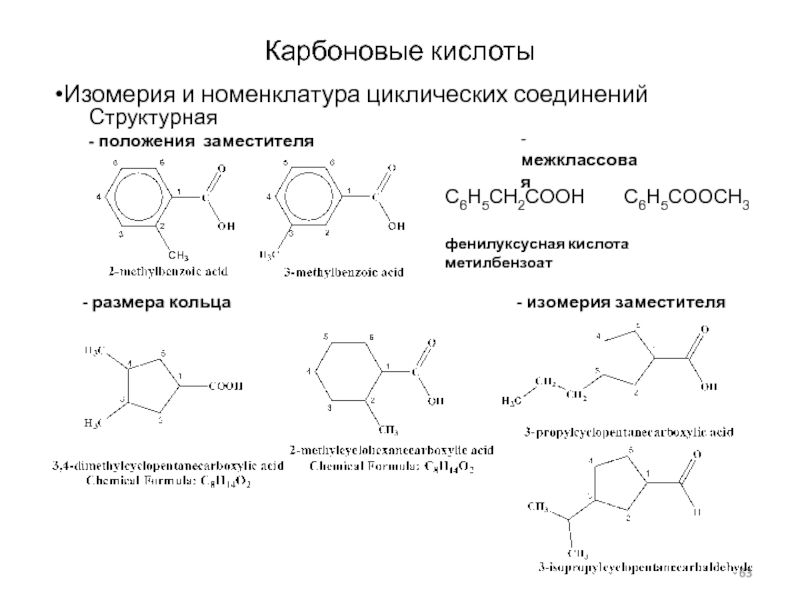
Слайд 63Карбоновые кислоты
Изомерия и номенклатура циклических соединений
Структурная
- положения заместителя
- размера
кольца
- изомерия заместителя
- межклассовая
C6H5CH2COOH C6H5COOCH3
фенилуксусная кислота метилбензоат
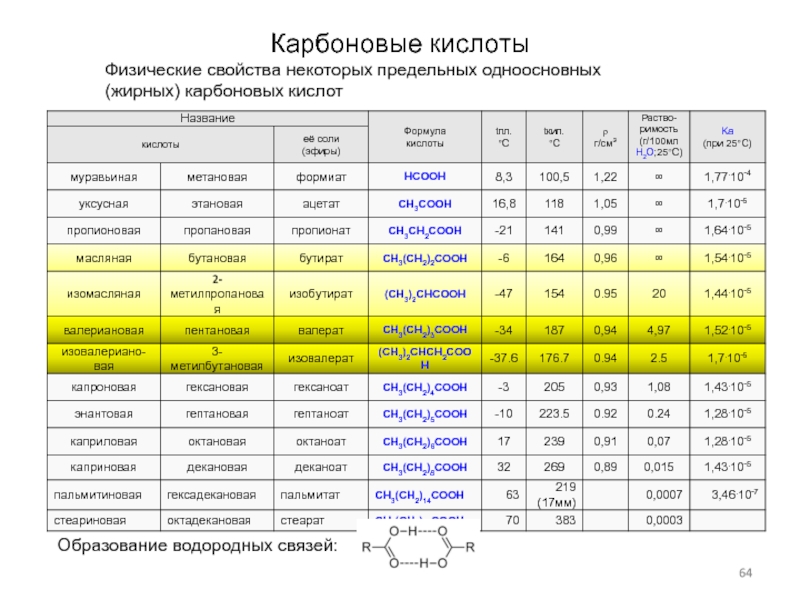
Слайд 64Карбоновые кислоты
Физические свойства некоторых предельных одноосновных
(жирных) карбоновых кислот
Образование водородных связей:
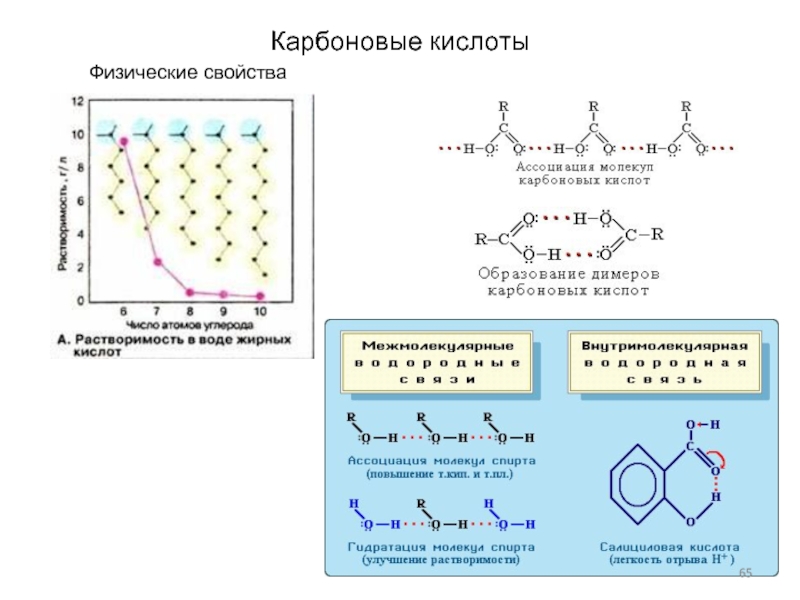
Слайд 65Карбоновые кислоты
Физические свойства
Слайд 66Карбоновые кислоты
Физические свойства
Азеотропы с водой
Azeotropes of water, BP=100°C
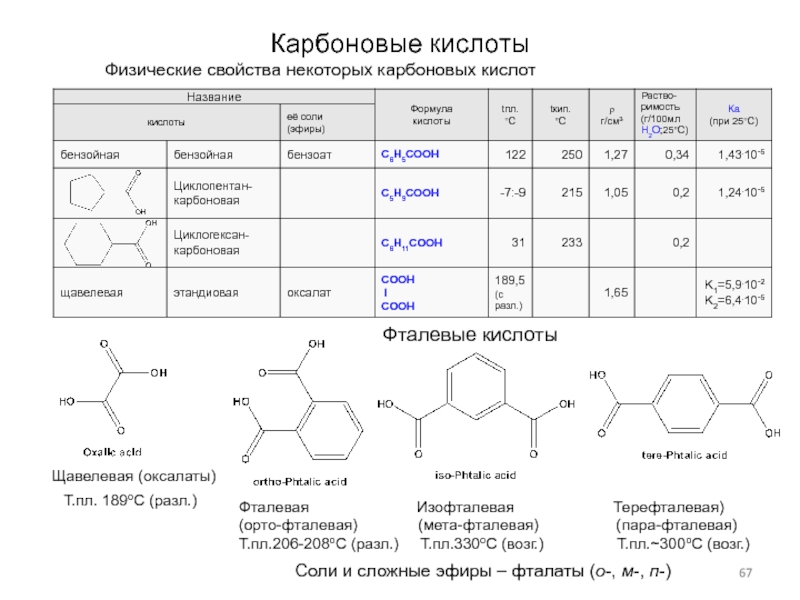
Слайд 67Карбоновые кислоты
Физические свойства некоторых карбоновых кислот
Щавелевая (оксалаты)
Т.пл. 189оС (разл.)
Фталевая
Изофталевая Терефталевая)
(орто-фталевая) (мета-фталевая) (пара-фталевая)
Т.пл.206-208оС (разл.) Т.пл.330оС (возг.) Т.пл.~300оС (возг.)
Фталевые кислоты
Соли и сложные эфиры – фталаты (о-, м-, п-)
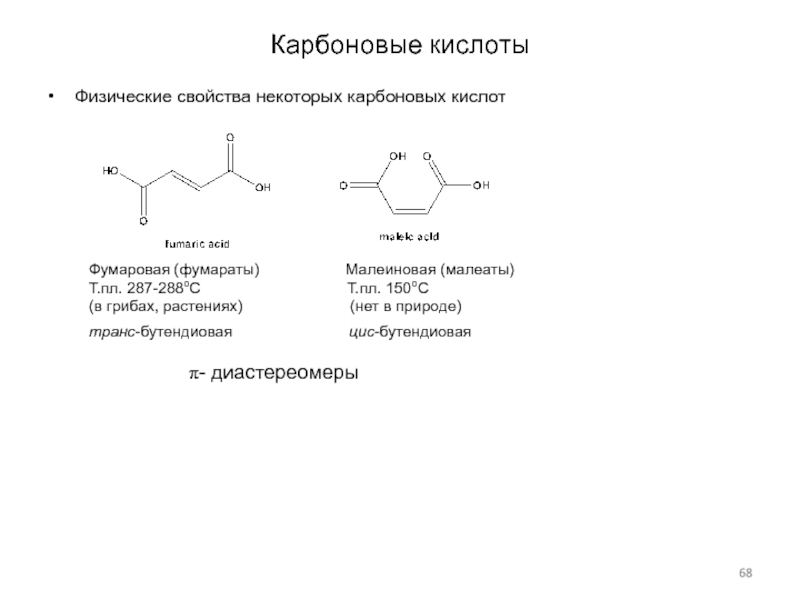
Слайд 68Карбоновые кислоты
Физические свойства некоторых карбоновых кислот
Фумаровая (фумараты)
Малеиновая (малеаты)
Т.пл. 287-288оС
Т.пл. 150оС
(в грибах, растениях) (нет в природе)
транс-бутендиовая цис-бутендиовая
p- диастереомеры
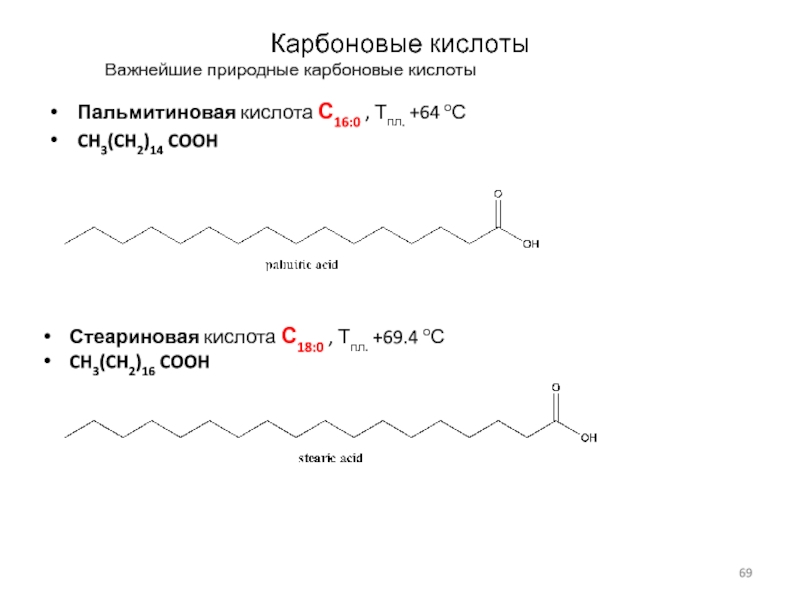
Слайд 69Карбоновые кислоты
Важнейшие природные карбоновые кислоты
Пальмитиновая кислота С16:0 , Тпл.
+64 оС
CH3(CH2)14 COOH
Стеариновая кислота С18:0 , Тпл. +69.4
оС
CH3(CH2)16 COOH
Слайд 70Карбоновые кислоты
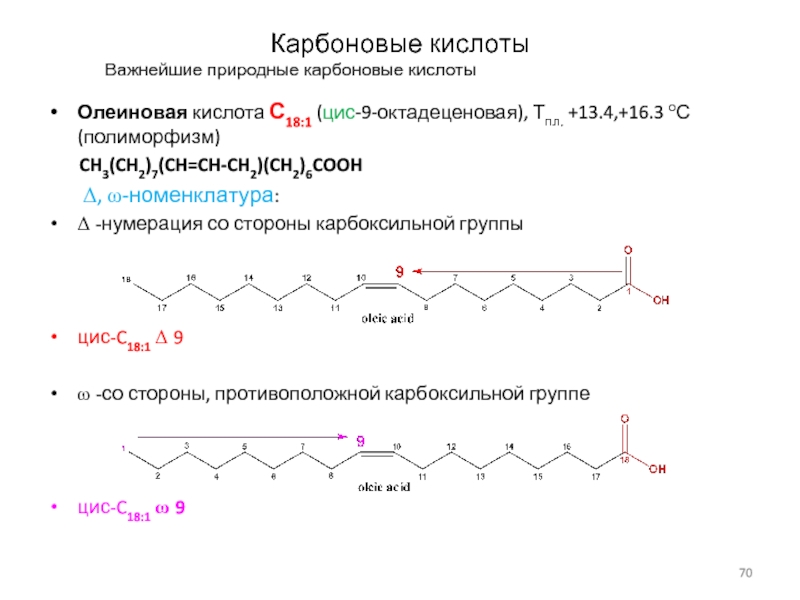
Важнейшие природные карбоновые кислоты
Олеиновая кислота С18:1 (цис-9-октадеценовая), Тпл.
+13.4,+16.3 оС (полиморфизм)
CH3(CH2)7(CH=CH-CH2)(CH2)6COOH
D, w-номенклатура:
D -нумерация со стороны карбоксильной группы
цис-C18:1 D 9
w -со стороны, противоположной карбоксильной группе
цис-C18:1 w 9
Слайд 71Карбоновые кислоты
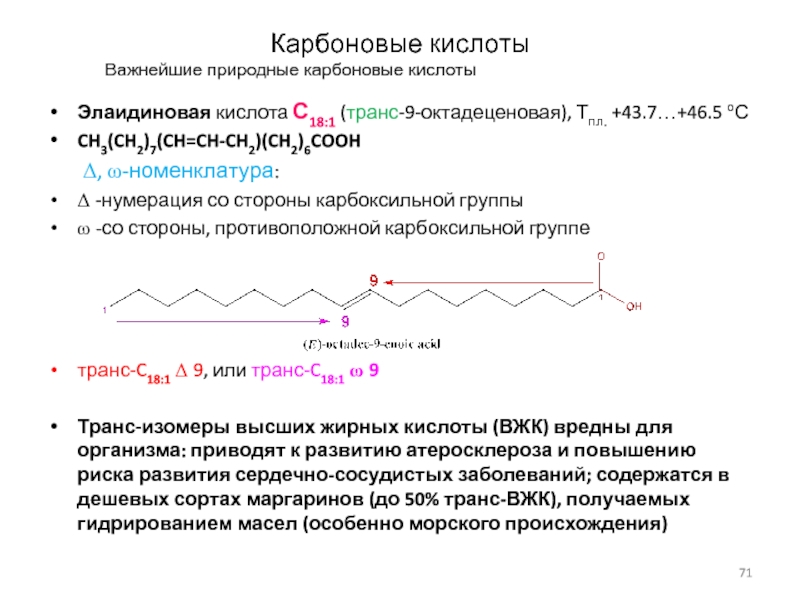
Важнейшие природные карбоновые кислоты
Элаидиновая кислота С18:1 (транс-9-октадеценовая), Тпл.
+43.7…+46.5 оС
CH3(CH2)7(CH=CH-CH2)(CH2)6COOH
D, w-номенклатура:
D -нумерация со стороны
карбоксильной группы
w -со стороны, противоположной карбоксильной группе
транс-C18:1 D 9, или транс-C18:1 w 9
Транс-изомеры высших жирных кислоты (ВЖК) вредны для организма: приводят к развитию атеросклероза и повышению риска развития сердечно-сосудистых заболеваний; содержатся в дешевых сортах маргаринов (до 50% транс-ВЖК), получаемых гидрированием масел (особенно морского происхождения)
Слайд 72Карбоновые кислоты
Содержание транс-изомеров жирных кислот в различных жирах
Таблица.[2]
*) Спреды -
масла комбинированные, сделанные из молочного жира (коровьего масла) с добавлением
растительных жиров. Спреды могут быть растительно-жировыми (когда молочный жир отсутствует полностью), растительно-сливочными (молочный жир - до 50%) и сливочно-растительными (когда жир молочный - свыше 50%).
Саломас — твердый жир, получаемый в промышленности путем гидрогенизации жидких жиров, в основном растительных масел и жиров морских млекопитающих и рыб.
Слайд 73Карбоновые кислоты
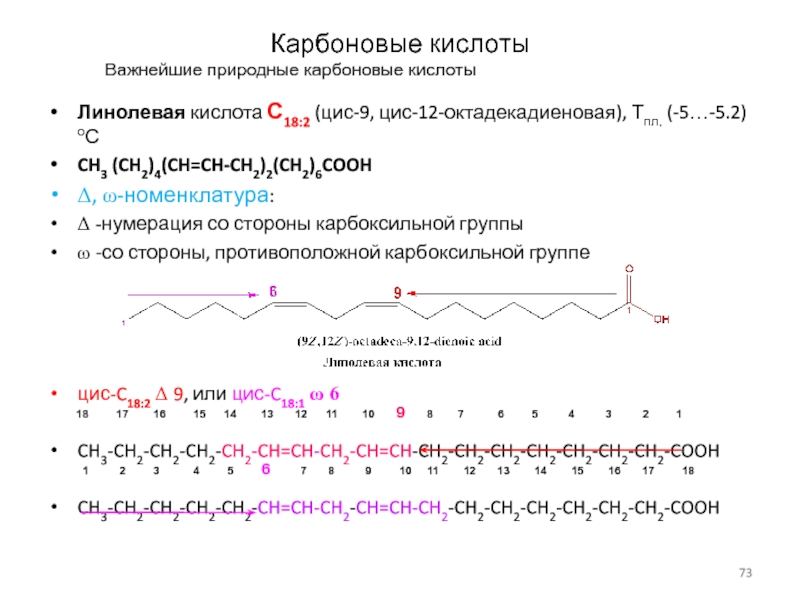
Важнейшие природные карбоновые кислоты
Линолевая кислота С18:2 (цис-9, цис-12-октадекадиеновая),
Тпл. (-5…-5.2) оС
CH3 (CH2)4(CH=CH-CH2)2(CH2)6COOH
D, w-номенклатура:
D -нумерация со стороны карбоксильной
группы
w -со стороны, противоположной карбоксильной группе
цис-C18:2 D 9, или цис-C18:1 w 6
CH3-CH2-CH2-CH2-CH2-CH=CH-CH2-CH=CH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH
CH3-CH2-CH2-CH2-CH2-CH=CH-CH2-CH=CH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
18 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
Слайд 74Карбоновые кислоты
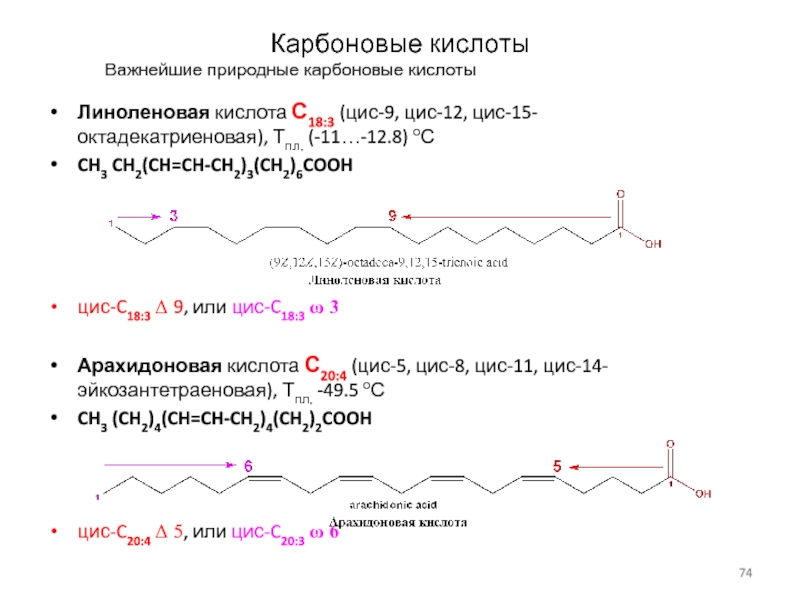
Важнейшие природные карбоновые кислоты
Линоленовая кислота С18:3 (цис-9, цис-12,
цис-15-октадекатриеновая), Тпл. (-11…-12.8) оС
CH3 CH2(CH=CH-CH2)3(CH2)6COOH
цис-C18:3 D 9, или цис-C18:3 w
3
Арахидоновая кислота С20:4 (цис-5, цис-8, цис-11, цис-14-эйкозантетраеновая), Тпл. -49.5 оС
CH3 (CH2)4(CH=CH-CH2)4(CH2)2COOH
цис-C20:4 D 5, или цис-C20:3 w 6
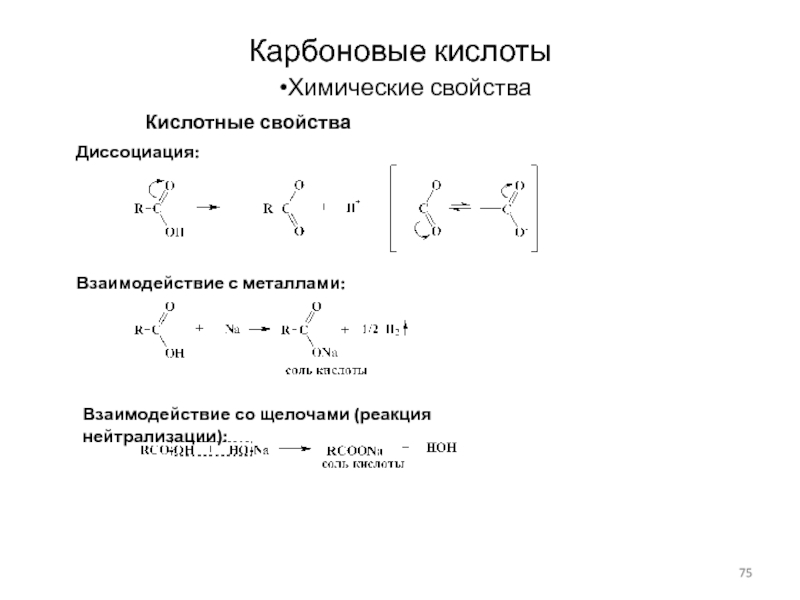
Слайд 75Карбоновые кислоты
Химические свойства
Кислотные свойства
Взаимодействие с металлами:
Диссоциация:
Взаимодействие со щелочами (реакция нейтрализации):
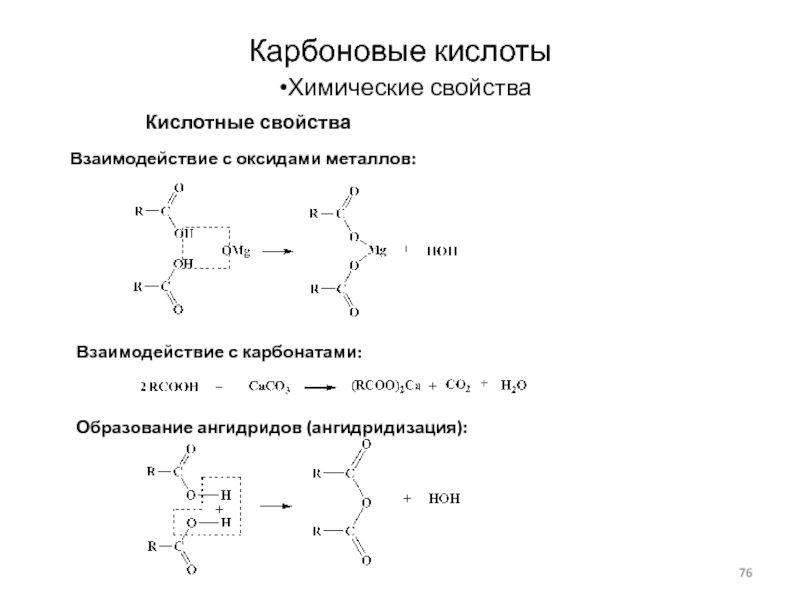
Слайд 76Карбоновые кислоты
Химические свойства
Кислотные свойства
Взаимодействие с оксидами металлов:
Образование ангидридов (ангидридизация):
Взаимодействие с
карбонатами:
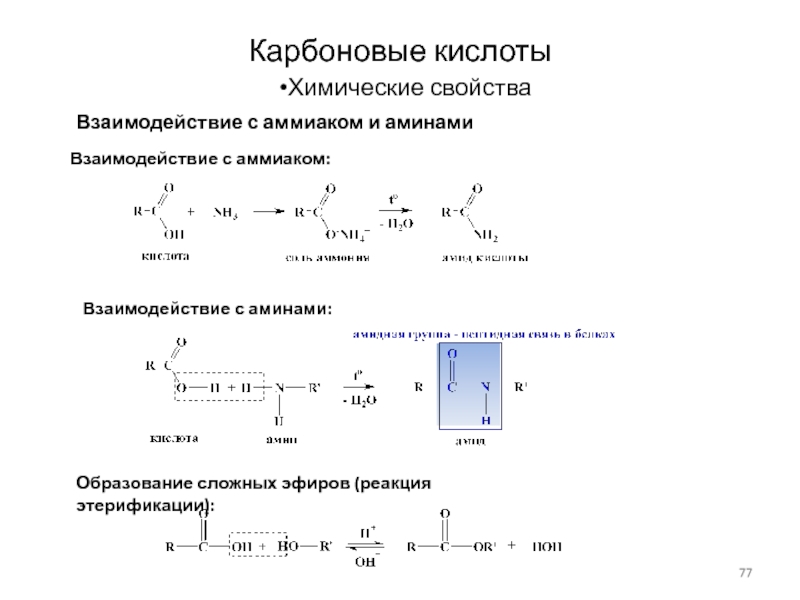
Слайд 77Карбоновые кислоты
Химические свойства
Взаимодействие с аммиаком и аминами
Взаимодействие с аммиаком:
Образование сложных
эфиров (реакция этерификации):
Взаимодействие с аминами:
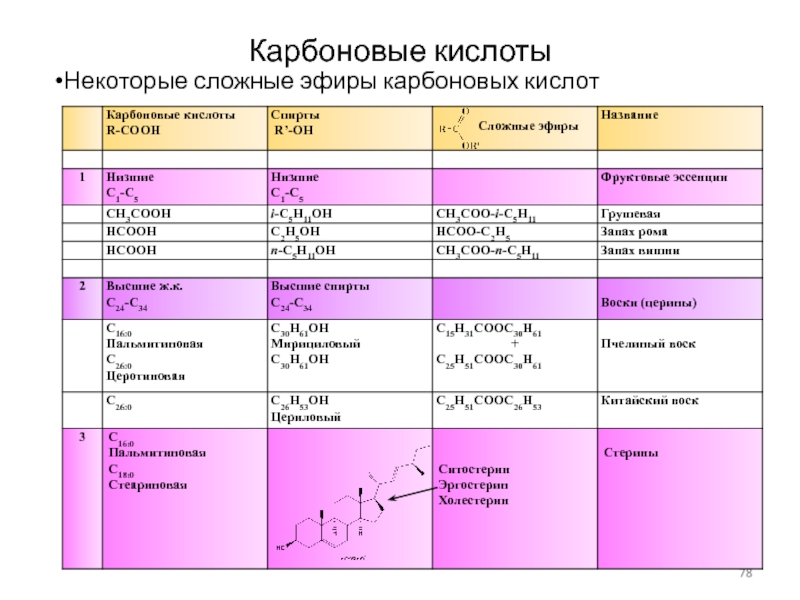
Слайд 78Карбоновые кислоты
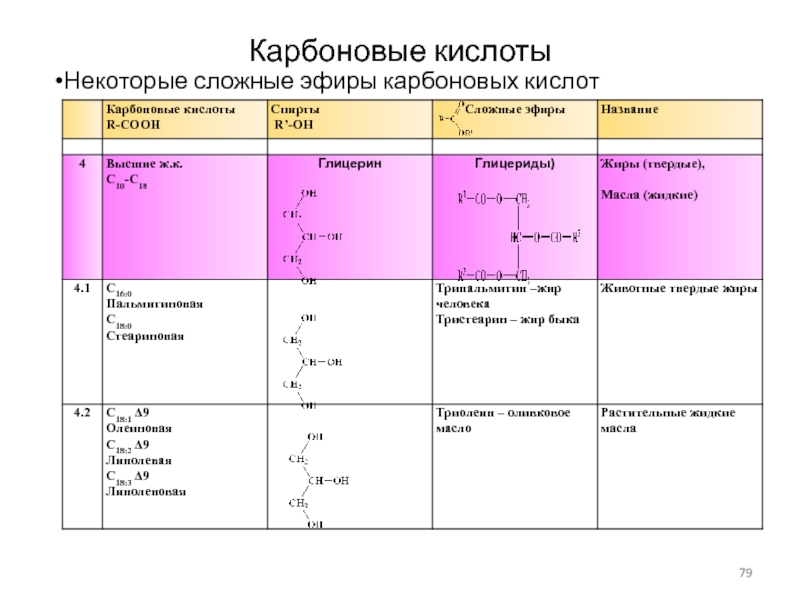
Некоторые сложные эфиры карбоновых кислот
Слайд 79Карбоновые кислоты
Некоторые сложные эфиры карбоновых кислот
Слайд 80Карбоновые кислоты
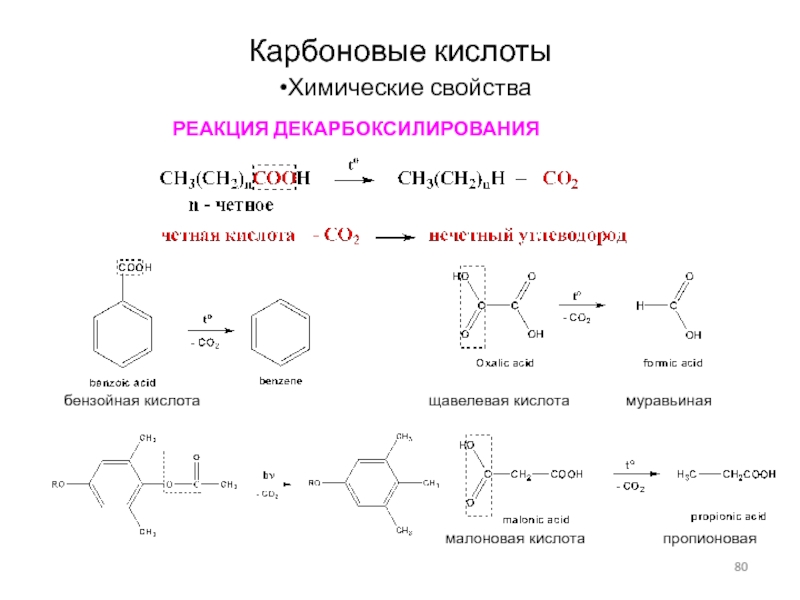
Химические свойства
РЕАКЦИЯ ДЕКАРБОКСИЛИРОВАНИЯ
бензойная кислота
щавелевая кислота муравьиная
малоновая кислота пропионовая
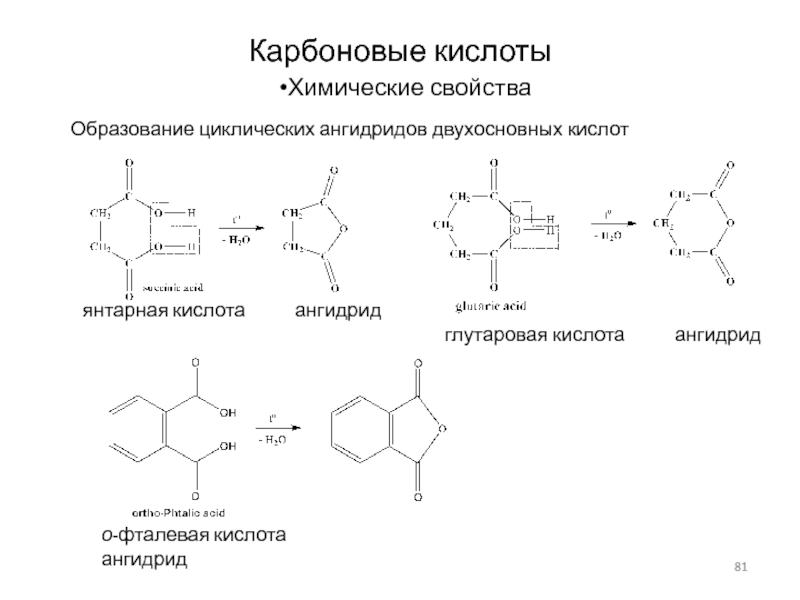
Слайд 81Карбоновые кислоты
Химические свойства
Образование циклических ангидридов двухосновных кислот
янтарная кислота
ангидрид
глутаровая кислота
ангидрид
о-фталевая кислота ангидрид
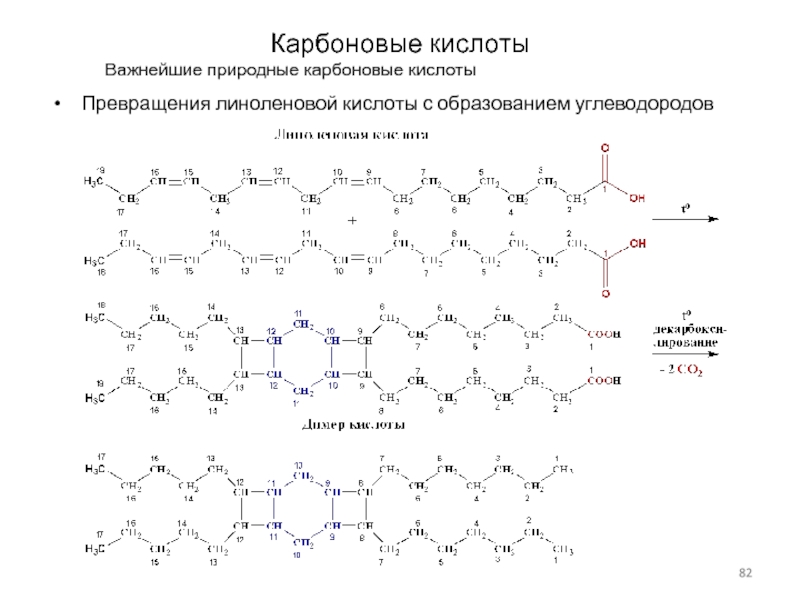
Слайд 82Карбоновые кислоты
Важнейшие природные карбоновые кислоты
Превращения линоленовой кислоты с образованием
углеводородов
Слайд 83Часть 7
Гетерофункциональные соединения
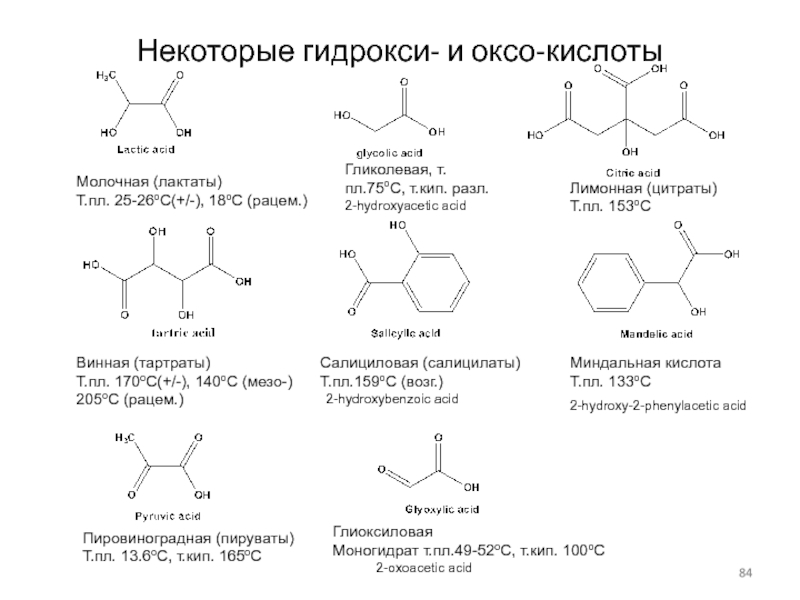
Слайд 84Некоторые гидрокси- и оксо-кислоты
Лимонная (цитраты)
Т.пл. 153оС
Молочная (лактаты)
Т.пл. 25-26оС(+/-), 18оС
(рацем.)
Винная (тартраты)
Т.пл. 170оС(+/-), 140оС (мезо-)
205оС (рацем.)
Салициловая (салицилаты)
Т.пл.159оС (возг.)
Миндальная кислота
Т.пл. 133оС
2-hydroxy-2-phenylacetic acid
2-hydroxybenzoic acid
Пировиноградная (пируваты)
Т.пл. 13.6оС, т.кип. 165оС
2-oxoacetic acid
Глиоксиловая
Моногидрат т.пл.49-52оС, т.кип. 100оС
2-hydroxyacetic acid
Гликолевая, т.пл.75оС, т.кип. разл.
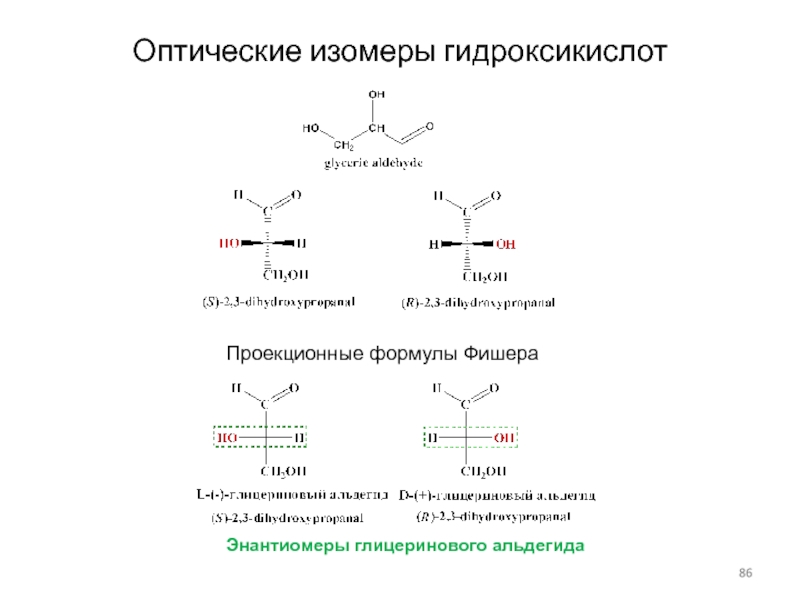
Слайд 85Оптические изомеры гидроксикислот
D, L -Система обозначения стереоизомеров.
В ряде случаев предпочитают
пользоваться не R,S -системой обозначения абсолютной конфигурации, а другой, D,L
-системой. Выбор D или L обозначения изомера основан на определенном расположении реперной группы в проекции Фишера. D , L -Номенклатура широко используется в названиях -амино, -гидроксикислот и углеводов.
По этой системе L -конфигурация приписывается стереозомеру, у которого в проекции Фишера реперная группа находится слева от вертикальной линии (от лат. "laevus" -левый). Соответственно, если реперная группа расположена в проекции Фишера справа, стереоизомер имеет D - конфигурацию (от лат. "dexter" - правый):
В проекции Фишера вверху располагает наиболее окисленный атом углерода (то есть, группу -СООН в амино- и гидроксилкслотах и группу -СН=О в углеводах).
Слайд 86Оптические изомеры гидроксикислот
Проекционные формулы Фишера
Энантиомеры глицеринового альдегида
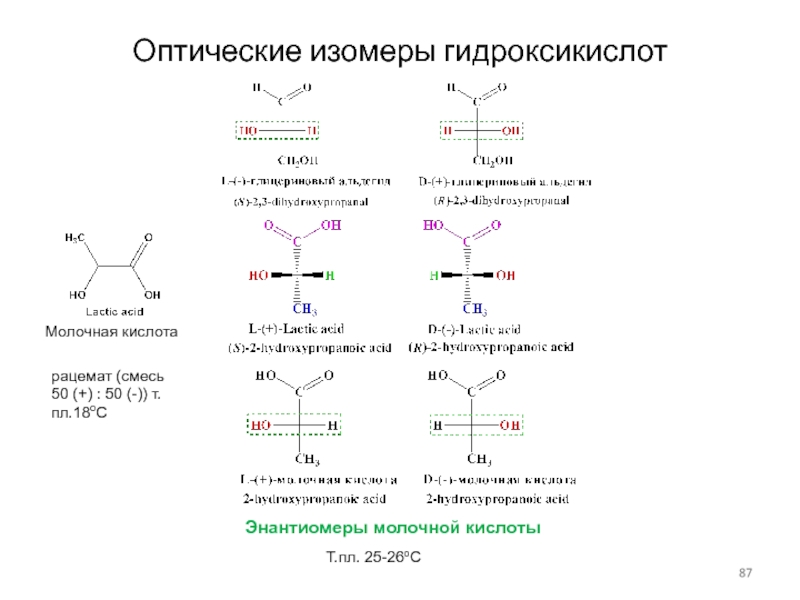
Слайд 87Оптические изомеры гидроксикислот
Молочная кислота
Энантиомеры молочной кислоты
Т.пл. 25-26оС
рацемат (смесь 50 (+)
: 50 (-)) т.пл.18оС
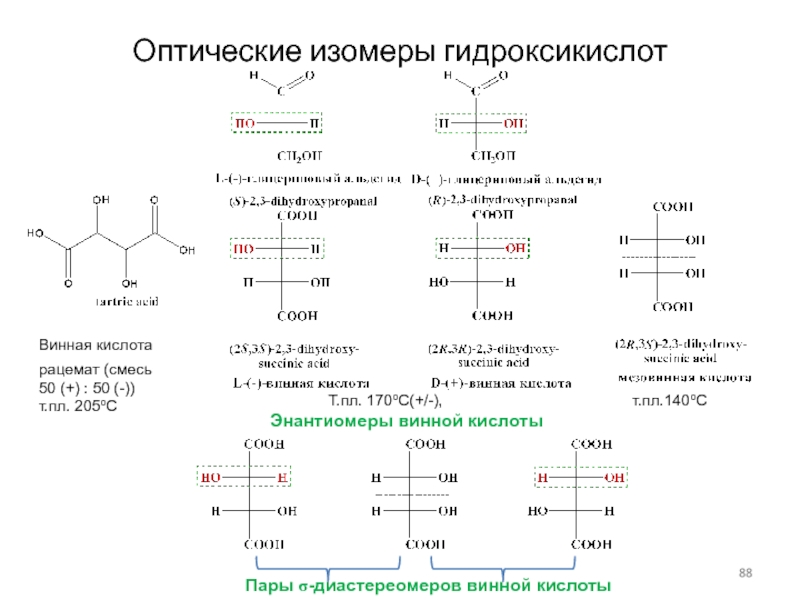
Слайд 88Оптические изомеры гидроксикислот
Т.пл. 170оС(+/-),
т.пл.140оС
Энантиомеры винной кислоты
Винная кислота
рацемат (смесь 50 (+) : 50 (-))
т.пл. 205оС
Пары s-диастереомеров винной кислоты
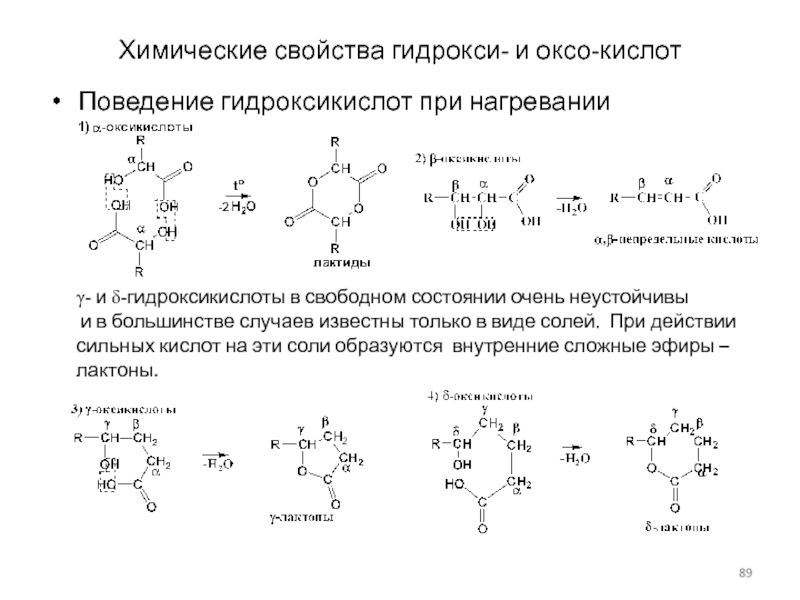
Слайд 89Химические свойства гидрокси- и оксо-кислот
Поведение гидроксикислот при нагревании
g- и d-гидроксикислоты
в свободном состоянии очень неустойчивы
и в большинстве случаев известны
только в виде солей. При действии сильных кислот на эти соли образуются внутренние сложные эфиры – лактоны.
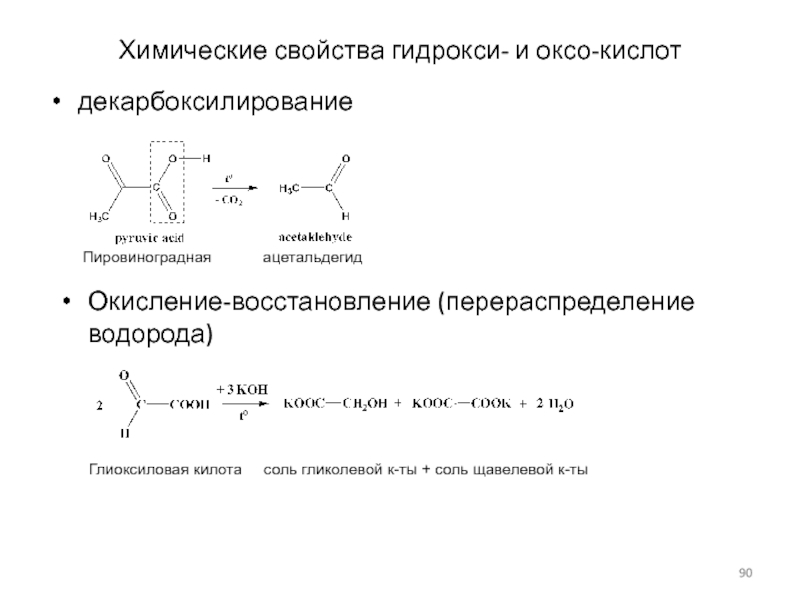
Слайд 90Химические свойства гидрокси- и оксо-кислот
декарбоксилирование
Пировиноградная
ацетальдегид
Окисление-восстановление (перераспределение водорода)
Глиоксиловая килота соль гликолевой к-ты
+ соль щавелевой к-ты
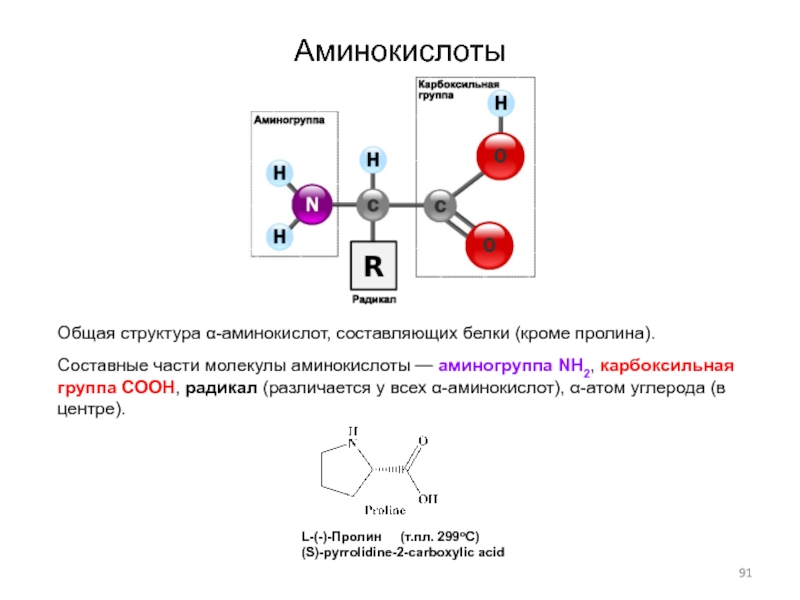
Слайд 91Аминокислоты
Общая структура α-аминокислот, составляющих белки (кроме пролина).
Составные части молекулы
аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у
всех α-аминокислот), α-атом углерода (в центре).
L-(-)-Пролин (т.пл. 299оС)
(S)-pyrrolidine-2-carboxylic acid
Слайд 92Аминокислоты
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат
асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома)
и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму, и лишь L-аминокислоты включаются в состав белков, синтезируемых на рибосомах. a-Аминокислоты D-ряда иногда называют «неприродными», т.к. они не используются для построения белков человеческого организма.
Данную особенность «живых» аминокислот весьма трудно объяснить, так как в реакциях между оптически неактивными веществами L и D-формы образуются в одинаковых количествах. Возможно, выбор одной из форм (L или D) — просто результат случайного стечения обстоятельств: первые молекулы, с которых смог начаться матричный синтез, обладали определенной формой, и именно к ним «приспособились» соответствующие ферменты.
Глицин (т.пл. 292оС)
Аминоуксусная кислота
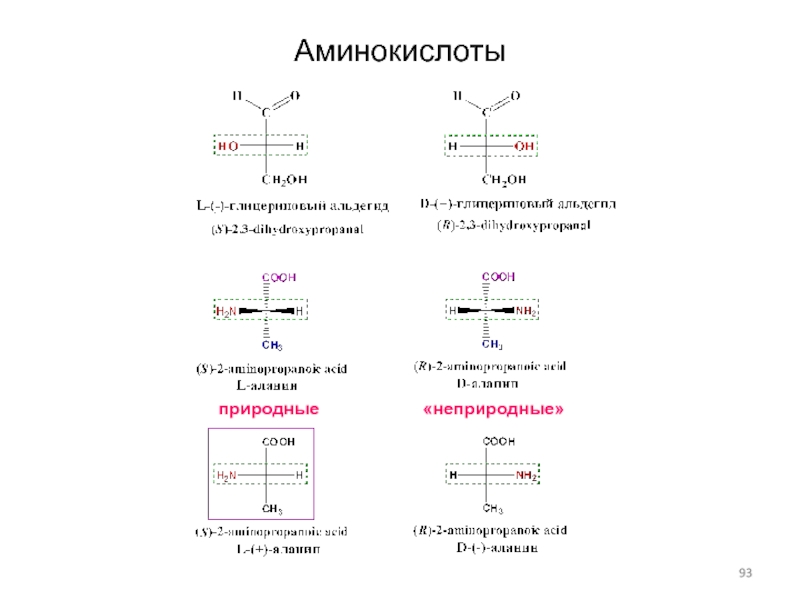
Слайд 93Аминокислоты
природные
«неприродные»
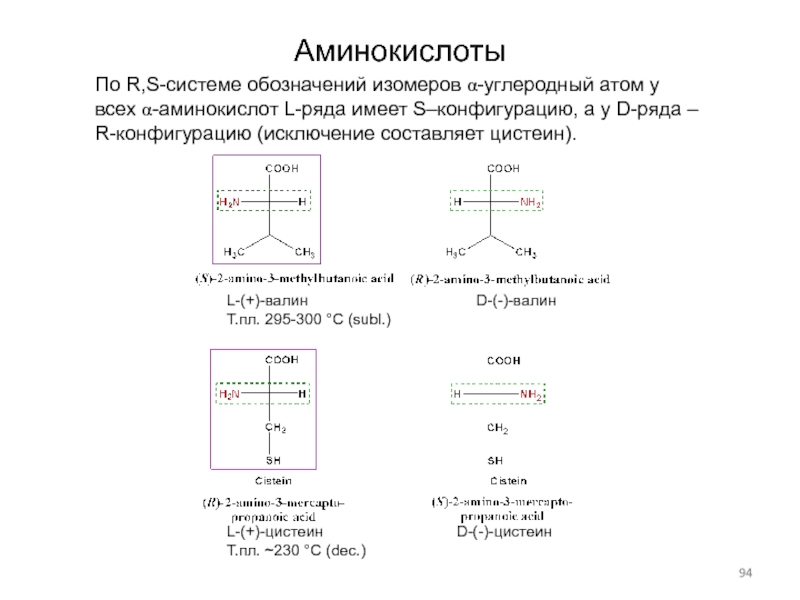
Слайд 94Аминокислоты
По R,S-системе обозначений изомеров a-углеродный атом у всех a-аминокислот L-ряда
имеет S–конфигурацию, а у D-ряда – R-конфигурацию (исключение составляет цистеин).
L-(+)-валин D-(-)-валин
Т.пл. 295-300 °C (subl.)
L-(+)-цистеин D-(-)-цистеин
Т.пл. ~230 °C (dec.)
Слайд 95Аминокислоты
L-(-)-треонин
D-(+)- треонин
L-(+)-алло-треонин D-(-)-алло-треонин
Т.пл. 272 °C (dec.) Т.пл. 276-278 °C (dec.)
(I) (II) (III) (IY)
Пары I и II, III и IY - энантиомеры
Пары I и III, I и IY; II и III, II и IY - s-диастереомеры
Аминокислоты с двумя асимметрическими атомами углерода
L-(+)-изолейцин
Т.пл. 288 °C (dec.)
(I) (II) (III) (IY)
Слайд 96Аминокислоты
Оптические изомеры аминокислот претерпевают медленную самопроизвольную неферментативную рацемизацию. Например,
в белке дентине (входит в состав зубов) L-аспартат переходит в
D-форму со скоростью 0,1 % в год, что может быть использовано для определения возраста биологических объектов.
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.
Остаток D-глутаминовой кислоты содержится в оболочке бактерий сибирской язвы. Против этого вида бактерий бессильны расщепляющие ферменты человека и животных. D-глутаминовая кислота безвкусна.
L-Глутаминовая кислота имеет вкус мяса. Получаемую гидролизом клейковины пшеницы L-глутаминовую кислоту применяют в виде глутамата натрия в качестве пищевой добавки.
L-(+)-глутаминовая кислота D-(-)- глутаминовая кислота
Т.пл. 200-202 °C (subl.)
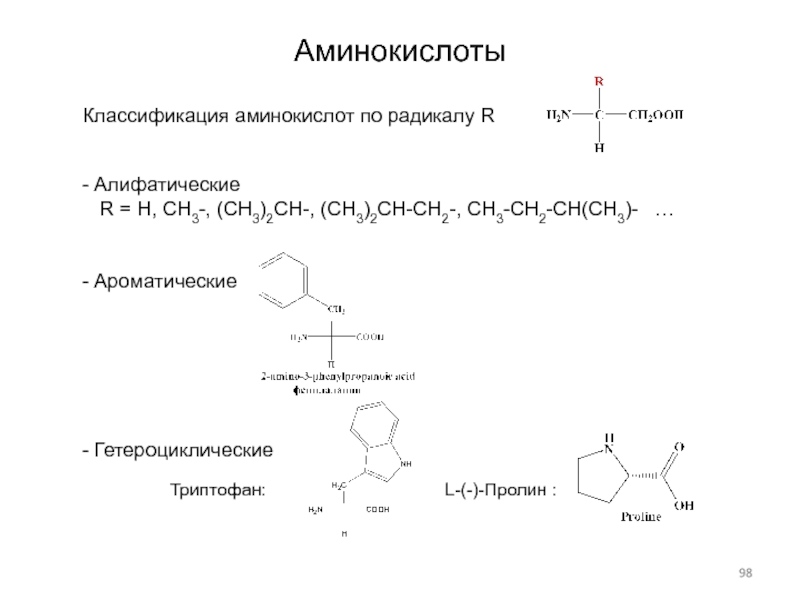
Слайд 98Аминокислоты
Классификация аминокислот по радикалу R
Алифатические
R = H, CH3-,
(CH3)2CH-, (CH3)2CH-CH2-, CH3-CH2-CH(CH3)- …
Ароматические
Гетероциклические
L-(-)-Пролин :
Триптофан:
Слайд 99Аминокислоты
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой температурой
плавления. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства
объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп.
Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
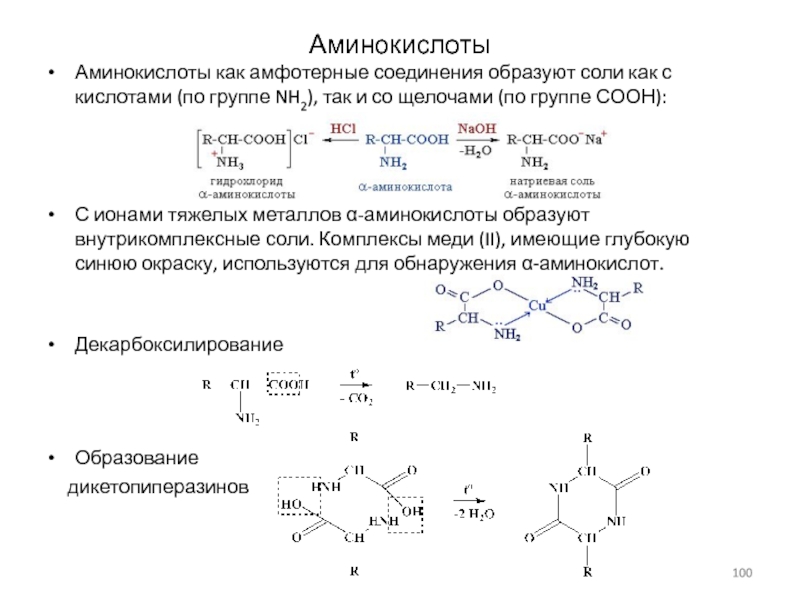
Слайд 100Аминокислоты
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по
группе NH2), так и со щелочами (по группе СООН):
С ионами
тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Декарбоксилирование
Образование
дикетопиперазинов
Слайд 101Аминокислоты
Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух
α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к
образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е. представляют собой продукт поликонденсации α-аминокислот
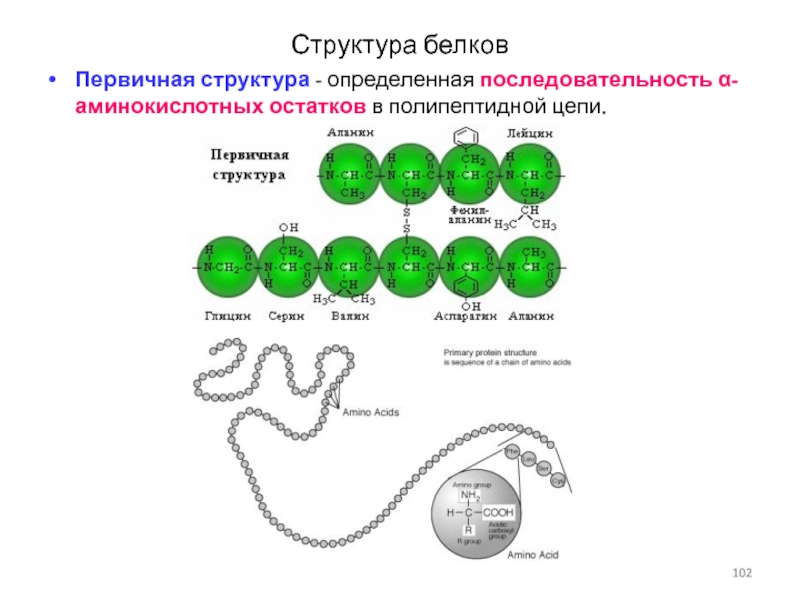
Слайд 102Структура белков
Первичная структура - определенная последовательность α-аминокислотных остатков в полипептидной
цепи.
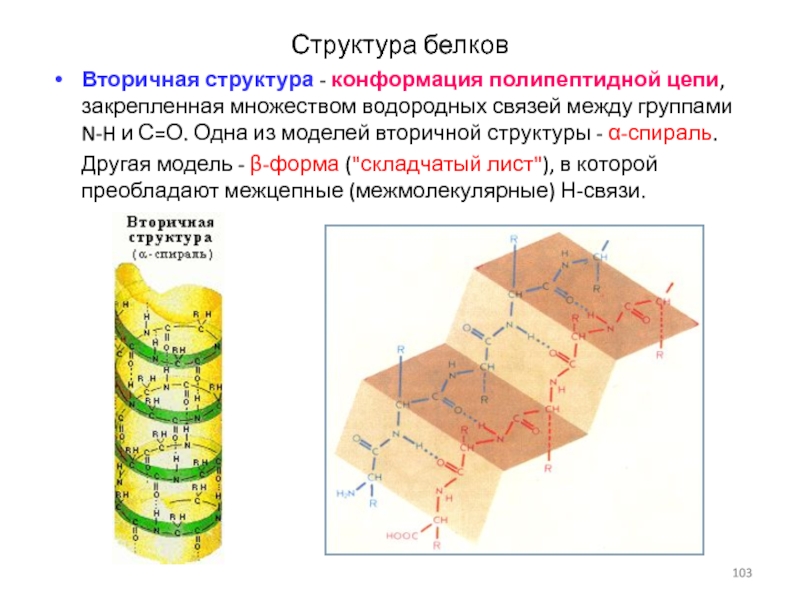
Слайд 103Структура белков
Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных
связей между группами N-H и С=О. Одна из моделей вторичной
структуры - α-спираль.
Другая модель - β-форма ("складчатый лист"), в которой преобладают межцепные (межмолекулярные) Н-связи.
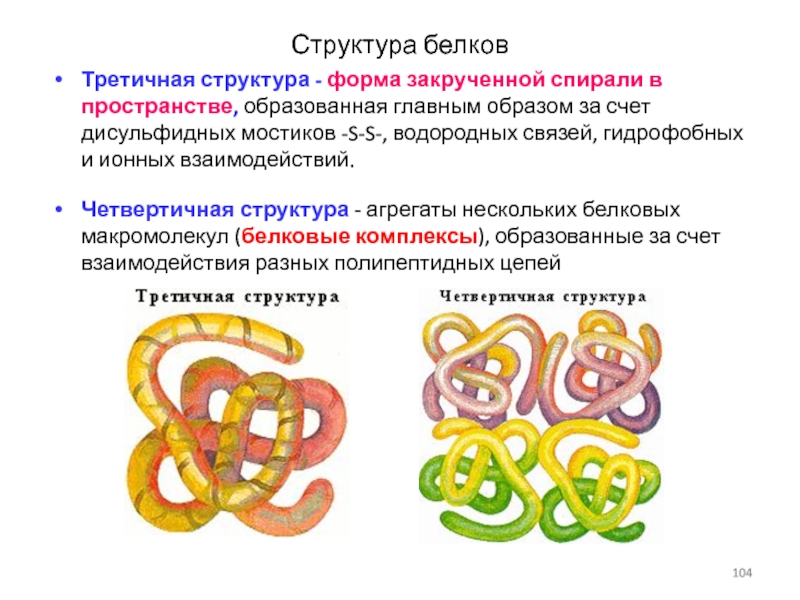
Слайд 104Структура белков
Третичная структура - форма закрученной спирали в пространстве, образованная
главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных
и ионных взаимодействий.
Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей
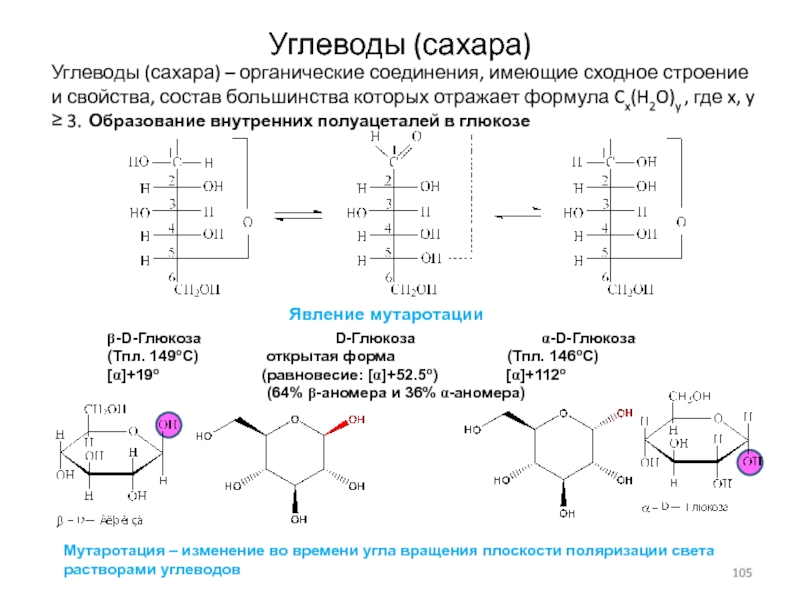
Слайд 105Углеводы (сахара)
Углеводы (сахара) – органические соединения, имеющие сходное строение и
свойства, состав большинства которых отражает формула Cx(H2O)y , где x,
y ≥ 3.
Образование внутренних полуацеталей в глюкозе
b-D-Глюкоза D-Глюкоза a-D-Глюкоза
(Тпл. 149oC) открытая форма (Тпл. 146oC)
[a]+19o (равновесие: [a]+52.5o) [a]+112o
(64% b-аномера и 36% a-аномера)
Явление мутаротации
Мутаротация – изменение во времени угла вращения плоскости поляризации света
растворами углеводов
Слайд 106Углеводы (сахара)
Общеизвестные представители: глюкоза (виноградный сахар) С6Н12О6, сахароза (тростниковый, свекловичный
сахар) С12Н22О11, крахмал и целлюлоза [С6Н10О5]n.
Углеводы содержатся в клетках
растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. Эти соединения образуются растениями в процессе фотосинтеза из углекислого газа и воды при участии хлорофилла. Животные организмы не способны синтезировать углеводы и получают их с растительной пищей.
Фотосинтез можно рассматривать как процесс восстановления СО2 с использованием солнечной энергии. Эта энергия освобождается в животных организмах в результате метаболизма углеводов, который заключается, с химической точки зрения, в их окислении.
Слайд 107Углеводы (сахара)
Основные представители полисахаридов – крахмал и целлюлоза – построены
из остатков одного моносахарида – глюкозы. Крахмал и целлюлоза имеют
одинаковую молекулярную формулу:
(C6H10O5)n, но совершенно различные свойства.
Крахмал – белое аморфное вещество, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер). Крахмал выполняет роль резервного углевода питания, служит источником энергии для реакций обмена веществ в растениях и животных.
Целлюлоза – твердое волокнистое вещество белого цвета, нерастворима в воде и органических растворителях. Волокна целлюлозы обладают высокой механической прочностью. Целлюлоза является основной составной частью стенок клеток растений.
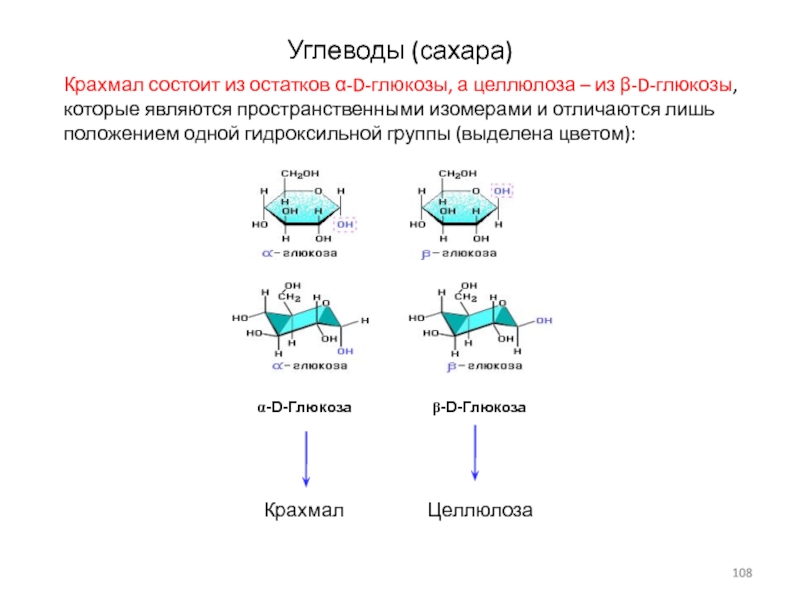
Слайд 108Углеводы (сахара)
Крахмал состоит из остатков α-D-глюкозы, а целлюлоза – из
β-D-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной
гидроксильной группы (выделена цветом):
a-D-Глюкоза
b-D-Глюкоза
Крахмал Целлюлоза
Слайд 109Углеводы (сахара)
Крахмалом называется смесь двух полисахаридов, построенных из остатков циклической
α-D-глюкозы.
В состав крахмала входят:
амилоза (внутренняя часть крахмального зерна) –
10-20%
амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы (средняя мол.масса 160 000) и имеет неразветвленное строение.
Слайд 110Углеводы (сахара)
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит
из 6 звеньев α-глюкозы.
При взаимодействии амилозы с иодом в
водном растворе молекулы иода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения как крахмала, так и иода (иодкрахмальная проба).
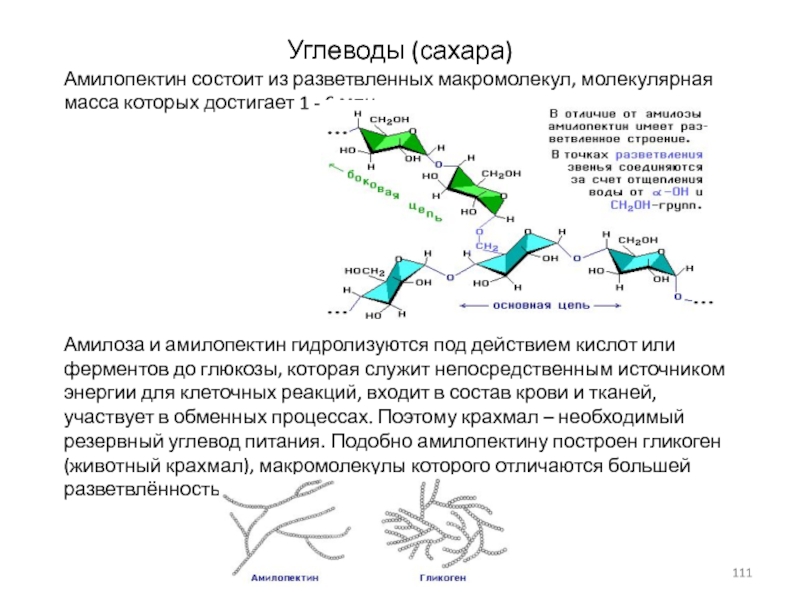
Слайд 111Углеводы (сахара)
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых
достигает 1 - 6 млн.
Амилоза и амилопектин гидролизуются под
действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания. Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
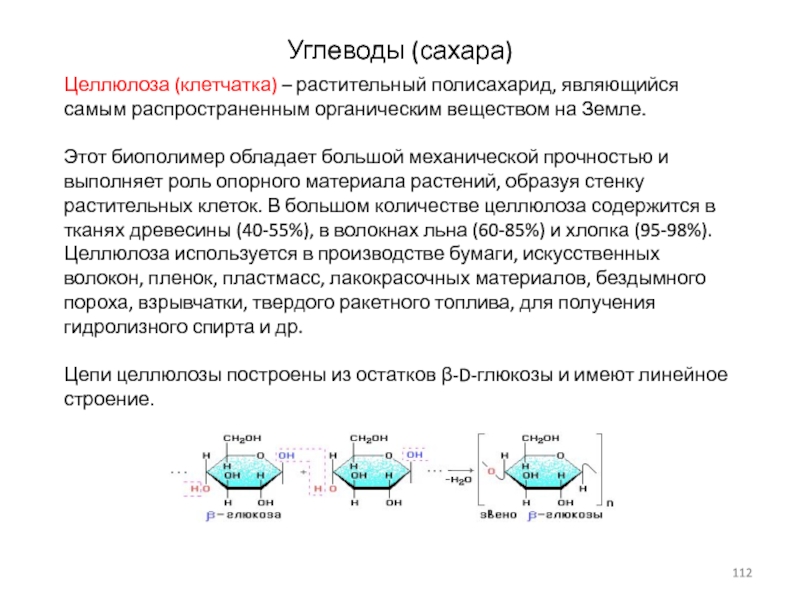
Слайд 112Углеводы (сахара)
Целлюлоза (клетчатка) – растительный полисахарид, являющийся самым распространенным органическим
веществом на Земле.
Этот биополимер обладает большой механической прочностью и
выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%).
Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и др.
Цепи целлюлозы построены из остатков β-D-глюкозы и имеют линейное строение.
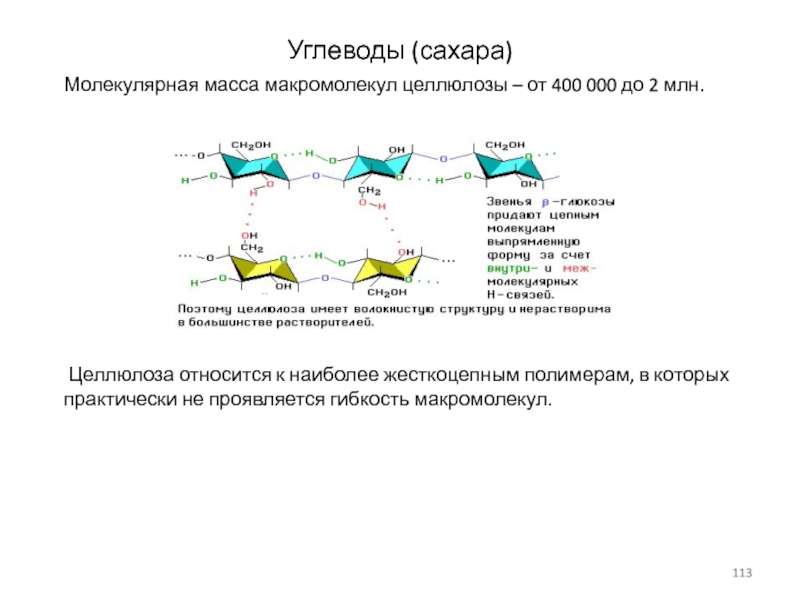
Слайд 113Углеводы (сахара)
Молекулярная масса макромолекул целлюлозы – от 400 000 до
2 млн.
Целлюлоза относится к наиболее жесткоцепным полимерам, в которых
практически не проявляется гибкость макромолекул.
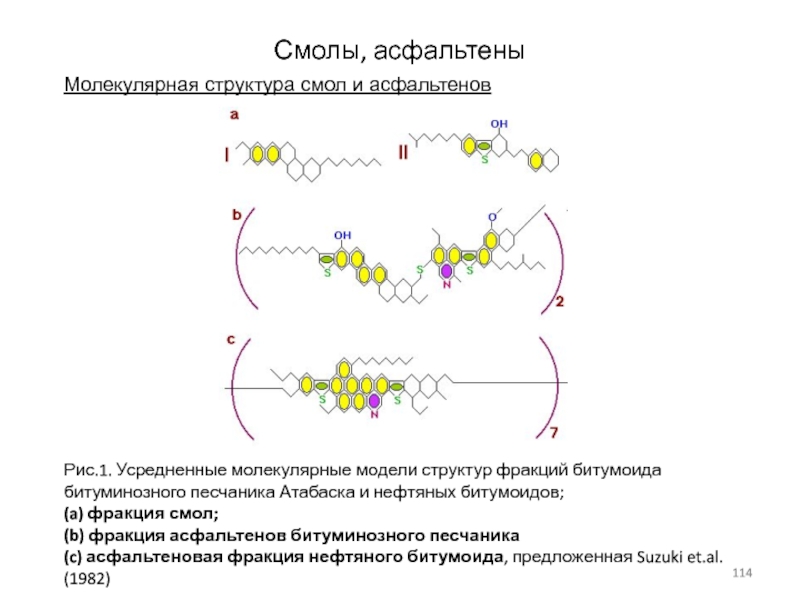
Слайд 114Смолы, асфальтены
Молекулярная структура смол и асфальтенов
Рис.1. Усредненные молекулярные модели структур
фракций битумоида битуминозного песчаника Атабаска и нефтяных битумоидов;
(a) фракция смол;
(b) фракция асфальтенов битуминозного песчаника
(c) асфальтеновая фракция нефтяного битумоида, предложенная Suzuki et.al. (1982)
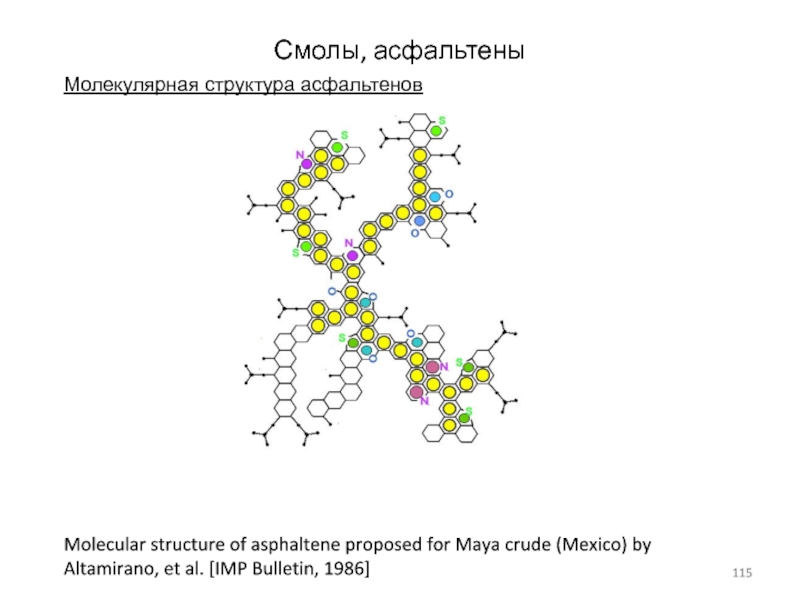
Слайд 115Смолы, асфальтены
Молекулярная структура асфальтенов
Molecular structure of asphaltene proposed for Maya
crude (Mexico) by Altamirano, et al. [IMP Bulletin, 1986]
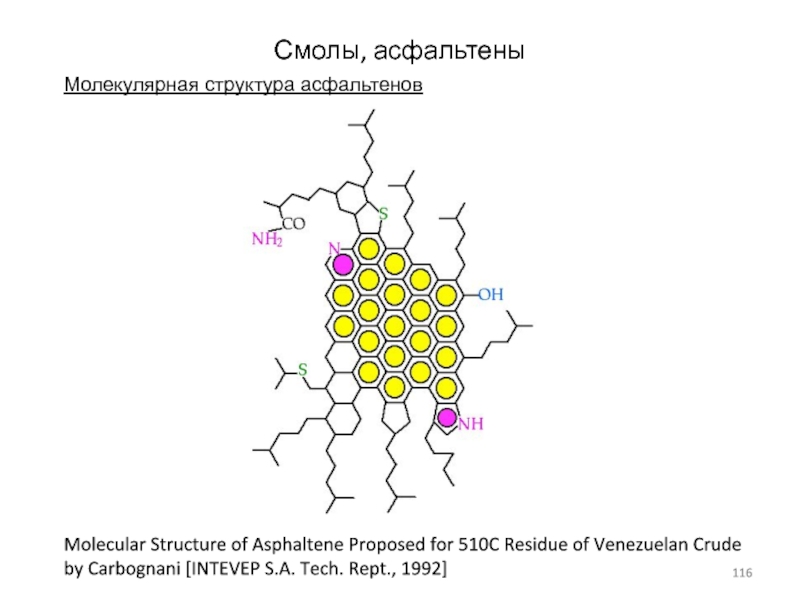
Слайд 116Смолы, асфальтены
Молекулярная структура асфальтенов
Molecular Structure of Asphaltene Proposed for 510C
Residue of Venezuelan Crude by Carbognani [INTEVEP S.A. Tech. Rept.,
1992]




![Часть 6
Кислород-, серо-, азот-содержащие соединения Некоторые физические константы алифатических предельных спиртов (CnH2n+1OH)[K3] Показатель измерен при 22°C[K4] Показатель измерен при 40°C Некоторые физические константы алифатических предельных спиртов (CnH2n+1OH)[K3] Показатель измерен при 22°C[K4] Показатель измерен при 40°C](/img/thumbs/f1a54b85cfb480173d8c4ac7a46896f5-800x.jpg)








![Часть 6
Кислород-, серо-, азот-содержащие соединения Карбоновые кислотыСодержание транс-изомеров жирных кислот в различных жирахТаблица.[2]*) Спреды - масла Карбоновые кислотыСодержание транс-изомеров жирных кислот в различных жирахТаблица.[2]*) Спреды - масла комбинированные, сделанные из молочного жира (коровьего](/img/tmb/4/341282/812ef6cefbda6c2c9428b8fe71995796-800x.jpg)








![Часть 6
Кислород-, серо-, азот-содержащие соединения Углеводы (сахара)Общеизвестные представители: глюкоза (виноградный сахар) С6Н12О6, сахароза (тростниковый, свекловичный сахар) Углеводы (сахара)Общеизвестные представители: глюкоза (виноградный сахар) С6Н12О6, сахароза (тростниковый, свекловичный сахар) С12Н22О11, крахмал и целлюлоза [С6Н10О5]n. Углеводы](/img/thumbs/3a0b32e711135b60f646ef731db9b173-800x.jpg)