Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
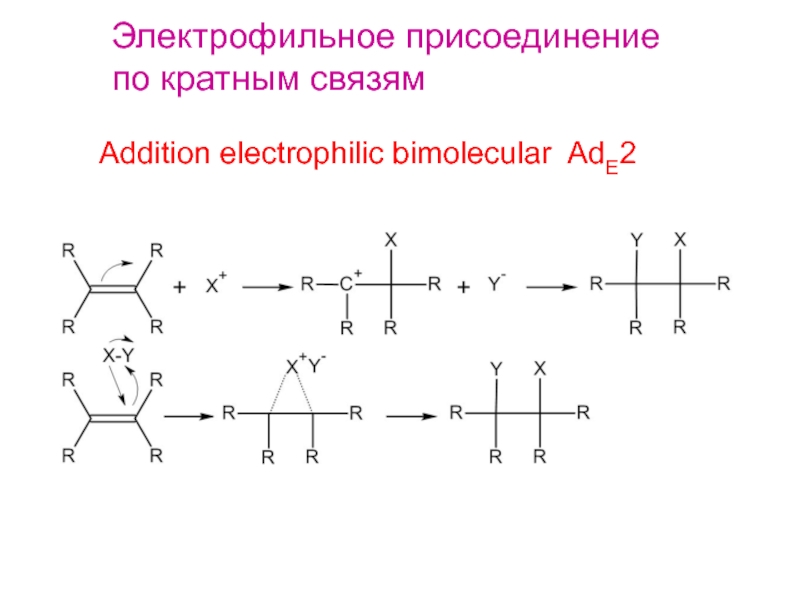
Электрофильное присоединение по кратным связям
Содержание
- 1. Электрофильное присоединение по кратным связям
- 2. Электрофильное присоединениепо кратным связямAddition electrophilic bimolecular AdE2
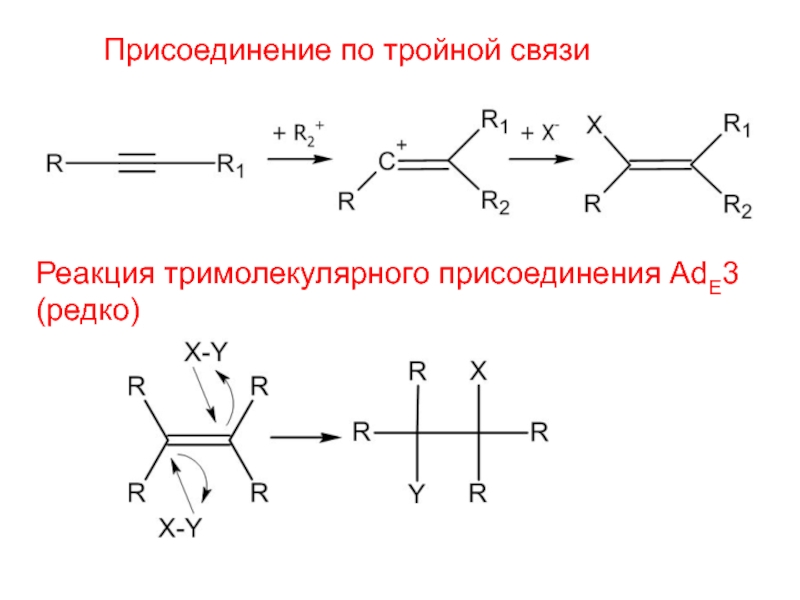
- 3. Присоединение по тройной связиРеакция тримолекулярного присоединения AdE3(редко)
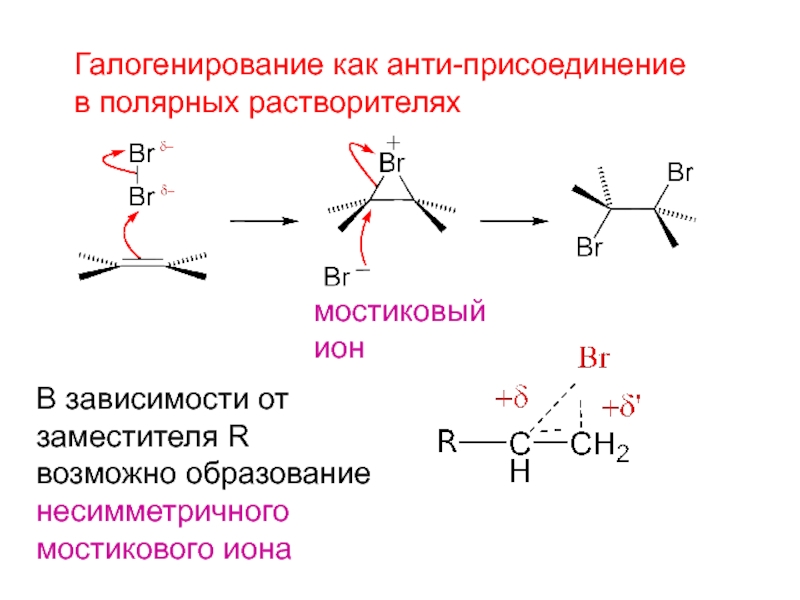
- 4. Галогенирование как анти-присоединениев полярных растворителяхВ зависимости отзаместителя Rвозможно образованиенесимметричногомостикового ионамостиковыйион
- 5. РСА галогенониевых ионов (длины связей в ангстремах)Асимметриябольше,
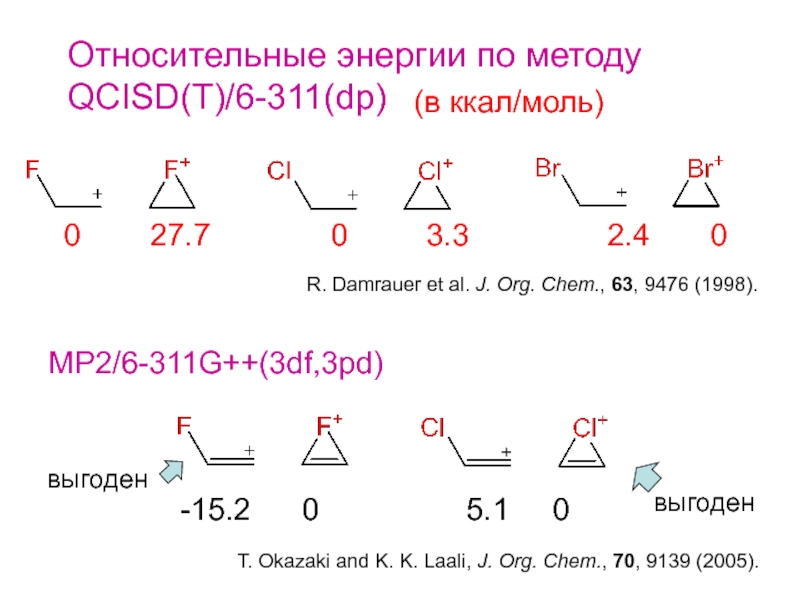
- 6. Относительные энергии по методу QCISD(T)/6-311(dp) 0
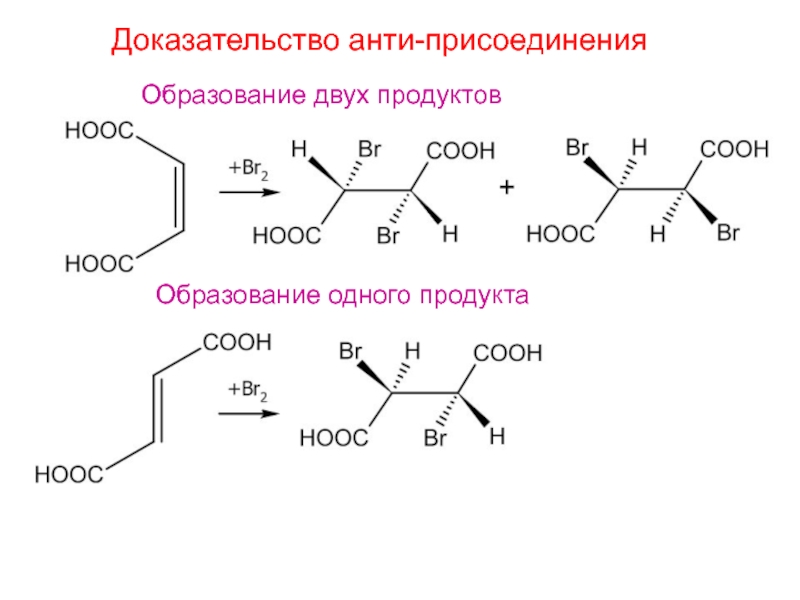
- 7. Доказательство анти-присоединенияОбразование двух продуктовОбразование одного продукта
- 8. Влияние полярности растворителяPr-CH=CH2 + Br2
- 9. КинетикаХлорирование (обычно второго порядка):w = k [RRC=CRR] [Cl2 ]Бромирование ( более сложный процесс):π-комплексСимметричныйбромониевыйионАсимимметричныйбромониевыйион
- 10. w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR]
- 11. Модели участия Br –(третий порядок) :F.A. Carroll.
- 12. Присоединение галогенводородовподчиняется правилу МорковниковаR - донорЕсли R
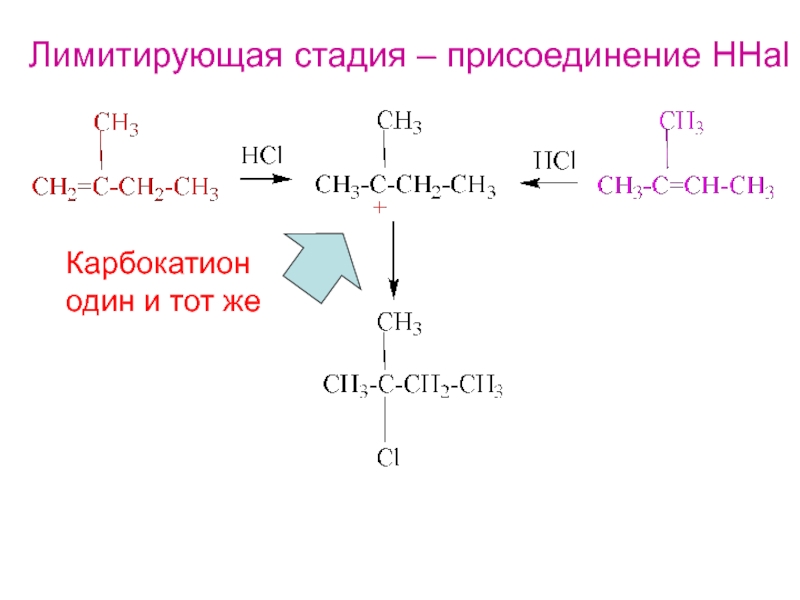
- 13. Лимитирующая стадия – присоединение HHalКарбокатионодин и тот же
- 14. Обычно осуществляется анти-присоединение HHal, к син-присоединению склонны стирол, инден, аценафтилен и их производные
- 15. Типичные реакции электрофильного присоединения:1. Гидратация. 2. Присоединение
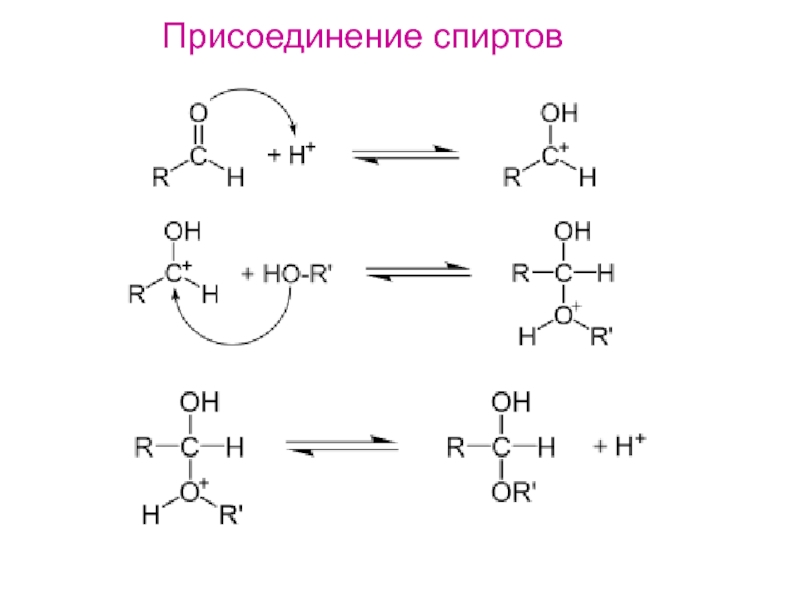
- 16. Присоединение спиртов
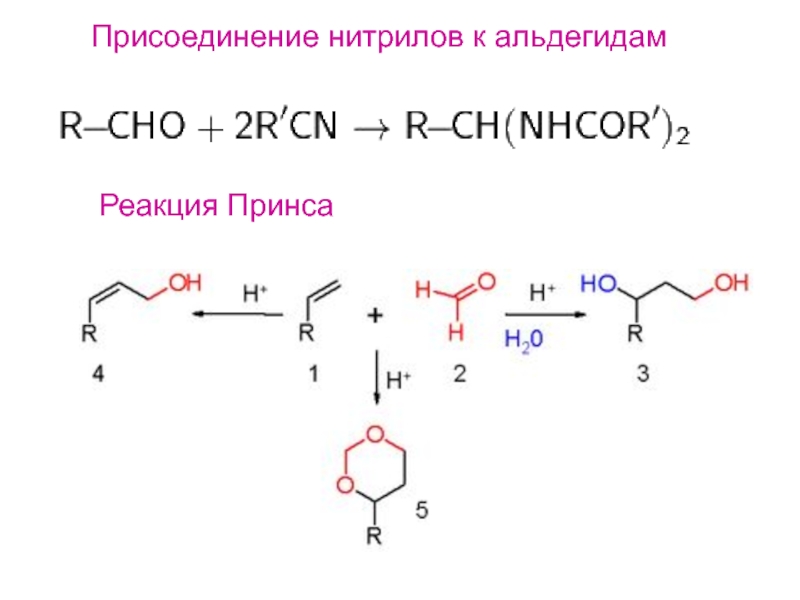
- 17. Присоединение нитрилов к альдегидамРеакция Принса
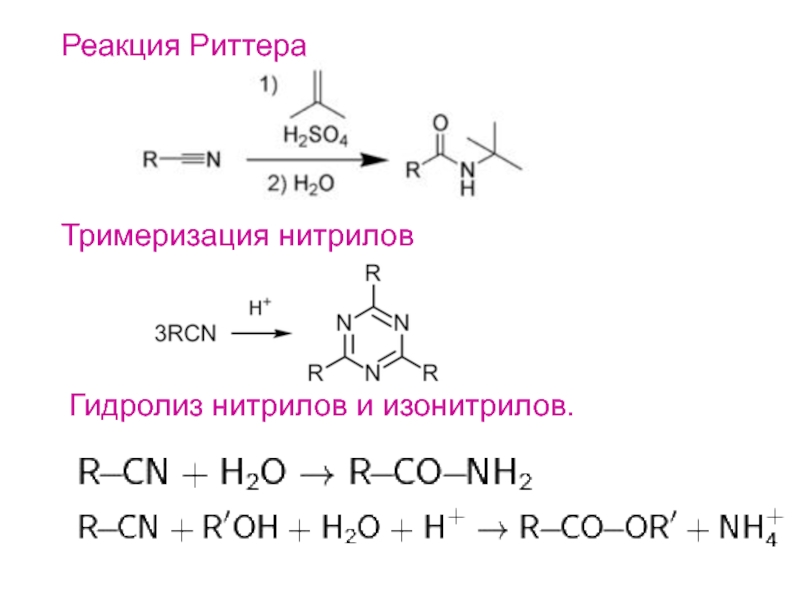
- 18. Реакция РиттераТримеризация нитрилов Гидролиз нитрилов и изонитрилов.
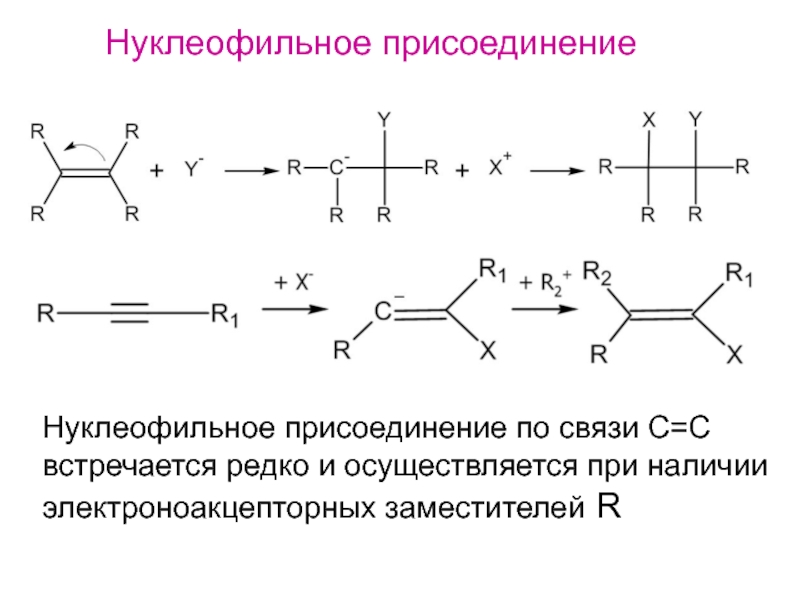
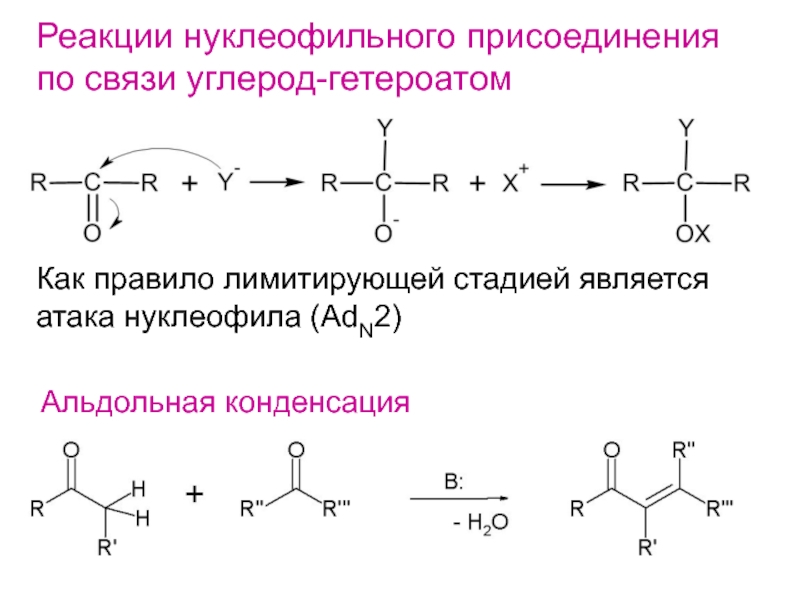
- 19. Нуклеофильное присоединениеНуклеофильное присоединение по связи С=Cвстречается редко и осуществляется при наличииэлектроноакцепторных заместителей R
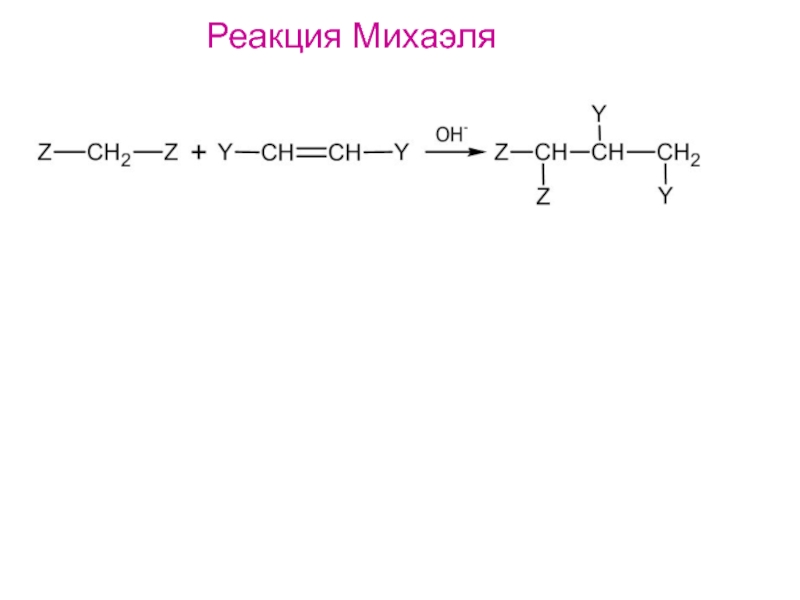
- 20. Реакция Михаэля
- 21. Реакции нуклеофильного присоединенияпо связи углерод-гетероатомКак правило лимитирующей стадией являетсяатака нуклеофила (AdN2)Альдольная конденсация
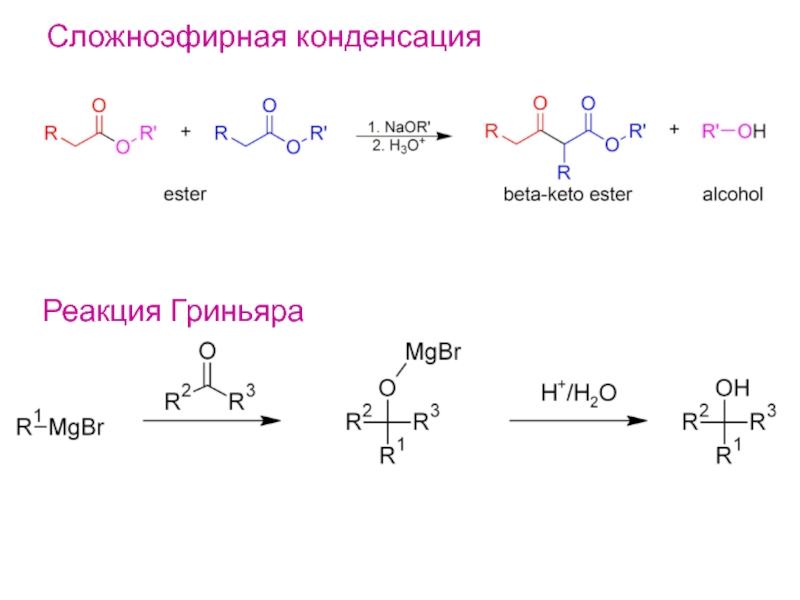
- 22. Сложноэфирная конденсацияРеакция Гриньяра
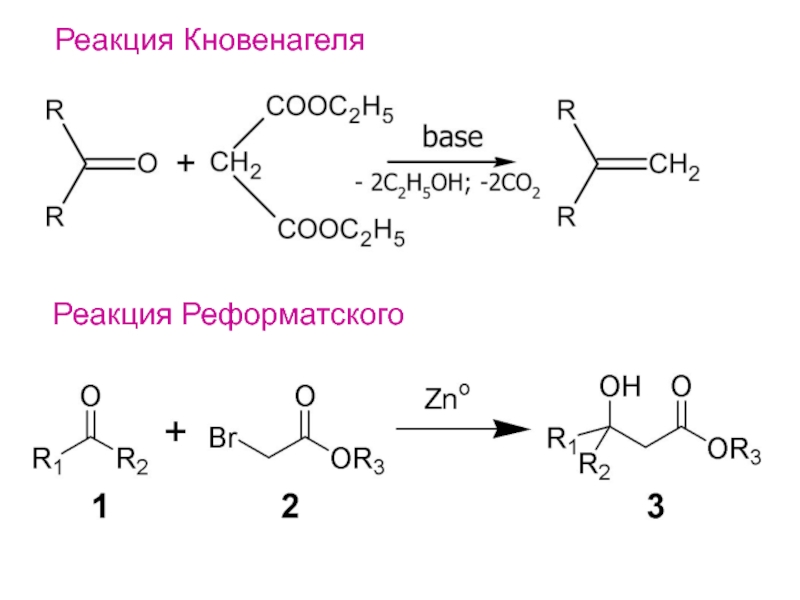
- 23. Реакция РеформатскогоРеакция Кновенагеля
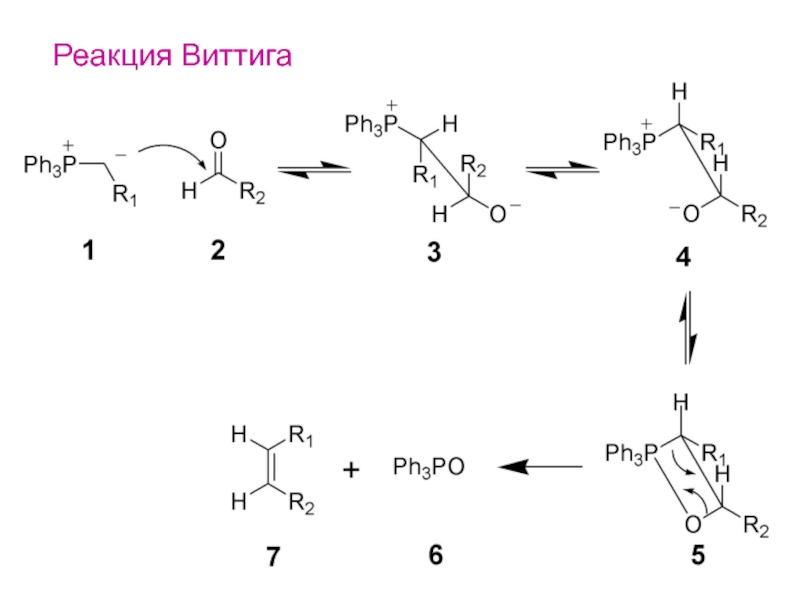
- 24. Реакция Виттига
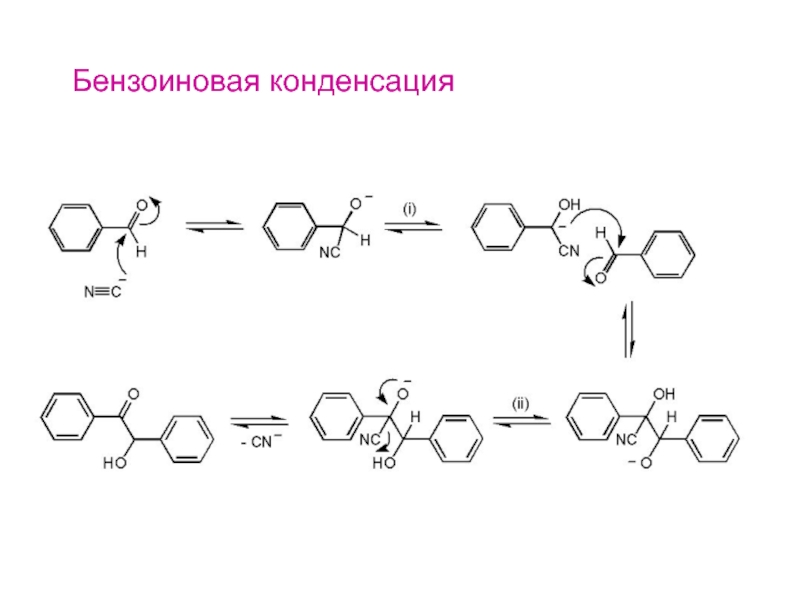
- 25. Бензоиновая конденсация
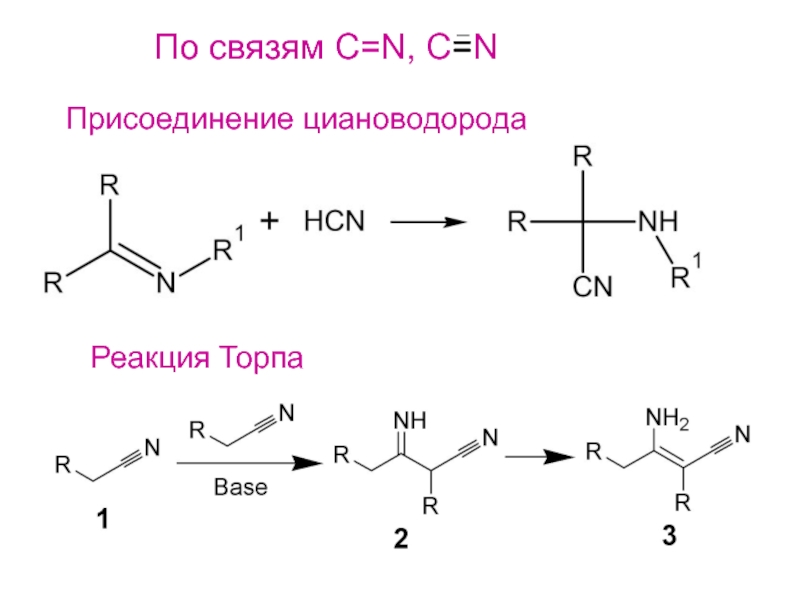
- 26. По связям С=N, C=NПрисоединение циановодородаРеакция Торпа
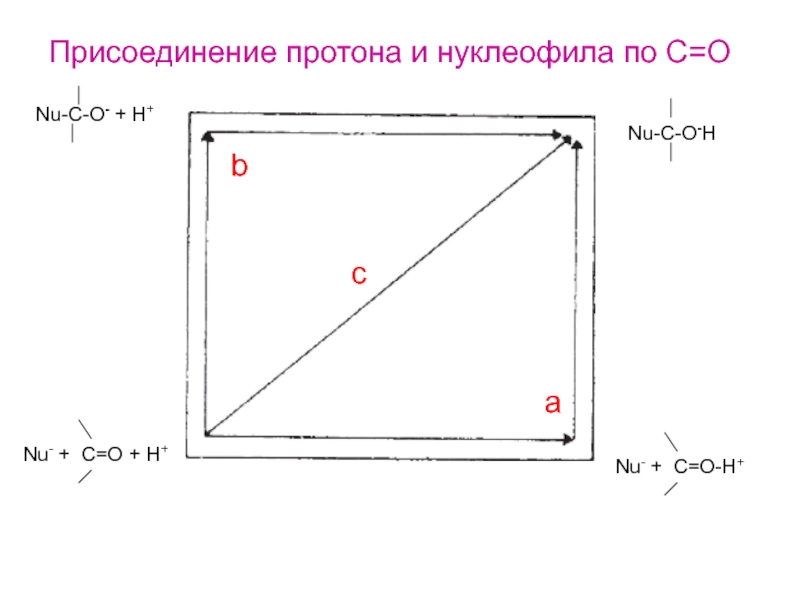
- 27. Nu-C-O- + H+Nu-C-O-HNu- + C=O + H+Nu- + C=O-H+acbПрисоединение протона и нуклеофила по С=О
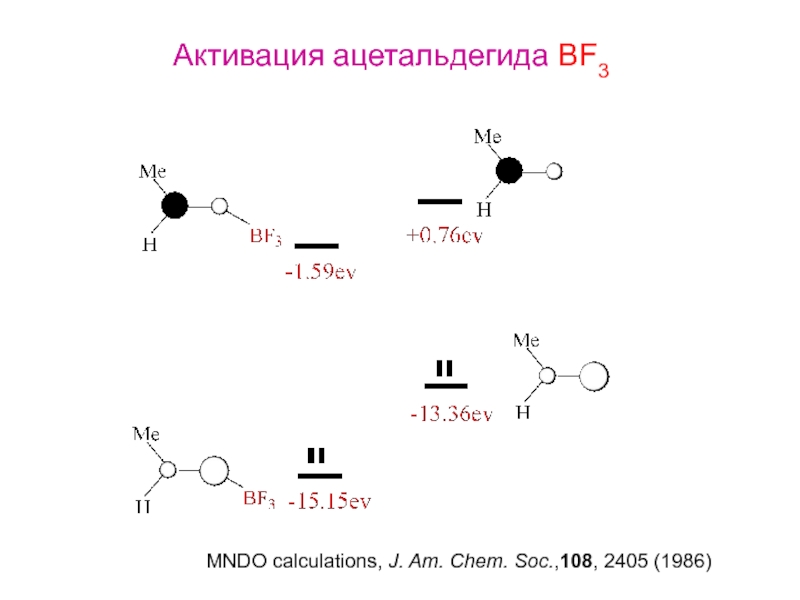
- 28. Активация ацетальдегида BF3MNDO calculations, J. Am. Chem. Soc.,108, 2405 (1986)
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Теоретические основы органической
химии
Электрофильное присоединение
по кратным связям
Лекция 32
(электронно-лекционный курс)
Проф. Бородкин Г.И.
Слайд 4Галогенирование как анти-присоединение
в полярных растворителях
В зависимости от
заместителя R
возможно образование
несимметричного
мостикового иона
мостиковый
ион
Слайд 5РСА галогенониевых ионов
(длины связей в ангстремах)
Асимметрия
больше, чем
для бромониевых
иодониевых
ионов
Brown et al. J. Am. Chem. Soc., 116, 2448 (1994).Слайд 6Относительные энергии по методу QCISD(T)/6-311(dp)
0
27.7 0
3.3 2.4 0(в ккал/моль)
R. Damrauer et al. J. Org. Chem., 63, 9476 (1998).
MP2/6-311G++(3df,3pd)
-15.2 0 5.1 0
T. Okazaki and K. K. Laali, J. Org. Chem., 70, 9139 (2005).
выгоден
выгоден
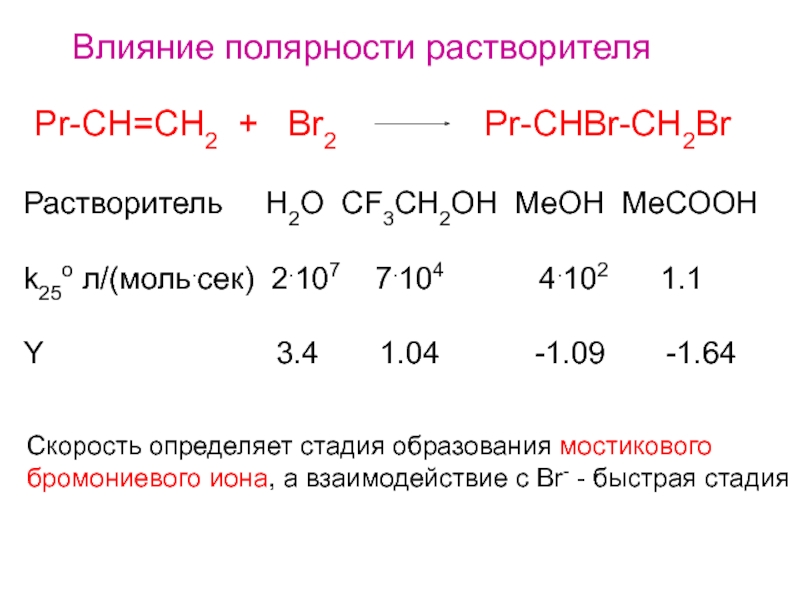
Слайд 8Влияние полярности растворителя
Pr-CH=CH2 + Br2
Pr-CHBr-CH2Br
Растворитель H2O CF3CH2OH MeOH MeCOOH
k25o
л/(моль.сек) 2.107 7.104 4.102 1.1Y 3.4 1.04 -1.09 -1.64
Скорость определяет стадия образования мостикового
бромониевого иона, а взаимодействие с Br- - быстрая стадия
Слайд 9Кинетика
Хлорирование (обычно второго порядка):
w = k [RRC=CRR] [Cl2 ]
Бромирование (
более сложный процесс):
π-комплекс
Симметричный
бромониевый
ион
Асимимметричный
бромониевый
ион
Слайд 10
w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR] [Br2]2
+ k3[RRC=CRR][Br2][Br
-]
Кинетика бромирования
В MeOH – псевдовторого порядка (при
высоких [Br-] важен вклад
3-его члена)J.-E. Dubois and G. Mouvier,
Tetrahedron Lett., 1325 (1963)
В неполярных растворителях – важен вклад
1-ого и 2-ого членов
G. Bellucci et al. J. Org. Chem., 50, 3313 (1985)
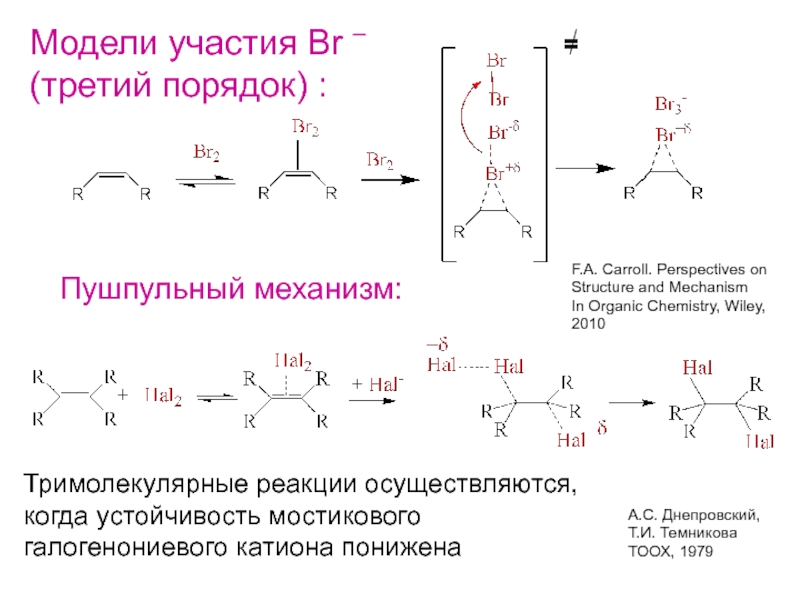
Слайд 11Модели участия Br –
(третий порядок) :
F.A. Carroll. Perspectives on
Structure and
Mechanism
In Organic Chemistry, Wiley,
2010
Пушпульный механизм:
=
А.С. Днепровский,
Т.И. Темникова
ТООХ, 1979
Тримолекулярные реакции
осуществляются,когда устойчивость мостикового
галогенониевого катиона понижена
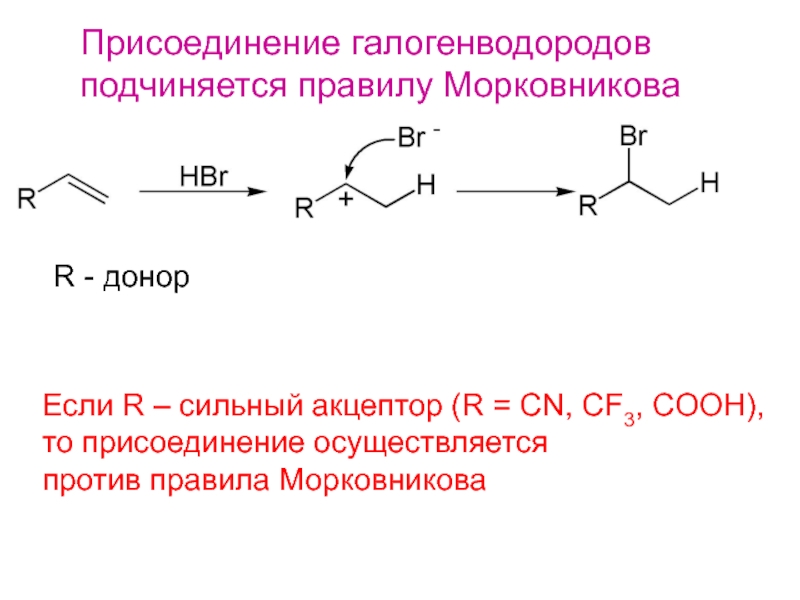
Слайд 12Присоединение галогенводородов
подчиняется правилу Морковникова
R - донор
Если R – сильный акцептор
(R = СN, СF3, COOH),
то присоединение осуществляется
против правила Морковникова
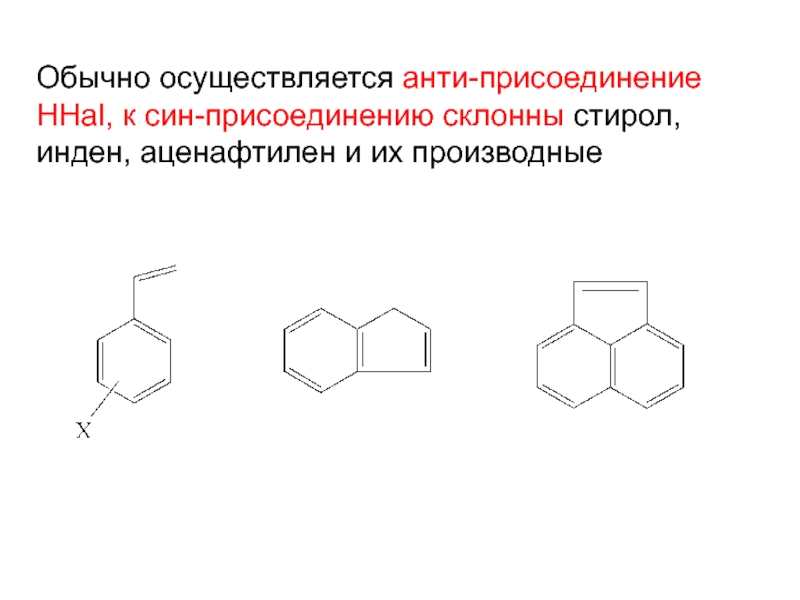
Слайд 14Обычно осуществляется анти-присоединение HHal, к син-присоединению склонны стирол, инден, аценафтилен
и их производные
Слайд 15Типичные реакции электрофильного присоединения:
1. Гидратация.
2. Присоединение спирта2. Присоединение спирта
с образованием простого эфира.
3. Присоединение хлорноватистой кислоты с
образованием хлоргидринов.4. Присоединение хлорангидридов и/или карбоновых кислот.
5. Присоединение аммиака и/или аминов.
6. Карбонилирование.
.


![Электрофильное присоединение по кратным связям КинетикаХлорирование (обычно второго порядка):w = k [RRC=CRR] [Cl2 ]Бромирование ( более сложный процесс):π-комплексСимметричныйбромониевыйионАсимимметричныйбромониевыйион КинетикаХлорирование (обычно второго порядка):w = k [RRC=CRR] [Cl2 ]Бромирование ( более сложный процесс):π-комплексСимметричныйбромониевыйионАсимимметричныйбромониевыйион](/img/thumbs/599e21df5b92ed7fc096bede4e091c51-800x.jpg)
![Электрофильное присоединение по кратным связям w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR] [Br2]2 + k3[RRC=CRR][Br2][Br -]Кинетика w = k1[RRC=CRR] [Br2] + k2 [RRC=CRR] [Br2]2 + k3[RRC=CRR][Br2][Br -]Кинетика бромированияВ MeOH – псевдовторого порядка (привысоких](/img/thumbs/12b68fdc5624940dcd65c7a7038db1df-800x.jpg)