Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
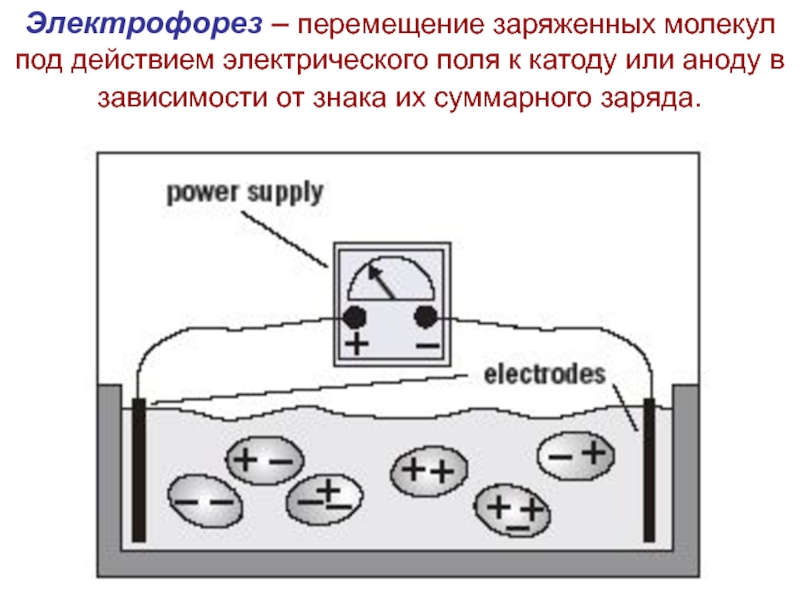
Электрофорез – перемещение заряженных молекул под действием электрического поля
Содержание
- 1. Электрофорез – перемещение заряженных молекул под действием электрического поля
- 2. z - заряд частицыE - напряженность электрического
- 3. Классификация электрофоретических методов разделенияПо характеру движения зоныэлектрофорез
- 4. Классификация электрофоретических методов разделенияПо форме и расположению
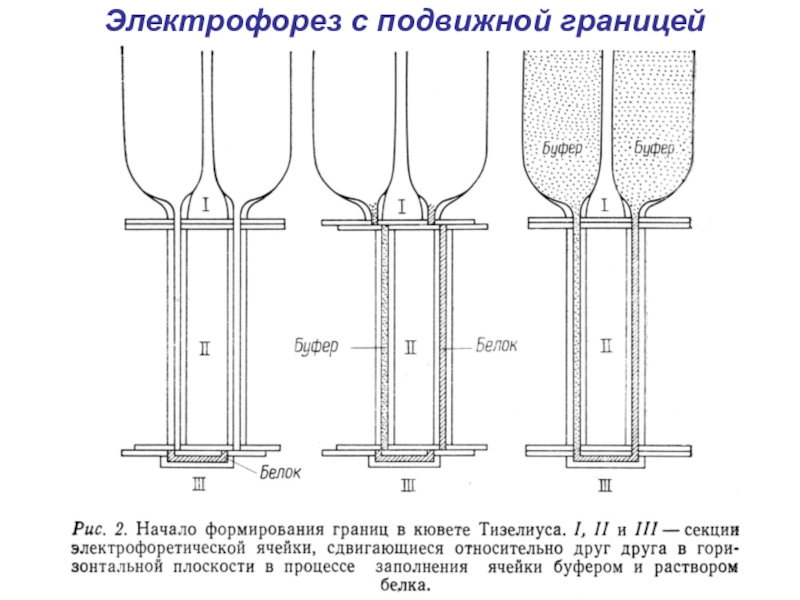
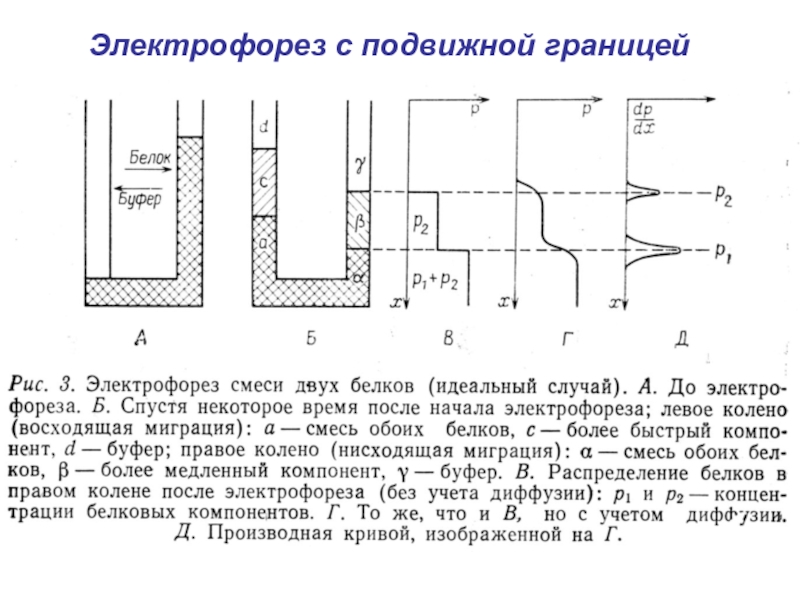
- 5. Электрофорез с подвижной границей
- 6. Электрофорез с подвижной границей
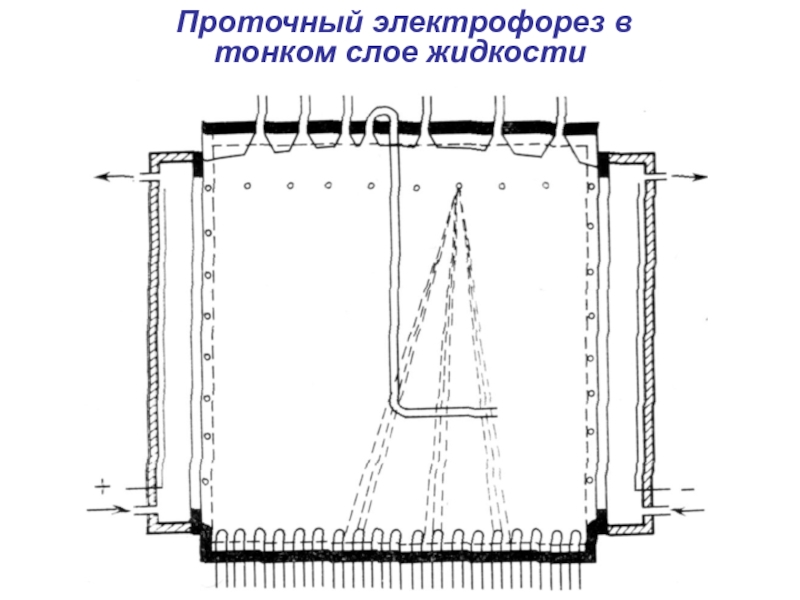
- 7. Проточный электрофорез в тонком слое жидкости
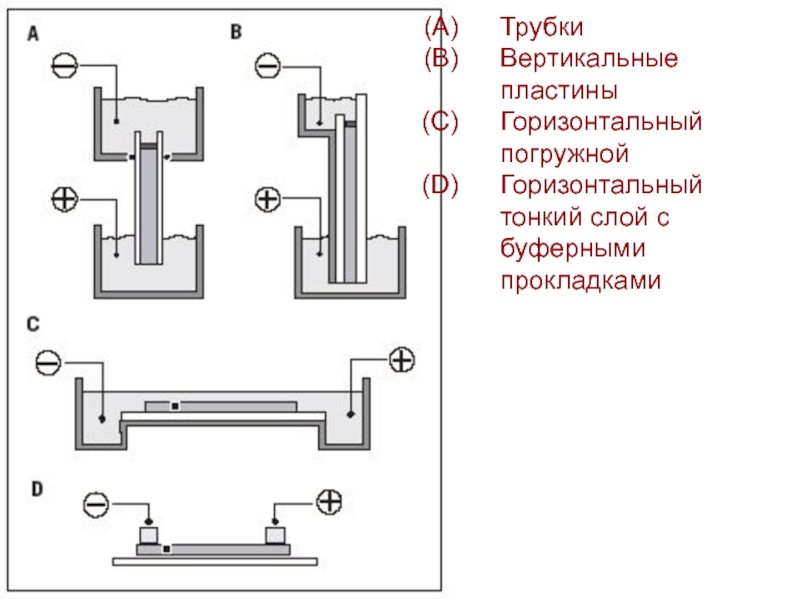
- 8. ТрубкиВертикальные пластины Горизонтальный погружнойГоризонтальный тонкий слой с буферными прокладками
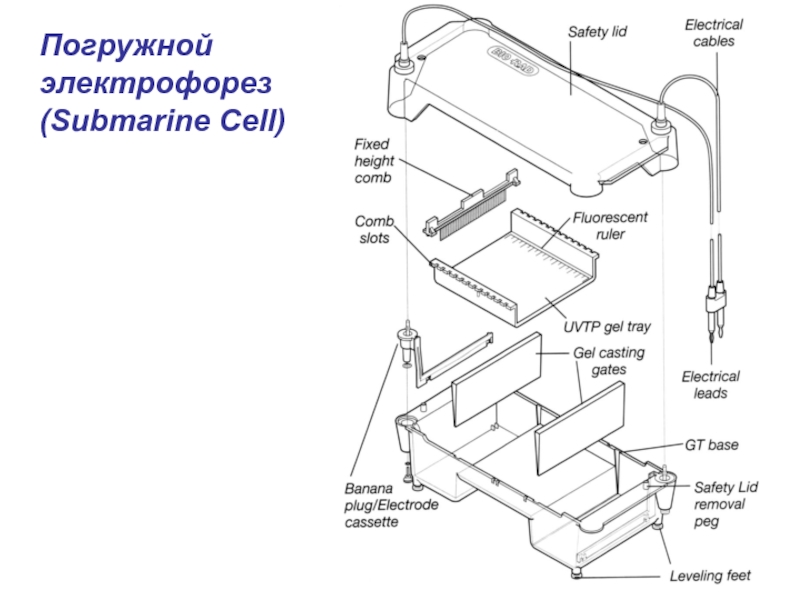
- 9. Погружной электрофорез(Submarine Cell)
- 10. Загрузка образцов в «колодцы». Три различных методаГоризонтальный
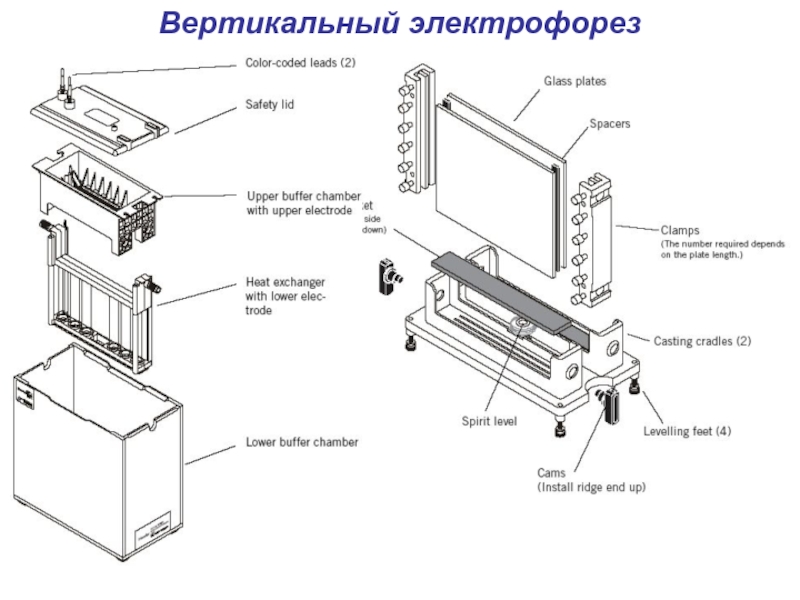
- 11. Вертикальный электрофорез
- 12. Вертикальный электрофорезФормирование карманов и загрузка образцов
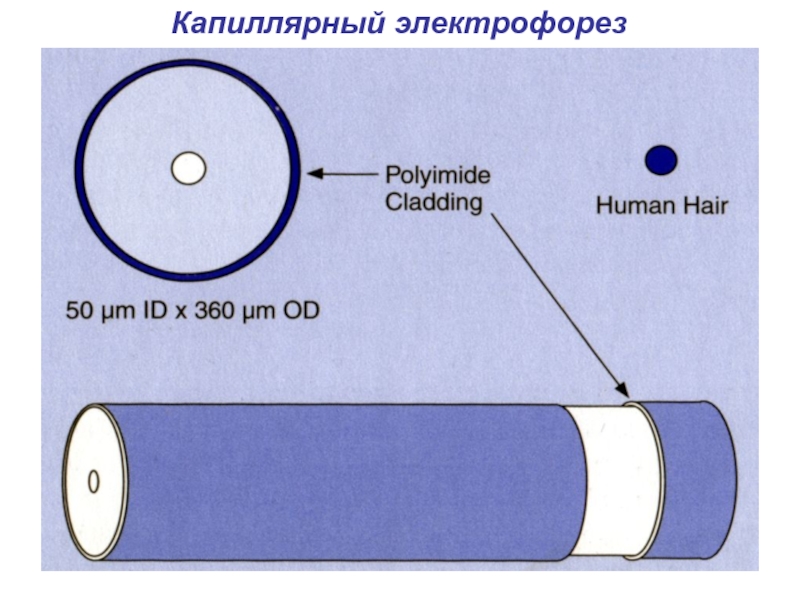
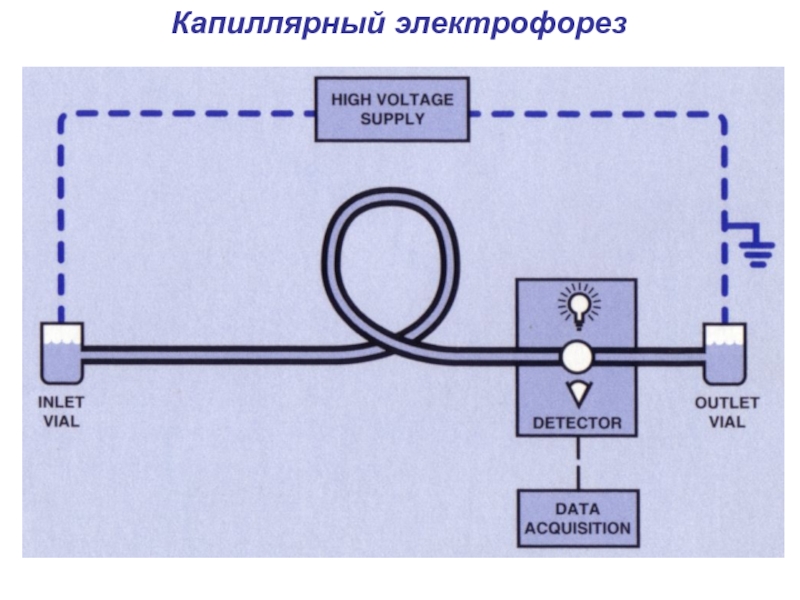
- 13. Капиллярный электрофорез
- 14. Капиллярный электрофорез
- 15. Электрофорез в агарозном гелеФормирование агарозного геля. А
- 16. Полиакриламидный гельCH2=CH-CONH2CH2=CH-CO OC-CH=CH2
- 17. Агарозный и полиакриламидный гели(A) Agarose gels form
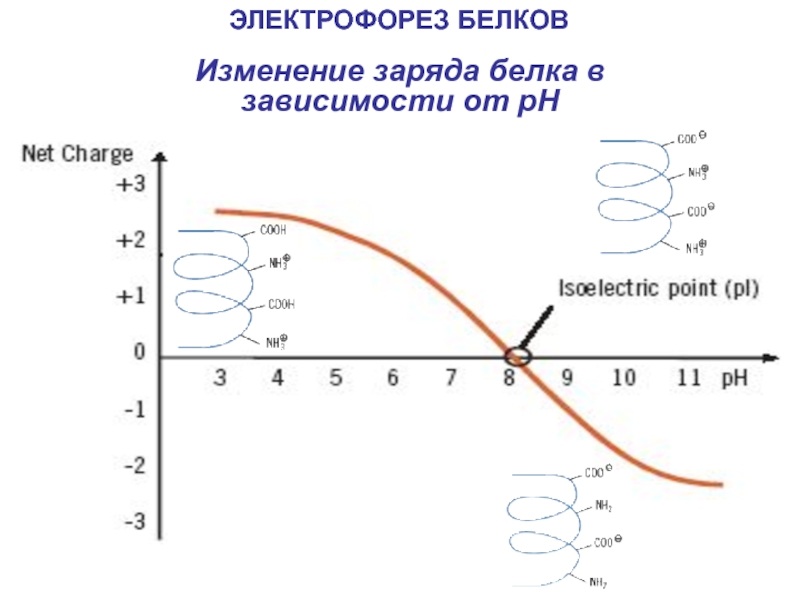
- 18. Изменение заряда белка в зависимости от pHЭЛЕКТРОФОРЕЗ БЕЛКОВ
- 19. Изоэлектрическое фокусированиеАмфолиты должны отвечать следующим требованиям:отсутствие взаимодействия
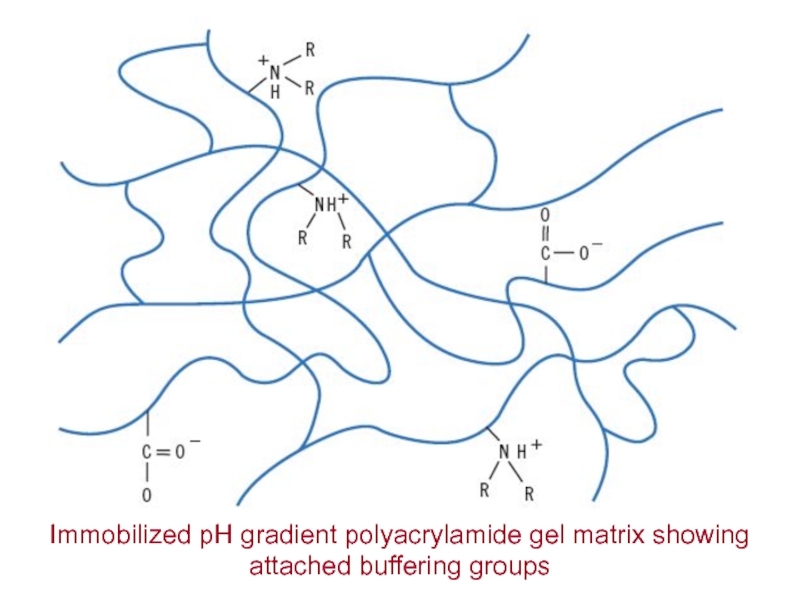
- 20. Immobilized pH gradient polyacrylamide gel matrix showing attached buffering groups
- 21. Схематическое изображение концентраций ионов в условиях изотахофорезаИоны
- 22. Диск-электрофорезА. Начало электрофорезаБ. Белки в концентрирующем гелеВ. Белки в процессе разделения
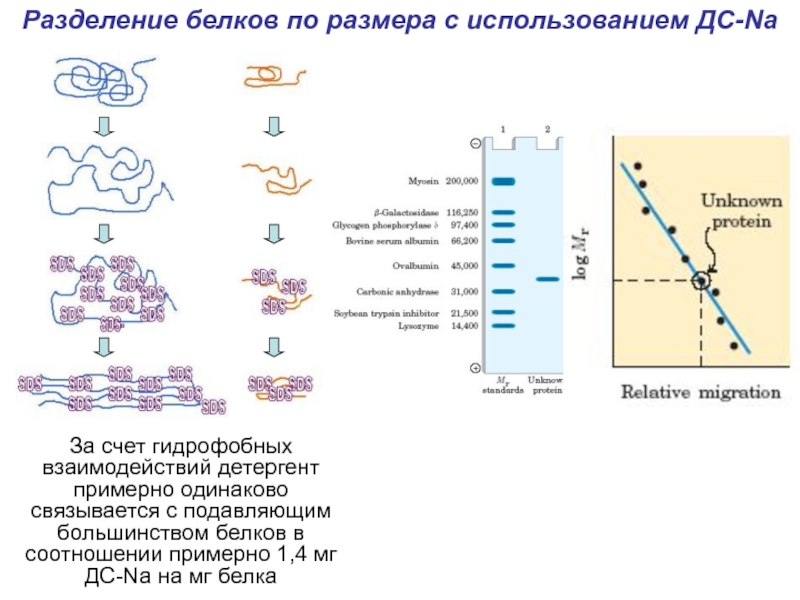
- 23. Разделение белков по размера с использованием ДС-NaЗа
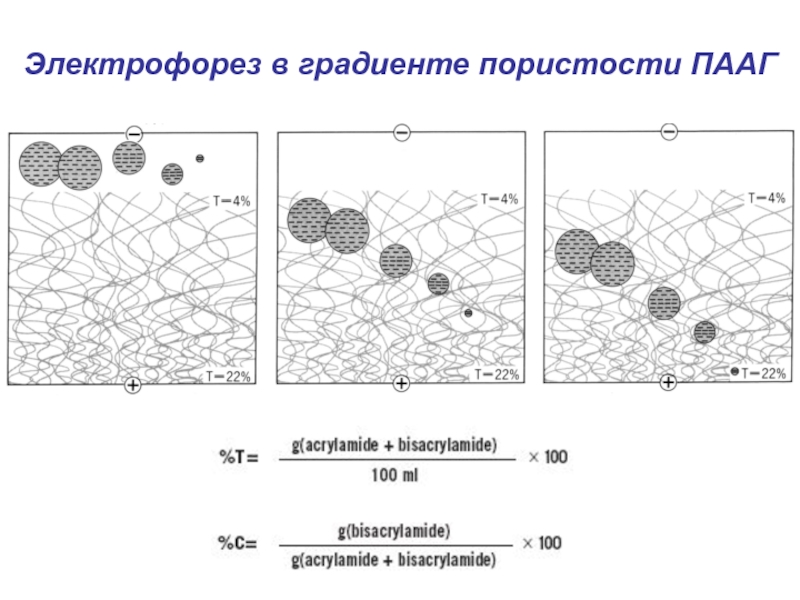
- 24. Электрофорез в градиенте пористости ПААГ
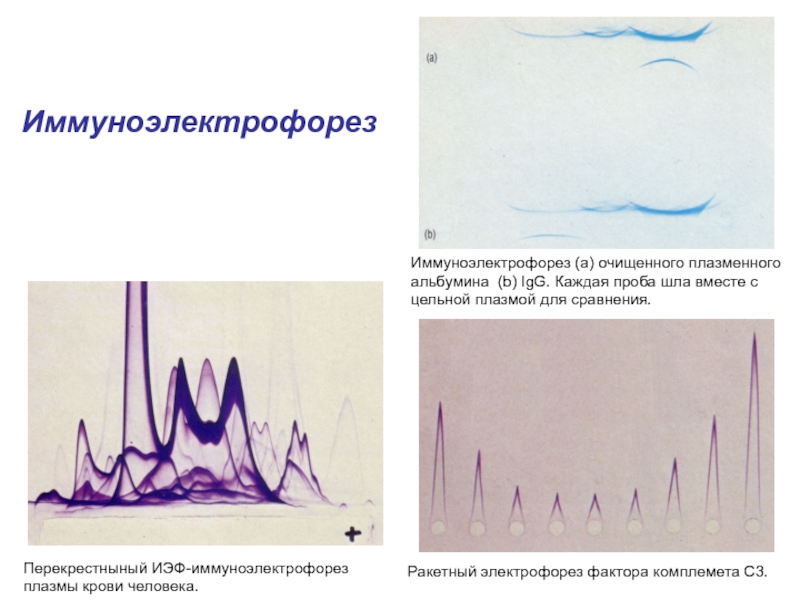
- 25. Иммуноэлектрофорез (а) очищенного плазменного альбумина (b) IgG.
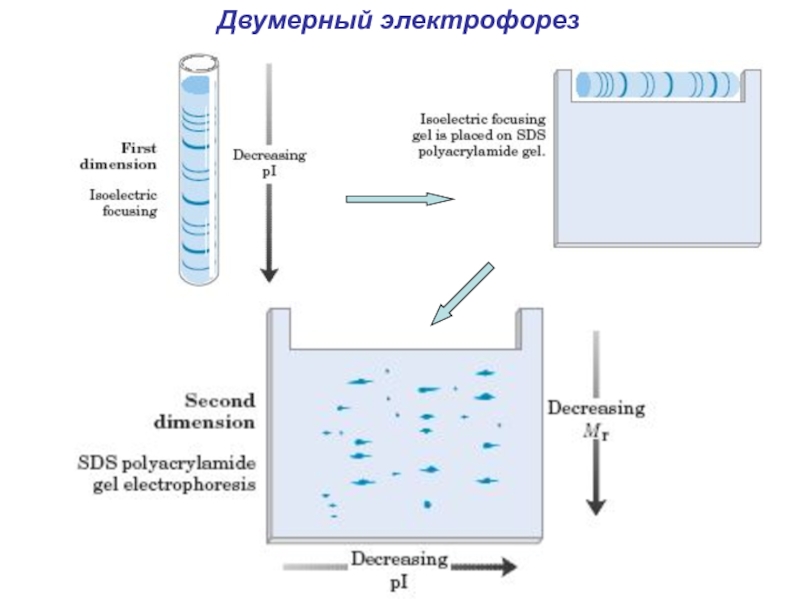
- 26. Двумерный электрофорез
- 27. Двумерный электрофорез
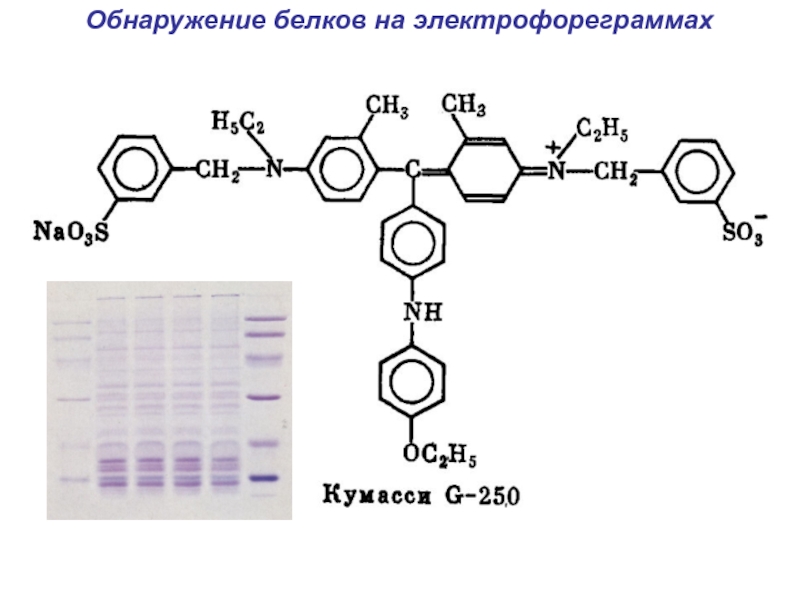
- 28. Обнаружение белков на электрофореграммах
- 29. ЭЛЕКТРОФОРЕЗ НУКЛЕИНОВЫХ КИСЛОТ
- 30. Поведение разных форм НК в гелеПоведение нуклеиновых
- 31. Поведение разных форм НК в геле2. Кольцевые
- 32. Скорость миграции линейных двунитевых молекул ДНК уменьшается
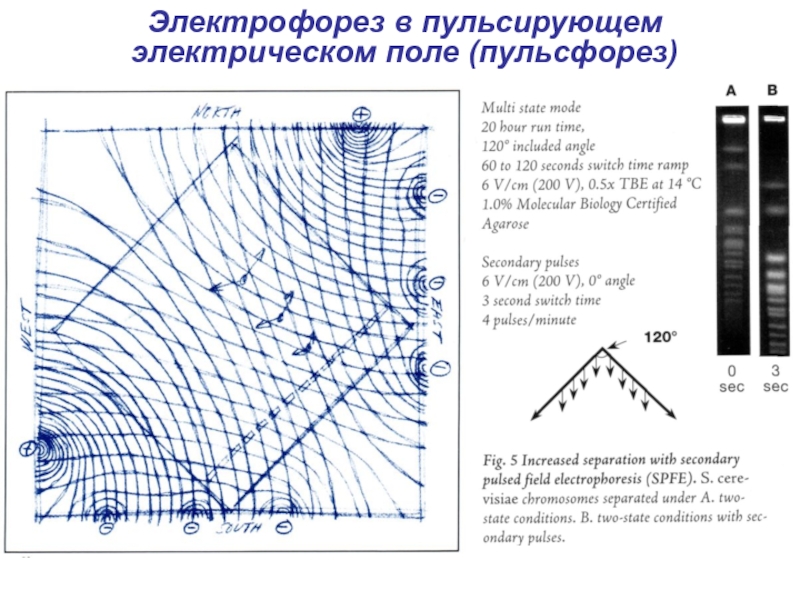
- 33. Электрофорез в пульсирующем электрическом поле (пульсфорез)
- 34. Two different fields are applied, using the
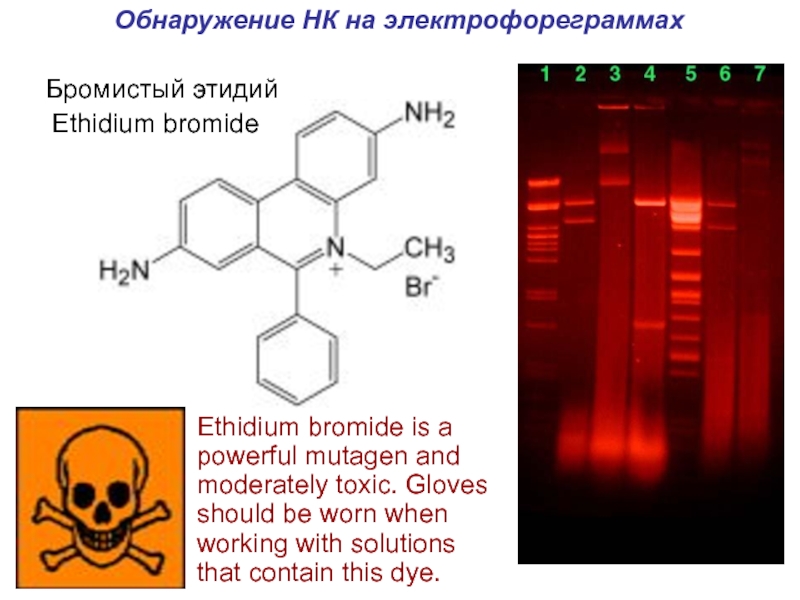
- 35. Обнаружение НК на электрофореграммахEthidium bromideEthidium bromide is
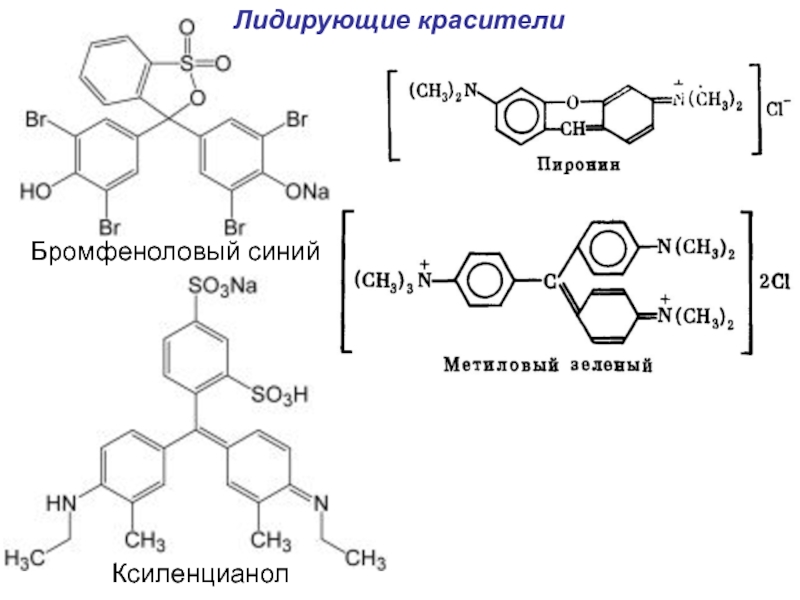
- 36. Бромфеноловый синийКсиленцианол Лидирующие красители
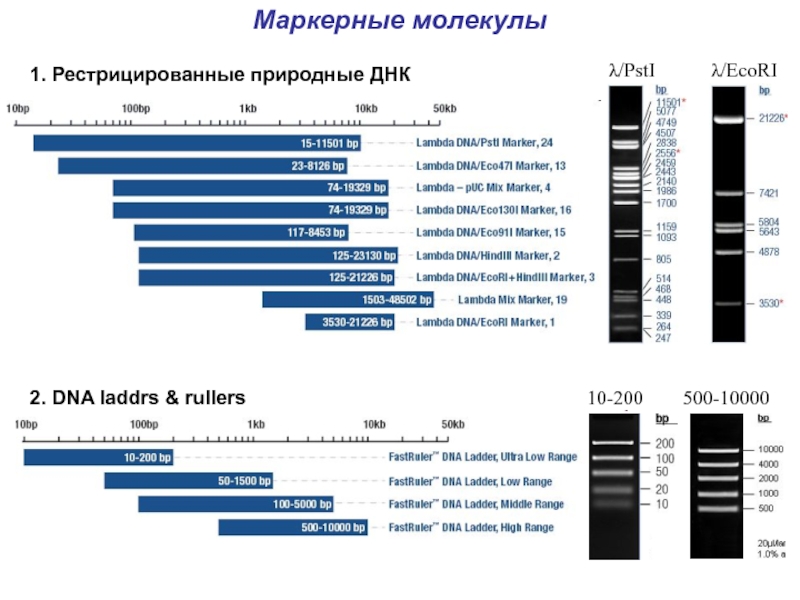
- 37. Маркерные молекулы1. Рестрицированные природные ДНК2. DNA laddrs & rullers
- 38. Источники питанияPS2A200 Power supply is a high
- 39. Разделение плазмы крови человека и маркерных белков
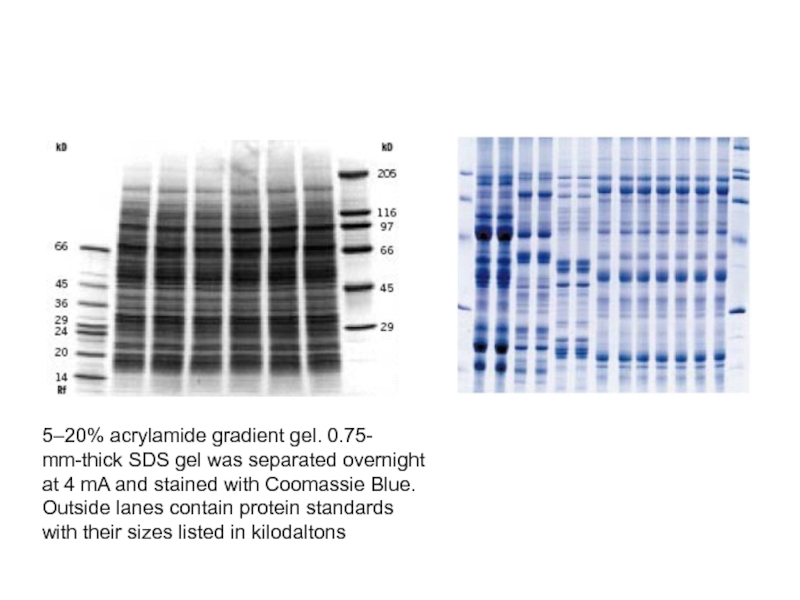
- 40. 5–20% acrylamide gradient gel. 0.75-mm-thick SDS gel
- 41. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2z - заряд частицы
E - напряженность электрического поля
- вязкость
среды
r - радиус частицы
Скорость движения идеализированной сферической частицы в
электрическом полеСкорость движения частиц (см/мин) при напряженности электрического поля 1 В/см называется электрофоретической подвижностью. Она имеет размерность см2·мин-1·В-1, а ее знак совпадает со знаком суммарного заряда. Различия в подвижности частиц служит основой для разделения смесей методом электрофореза.
Слайд 3Классификация электрофоретических методов разделения
По характеру движения зоны
электрофорез с подвижной границей
зональный
электрофорез
стационарный или вытесняющий ЭФ (изотахофорез, изоэлектрофокусирование)
По типу поддерживающей среды
ЭФ в
свободной средеЭФ в градиенте плотности
ЭФ в поддерживающих средах с капиллярной структурой
электрофорез на бумаге,
электрофорез на ацетата целлюлозы,
гель-электрофорез (в ПААГ, в агарозном и агаровом геле, в крахмальном геле, в гранулированных гелях)
Слайд 4Классификация электрофоретических методов разделения
По форме и расположению поддерживающей среды
горизонтальный ЭФ
(в прямоугольных блоках (пластинах), в тонком слое жидкости, во вращающихся
трубках)ветикальный (в прямоугольных блоках, в трубках)
капиллярный электрофорез.
По количеству направлений миграции
одномерный
двумерный
Слайд 8Трубки
Вертикальные пластины
Горизонтальный погружной
Горизонтальный тонкий слой с буферными прокладками
Слайд 10Загрузка образцов в «колодцы». Три различных метода
Горизонтальный электрофорез
Нанесение образцов на
гель с использованием кусочков фильтровальной бумаги (А) и с использованием
аппликатора (Б)А
Б
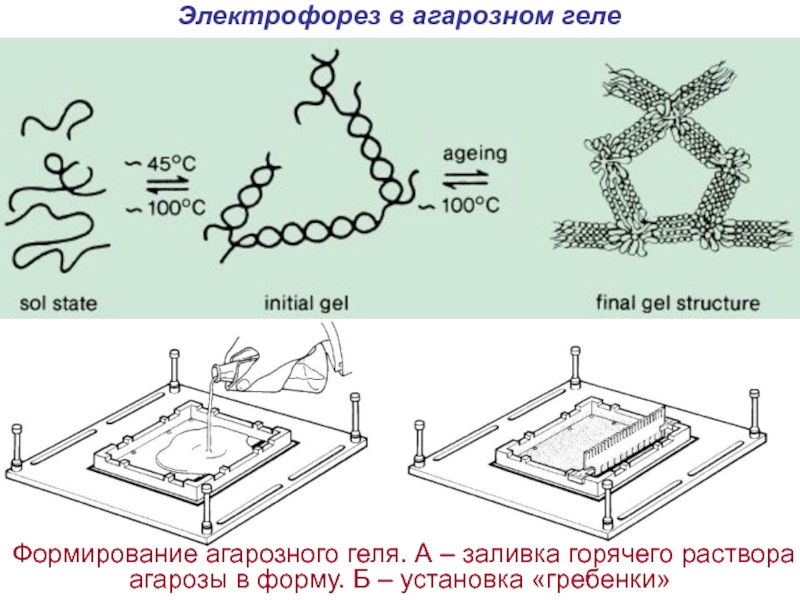
Слайд 15Электрофорез в агарозном геле
Формирование агарозного геля. А – заливка горячего
раствора агарозы в форму. Б – установка «гребенки»
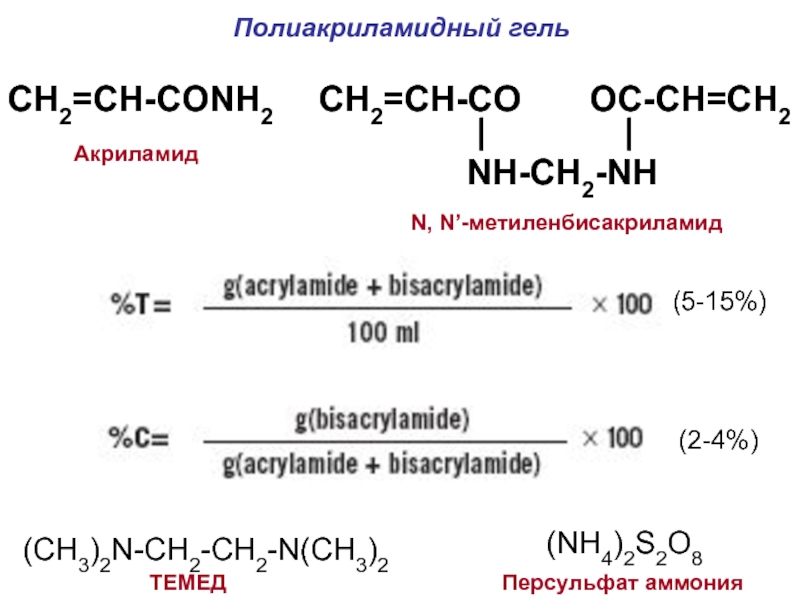
Слайд 16Полиакриламидный гель
CH2=CH-CONH2
CH2=CH-CO OC-CH=CH2
|
|NH-CH2-NH
Акриламид
N, N’-метиленбисакриламид
(5-15%)
(2-4%)
(CH3)2N-CH2-CH2-N(CH3)2
ТЕМЕД
(NH4)2S2O8
Персульфат аммония
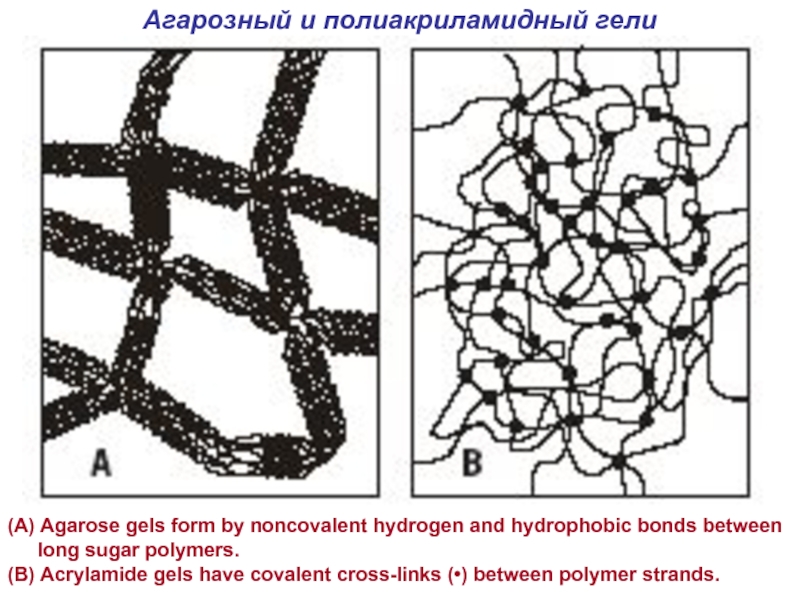
Слайд 17Агарозный и полиакриламидный гели
(A) Agarose gels form by noncovalent hydrogen
and hydrophobic bonds between long sugar polymers.
(B) Acrylamide gels
have covalent cross-links (•) between polymer strands.Слайд 19Изоэлектрическое фокусирование
Амфолиты должны отвечать следующим требованиям:
отсутствие взаимодействия с белками,
низкая молекулярная
масса,
наименьшее возможное различие между рК и pI,
хорошая электропроводность,
наименьшее возможное
поглощение света в области УФ-поглощения белков,равномерное распределение зон pI амфолитов,
максимальное количество различных значений рI.
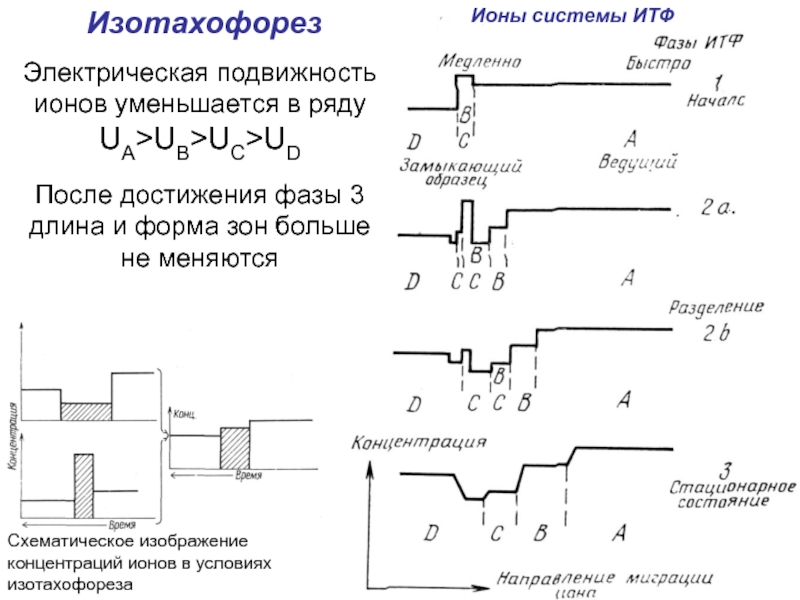
Слайд 21Схематическое изображение концентраций ионов в условиях изотахофореза
Ионы системы ИТФ
Изотахофорез
Электрическая подвижность
ионов уменьшается в ряду
UA>UB>UC>UD
После достижения фазы 3 длина и форма
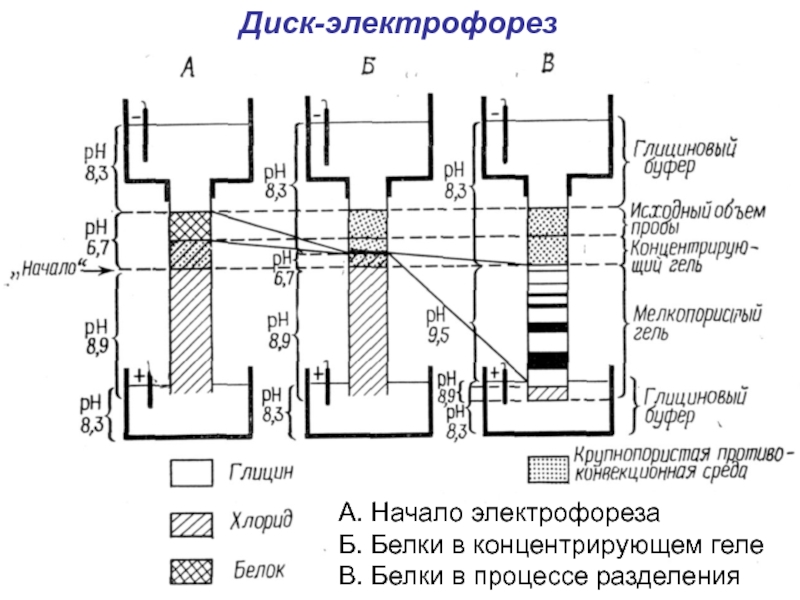
зон больше не меняютсяСлайд 22Диск-электрофорез
А. Начало электрофореза
Б. Белки в концентрирующем геле
В. Белки в процессе
разделения
Слайд 23Разделение белков по размера с использованием ДС-Na
За счет гидрофобных взаимодействий
детергент примерно одинаково связывается с подавляющим большинством белков в соотношении
примерно 1,4 мг ДС-Na на мг белкаСлайд 25Иммуноэлектрофорез (а) очищенного плазменного альбумина (b) IgG. Каждая проба шла
вместе с цельной плазмой для сравнения.
Ракетный электрофорез фактора комплемета C3.
Перекрестныный
ИЭФ-иммуноэлектрофорез плазмы крови человека.Иммуноэлектрофорез
Слайд 30Поведение разных форм НК в геле
Поведение нуклеиновых кислот в геле
сильно зависит от их вторичной структуры:
1. Однонитевые и двунитевые молекулы.
В поведении однонитевых (РНК, денатурированная ДНК) и двунитевых молекул НК многое определяется их размерами. В случае коротких полинуклеотидных цепей нативная двунитевая молекула имеет более жесткую структуру, чем таких же размеров однонитевая. Она труднее изгибается, проходя через пространственную сетку геля. В силу этого, например, относительно короткие двунитевые фрагменты ДНК при близких к нейтральному значениях рН будут отставать при электрофорезе в ПААГ от денатурированных ДНК такой же длины. Однако для более крупных молекул ситуация может измениться на противоположную. Длинная двунитевая цепочка оказывается уже в целом довольно гибкой: она продвигается через поры геля, как бы «извиваясь ужом». Между тем однонитевая цепь той же длины сворачивается в «хаотический клубок» такого размера, что его продвижение в геле оказывается более затрудненным. В этом случае денатурированная ДНК при электрофорезе отстает от нативной. Естественно, что граница обращения описанного эффекта зависит от размера пор геля. Слайд 31Поведение разных форм НК в геле
2. Кольцевые ДНК. Двунитевые ДНК
форм I, II и III. Вирусные и митохондриальные двунитевые ДНК,
а также плазмиды бактерий могут иметь структуру замкнутого двунитевого кольца. Нативное состояние такого кольца - «сверхскрученное». Кольцо в целом сворачивается в «жгут», что сильно увеличивает его компактность (форма I). Если же хотя бы в одной из двух нитей кольца имеется единичный разрыв сахарофосфатной цепи, то «жгут» разворачивается и силами электростатического отталкивания фосфатных групп кольцо расправляется. Компактность молекулы становится меньше, наружные размеры увеличиваются (форма II). Форма I при электрофорезе всегда мигрирует быстрее, чем форма II. Что касается линейной двунитевой молекулы ДНК (форма III), то она может мигрировать быстрее или медленнее, чем сверхскрученное кольцо одинаковой с ней молекулярной массы, в зависимости от среднего размера пор геля. Для крупнопористого геля решающим фактором может оказаться компактность формы I, для мелких пор на первый план выступает большая гибкость линейной молекулы.Слайд 32Скорость миграции линейных двунитевых молекул ДНК уменьшается с увеличением их
молекулярной массы, но лишь до определенного предела. При молекулярной массе
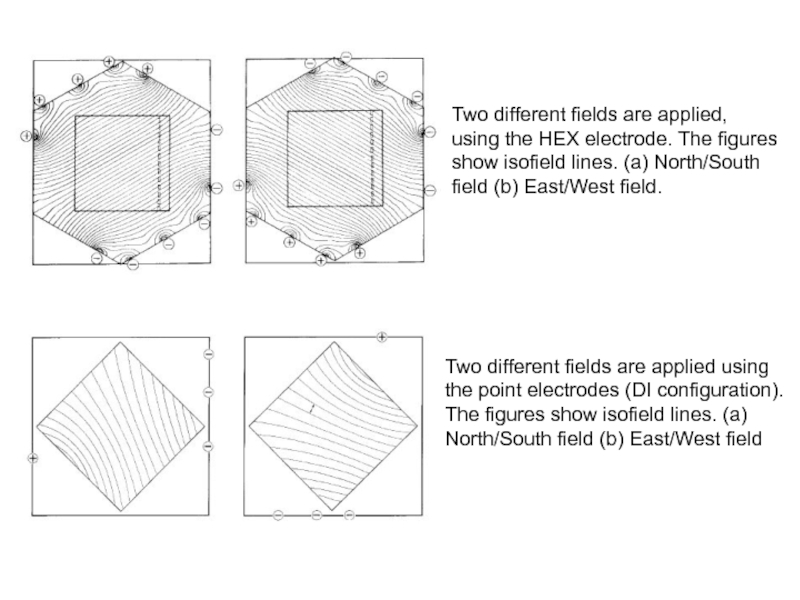
более 5 млнв 1,6 %-ном геле агарозы и более 12 млн. в 0,8 %-ном линейные молекулы ДНК мигрируют с одинаковой скоростью независимо от их молекулярной массы (!) и, следовательно, не могут быть разделены электрофорезом. Это происходит именно вследствие гибкости длинных молекул ДНК. Их противоположные концы мигрируют в электрическом поле независимо друг от друга, и вся молекула, извиваясь, проходит через гель одинаково легко (или одинаково трудно) при любой ее длине.Слайд 34Two different fields are applied, using the HEX electrode. The
figures show isofield lines. (a) North/South field (b) East/West field.
Two
different fields are applied using the point electrodes (DI configuration).The figures show isofield lines. (a) North/South field (b) East/West field
Слайд 35Обнаружение НК на электрофореграммах
Ethidium bromide
Ethidium bromide is a powerful mutagen
and moderately toxic. Gloves should be worn when working with
solutions that contain this dye.Бромистый этидий
Слайд 38Источники питания
PS2A200 Power supply is a high current power supply
ideal for all types of electrophoresis blotting and short electrophoresis
runs.200 V, 2000 mA, 200 W maximum.
Constant voltage, constant current, or constant power modes.
4 timer options to choose from: continuous run, set time run, set time run followed by a hold at 5 V, or set Volt-hour run.
Single unit increments in settings and read-outs for precision and reproducibility.
Print log of run parameters via RS-232 port.
Designed for high current applications such as tank blotting.
Stores and recalls three protocols.
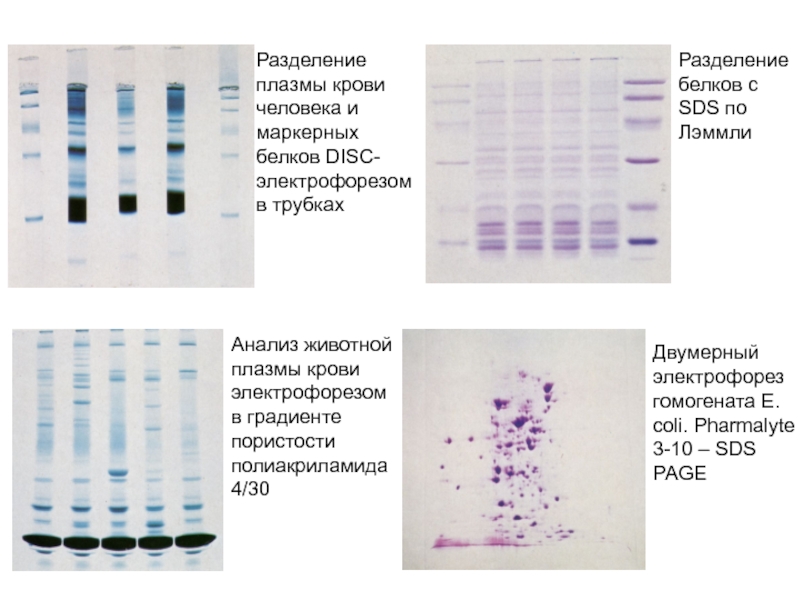
Слайд 39Разделение плазмы крови человека и маркерных белков DISC-электрофорезом в трубках
Разделение
белков с SDS по Лэммли
Анализ животной плазмы крови электрофорезом в
градиенте пористости полиакриламида 4/30Двумерный электрофорез гомогената E. coli. Pharmalyte 3-10 – SDS PAGE