Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация
Содержание
- 1. Электролитическая диссоциация
- 2. ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫВеществаНеэлектролиты
- 3. Почему растворы электролитов проводят электрический ток?Сванте Аррениус(1859-1927)
- 4. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 5. Лучше всего диссоциируют вещества с ионной и
- 6. Ориентация молекул – диполей воды около ионов;Гидратация
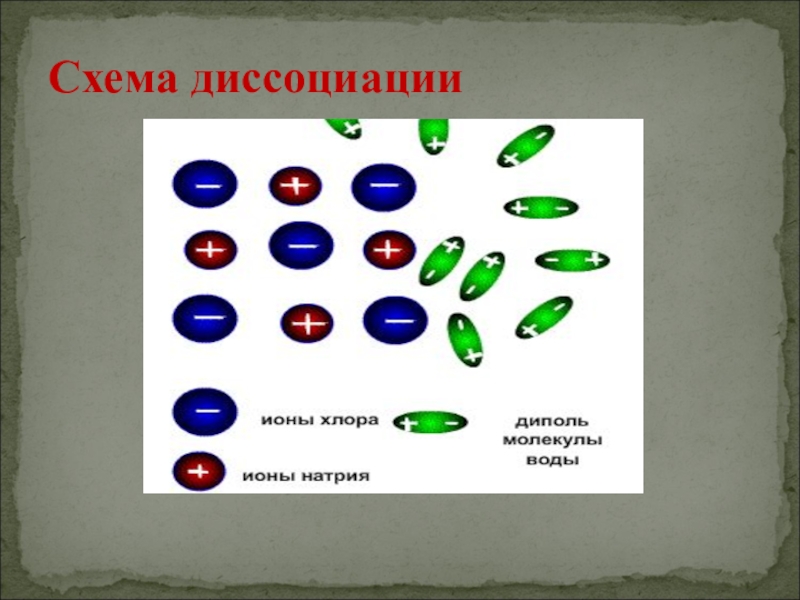
- 7. Схема диссоциации
- 8. NaCl = Na+ + Cl-NaCl –
- 9. ЭлектролитыСильныевсе растворимые соли;сильные кислотыH2SO4, HCl, HNO3все щелочиNaOH, KOHСлабыеслабые кислотыH2S, H2CO3, HNO2водный раствор аммиакаNH3*H2Oорганические вещества
- 10. Домашнее задание1. параграф 36 выучить
- 11. Скачать презентанцию
ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫВеществаНеэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток.Электролиты – вещества, растворы и расплавы которых проводят электрический ток
Слайды и текст этой презентации
Слайд 2
ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ
Вещества
Неэлектролиты – вещества, растворы
и расплавы которых не проводят электрический ток.
и расплавы которых проводят электрический токСлайд 3Почему растворы электролитов проводят электрический ток?
Сванте Аррениус
(1859-1927)
Разработал теорию
электролитической диссоциации. За исследования в области электролитов был удостоен Нобелевской
премии (1903 г.)Слайд 4Электролитическая диссоциация – процесс распада электролита на ионы при растворении
его в воде или расплавлении.
Слайд 5Лучше всего диссоциируют вещества с ионной и ковалентной полярной связью:
Кислоты
: HCl, H2SO4, HF, HNO3
Основания: NaOH, Ba(OH)2, KOH
Соли : NaCl,
CuSO4, KNO3Слайд 6Ориентация молекул – диполей воды около ионов;
Гидратация (взаимодействие) молекул воды
с противоположно заряженными ионами поверхностного слоя кристалла;
Диссоциация (распад) кристалла электролита
на гидратированные ионыПоследовательность процессов, происходящих при электролитической диссоциации:
Слайд 8NaCl = Na+ + Cl-
NaCl – молекула хлорида натрия
Na+
- ион натрия
Cl- - ион хлора
Уравнение реакции: