Слайд 1Ферменты: понятие, общие свойства, локализация ферментов.
Слайд 2ФЕРМЕНТЫ - органические вещества белковой природы, которые во много раз
ускоряют протекание реакций, не подвергаясь при этом химическим превращениям.
В
настоящее время известно более 3700 ферментов.
В научной литературе на русском языке утвердились оба термина : «ферменты» и «энзимы»,
но предпочтение отдают термину «фермент», хотя наука о ферментах называется энзимологией.
Слово«фермент» происходит от лат. fеrmentum– закваска, слово – «энзим» от греч. еn– в, внутри и zyme– дрожжи.
Слайд 3При наименовании фермента за основу берут название субстрата и добавляют
суффикс «аза».
Так появились, в частности, протеиназы – ферменты, расщепляющие
белки (протеины), липазы (расщепляют липиды, или жиры)и т.д.
Некоторые ферменты получили специальное (тривиальное) название, например, пищеварительные ферменты – пепсин, химотрипсин и трипсин.
Слайд 4Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты:
1) катализируют только энергетически возможные реакции, т.е. реакции, которые могут
протекать и без них;
2) не изменяют направление реакции;
3) не сдвигают равновесие обратимой реакции, а лишь ускоряют его наступление;
4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде.
Слайд 5Отличие ферментов от небиологических катализаторов заключается в том, что:
1)
скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами (эффективность
действия ферментов).
2) ферменты обладают высокой специфичностью действия;
3) ферменты катализируют реакции в очень мягких условиях (обычное давление, нейтральная рН, невысокая tº);
4) активность ферментов в клетках строго регулируется как на генетическом уровне, так и посредством определённых низкомолекулярных соединений (субстратов и продуктов реакции, катализируемых этими же ферментами);
5) скорость ферментативной реакции прямо пропорциональна количеству фермента.
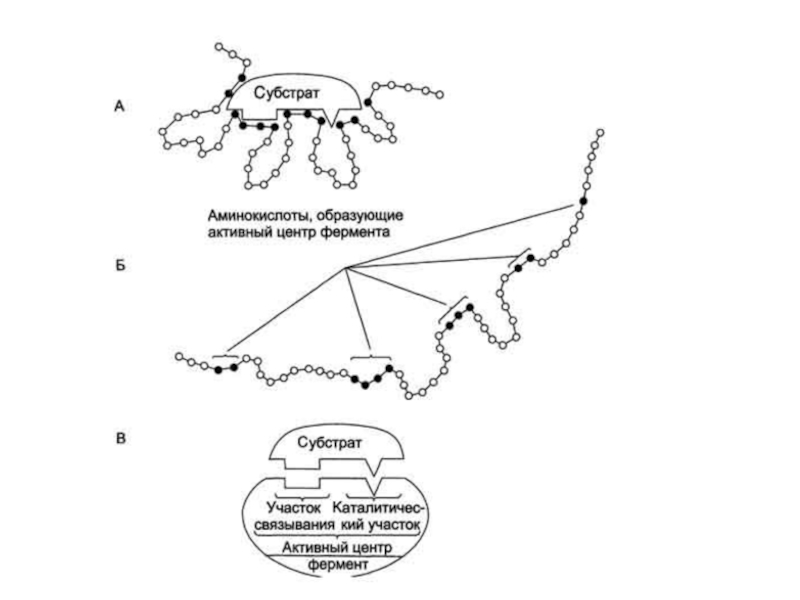
Слайд 6Специфичность –
наиболее важное свойство ферментов, определяющее биологическую значимость этих
молекул.
Биологическая функция фермента, как и любого белка, обусловлена наличием в
его структуре активного центра.
Лиганд, взаимодействующий с активным центром фермента, называют субстратом.
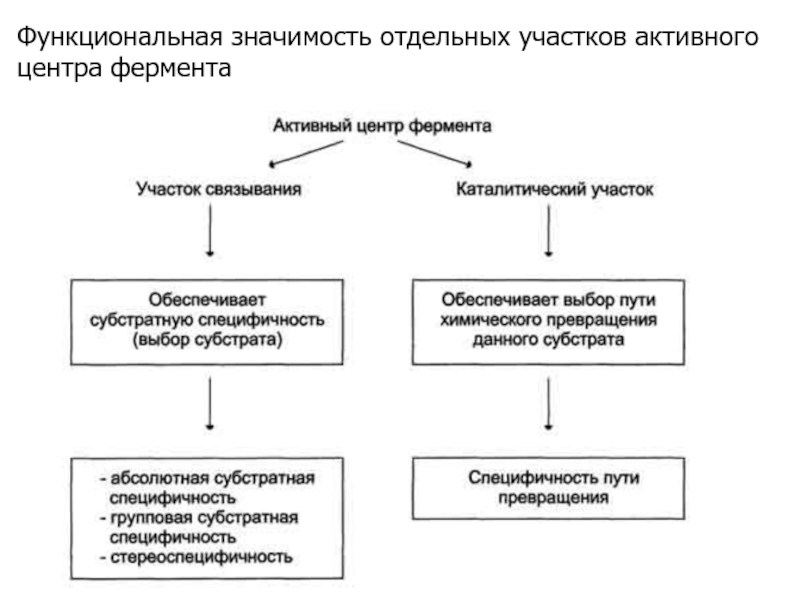
В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата – участок связывания, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата – каталитический участок.
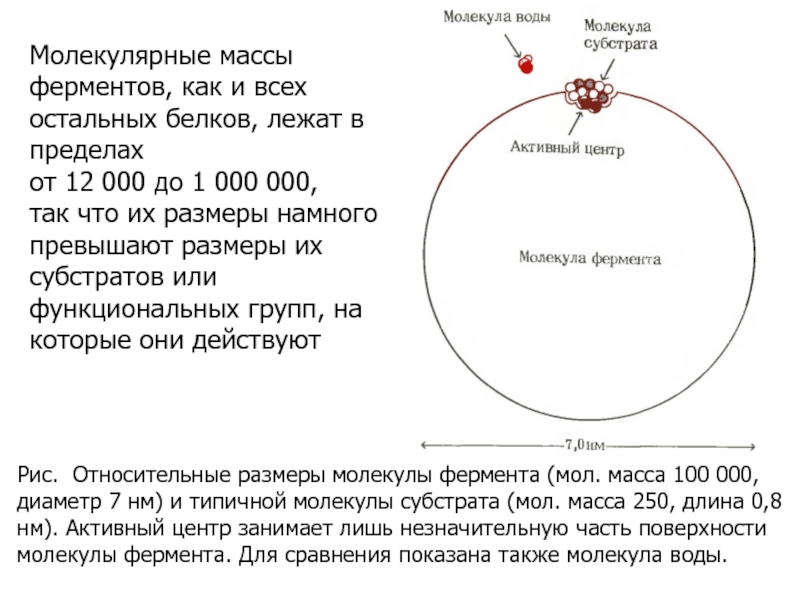
Слайд 8Рис. Относительные размеры молекулы фермента (мол. масса 100 000, диаметр
7 нм) и типичной молекулы субстрата (мол. масса 250, длина
0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды.
Молекулярные массы ферментов, как и всех остальных белков, лежат в пределах
от 12 000 до 1 000 000,
так что их размеры намного превышают размеры их субстратов или функциональных групп, на которые они действуют
Слайд 9В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается)
с ферментом, формируя фермент-субстратный комплекс.
В каталитическом участке субстрат претерпевает
химическое превращение в продукт, который затем высвобождается из активного центра фермента.
Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔ ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
Данные обозначения общеприняты и происходят от английских слов enzyme, substrat, product.
Слайд 10Функциональная значимость отдельных участков активного центра фермента
Слайд 111. Субстратная специфичность
- способность каждого фермента взаимодействовать лишь с одним
или несколькими определёнными субстратами.
Различают:
- абсолютную субстратную специфичность;
- групповую субстратную
специфичность;
- стереоспецифичность.
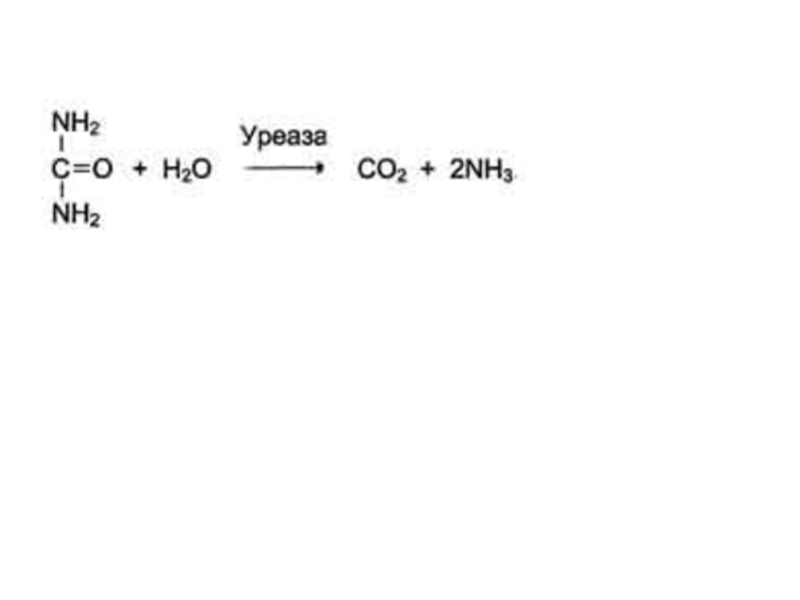
Слайд 12Абсолютная субстратная специфичность
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен
только одному субстрату.
Следует отметить, что таких ферментов в живых
организмах мало.
Пример - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина:
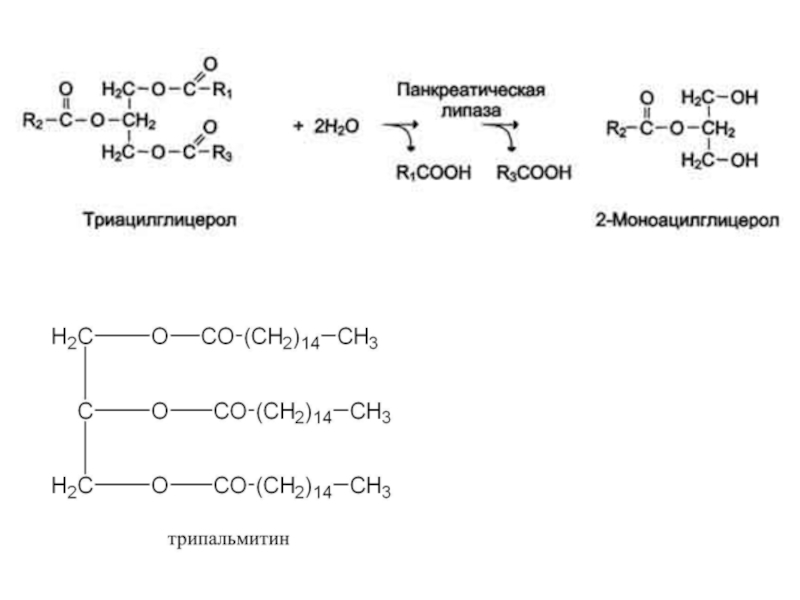
Слайд 14Групповая субстратная специфичность
Большинство ферментов катализирует однотипные реакции с небольшим количеством
(группой) структурно похожих субстратов.
Пример - фермент панкреатическая липаза катализирует гидролиз
жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот.
Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира.
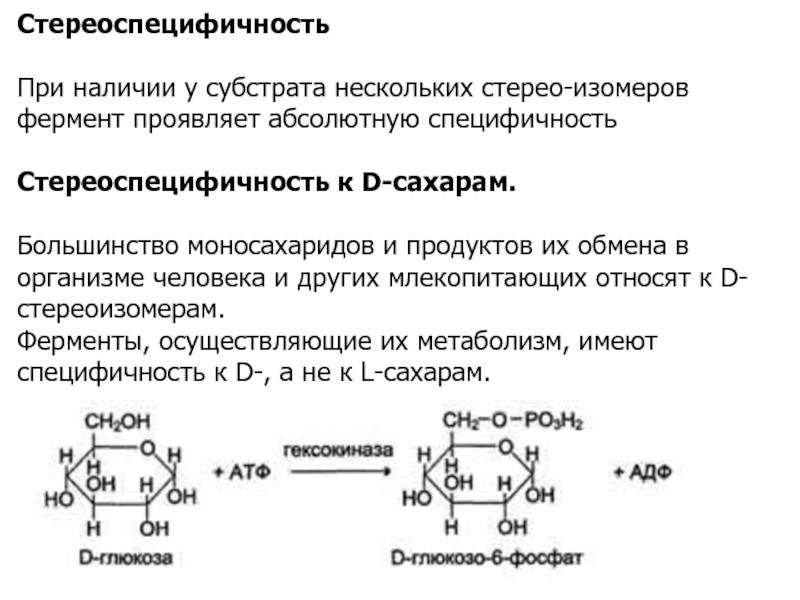
Слайд 16Стереоспецифичность
При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность
Стереоспецифичность
к D-сахарам.
Большинство моносахаридов и продуктов их обмена в организме человека
и других млекопитающих относят к D-стереоизомерам.
Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.
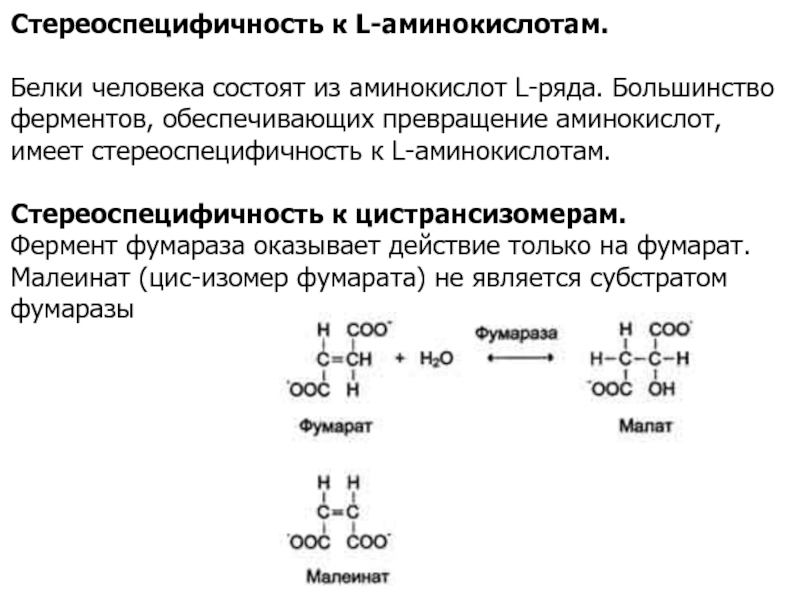
Слайд 17Стереоспецифичность к L-аминокислотам.
Белки человека состоят из аминокислот L-ряда. Большинство
ферментов, обеспечивающих превращение аминокислот, имеет стереоспецифичность к L-аминокислотам.
Стереоспецифичность к цистрансизомерам.
Фермент
фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы
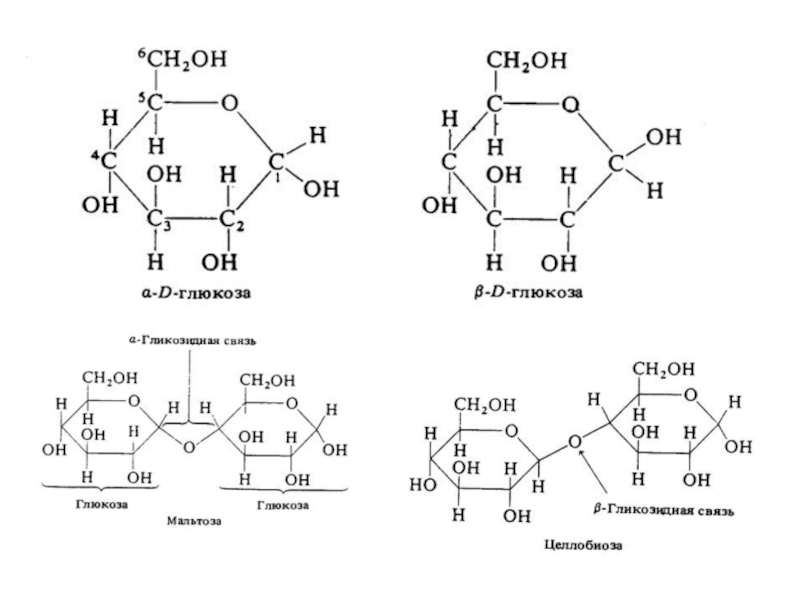
Слайд 18Стереоспецифичносгь к α- и β-гликозидным связям.
Фермент амилаза действует только
на α-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры
глюкозы), остатки глюкозы в которых соединены α-гликозидными связями.
Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
Слайд 202. Каталитическая специфичность
Фермент катализирует превращение присоединённого субстрата по одному из
возможных путей его превращения,
Это свойство обеспечивается строением каталитического участка
активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
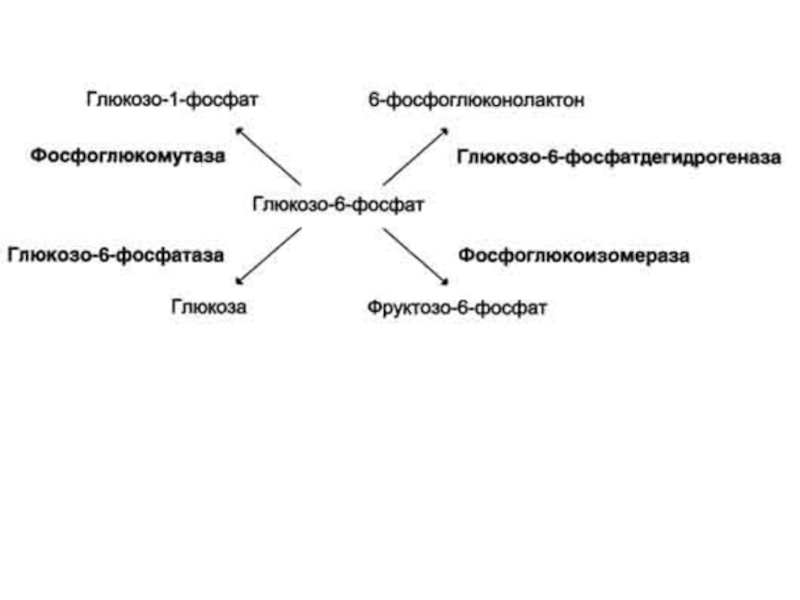
Так, молекула глюкозо-6-фосфата в клетках печени человека – субстрат 4 различных ферментов, однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов.
Слайд 22Локализация ферментов
Большинство ферментов имеет внутриклеточную локализацию и распределены в организме
неравномерно.
Все ферменты одного метаболического пути, как правило, находятся в
одном отделе клетки.
Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов.
Например, синтез жирных кислот происходит в цитоплазме, а их распад в митохондриях. Если бы такого разделения не существовало, образовывались бы бесполезные с функциональной и энергетической точки зрения пути.
Слайд 23В метаболических путях продукт первой ферментативной реакции служит субстратом второй
и так далее до формирования конечного продукта.
Промежуточные продукты метаболического
пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т.е. метаболические пути связаны между собой промежуточными продуктами.
В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни при каких условиях не может быть вычленен из метаболического пути и обязательно служит субстратом следующей реакции. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов.
Обычно такие комплексы связаны с мембранами.
Слайд 24Примеры мультиферментных комплексов:
- пируватдегидрогеназный комплекс, под действием которого происходит
окислительное декарбоксилирование пировиноградной кислоты (пирувата)
- синтазу жирных кислот, катализирующую
синтез пальмитиновой кислоты.