Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты биокатализаторы
Содержание
- 1. Ферменты биокатализаторы
- 2. План лекцииПонятие о ферментах. Сущность явлений ферментативного
- 3. Слайд 3
- 4. Практически все реакции в живом организме протекают
- 5. Известно, что для осуществления химической реакциинеобходимо, чтобы
- 6. Сущность действия ферментов, так жекак неорганических катализаторов
- 7. Слайд 7
- 8. Рассмотрим реакцию разложения угольнойкислоты (не ферментативной реакцией):Н2СО3
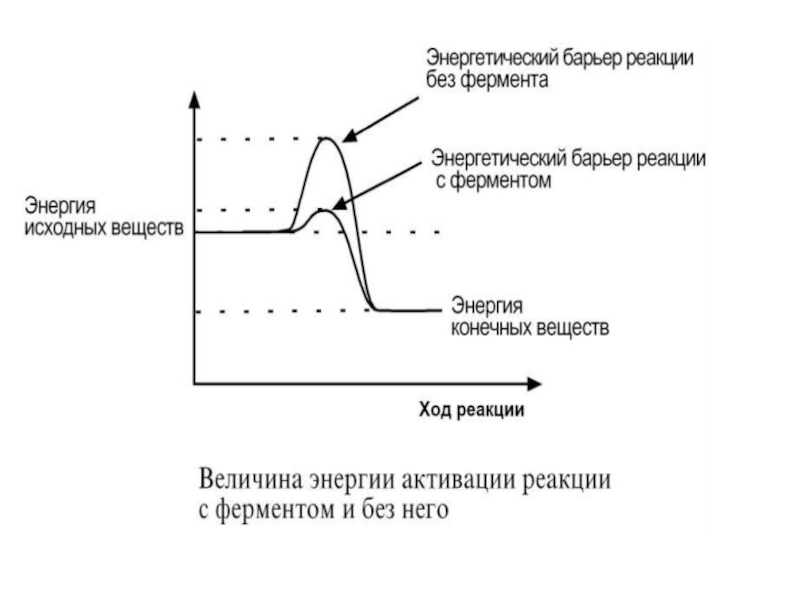
- 9. Рис. 1. Изменение свободной энергии при разложении угольной кислоты
- 10. При достижении этого энергетического барьера в молекуле
- 11. 1) катализируют только энергетически возможные реакции, т.
- 12. 1) Скорость ферментативных реакций намного выше;2) Высокая
- 13. Этапы ферментативного катализаВ ферментативной реакции можно выделить
- 14. Механизмы ферментативного катализаКислотно-основной катализ – в
- 15. 2. Ковалентный катализ – ферменты реагируют
- 16. Строение ферментов
- 17. Общая характеристикаФерменты имеют белковую природу и обладают
- 18. Простые ферменты состоят только из аминокислот –
- 19. Схема формирования сложного ферментаКофактор + апофермент = холоферментholo – весь, целый
- 20. У сложных ферментов в активном центре обязательно
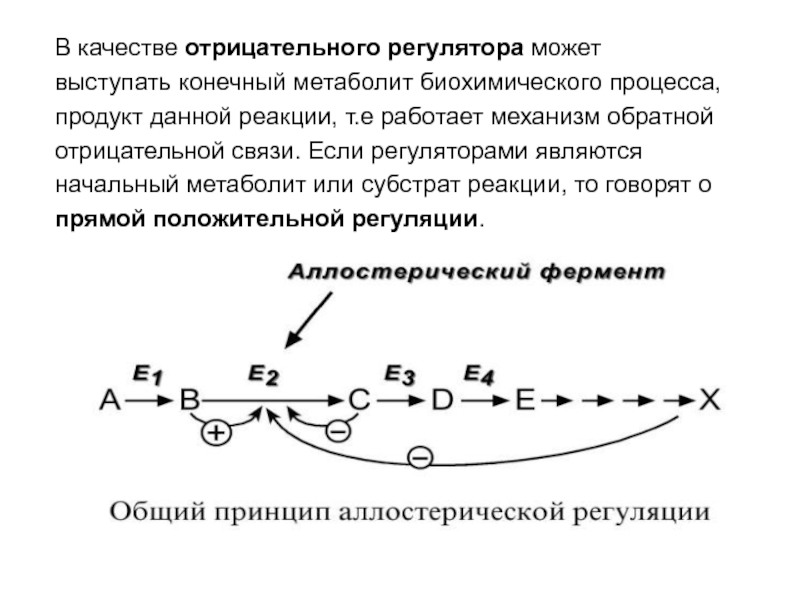
- 21. 2. Аллостерический центр (allos – чужой) –
- 22. Схематическре изображение аллостерического фермента
- 23. Структурно-функциональная организация ферментовили как ферменты работают.В составе
- 24. Биологическая функция фермента, как и любогобелка обусловлена
- 25. Схематичное изображение основных участков фермента в белковой глобуле
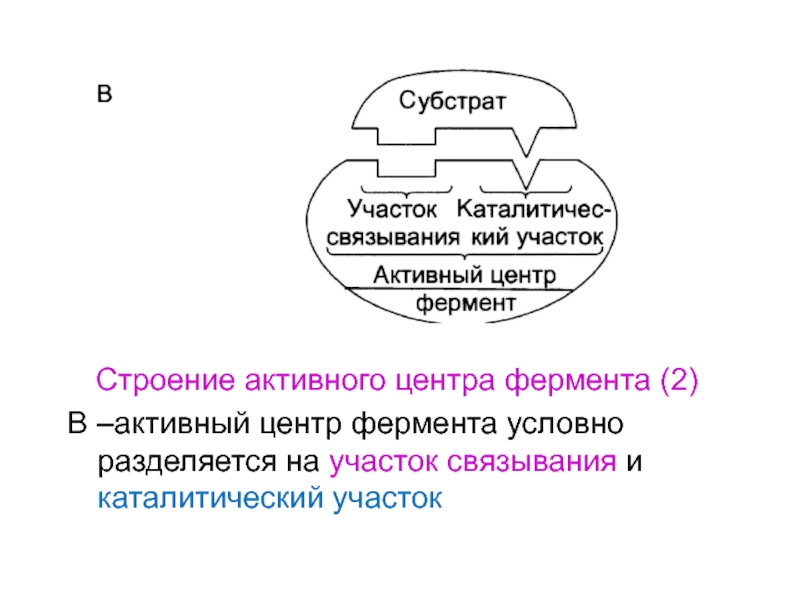
- 26. Строение активного центра фермента (1)А – присоединение
- 27. Строение активного центра фермента (2)В –активный центр фермента условно разделяется на участок связывания и каталитический участок
- 28. Рис.2. Функциональная значимость отдельных участков активного центра фермента
- 29. Что означает выражение «активность фермента»?При сравнении
- 30. Активность фермента подразумевает результат реакции, а именно
- 31. 1. Активность фермента выражается в скорости накопления
- 32. Таким образом, активность фермента может выражаться, например,
- 33. 2. Создание стандартных условий, чтобы можно было
- 34. От чего зависит активность ферментов? Свойства ферментов
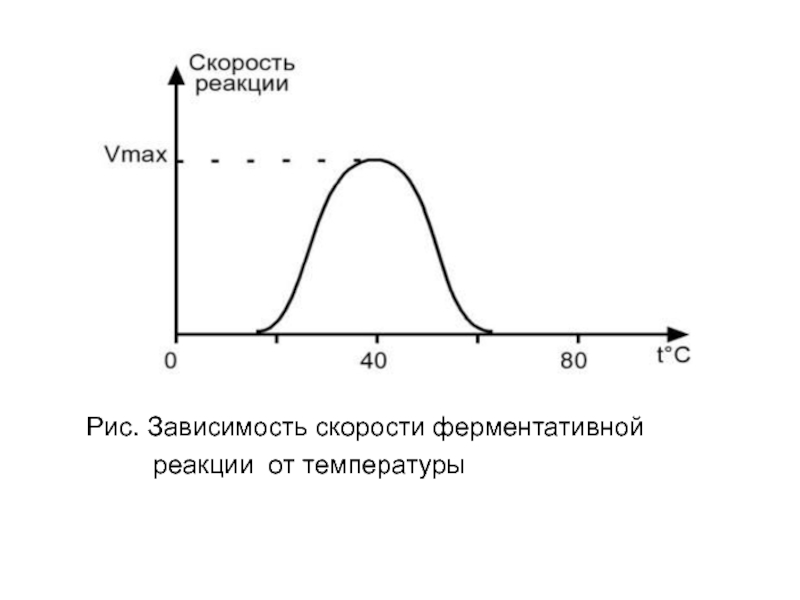
- 35. Рис. Зависимость скорости ферментативной реакции от температуры
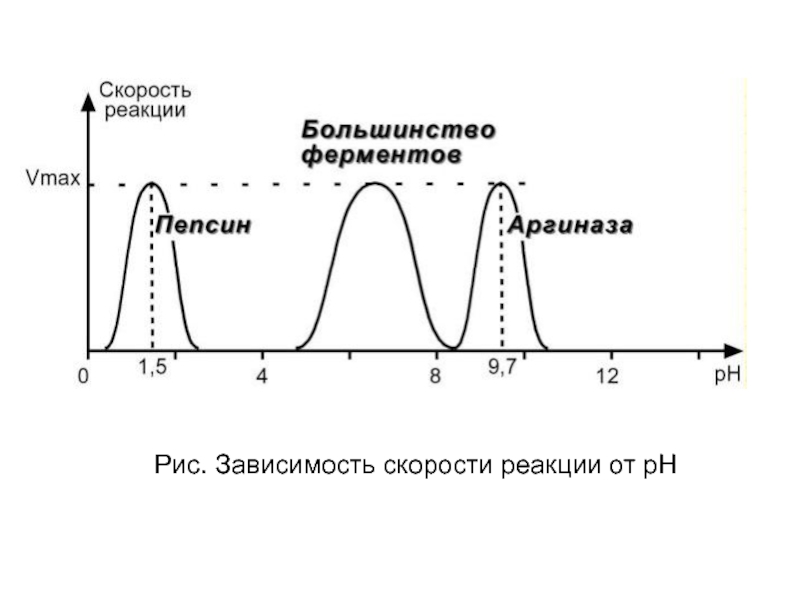
- 36. Рис. Зависимость скорости реакции от рН
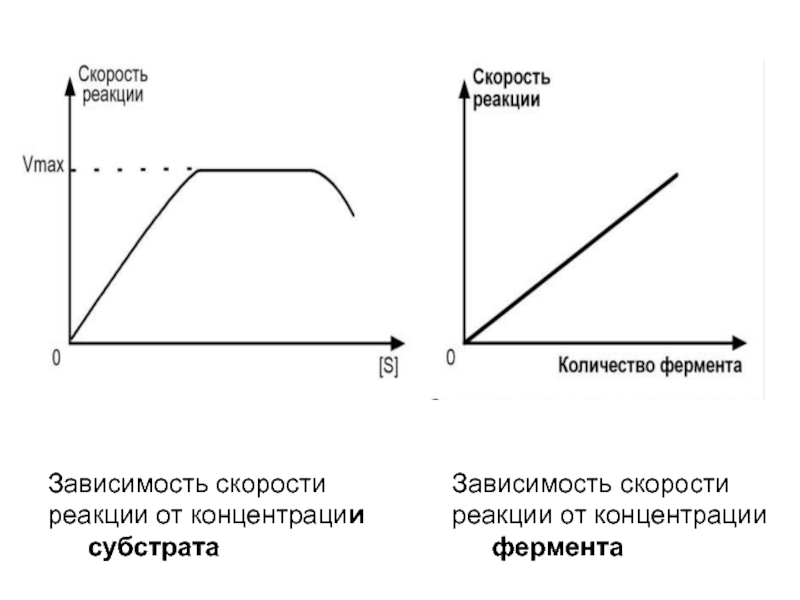
- 37. Зависимость скорости реакции от концентрации субстратаЗависимость скорости реакции от концентрации фермента
- 38. Ферменты избирательны в своём действии
- 39. Ферменты избирательны в своём действииСпецифичность, т.е. высокая
- 40. 1 СтереоспецифичностьПри наличии у субстрата нескольких стереоизомеров
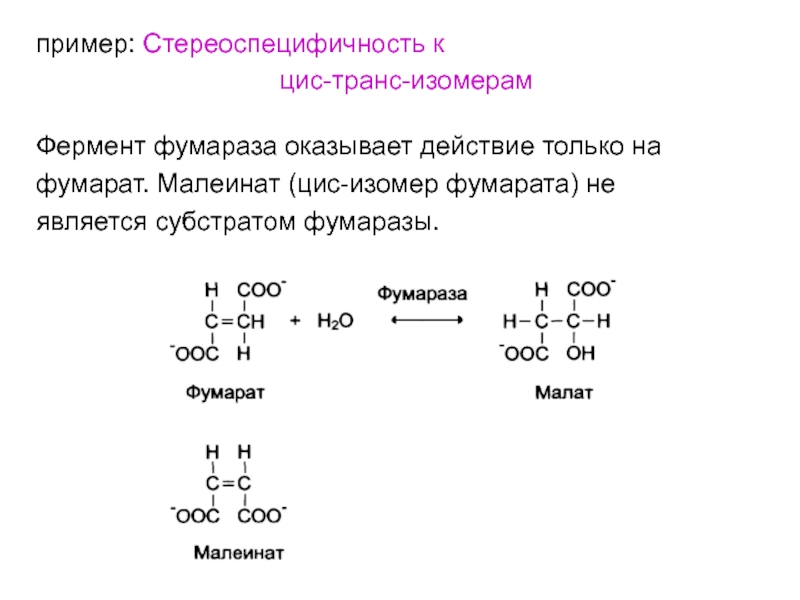
- 41. пример: Стереоспецифичность к цис-транс-изомерамФермент фумараза оказывает действие
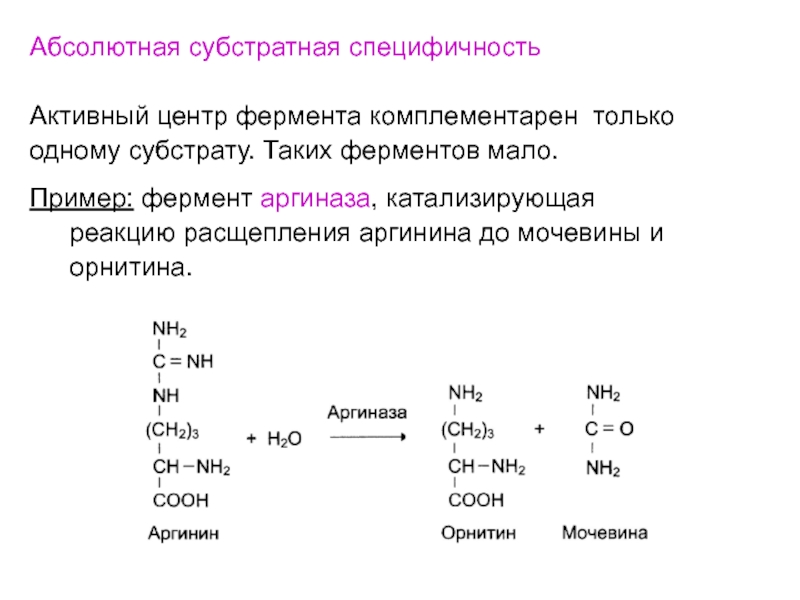
- 42. Абсолютная субстратная специфичность Активный центр фермента комплементарен только
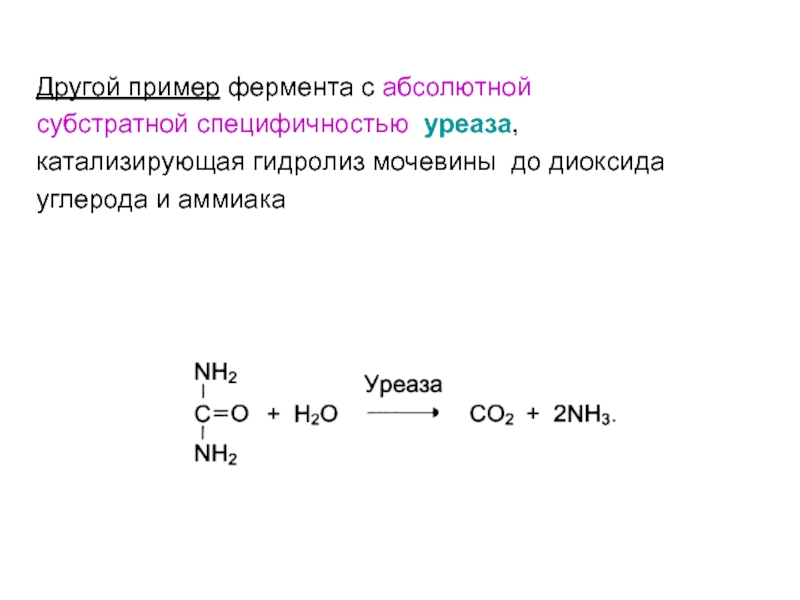
- 43. Другой пример фермента с абсолютной субстратной специфичностью уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака
- 44. Групповая субстратная специфичностьБольшинство ферментов катализируют однотипные реакции
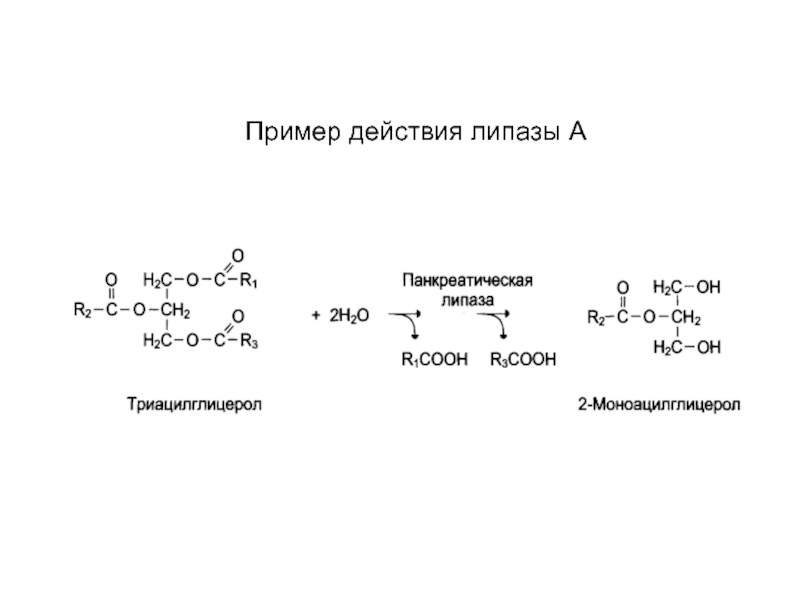
- 45. Пример действия липазы А
- 46. Относительная специфичность – превращение субстратов с некоторыми
- 47. МЕХАНИЗМЫ СПЕЦИФИЧНОСТИ В общем виде все сводится
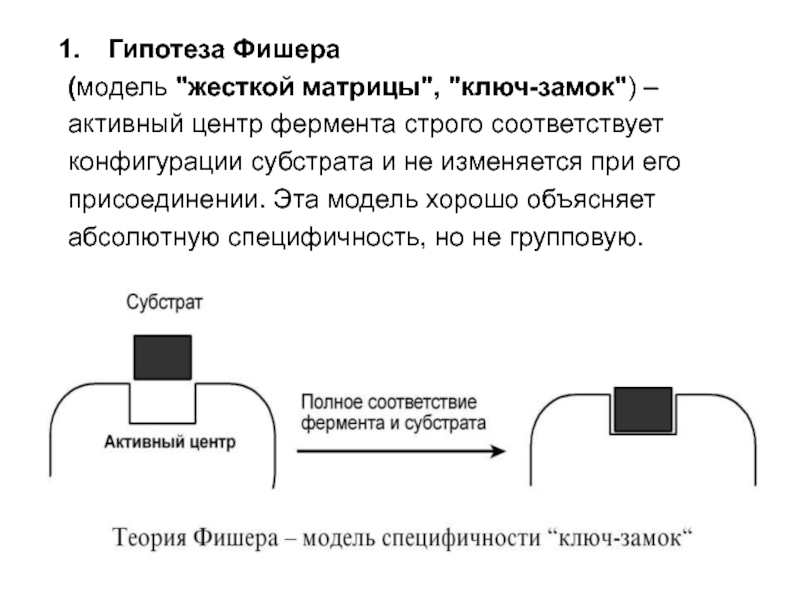
- 48. Гипотеза Фишера (модель "жесткой матрицы", "ключ-замок") –
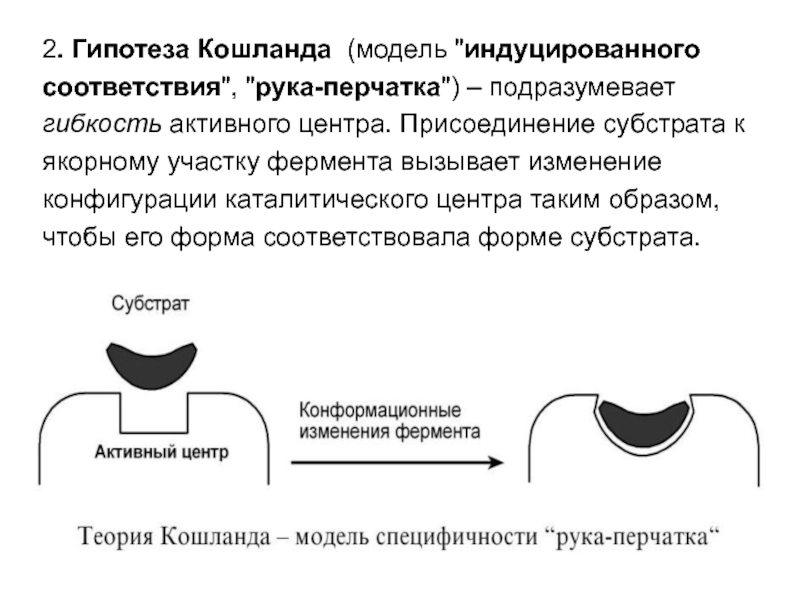
- 49. 2. Гипотеза Кошланда (модель "индуцированного соответствия", "рука-перчатка")
- 50. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ IN VIVO Активность ферментов в
- 51. 1. Компартментализация,2. Доступность субстрата или кофермента,3. Изменение
- 52. Компартментализация. Компартментализация – это сосредоточение ферментов и
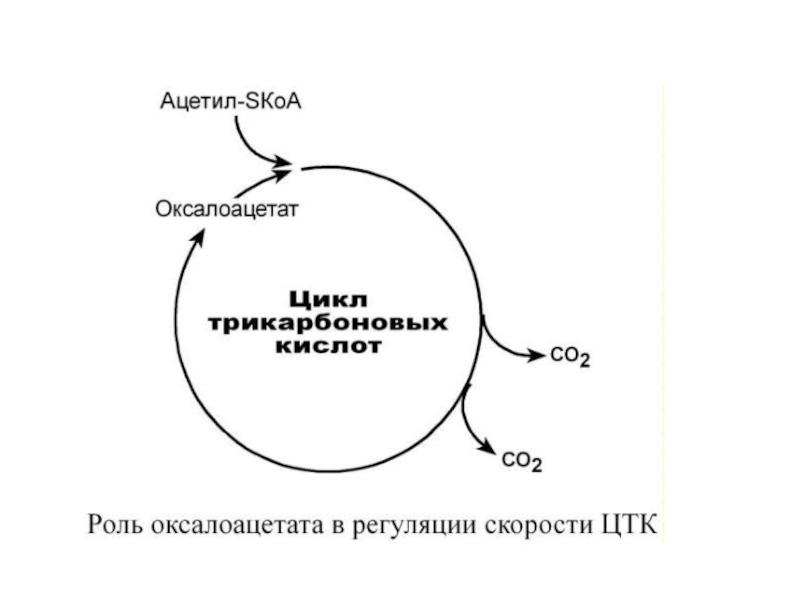
- 53. 2. Доступность субстрата или кофермента. Здесь работает
- 54. Слайд 54
- 55. 3. Изменение количества фермента. Изменение количества фермента
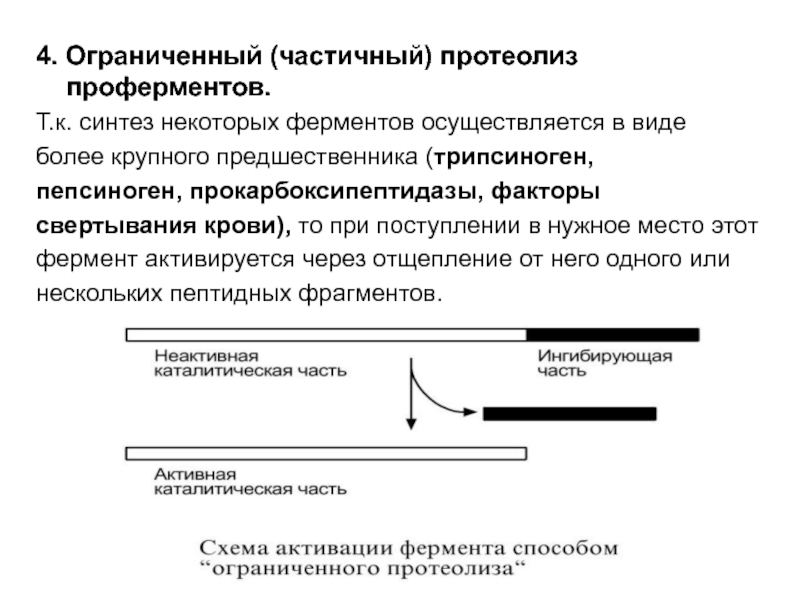
- 56. 4. Ограниченный (частичный) протеолиз проферментов. Т.к. синтез
- 57. 5. Аллостерическая регуляция. Аллостерические ферменты построены из двух
- 58. В качестве отрицательного регулятора может выступать конечный
- 59. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется
- 60. Слайд 60
- 61. 6. Белок-белковое взаимодействие. Термин белок-белковое взаимодействие обозначаетситуацию,
- 62. Слайд 62
- 63. Другим примером белок-белкового взаимодействия может быть регуляция
- 64. Слайд 64
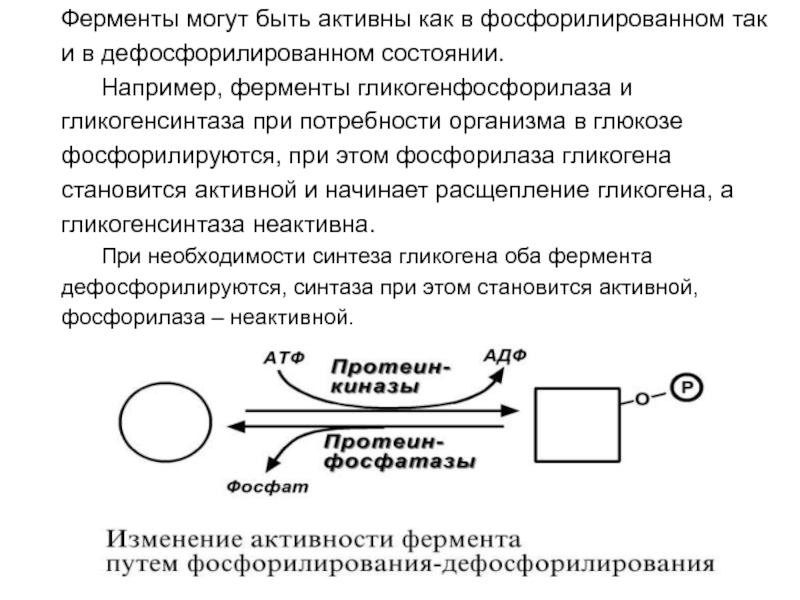
- 65. 7. Ковалентная (химическая) модификация. Ковалентная модификация заключается
- 66. Ферменты могут быть активны как в фосфорилированном
- 67. II классификация и номенклатура ферментовКаждый фермент имеет
- 68. II классификация и номенклатура ферментовВ 1961 г
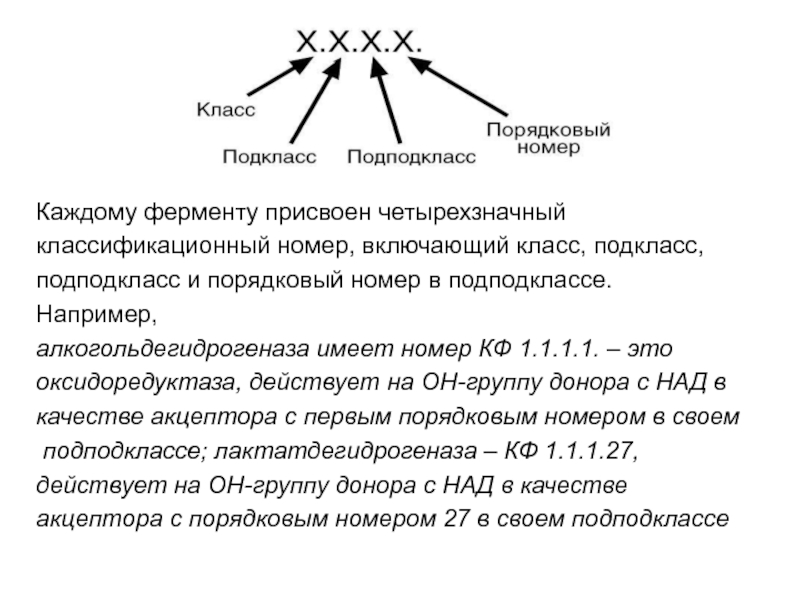
- 69. Каждому ферменту присвоен четырехзначный классификационный номер, включающий
- 70. Номенклатера ферментовТривиальное название – название, сложившееся исторически.
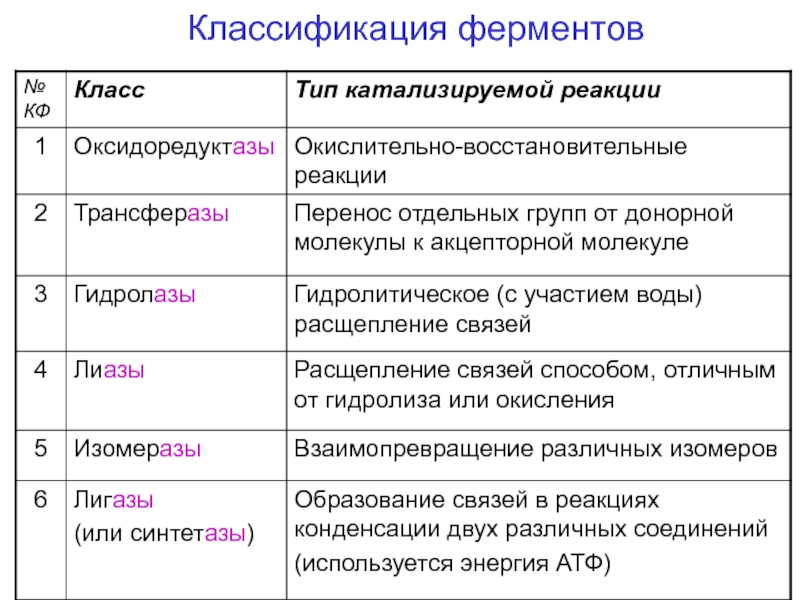
- 71. Классификация ферментов
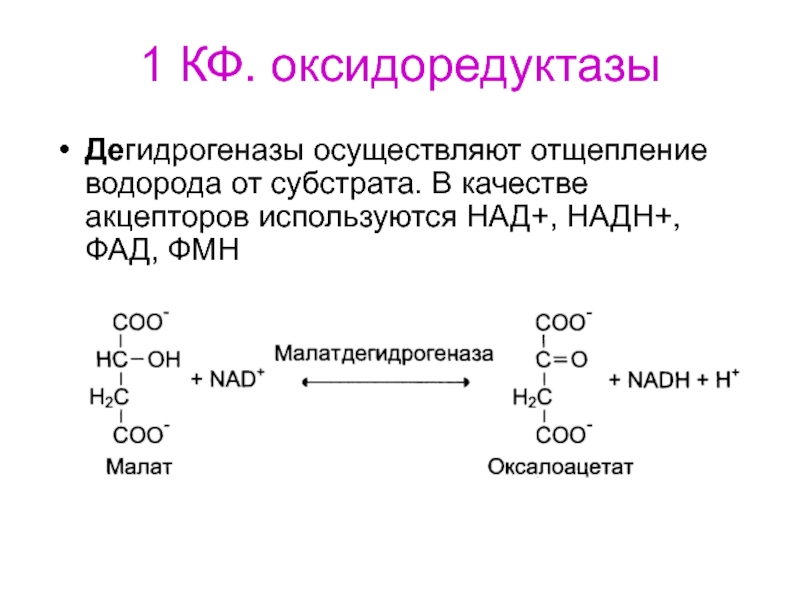
- 72. 1 КФ. оксидоредуктазыДегидрогеназы осуществляют отщепление водорода от субстрата. В качестве акцепторов используются НАД+, НАДH+, ФАД, ФМН
- 73. 1 КФ. оксидоредуктазыДругой пример:У оксидоредуктаз, акцептором электрона(ов) служит молекулярный кислород.
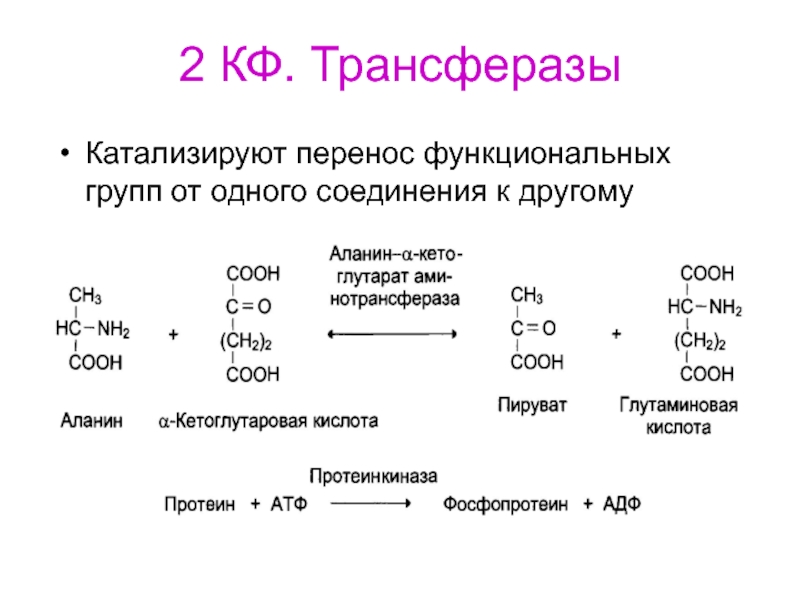
- 74. 2 КФ. ТрансферазыКатализируют перенос функциональных групп от одного соединения к другому
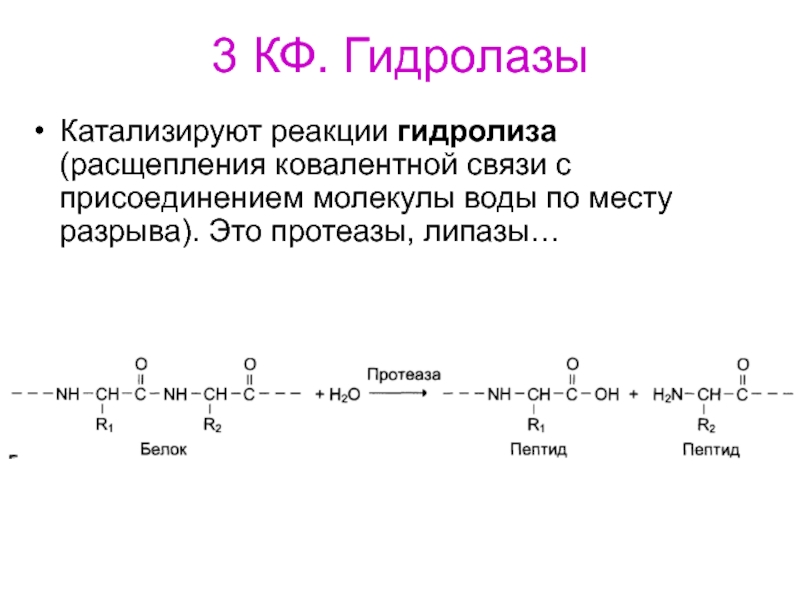
- 75. 3 КФ. ГидролазыКатализируют реакции гидролиза (расщепления ковалентной
- 76. 4 КФ. ЛиазыК лиазам относят ферменты, отщепляющие
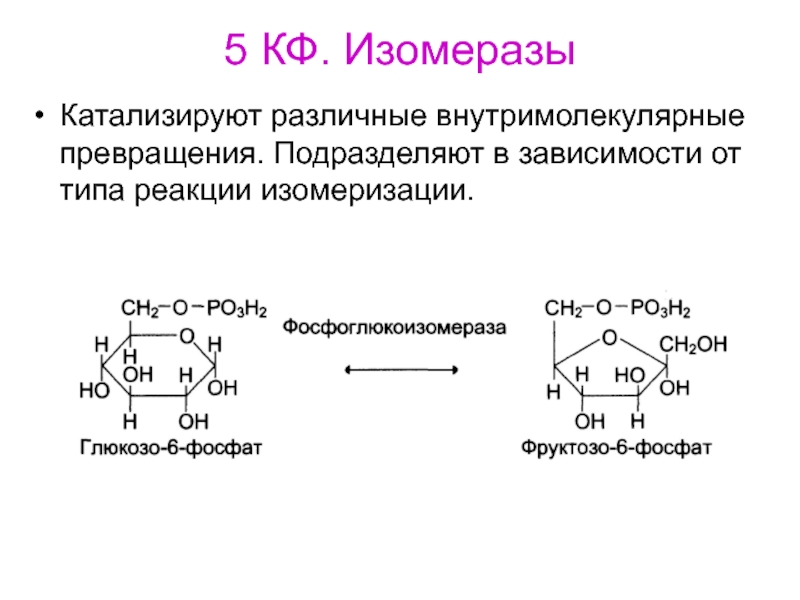
- 77. 5 КФ. ИзомеразыКатализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
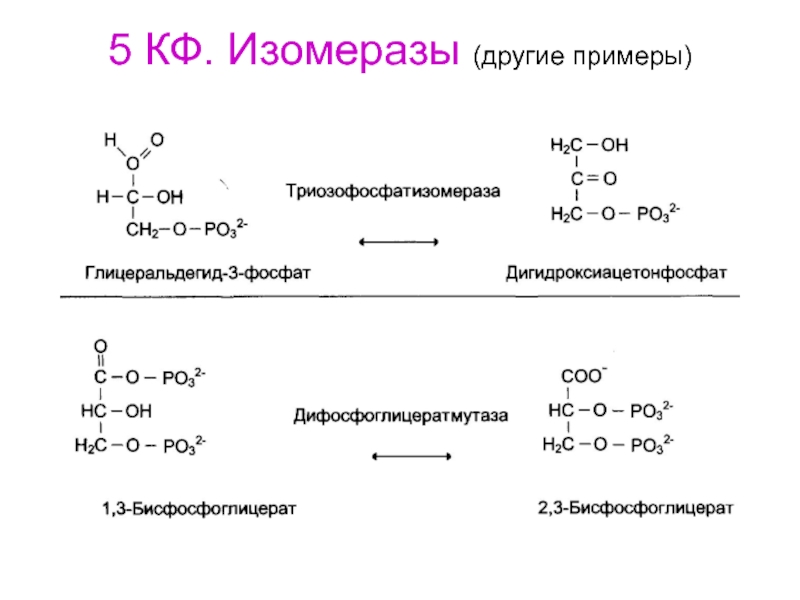
- 78. 5 КФ. Изомеразы (другие примеры)
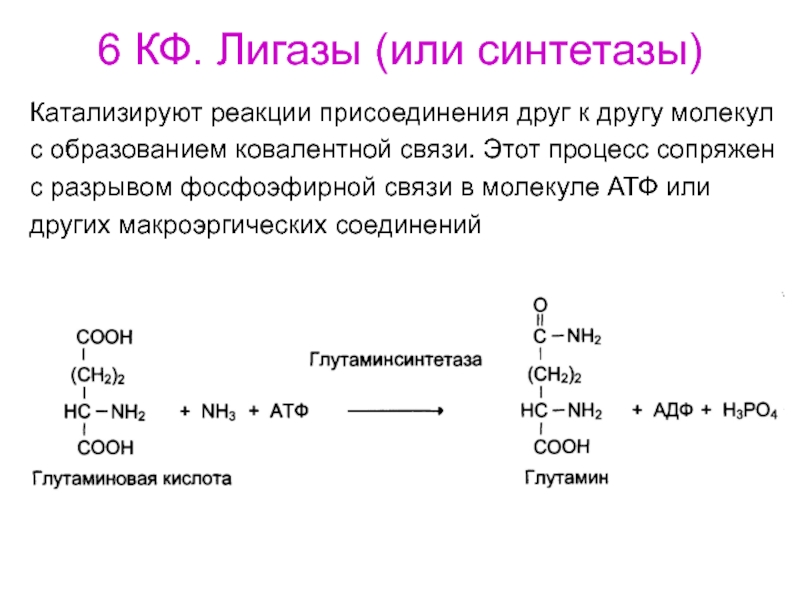
- 79. 6 КФ. Лигазы (или синтетазы)Катализируют реакции присоединения
- 80. Слайд 80
- 81. Слайд 81
- 82. III. Кофакторы и коферментыБольшинство ферментов для проявления
- 83. Большинство ферментов состоит из термолабильной белковой части
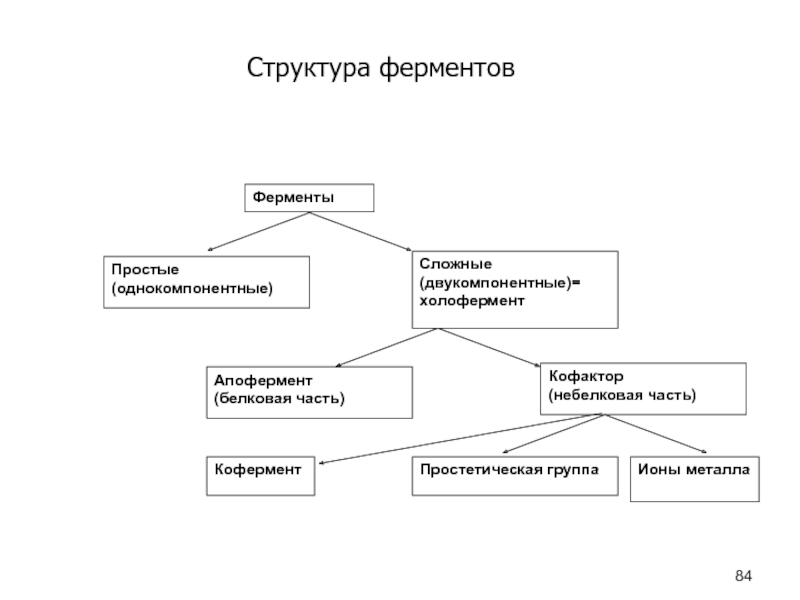
- 84. Структура ферментовФерментыПростые(однокомпонентные)Сложные(двукомпонентные)=холоферментАпофермент(белковая часть)Кофактор(небелковая часть)Ионы металлаПростетическая группаКофермент
- 85. Структурная организация ферментов Структура
- 86. Важнейшие коферменты ферментов
- 87. Невитаминные кофакторы К невитаминным кофакторам относят следующие
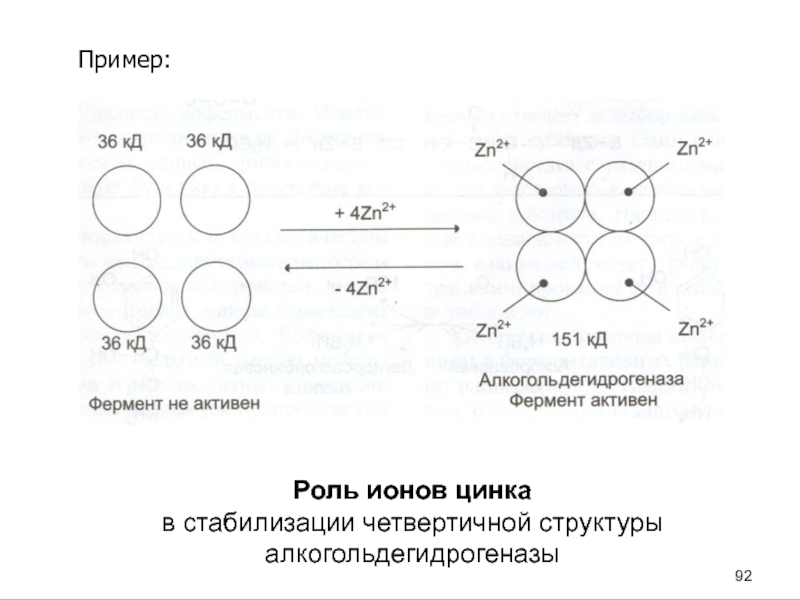
- 88. Роль металлов в функционировании ферментов1. Ионы металла
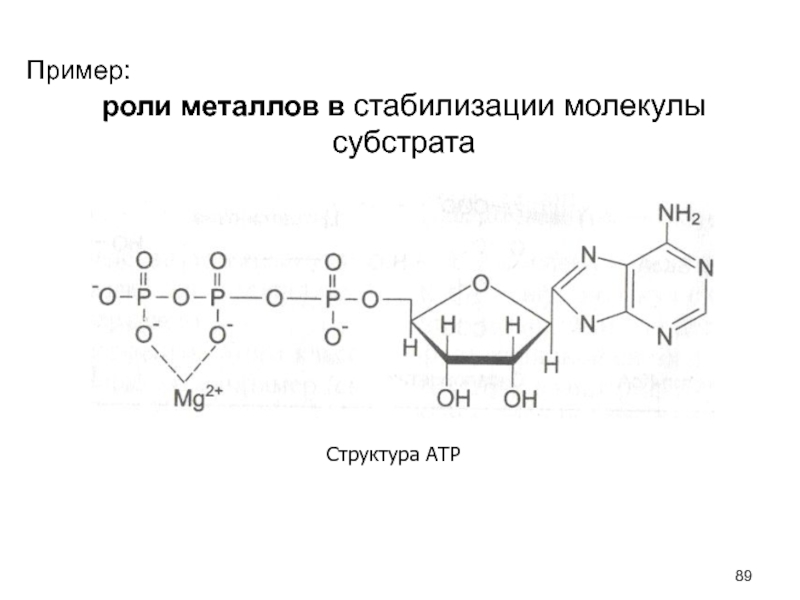
- 89. Пример:роли металлов в стабилизации молекулы субстрата Структура АТР
- 90. Слайд 90
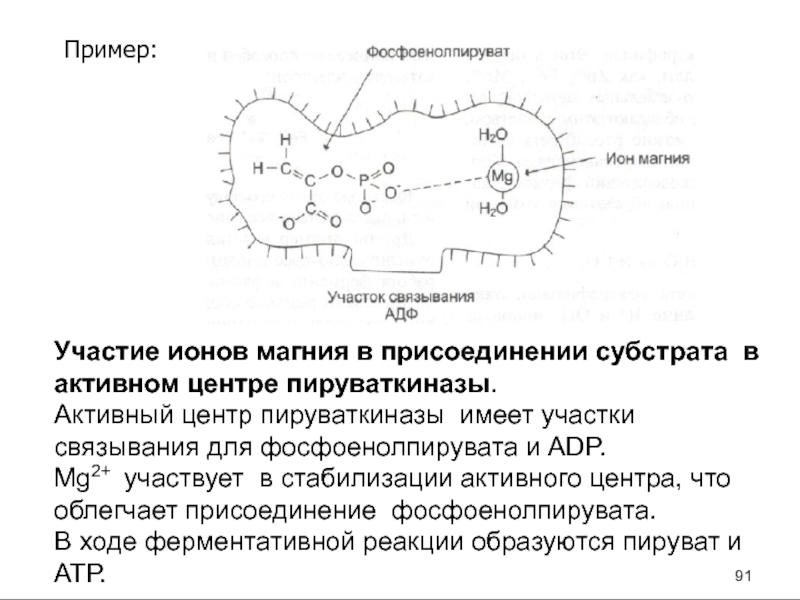
- 91. Пример:
- 92. Пример:
- 93. Активные и аллостерические центры, их характеристика Аллостерический центр
- 94. IV Механизм действия ферментовМеханизм действия ферментов может
- 95. А. Энергетические изменения при химических реакцияхЛюбые химические
- 96. Рассмотрим реакцию разложения угольнойкислоты (не ферментативной реакцией):Н2СО3
- 97. Рис. 1. Изменение свободной энергии при разложении угольной кислоты
- 98. При достижении этого энергетического барьера в молекуле
- 99. Чем больше молекул обладают энергией, превышающей уровень
- 100. Таким образом, ферменты снижают высотуэнергетического барьера, в
- 101. Рис. 2. Измение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами
- 102. Таким образом, биологические катализаторы (ферменты) не изменяют
- 103. Фермент, выполняя функцию катализатора химической реакции, подчиняется
- 104. Сходство ферментов с небиологическими катализаторами:фермент катализирует энергетически
- 105. Отличие ферментов от небиологических катализаторов:скорость ферментативных реакций
- 106. Б. Кинетика ферментативного катализаСм стр. 94Ученые Михаэлис
- 107. Влияние концентрации субстрата на скорость ферментативной реакции Ферменты. Строение, свойства, механизм действия
- 108. E+S→ES* → ES** → EP → E+P Диффузия
- 109. Механизм действия ферментовФакторы, влияющие на эффективность ферментативного катализа1. Сближение и ориентация
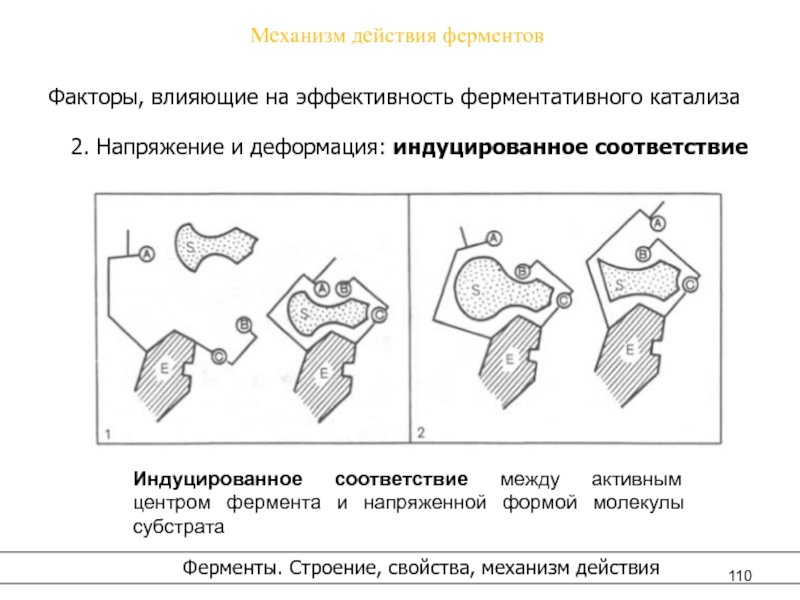
- 110. Механизм действия ферментовФакторы, влияющие на эффективность ферментативного
- 111. Молекулярные механизмы ферментативного катализаМеханизмы ферментативного катализа определяются
- 112. Сложно…..
- 113. Кислотно-основной катализКонцепция кислотно-основного катализа объясняет ферментативную активность
- 114. Факторы, влияющие на эффективность ферментативного катализа Общий кuслотно-основный катализ
- 115. К аминокислотам, участвующим в кислотно-основном катализе, в
- 116. Примером кислотно-основного катализа ,в котором кофакторами являются
- 117. Механизм кислотно-основного катализа на примере алкогольдегидрогеназы печениI
- 118. продолжение:… Отрицательный заряд перераспределяется между атомом кислорода
- 119. 2. Ковалентный катализКовалентный катализ основан на атаке
- 120. Действие «сериновых протеаз», таких как трипсин, химитрипсин
- 121. Механизм ковалентного катализа в активном центре химотрипсина
- 122. Механизм действия ферментовФакторы, влияющие на эффективность ферментативного
- 123. Специфичность действия ферментовГипотеза «ключа и замка» Ферменты.
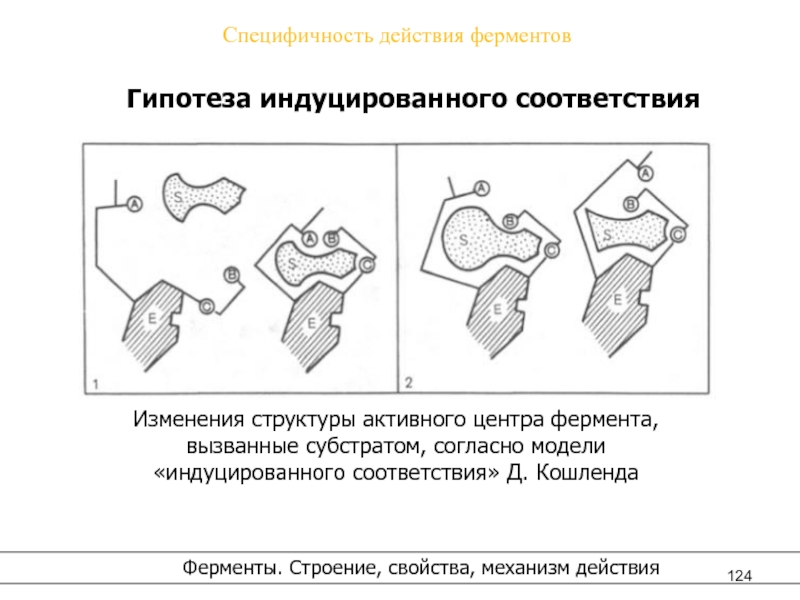
- 124. Специфичность действия ферментовГипотеза индуцированного соответствия Изменения структуры
- 125. Объяснить:Методы определения скорости ферментативных реакцияПо убыли субстрата,
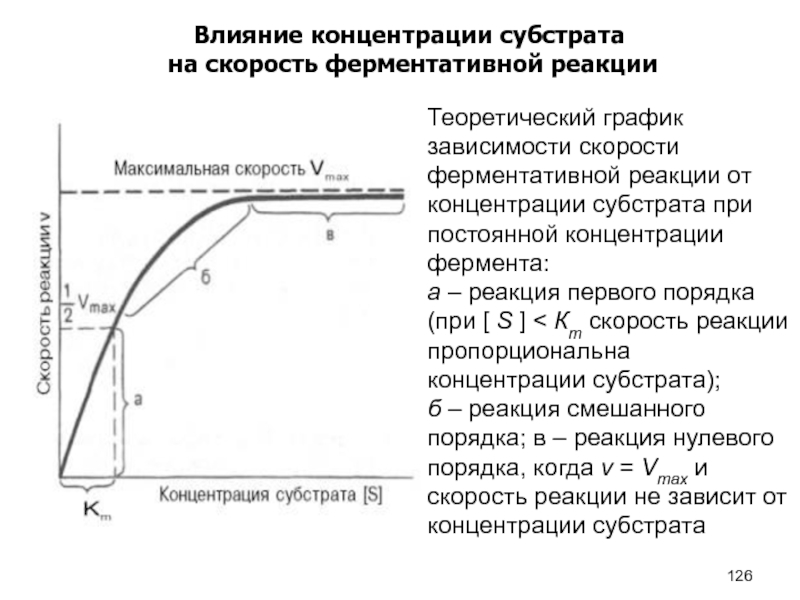
- 126. Влияние концентрации субстрата на скорость ферментативной реакции
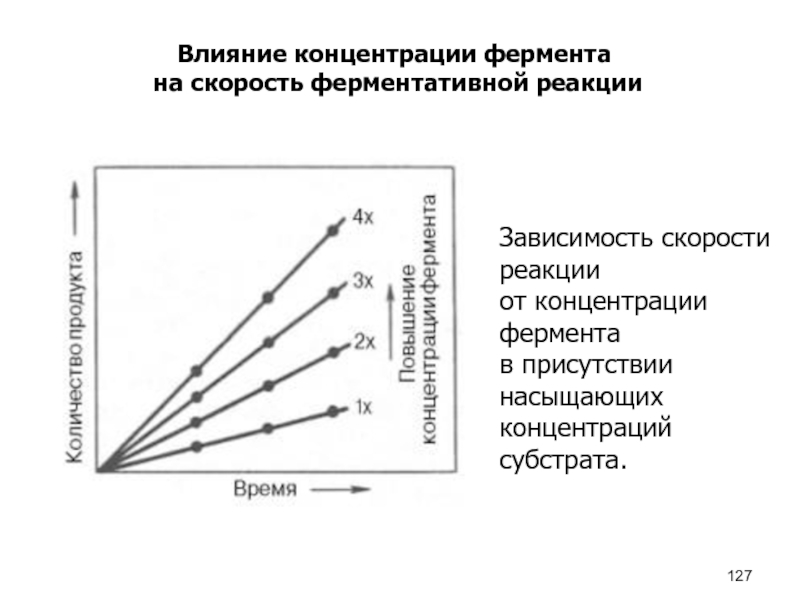
- 127. Влияние концентрации фермента на скорость ферментативной реакцииЗависимость
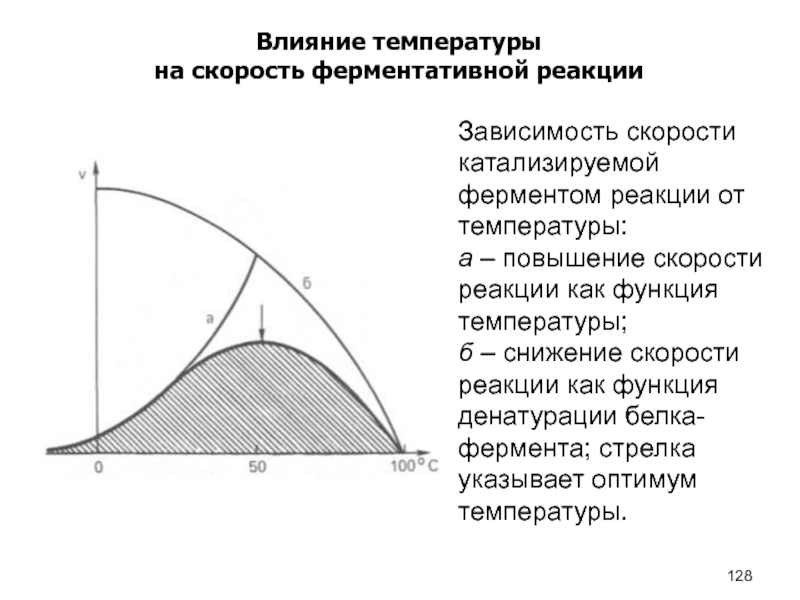
- 128. Влияние температурына скорость ферментативной реакцииЗависимость скорости катализируемой
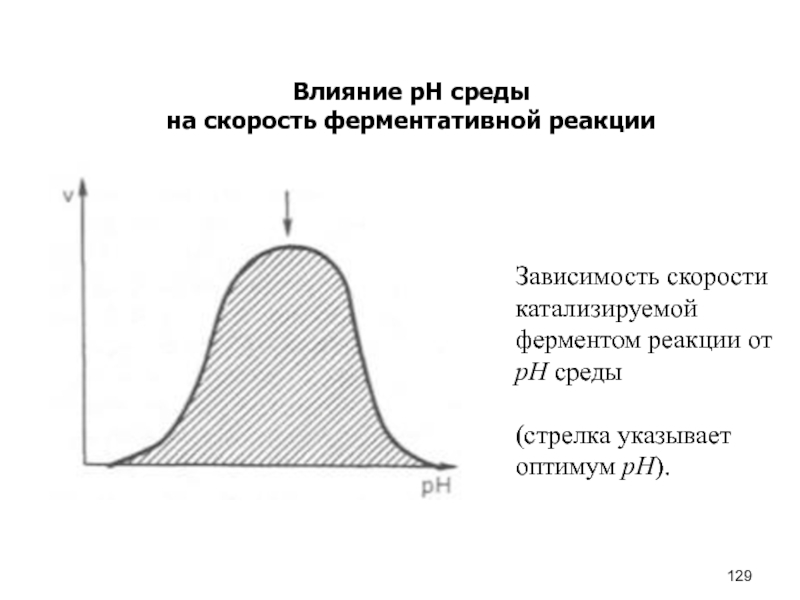
- 129. Влияние рН средына скорость ферментативной реакции
- 130. Лекция Регуляция ферментативной активности. Классификация ферментов
- 131. План лекцииАктиваторы ферментовИнгибиторы ферментовРегуляция активности ферментовКлассификация и номенклатура ферментов
- 132. Активаторы ферментов Регуляция ферментативной активности.
- 133. Ингибиторы ферментов Регуляция ферментативной активности.
- 134. Ингибиторы ферментов Регуляция ферментативной активности. Классификация ферментовНеобратимое ингибирование на примере ацетилхолинэстеразыРеакция, катализируемая ацетилхолинэстеразой
- 135. Ингибиторы ферментов Регуляция ферментативной активности. Классификация ферментовНеобратимое ингибирование на примере ацетилхолинэстеразыЕНеобратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом
- 136. Ингибиторы ферментов Регуляция ферментативной активности.
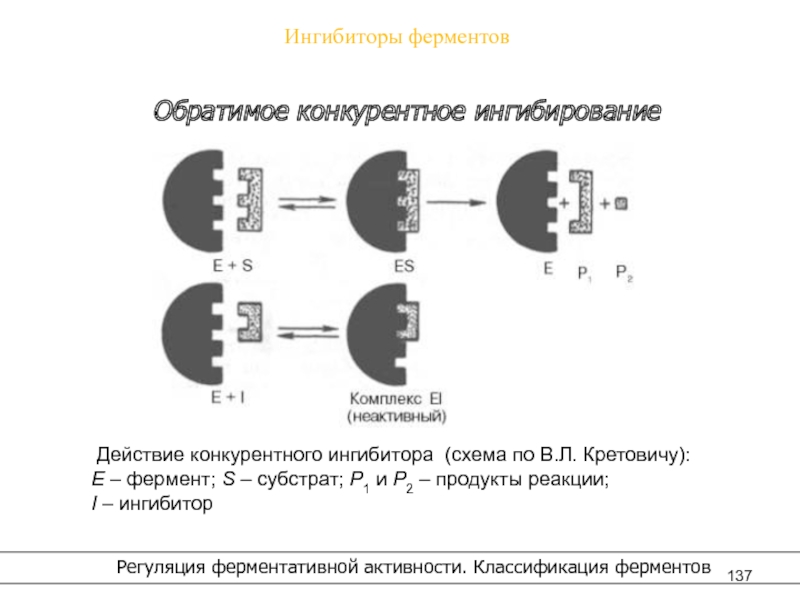
- 137. Ингибиторы ферментов Регуляция ферментативной активности. Классификация ферментовОбратимое конкурентное ингибирование
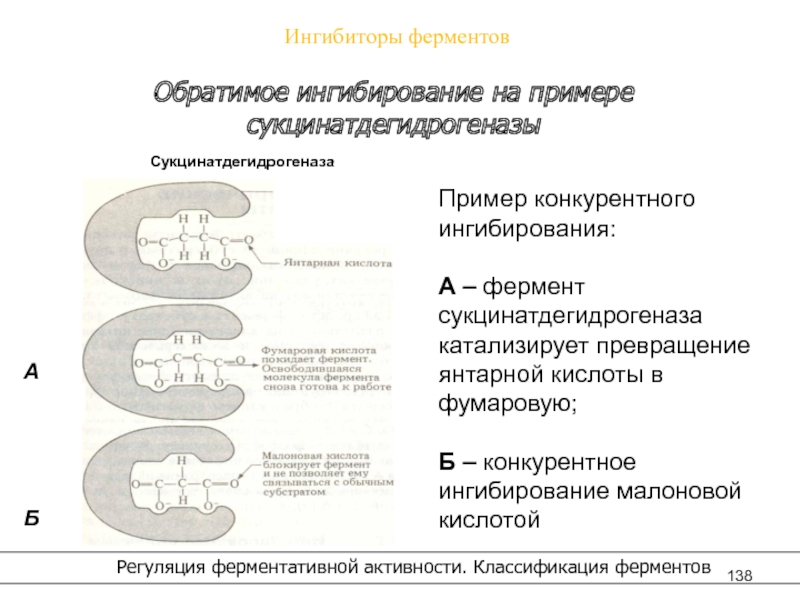
- 138. Ингибиторы ферментов Регуляция ферментативной активности. Классификация ферментовОбратимое ингибирование на примере сукцинатдегидрогеназы
- 139. ОбъяснитьОбратимое ингибирование«снимается» (ликвидируется) высокой концентрацией субстрата
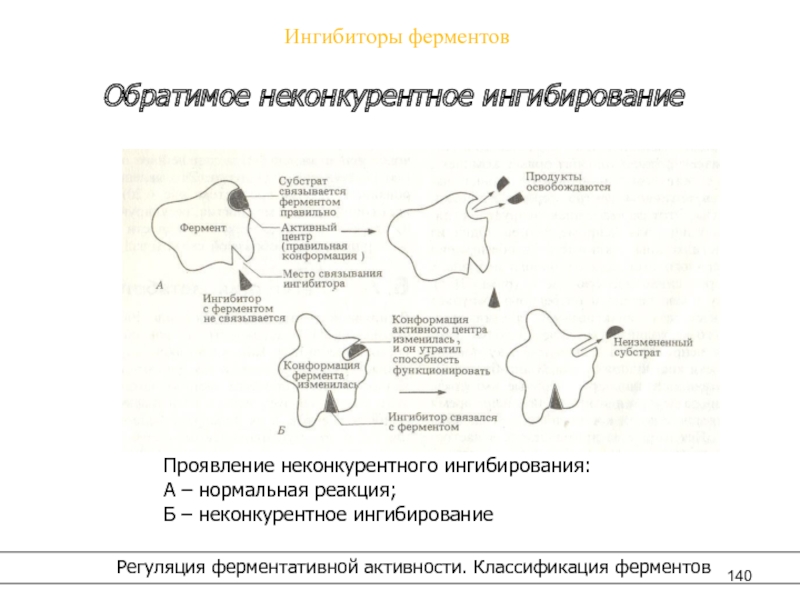
- 140. Ингибиторы ферментов Регуляция ферментативной активности.
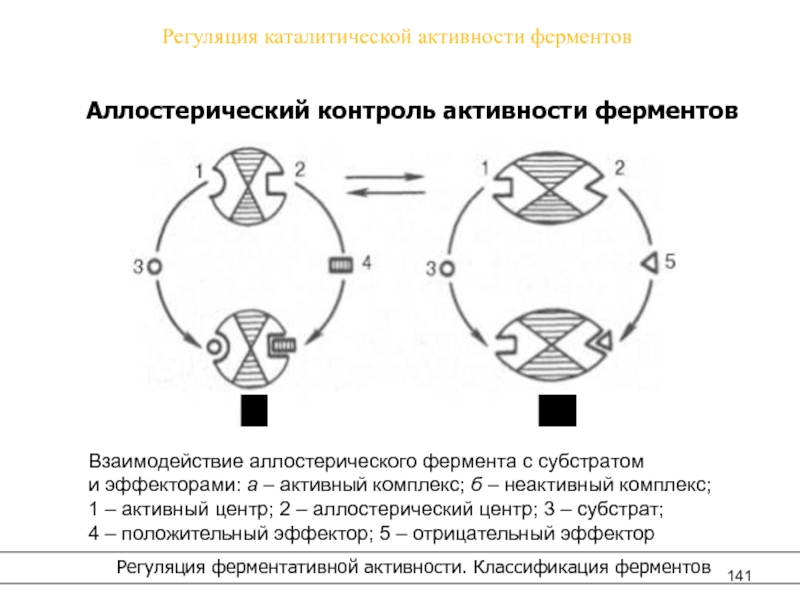
- 141. Регуляция каталитической активности ферментов Регуляция ферментативной активности. Классификация ферментовАллостерический контроль активности ферментоваб
- 142. ОбъяснитьСтроение клеткиорганеллыкомпартментыкомпартментализация клетки
- 143. Локализация ферментов в клетке
- 144. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2План лекции
Понятие о ферментах. Сущность явлений ферментативного катализа
Структурная организация ферментов
Механизм
действия ферментов
Специфичность действия ферментов
Кинетика ферментативных реакций
Факторы, влияющие на скорость ферментативных
реакцийКлассификация ферментов
Слайд 4 Практически все реакции в живом организме протекают с участием природных
биокатализаторов, называемых ферментами, или энзимами.
Слово «фермент» происходит от лат.
fеrmеntum – закваска, а «энзим» – от греч. еп – в, внутри и zyme – дрожжи.В настоящее время известно около 10000 ферментов.
Понятие о ферментах
Слайд 5
Известно, что для осуществления химической реакции
необходимо, чтобы реагирующие вещества имели
суммарную энергию выше чем величина называемая
энергетическим барьером реакции. Преодоление
энергии активации в химической реакции достигается
либо увеличением энергии взаимодействующих
молекул, например нагреванием, облучением,
повышением давления, либо снижением требуемых для
реакции затрат энергии при помощи катализаторов.
По своей сути ферменты являются биологическими
катализаторами. Сущность действия ферментов, так же
как неорганических катализаторов заключается:
Слайд 6Сущность действия ферментов, так же
как неорганических катализаторов заключается:
в активации молекул
реагирующих веществ,
в разбиении реакции на несколько стадий, энергетический барьер каждой
из которых ниже такового общей реакции.Однако энергетически невозможные реакции
ферменты катализировать не могут.
Слайд 8Рассмотрим реакцию разложения угольной
кислоты (не ферментативной реакцией):
Н2СО3 → Н2О +
СО2
Угольная кислота слабая; реакция её
разложения пойдет в обычных условиях,
еслимолекулы угольной кислоты имеют энергию
превышающую определённый уровень,
называемый энергией активации Еа (рис. 1).
Энергией активации называют
дополнительное количество кинетической энергии,
необходимое молекулам вещества, чтобы они
вступили в реакцию.
Слайд 10При достижении этого энергетического барьера в
молекуле происходят изменения, вызывающие
перераспределение химических связей и образование
новых соединений. Говорят, что молекулы, обладающие
Еа, находятся в переходном состоянии. Разницу энергий
Между исходным реагентом Н2СО3 и конечными соедине-
ниями Н2О и СО2 называют свободной энергией
реакции (ΔG). Молекулы Н2О и СО2 более стабильные
вещества, чем Н2СО3 , т.е. обладают меньшей энергией и
при обычных условиях практически не реагируют.
Выделившаяся энергия рассеивается в виде тепла.
В нашем организме эту реакцию осуществляет фермент
карбоангидраза при 37○С.
Слайд 111) катализируют только энергетически возможные реакции, т. е. те реакции,
которые могут протекать и без них;
2) не изменяют направление реакции;
3)
не сдвигают равновесие обратимой реакции,
а лишь ускоряют его наступление;4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде.
Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты:
Слайд 121) Скорость ферментативных реакций намного выше;
2) Высокая специфичность;
3) Мягкие условия
работы (внутриклеточные);
4) Возможность регулирования скорости реакции;
5) Скорость ферментативной реакции пропорциональна
количеству фермента. Отличие ферментов от небиологическими катализаторами заключается в том, что ферменты:
Слайд 13Этапы ферментативного катализа
В ферментативной реакции можно выделить
следующие этапы:
Присоединение
субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2.
Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Слайд 14 Механизмы ферментативного катализа
Кислотно-основной катализ –
в активном центре фермента
находятся группы специфичных
аминокислотных остатков (радикалов ), которые являются
хорошими
донорами или акцепторами протонов. Такие группы представляют собой мощные
катализаторы многих органических реакций.
Слайд 15
2. Ковалентный катализ – ферменты реагируют со
своими субстратами, образуя
при помощи
ковалентных связей очень нестабильные
фермент-субстратные комплексы, из которых
в ходе внутримолекулярных перестроек
образуются продукты реакции.
Слайд 17Общая характеристика
Ферменты имеют белковую природу и обладают всеми
свойствами, характерными
для белков:
При гидролизе ферменты как и белки распадаются на аминокислоты
Молекулярная
масса ферментов, как и белков 10 000 - 1 000 000 Да.Ферменты амфотерны, обладают электрофоретической подвижностью, имеют ИЭТ, подвергаются денатурации и др.
Подобно белкам они делятся на простые и сложные
Слайд 18Простые ферменты состоят только из аминокислот – например, пепсин, трипсин,
лизоцим.
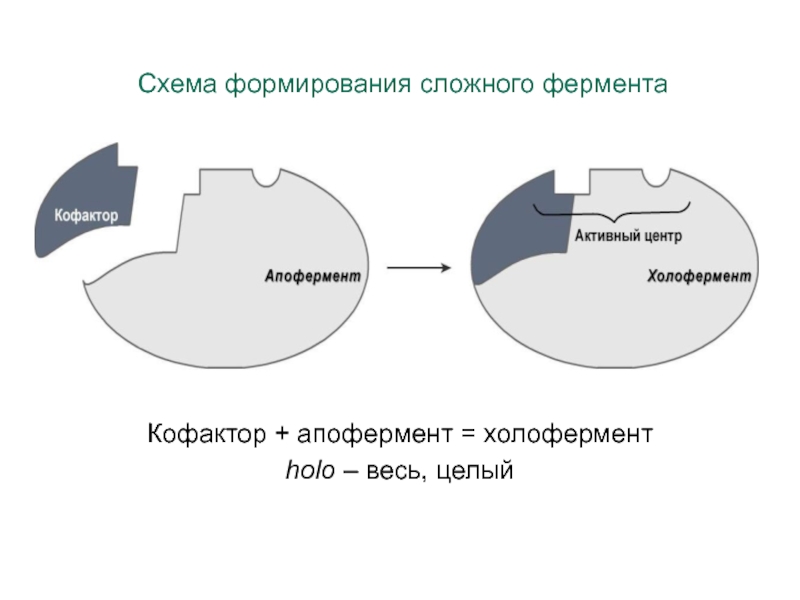
Сложные ферменты (холоферменты) имеют в
своем составе белковую часть,
состоящую из аминокислот – апофермент, и небелковую часть –
кофактор.
Кофактор, в свою очередь, может называться
коферментом или простетической группой.
Примером могут быть:
- сукцинатдегидрогеназа (содержит ФАД),
- аминотрансферазы (содержат пиридоксальфосфат),
- пероксидаза (содержит гем).
Кофакторы – ионы металлов, коферменты –
низкомолекулярные вещества небелковой природы, чаще всего
витамины.
Слайд 20
У сложных ферментов в активном центре
обязательно расположены функциональные
группы
кофактора. Кофактор участвует в связывании
субстрата или в его превращении.
Для
осуществления катализа необходим полноценныйкомплекс апобелка и кофактора,
по отдельности катализ они осуществить не могут.
Как и многие белки, ферменты могут быть мономерами,
т.е. состоят их одной субъединицы, и полимерами,
состоящими из нескольких субъединиц
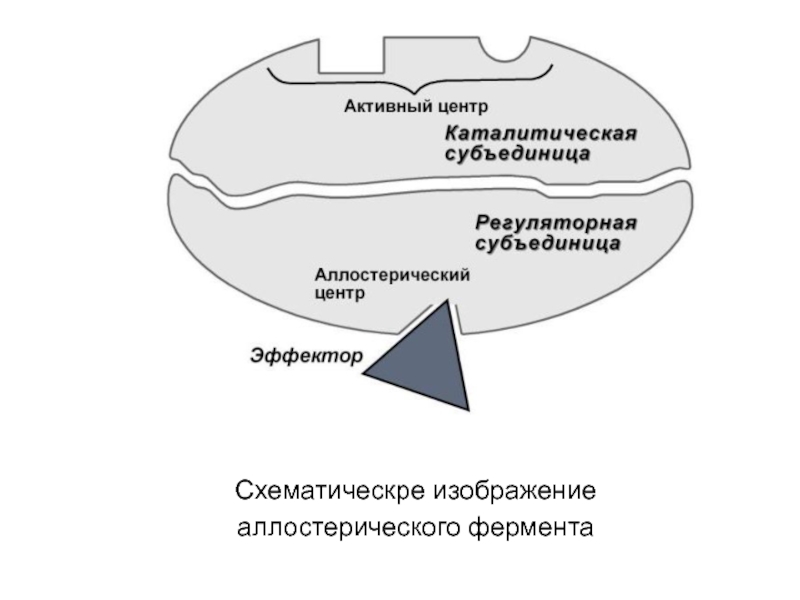
Слайд 212. Аллостерический центр (allos – чужой) – центр
регуляции активности
фермента, который пространственно
отделен от активного центра и имеется не у
всех ферментов.
Связывание с аллостерическим центром какой-либо
молекулы (называемой активатором или ингибитором, а
также эффектором, модулятором, регулятором) вызывает
изменение конфигурации белка-фермента и, как следствие,
скорости ферментативной реакции. В качестве такого
регулятора может выступать продукт данной или одной из
последующих реакций, субстрат реакции или иное
вещество.
Аллостерические ферменты являются полимерными
белками, их активный и регуляторный центры находятся в
разных субъединицах.
Слайд 23Структурно-функциональная организация ферментов
или как ферменты работают.
В составе фермента выделяют области,
выполняющие
различную функцию:
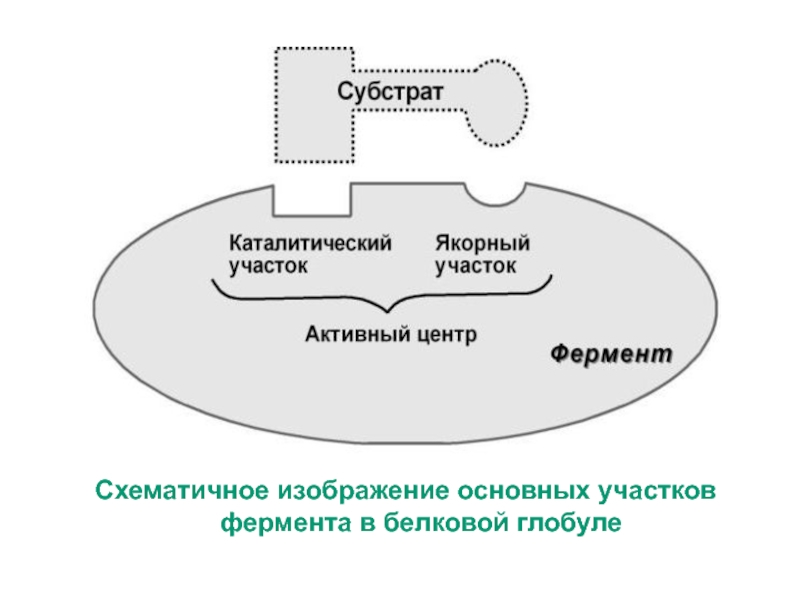
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая
непосредственное связывание с молекулой субстрата и осуществляющая катализ.В активном центре выделяют два участка:
- якорный (контактный, связывающий)
- каталитический.
Ферменты состоящий из нескольких мономеров могут иметь
несколько активных центров. У сложных ферментов в активном
центре расположен кофактор.
Слайд 24Биологическая функция фермента, как и любого
белка обусловлена наличием в его
структуре
активного центра. Лиганд, взаимодействующий
с активным центром фермента, называют субстратом
(Substrat).
В активном центре фермента есть аминокислотные
остатки, функциональные группы которых обеспечивают
связывание субстрата, и аминокислотные остатки,
функциональные группы которых осуществляют
химическое превращение субстрата.
Условно эти группы обозначают как
участок связывания субстрата (якорный участок) и
каталитический участок.
Слайд 26Строение активного центра фермента (1)
А – присоединение субстрата к ферменту
в активном центре
Б – положение аминокислотных остатков, формирующих активный центр
фермента, в первичной структуре белка
Слайд 27Строение активного центра фермента (2)
В –активный центр фермента условно разделяется
на участок связывания и каталитический участок
Слайд 29Что означает выражение
«активность фермента»?
При сравнении в характеристике ферментов и
их
изоформ есть понятия:
активный фермент,
малоактивный
фермент, неактивный фермент и др.
Это означает способность, скорость с которой
ферменты осуществляют химические превращения
своих субстратов. Определение количества фермента
не является таким показателем. Активность более
широкое понятие.
Слайд 30Активность фермента подразумевает результат
реакции, а именно убыль субстрата или
накопление
продукта. Естественно при этом нельзя игнорировать
время, которое потратил фермент,
и число молекул Фермента. Но так как число молекул фермента не
всегда можно подсчитать, то используют количество
биологического материала, содержащего фермент
(объем или массу).
Следовательно при определении активности ферментов учитываются три переменные:
1. масса полученного продукта или исчезнувшего
субстрата,
2. время потраченное на реакцию,
3. количество фермента или массу или объем
биологического материала, содержащего фермент.
Слайд 311. Активность фермента выражается в скорости накопления продукта или скорости
убыли субстрата в пересчете на количество материала, содержащего фермент за
единицу времени.В практике обычно используют:
единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
единицы времени – минута, час, секунда,
единицы массы или объема – грамм (кг, мг), литр (мл).
Международная единица активности (МЕ, Unid)
соответствует мкМоль/мин
Слайд 32Таким образом, активность фермента может
выражаться, например, в
ммоль /
с × л,
г / час × л,
МЕ/л,
кат/мл
и т.д. Например,
- известно, что 1 г пепсина расщепляет 50 кг
яичного белка за один час – таким образом, его
активность составит 50 кг/час на 1 г фермента.
Если количество слюны в 1,6 г расщепляет 175 кг
крахмала в час – активность амилазы слюны составит
109,4 кг крахмала в час на 1 г слюны.
Слайд 332. Создание стандартных условий, чтобы можно было сравнивать результаты, полученные
в разных лабораториях
- оптимальная рН, и
фиксированная температура,
например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом.
3. Избыток субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.
Слайд 34От чего зависит активность ферментов?
Свойства ферментов
Активность ферментов зависит от:
-
температуры,
- рН,
- концентрации субстрата,
- концентрации фермента
Слайд 37Зависимость скорости реакции от концентрации субстрата
Зависимость скорости реакции от
концентрации фермента
Слайд 39Ферменты избирательны в своём действии
Специфичность, т.е. высокая избирательность
действия ферментов,
основана на комплементарности
структуры субстрата и активного центра фермента.
Разные ферменты по
отношению к субстрату проявляют:- стереоспецифичность,
- абсолютную специфичность,
- групповую специфичность,
- относительную специфичность.
Слайд 401 Стереоспецифичность
При наличии у субстрата нескольких
стереоизомеров фермент проявляет абсолютную
специфичность к одному из них.
В организме человека наблюдают специфичность
ферментов к следующим стереоизомерам.
Стереоспецифичность к
D-сахарам,
L-аминокислотам,
цис- транс- изомерам,
альфа- и бета- гликозидным связям.
Слайд 41пример: Стереоспецифичность к
цис-транс-изомерам
Фермент фумараза оказывает действие только на
фумарат.
Малеинат (цис-изомер фумарата) не
является субстратом фумаразы.
Слайд 42Абсолютная субстратная специфичность
Активный центр фермента комплементарен только
одному субстрату. Таких
ферментов мало.
Пример: фермент аргиназа, катализирующая
реакцию расщепления аргинина до мочевины
и орнитина.
Слайд 43
Другой пример фермента с абсолютной
субстратной специфичностью уреаза,
катализирующая гидролиз
мочевины до диоксида
углерода и аммиака
Слайд 44Групповая субстратная специфичность
Большинство ферментов катализируют
однотипные реакции с небольшим количеством
(группой)
структурно похожих субстратов.
Примеры:
- протеолитические ферменты гидролизующие
пептидные связи в
белках (пепсин, трипсин, химотрипсин),
- панкреатическая липаза гиролизует
триациацилглицерины или жиры и масла.
Слайд 46Относительная специфичность – превращение
субстратов с некоторыми общими признаками.
Например,
цитохром Р450 окисляет только
гидрофобные вещества, которых насчитывается
около 7000.
Слайд 47МЕХАНИЗМЫ СПЕЦИФИЧНОСТИ
В общем виде все сводится к комплементарному
взаимодействию
фермента и субстрата. При этом
функциональные группы субстрата взаимодействуют
с соответствующими
им функциональными группами фермента. Наличие субстратной специфичности
объясняют две гипотезы:
1. Гипотеза Фишера
2. Гипотеза Кошланда
Слайд 48Гипотеза Фишера
(модель "жесткой матрицы", "ключ-замок") –
активный центр фермента
строго соответствует
конфигурации субстрата и не изменяется при его
присоединении.
Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
Слайд 492. Гипотеза Кошланда (модель "индуцированного
соответствия", "рука-перчатка") – подразумевает
гибкость
активного центра. Присоединение субстрата к
якорному участку фермента вызывает изменение
конфигурации каталитического центра таким образом,
чтобы его форма соответствовала форме субстрата.
Слайд 50РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ IN VIVO
Активность ферментов в клетке непостоянна во
времени. Она чутко реагирует на ситуацию, в
которой оказывается клетка,
на факторы, воздействующие на клетку как снаружи, так и изнутри.
Главная цель этой реакции – отреагировать на
изменение окружающей среды, приспособить клетку к
новым условиям, дать должный ответ на
гормональные и иные стимулы, а в некоторых
ситуациях – получить шанс выжить.
Слайд 51
1. Компартментализация,
2. Доступность субстрата или кофермента,
3. Изменение количества фермента,
4. Ограниченный
частичный протеолиз
проферментов,
5. Аллостерическая регуляция
Слайд 52Компартментализация.
Компартментализация – это сосредоточение
ферментов и их субстратов в
одном компартменте
(одной органелле) – в эндоплазматическом
ретикулуме, митохондриях, лизосомах.
Например,
- бета-окисление жирных кислот протекает в митохондриях,
- синтез белка – в рибосомах,
- синтез иРНК в ядре, для эукариотов.
И ферменты осуществляющие эти процессы
находятся только в этих органеллах (компартментах)
.
Слайд 532. Доступность субстрата или кофермента.
Здесь работает закон действия масс
– фундаментальный
закон химической кинетики: при постоянной температуре
скорость химической реакции пропорциональна
произведению концентрации реагирующих веществ.
Или упрощенно – скорость, с которой вещества реагируют
друг с другом, зависит от их концентрации.
Таким образом, изменение количества хотя бы одного из
субстратов прекращает или начинает реакцию.
Для цикла трикарбоновых кислот таким субстратом
является оксалоацетат (щавелевоуксусная кислота).
3. Изменение количества фермента.
Слайд 553. Изменение количества фермента.
Изменение количества фермента может происходить в
результате увеличения или снижения его синтеза.
Изменение скорости синтеза фермента
обычно зависит от количества определенных гормонов или субстратов
реакции.
Например, гормон кортизол стимулирует синтез ферментов
глюконеогенеза, что обеспечивает стабильность
концентрации глюкозы в крови и устойчивость ЦНС к стрессу.
- При беременности и после родов под воздействием
лактотропного гормона в молочной железе активно идет
синтез фермента лактозосинтазы.
- Исчезновение пищеварительных ферментов при длительном
голодании и их появление в восстановительный период (в
результате изменения секреции кишечных гормонов).
- Этанол стимулирует в печени синтез "своего" фермента (обезвреживающего спирт) - изофермента Р450.
Слайд 564. Ограниченный (частичный) протеолиз проферментов.
Т.к. синтез некоторых ферментов осуществляется
в виде
более крупного предшественника (трипсиноген,
пепсиноген, прокарбоксипептидазы, факторы
свертывания
крови), то при поступлении в нужное место этот фермент активируется через отщепление от него одного или
нескольких пептидных фрагментов.
Слайд 575. Аллостерическая регуляция.
Аллостерические ферменты построены из двух и
более субъединиц:
одни субъединицы содержат
каталитический центр, другие являются регуляторными.
Присоединение эффектора к
аллостерической (регуляторной) субъединице изменяет
конформацию белка и активность каталитической
субъединицы.
Аллостерические ферменты обычно стоят в начале
метаболических путей, и от их активности зависит
течение многих последующих реакций. Поэтому они
часто называются ключевыми ферментами.
Слайд 58В качестве отрицательного регулятора может
выступать конечный метаболит биохимического процесса,
продукт данной реакции, т.е работает механизм обратной
отрицательной связи. Если
регуляторами являются начальный метаболит или субстрат реакции, то говорят о
прямой положительной регуляции.
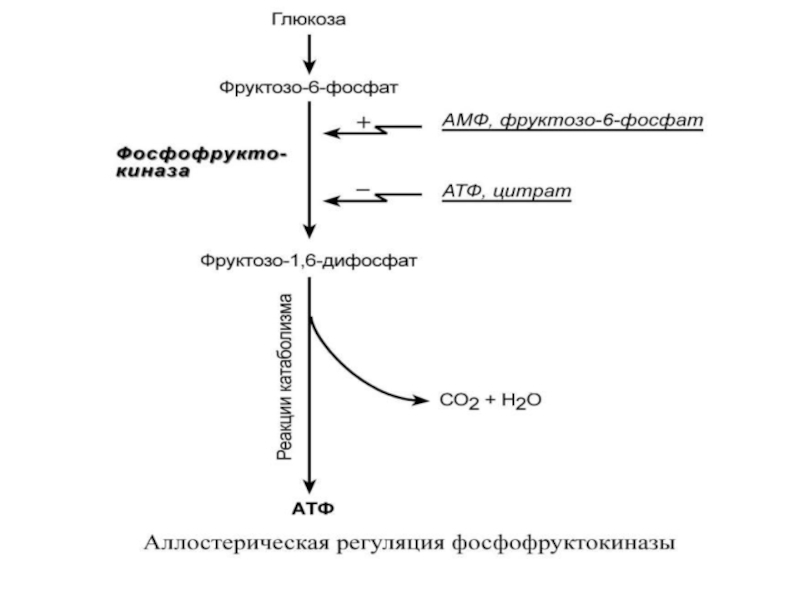
Слайд 59
Например,
фермент энергетического распада глюкозы,
фосфофруктокиназа, регулируется промежуточными
И конечными
продуктами этого распада.
При этом АТФ, лимонная кислота,
фруктозо-1,6-дифосфат являются
ингибиторами, а фрук-тозо-6-фосфат и АМФ – активаторами
фермента.
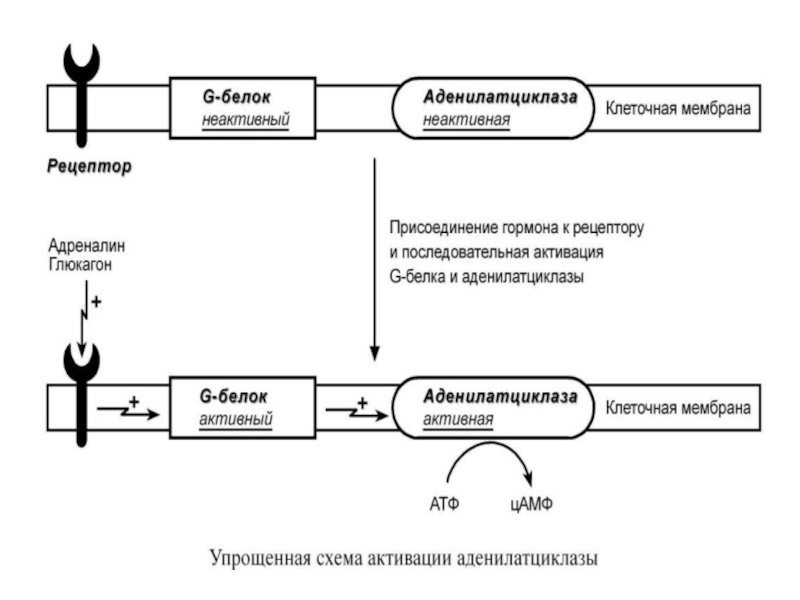
Слайд 616. Белок-белковое взаимодействие.
Термин белок-белковое взаимодействие обозначает
ситуацию, когда в качестве
регулятора выступают не
метаболиты биохимических процессов, а
специфичные белки (гормоны и
др). Влияние каких-либо факторов на эти белки
изменяет их активность, и они, в свою очередь,
воздействуют на нужный фермент.
К примеру, мембранный фермент аденилатциклаза
является чувствительным к воздействию
мембранного G-белка, который сам активируется при
действии на клетку некоторых гормонов (например,
адреналина и глюкагона).
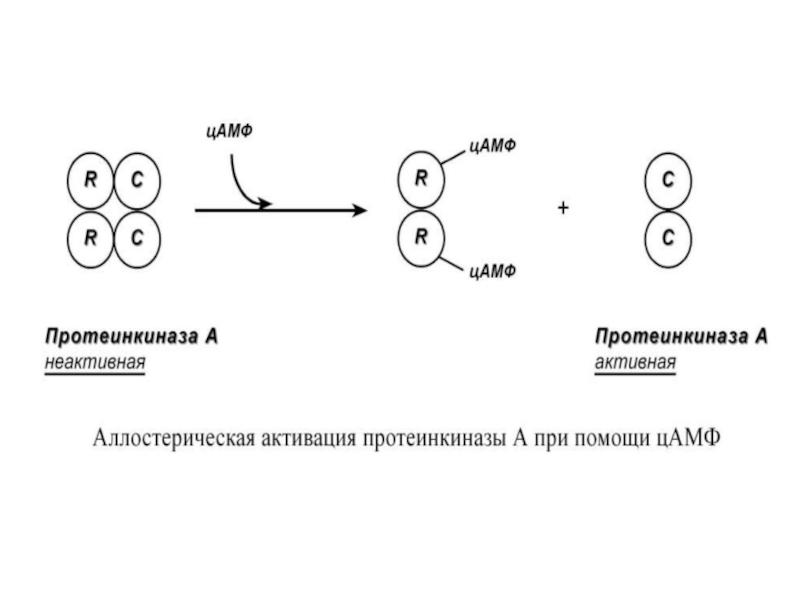
Слайд 63Другим примером белок-белкового взаимодействия
может быть регуляция активности протеинкиназы А.
Протеинкиназа А является тетрамерным ферментом,
состоящим из 2 каталитических (С)
и 2 регуляторных (R)субъединиц. Активатором для протеинкиназы А
является цАМФ. Присоединение цАМФ к регуляторным
субъединицам фермента вызывает изменение их
конформации и отхождение от каталитических
субъединиц.
Каталитические субъединицы при этом активируются.
Слайд 657. Ковалентная (химическая) модификация.
Ковалентная модификация заключается в
обратимом присоединении
или отщеплении
определенной группы, благодаря чему изменяется
активность фермента. Чаще всего
такой группой является фосфорная кислота, реже метильные и
ацетильные группы. Фосфорилирование фермента
происходит по остаткам серина, треонина, тирозина.
Присоединение фосфорной кислоты к белку
осуществляют ферменты протеинкиназы,
отщепление – протеин-фосфатазы.
Слайд 66Ферменты могут быть активны как в фосфорилированном так
и в
дефосфорилированном состоянии.
Например, ферменты гликогенфосфорилаза и
гликогенсинтаза при потребности организма
в глюкозе фосфорилируются, при этом фосфорилаза гликогена
становится активной и начинает расщепление гликогена, а
гликогенсинтаза неактивна.
При необходимости синтеза гликогена оба фермента
дефосфорилируются, синтаза при этом становится активной,
фосфорилаза – неактивной.
Слайд 67II классификация и номенклатура ферментов
Каждый фермент имеет 2 названия.
Первое
короткое, так называемое рабочее.
Второе (более полное) систематическое.
Рабочее название
В названиях большинства
ферментов содержится суффикс «аза», присоединённый к названию субстрата
реакции,
например уреаза, сахараза, липаза, нуклеаза
или к названию химического превращения определённого
субстрата, например лактатдегидрогеназа,
аденилатциклаза, фосфоглюкомутаза,
пируваткарбоксилаза.
Слайд 68II классификация и номенклатура ферментов
В 1961 г в Москве V
Международный биохимический
союз принял современную классификацию ферментов.
В соответствии с
этой классификацией все ферментыделятся:
на классы – по типу катализируемой реакции,
каждый класс подразделяется на подклассы – по природе атакуемой химической группы,
подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора.
Слайд 69Каждому ферменту присвоен четырехзначный
классификационный номер, включающий класс, подкласс,
подподкласс
и порядковый номер в подподклассе.
Например,
алкогольдегидрогеназа имеет номер КФ
1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в
качестве акцептора с первым порядковым номером в своем
подподклассе; лактатдегидрогеназа – КФ 1.1.1.27,
действует на ОН-группу донора с НАД в качестве
акцептора с порядковым номером 27 в своем подподклассе
Слайд 70Номенклатера ферментов
Тривиальное название – название, сложившееся исторически.
Например, пепсин, трипсин.
Для некоторых ферментов к названию субстрата добавляется окончание "-аза" –
уреаза, амилаза, липаза. 2. Систематическое название – согласно современной классификации. Как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий.
Слайд 721 КФ. оксидоредуктазы
Дегидрогеназы осуществляют отщепление водорода от субстрата. В качестве
акцепторов используются НАД+, НАДH+, ФАД, ФМН
Слайд 731 КФ. оксидоредуктазы
Другой пример:
У оксидоредуктаз, акцептором электрона(ов) служит молекулярный кислород.
Слайд 753 КФ. Гидролазы
Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением
молекулы воды по месту разрыва). Это протеазы, липазы…
Слайд 764 КФ. Лиазы
К лиазам относят ферменты, отщепляющие от субстрата негидролитическим
путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,
SH2 или другие) или присоединение, чаще всего молекулы воды, по двойной связиСлайд 775 КФ. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от
типа реакции изомеризации.
Слайд 796 КФ. Лигазы (или синтетазы)
Катализируют реакции присоединения друг к другу
молекул
с образованием ковалентной связи. Этот процесс сопряжен
с разрывом фосфоэфирной связи
в молекуле АТФ или других макроэргических соединений
Слайд 82III. Кофакторы и коферменты
Большинство ферментов для проявления
ферментативной активности нуждается
в
низкомолекулярных органических
соединениях небелковой природы -
КОФЕРМЕНТах.
и/или ионах металлов -
КОФАКТОРах.Слайд 83Большинство ферментов состоит из
термолабильной белковой части и
термостабильного небелкового
фактора –
кофермента.
Белковую часть называют «апофермент»,
который в отсутствии кофермента не
обладает каталитической активностью.
Кофермент с белковой молекулой
(апоферментом) формируют молекулу
холофермента, обладающую
каталитической активностью.
(«холо» = весь целый, холофермент = апофермент + кофермент)
Слайд 84Структура ферментов
Ферменты
Простые
(однокомпонентные)
Сложные
(двукомпонентные)=
холофермент
Апофермент
(белковая часть)
Кофактор
(небелковая часть)
Ионы металла
Простетическая группа
Кофермент
Слайд 85
Структурная организация ферментов
Структура ферментов
Согласно одной из классификаций все
коферменты делят
на 2 группы:– производные витаминов;
– невитаминные кофакторы.
Слайд 87Невитаминные кофакторы
К невитаминным кофакторам относят следующие соединения:
– НS-глутатион,
– АТФ,
–
липоевая кислота,
– производные нуклеозидов (уридинфосфат, цитидинфосфат,
фосфоаденозинфосфосульфат),– порфиринсодержащие вещества,
– тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот к рибосоме, где осуществляется синтез белка.
Слайд 88
Роль металлов в функционировании ферментов
1. Ионы металла выполняют функцию стабилизаторов
молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента,
а именно третичной и четвертичной структур:а) ионы металлов – стабилизаторы молекулы субстрата;
б) ионы металлов – стабилизаторы активного центра фермента;
в) роль металлов в стабилизации третичной и четвертичной структуры фермента;
2. Ионы металлов могут принимать непосредственное участие в акте катализа:
а) участие в электрофильном катализе;
б) участие в окислительно-восстановительных реакциях;
3. Роль металлов в регуляции aктивности ферментов.
Слайд 93Активные и аллостерические центры, их характеристика
Аллостерический центр (или центры)
(от
греч. allos– другой, иной и
steros– пространственный, структурный) –
участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы),молекулы которых отличаются по структуре от субстратов.
Слайд 94IV Механизм действия ферментов
Механизм действия ферментов может быть рассмотрен с
2-х позиций:
С точки зрения изменения энергетики химических реакций и
С точки
зрения событий в активном центреСлайд 95А. Энергетические изменения при химических реакциях
Любые химические реакции протекают
подчиняясь
двум основным законам
термодинамики:
Закону сохранения энергии
2. Закону энтропии
…общая
энергия химической системы и её окружения остаётся постоянной, при этом химическая система
стремится к снижению упорядоченности (то есть
увеличению энтропии).
Энтропия – мера беспорядка.
Слайд 96Рассмотрим реакцию разложения угольной
кислоты (не ферментативной реакцией):
Н2СО3 → Н2О +
СО2
Угольная кислота слабая; реакция её
разложения пойдет в обычных условиях,
еслимолекулы угольной кислоты имеют энергию
превышающую определённый уровень,
называемый энергией активации Еа (рис. 1).
Энергией активации называют
дополнительное количество кинетической энергии,
необходимое молекулам вещества, чтобы они
вступили в реакцию.
Слайд 98При достижении этого энергетического барьера в
молекуле происходят изменения, вызывающие
перераспределение химических связей и образование
новых соединений. Говорят, что молекулы, обладающие
Еа, находятся в переходном состоянии. Разницу энергий
Между исходным реагентом Н2СО3 и конечными соедине-
ниями Н2О и СО2 называют свободной энергией
реакции (ΔG). Молекулы Н2О и СО2 более стабильные
вещества, чем Н2СО3 , т.е. обладают меньшей энергией и
при обычных условиях практически не реагируют.
Выделившаяся энергия рассеивается в виде тепла.
Слайд 99Чем больше молекул обладают энергией,
превышающей уровень Еа, тем выше
скорость
химической реакции.
Повысить скорость химической реакции можно
нагреванием. При этом
увеличивается скорость реагирующих молекул. Однако для живых организмов
высокие температуры губительны, поэтому в клетке
для ускорения химических реакций используются
ферменты.
Ферменты обеспечивают высокую скорость реакций
при оптимальных условиях, существующих в клетке,
путём понижения уровня энергии активации (Еа)
субстрата(ов).
Слайд 100Таким образом, ферменты снижают высоту
энергетического барьера, в результате возрастает
количество
реакционно-способных молекул,
следовательно, увеличивается скорость реакции.
В механизме ферментативного катализа решающее
значение имеет образование нестойких
промежуточных соединений –
фермент-субстратный комплекс ES,
подвергающийся превращению в нестабильный
переходный комплекс ЕР, который
почти мгновенно распадается на свободный
фермент и продукт реакции (Е + Р).
E+S→ES* → ES** → EP → E+P
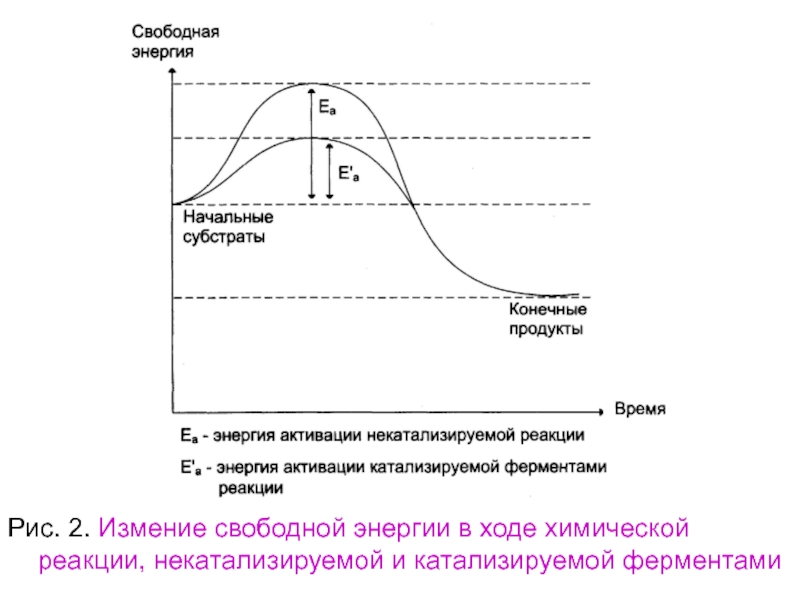
Слайд 101Рис. 2. Измение свободной энергии в ходе химической реакции, некатализируемой
и катализируемой ферментами
Слайд 102Таким образом, биологические катализаторы (ферменты)
не изменяют свободную энергию субстратов
и поэтому не
меняют равновесие
реакции (рис. 2).
Объяснение к рис.
2. Фермент понижает активацию Еа, т.е. снижает
высоту энергетического барьера, в результате
возрастает доля реакционно-способных молекул,
следовательно, увеличивается скорость реакции.
Слайд 103
Фермент, выполняя функцию катализатора
химической реакции, подчиняется общим законам
катализа
и обладает всеми свойствами,
характерными для небиологических катализаторов,
однако имеет и
отличительные свойства, связанные сособенностями строения ферментов.
Слайд 104Сходство ферментов с небиологическими катализаторами:
фермент катализирует энергетически возможные реакции;
энергия химической
системы остается постоянной;
в ходе реакции направление реакции не изменяется;
ферменты не
расходуются в ходе реакции.Слайд 105Отличие ферментов от небиологических катализаторов:
скорость ферментативных реакций выше, чем реакций
катализируемых
небелковыми катализаторами;
ферменты обладают высокой специфичностью;
ферментативная реакция проходит в клетке,
т.е.при температуре 37ºС,
постоянном атмосферном давлении и
физиологическом значении рН;
скорость ферментативной реакции можно регулировать.
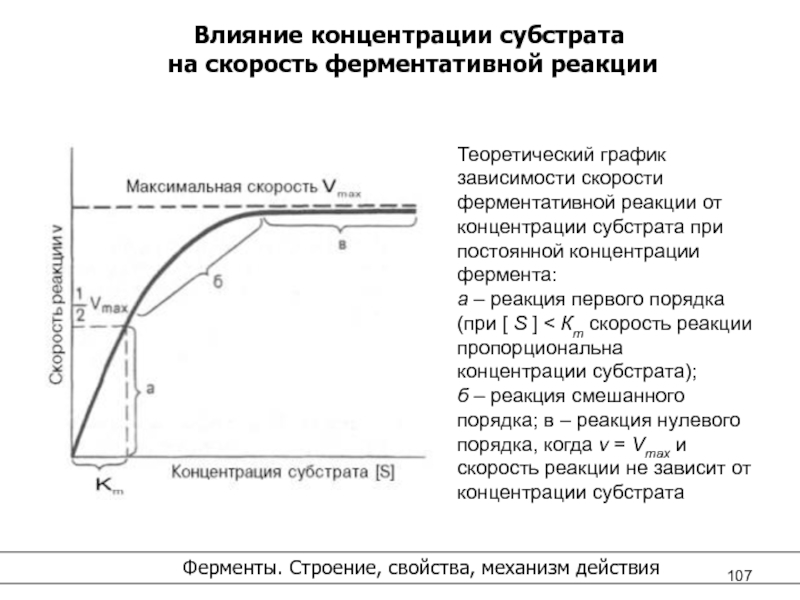
Слайд 106Б. Кинетика ферментативного катализа
См стр. 94
Ученые Михаэлис и Ментен разработали
теорию
взаимодействия фермента и субстрата.
Константа Михаэлис-Ментен (Кm) показывает
концентрацию субстрата при которой
достигается ½ V max (1/2 скорости фермента).
Кm показывает сродство фермента к субстрату,
чем меньше её значение, тем больше сродство.
Слайд 107
Влияние концентрации субстрата
на скорость ферментативной реакции
Ферменты. Строение,
свойства, механизм действия
Слайд 108
E+S→ES* → ES** → EP → E+P
Диффузия субстрата(S) к ферменту(E)
и стерическое связывание его с активным центром фермента, т. е.
образованиефермент-субстратного комплекса (ES).
II. Преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов (ES*, ES**…).
III. Отделение продуктов (Р) реакции от активного центра и диффузия его в окружающую среду.
Теории и стадии ферментативного катализа
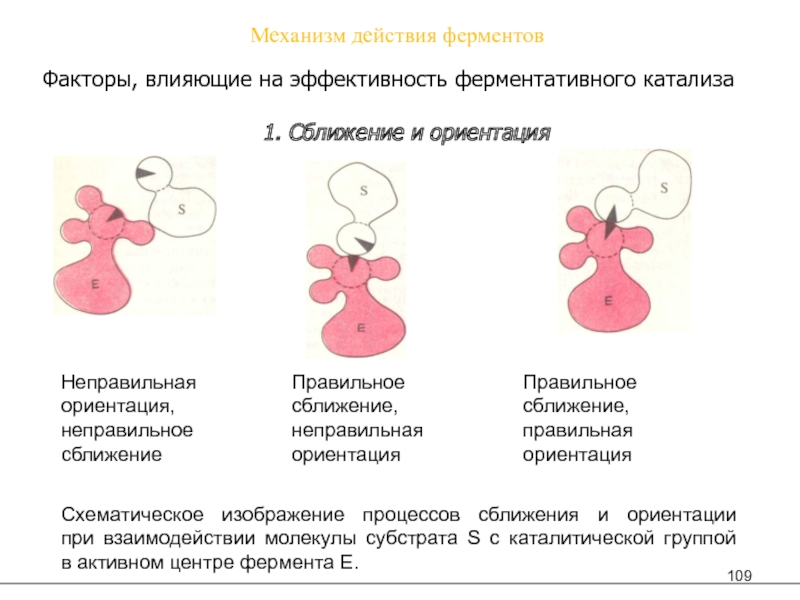
Слайд 109Механизм действия ферментов
Факторы, влияющие на эффективность ферментативного катализа
1. Сближение и
ориентация
Слайд 110Механизм действия ферментов
Факторы, влияющие на эффективность ферментативного катализа
2. Напряжение и
деформация: индуцированное соответствие
Ферменты. Строение, свойства, механизм действия
Слайд 111Молекулярные механизмы ферментативного катализа
Механизмы ферментативного катализа определяются ролью функциональных групп
активного центра фермента в химической реакции превращения субстрата в продукт.
Выделяют 2 основных механизма ферментативного катализа:
кислотно-основной и ковалентный катализ
Слайд 113Кислотно-основной катализ
Концепция кислотно-основного катализа объясняет ферментативную активность участием в химической
реакции кислотных групп (доноры протонов) и/или основных групп (акцепторы протонов).
Кислотно-основной катализ - часто встречающееся явление.
Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как кислот, так и оснований.
Слайд 114
Факторы, влияющие на эффективность ферментативного катализа
Общий кuслотно-основный катализ
Слайд 115
К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят
цистеин, тирозин, серин, лизин,
глутаминовую и аспарагиновую кислоты и
гистидин.
Радикалы
этих аминокислот в протонированной форме – кислоты (доноры протона), в депротонированной форме – основания (акцепторы протона).
Слайд 116
Примером кислотно-основного катализа ,в котором кофакторами являются ионы Zn2+, а
в качестве кофермента используется молекула NAD+, можно привести фермент алкогольдегидрогеназу
печени, катализирующую реакцию окисления спирта до уксусного альдегида:С2Н50Н + NAD+ → CН3-НC=0 + NADH+Н+
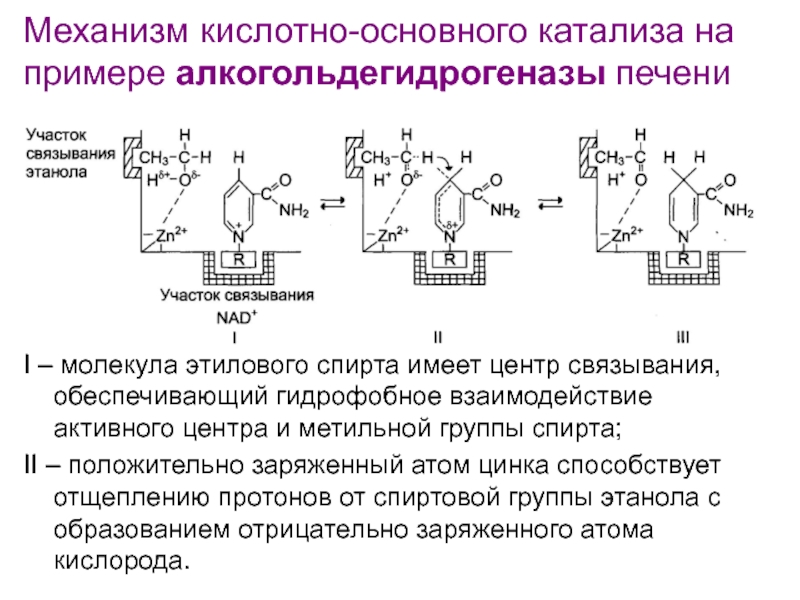
Слайд 117Механизм кислотно-основного катализа на примере алкогольдегидрогеназы печени
I – молекула этилового
спирта имеет центр связывания, обеспечивающий гидрофобное взаимодействие активного центра и
метильной группы спирта;II – положительно заряженный атом цинка способствует отщеплению протонов от спиртовой группы этанола с образованием отрицательно заряженного атома кислорода.
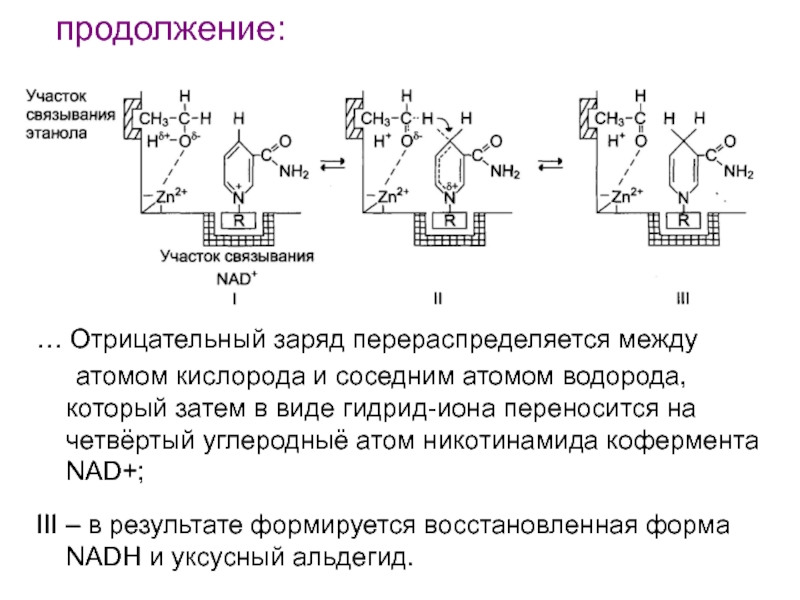
Слайд 118продолжение:
… Отрицательный заряд перераспределяется между
атомом кислорода и соседним атомом
водорода, который затем в виде гидрид-иона переносится на четвёртый углеродныё
атом никотинамида кофермента NAD+;III – в результате формируется восстановленная форма NADH и уксусный альдегид.
Слайд 1192. Ковалентный катализ
Ковалентный катализ основан на атаке
нуклеофильных (отрицательно заряженных)
или
электрофильных (положительно
заряженных) групп активного цента
фермента молекулами субстрата с
формированием ковалентной связи между
субстратом и коферментом или
функциональной группой аминокислотного
остатка активного центра фермента.
Слайд 120
Действие «сериновых протеаз», таких как
трипсин, химитрипсин и тромбин,
пример
механизма ковалентного катализа
когда ковалентная связь образуется между
субстратом и аминокислотным
остатком (радикалом) серина в активном центре
фермента.
Термин «сериновые протеазы» связан с тем
что, аминокислотный остаток серина входит
в состав активного центра всех этих
ферментов и участвует непосредственно в
катализе.
Слайд 122Механизм действия ферментов
Факторы, влияющие на эффективность ферментативного катализа
Ковалентный катализ
Одна из
моделей ковалентного катализа. В некоторых ферментативных реакциях фермент замещает функциональную
группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX. К ферментам, осуществляющим ковалентный катализ, отноcится химотрипсин. Ферменты. Строение, свойства, механизм действия
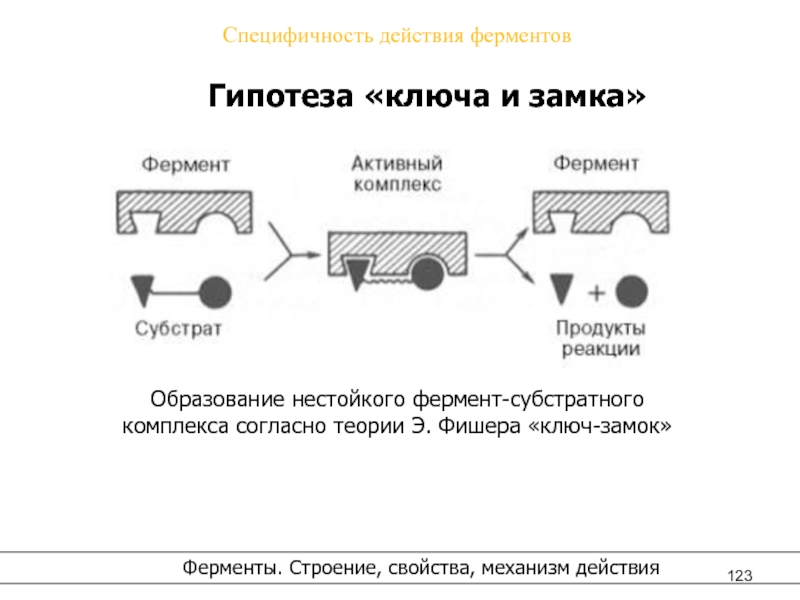
Слайд 123Специфичность действия ферментов
Гипотеза «ключа и замка»
Ферменты. Строение, свойства, механизм
действия
Образование нестойкого фермент-субстратного
комплекса согласно теории Э. Фишера «ключ-замок»
Слайд 124Специфичность действия ферментов
Гипотеза индуцированного соответствия
Изменения структуры активного центра фермента,
вызванные субстратом, согласно модели
«индуцированного соответствия» Д. Кошленда
Ферменты. Строение,
свойства, механизм действияСлайд 125Объяснить:
Методы определения скорости
ферментативных реакция
По убыли субстрата,
По нарастанию концентрации
продуктов реакции
…синтетические цветные аналоги субстрата…
…образование с продуктом реакции цветных соединений,
Концентрацию
которых определяют на ФЭК. Не окрашенные (в УФ спектре)
спектрофотометрически
Слайд 127
Влияние концентрации фермента
на скорость ферментативной реакции
Зависимость скорости реакции
от
концентрации фермента
в присутствии насыщающих
концентраций субстрата.
Слайд 128
Влияние температуры
на скорость ферментативной реакции
Зависимость скорости катализируемой ферментом реакции от
температуры:
а – повышение скорости реакции как функция температуры;
б – снижение
скорости реакции как функция денатурации белка-фермента; стрелка указывает оптимум температуры.Слайд 131План лекции
Активаторы ферментов
Ингибиторы ферментов
Регуляция активности ферментов
Классификация и номенклатура ферментов
Слайд 132
Активаторы ферментов
Регуляция ферментативной активности. Классификация ферментов
Примеры активаторов
Активирующее влияние на
скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы,
например:– соляная кислота активирует действие пепсина желудочного сока;
– желчные кислоты повышают активность панкреатической липазы;
– соединения, содержащие свободные SН-группы (глутатион, цистеин), активируют некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназу), pacтительную протеиназу и др.
– ионы металлов особенно часто выступают активаторами. Около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов.
Слайд 133
Ингибиторы ферментов
Регуляция ферментативной активности. Классификация ферментов
Необратимое ингибирование
Если ингибитор
вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию
функциональных групп фермента, то такой тип ингибирования называется необратимым.Необратимое действие ингибитора в самом простом случае может быть описано уравнением:
E + I → EI,
где Е – фермент, I – ингибитор, EI – комплекс.
Многие лекарства / яды – являются ингибиторами ферментов
Слайд 134
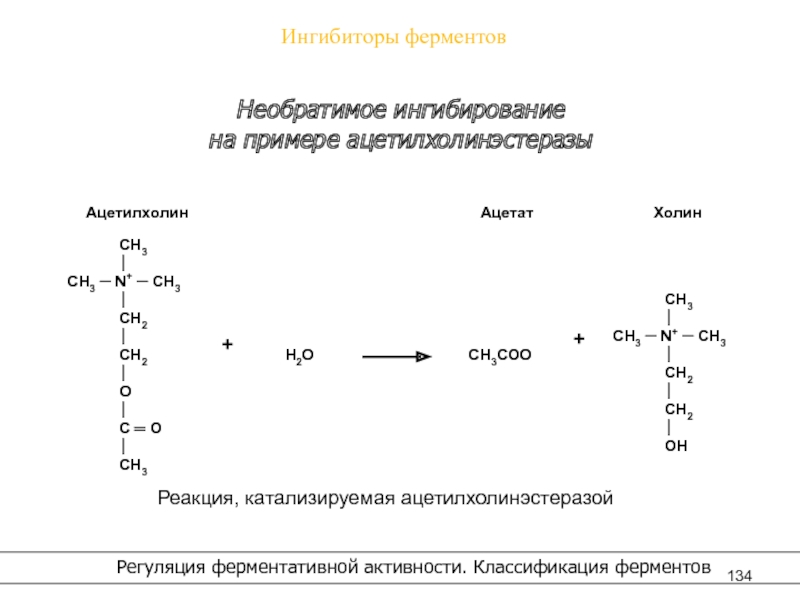
Ингибиторы ферментов
Регуляция ферментативной активности. Классификация ферментов
Необратимое ингибирование
на примере
ацетилхолинэстеразы
Реакция, катализируемая ацетилхолинэстеразой
Слайд 135
Ингибиторы ферментов
Регуляция ферментативной активности. Классификация ферментов
Необратимое ингибирование
на примере
ацетилхолинэстеразы
Е
Необратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом
Слайд 136
Ингибиторы ферментов
Регуляция ферментативной активности. Классификация ферментов
Обратимое ингибирование
В случае
обратимого действия ингибитор образует с ферментом непрочный комплекс, способный распадаться, в результате
чего снова возникает активный фермент.Обратимое действие ингибитора может быть описано уравнением:
E + I ↔ EI,
где Е – фермент, I – ингибитор, EI – комплекс.
Обратимое ингибирование делят на:
– конкурентное,
– неконкурентное.