Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физическое материаловедение Молекулярная спектроскопия
Содержание
- 1. Физическое материаловедение Молекулярная спектроскопия
- 2. Молекулярная спектроскопияМолекулаПримесные атомы и молекулы изменяют свойства
- 3. Таблица.Типы химической связи и их основные отличительные признаки.http://www.alhimikov.net/himsvyas/Page-1.html
- 4. КОВАЛЕНТНАЯ СВЯЗЬ.Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
- 5. Простейшая одноэлектронная ковалентная химическая связь Создается одним
- 6. Одинарная ковалентная связьСоздается связывающей электронной парой, которая
- 7. Электроотрицательность (χ) — фундаментальное химическое свойство атома,
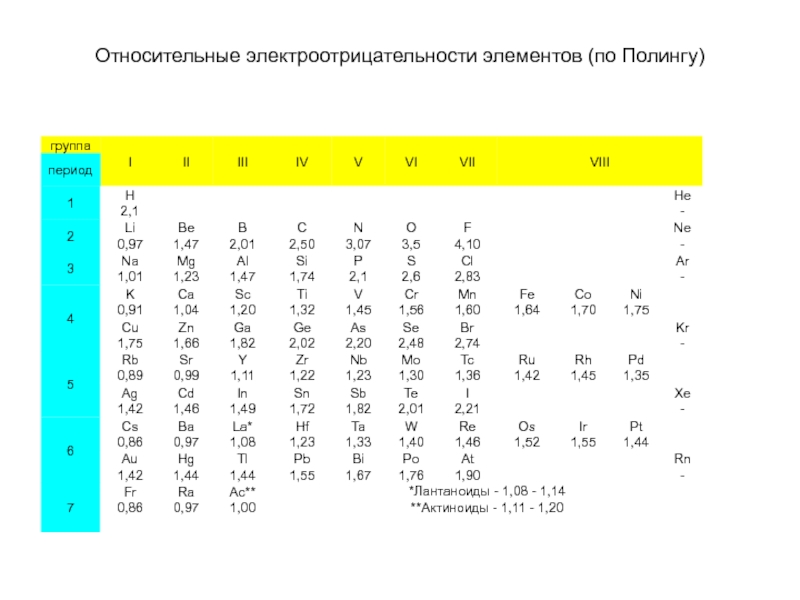
- 8. Относительные электроотрицательности элементов (по Полингу)
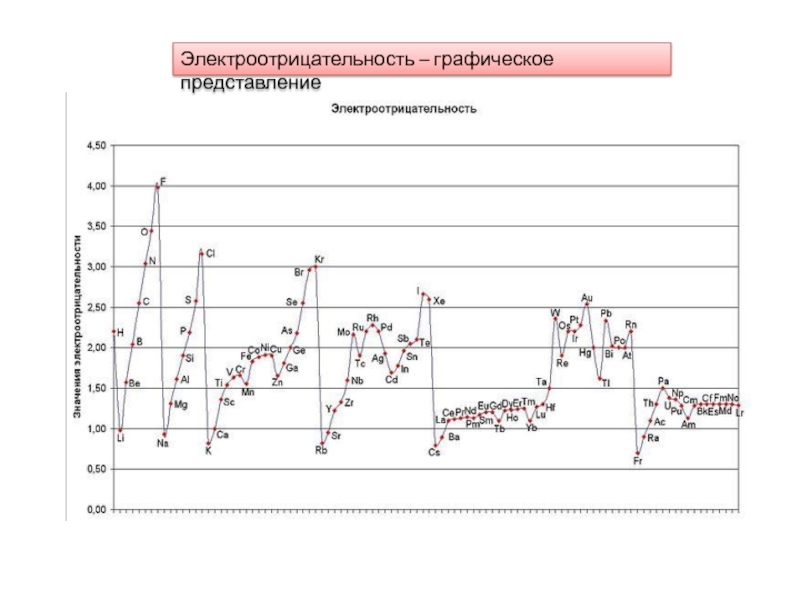
- 9. Электроотрицательность – графическое представление
- 10. Теория молекулярных орбиталей (МО) дает представление о
- 11. Ковалентная связь (атомная связь, гомеополярная связь) — химическая
- 12. Существует несколько способов образования ковалентных связей за
- 13. Потенциал Леннард-Джонса и Ван дер
- 14. Схема уровней энергии двухатомной молекулы: а и
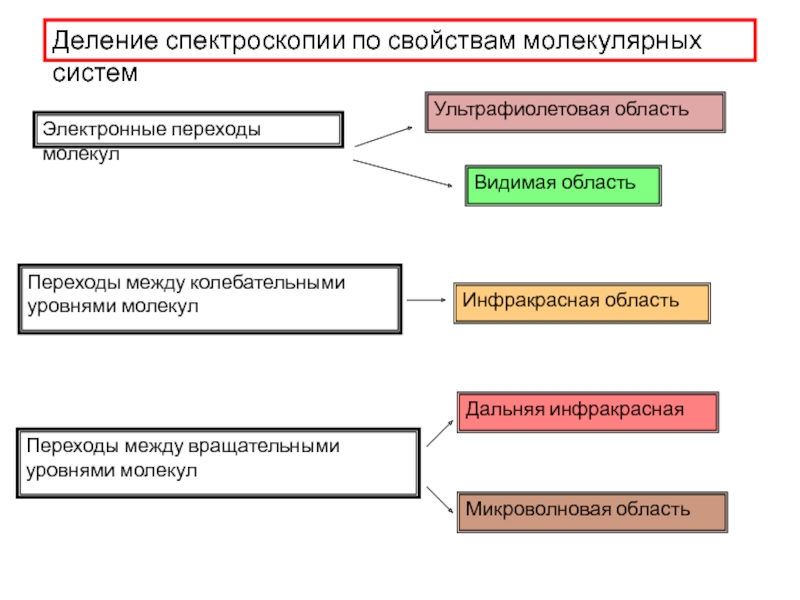
- 15. Деление спектроскопии по свойствам молекулярных систем
- 16. Колебательные спектрыЗависимость потенциальной энергии V гармонического осциллятора
- 17. ν = 1/2π (Ке /μ)1/2 – частота
- 18. Потенциал Морзе:построение потенциальных кривых по экспериментальным даннымUr
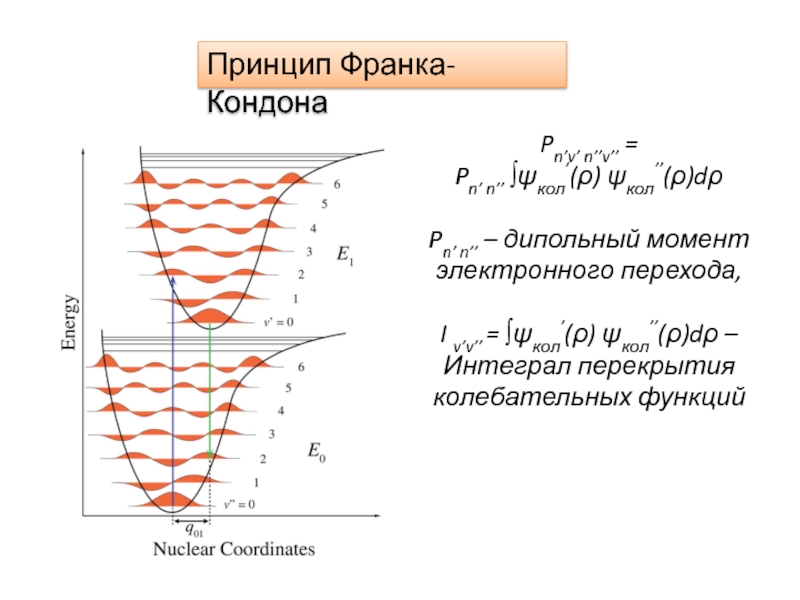
- 19. Принцип Франка-КондонаPn’v’ n’’v’’ = Pn’ n’’ ∫ψкол’(ρ)
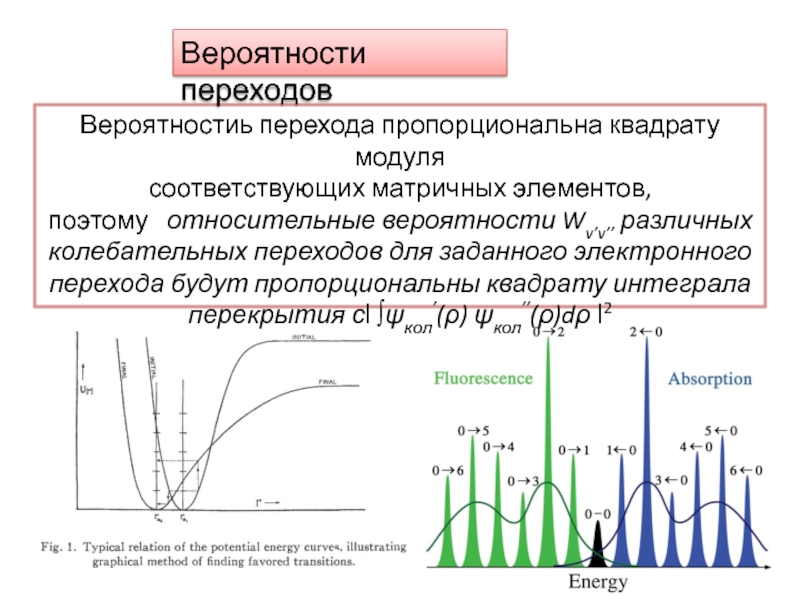
- 20. Вероятностиь перехода пропорциональна квадрату модулясоответствующих матричных элементов,поэтому
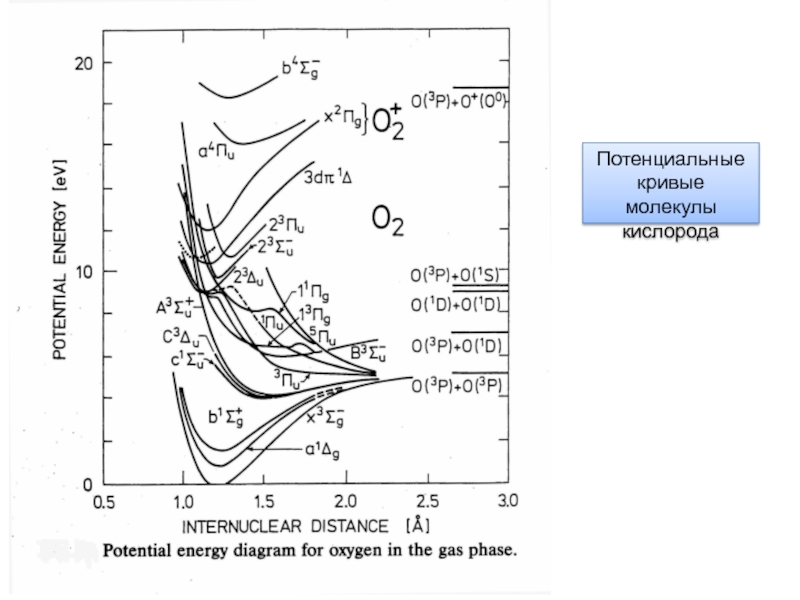
- 21. Потенциальные кривые молекулы кислорода
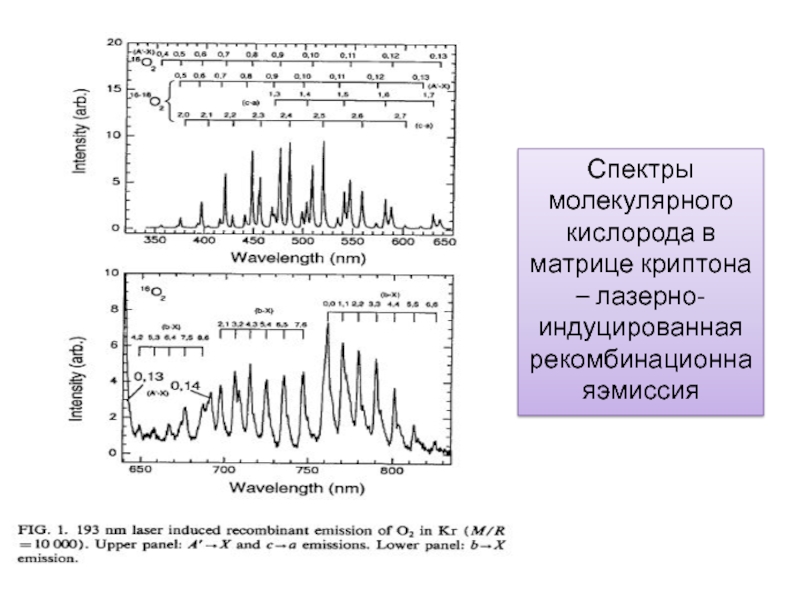
- 22. Спектры молекулярного кислорода в матрице криптона – лазерно-индуцированная рекомбинационнаяэмиссия
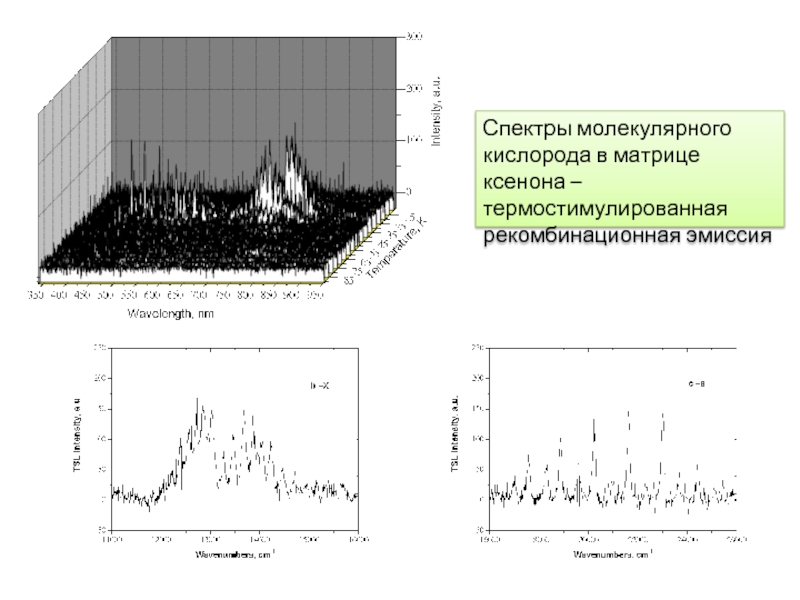
- 23. Спектры молекулярного кислорода в матрице ксенона – термостимулированнаярекомбинационная эмиссия
- 24. Диаграмма энергетических уровней N2 и основные молекулярные серии
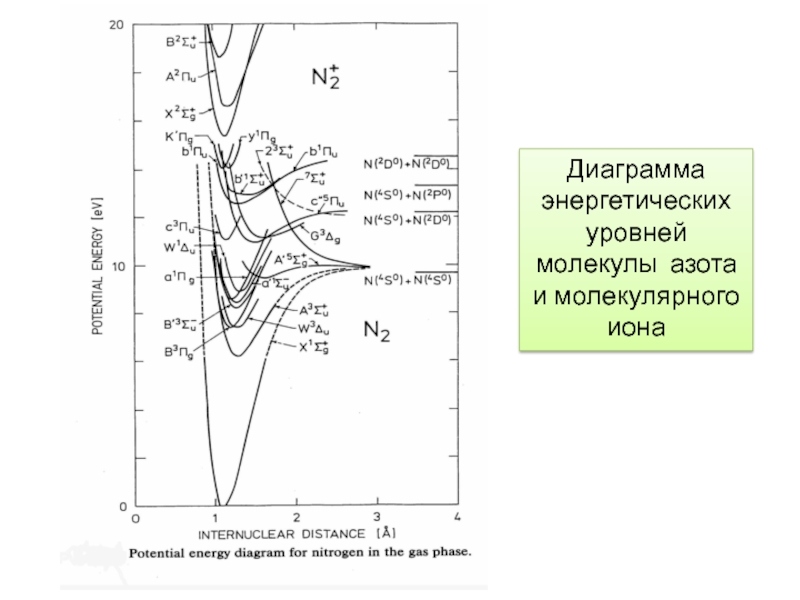
- 25. Диаграмма энергетических уровней молекулы азота и молекулярного иона
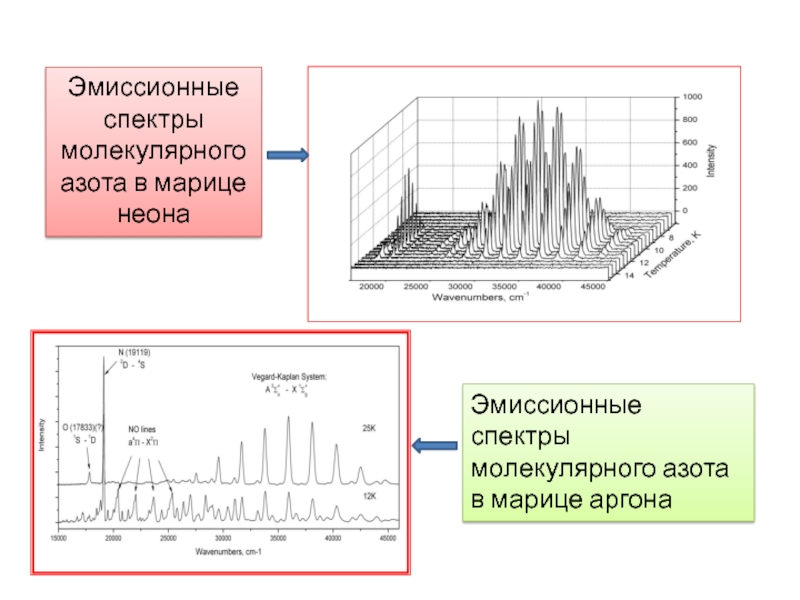
- 26. Эмиссионные спектры молекулярного азота в марице неонаЭмиссионные спектры молекулярного азота в марице аргона
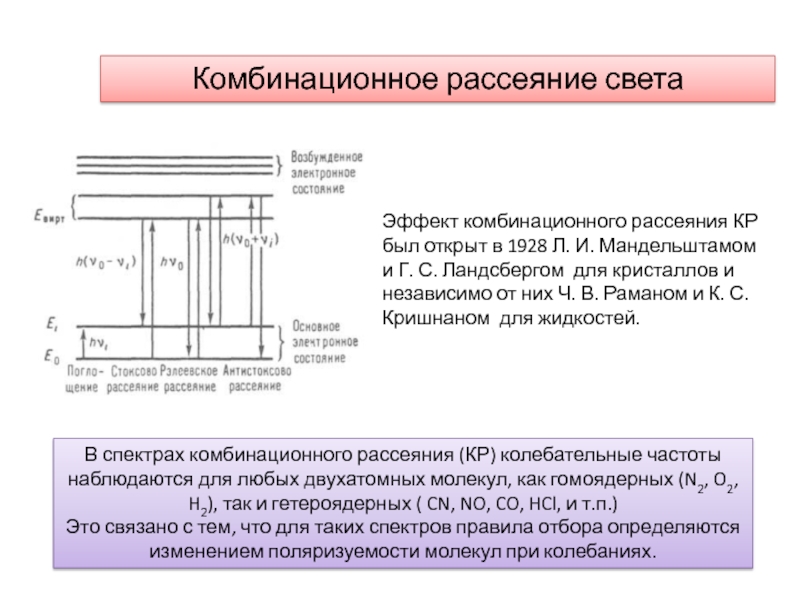
- 27. Комбинационное рассеяние светаВ спектрах комбинационного рассеяния (КР)
- 28. Колебательные спектры позволяют изучать не только внутримолекулярную
- 29. Электронно-колебательная спектроскопия применяется для исследования строения молекул
- 30. Научное открытие "Явление возникновения линейчатых спектров вещества".
- 31. Матричная изоляцияТехника матричной изоляции различных соединений в
- 32. Литература:1. М.А. Ельяшевич, Атомная и молекулярная спектроскопия,
- 33. Скачать презентанцию
Слайды и текст этой презентации
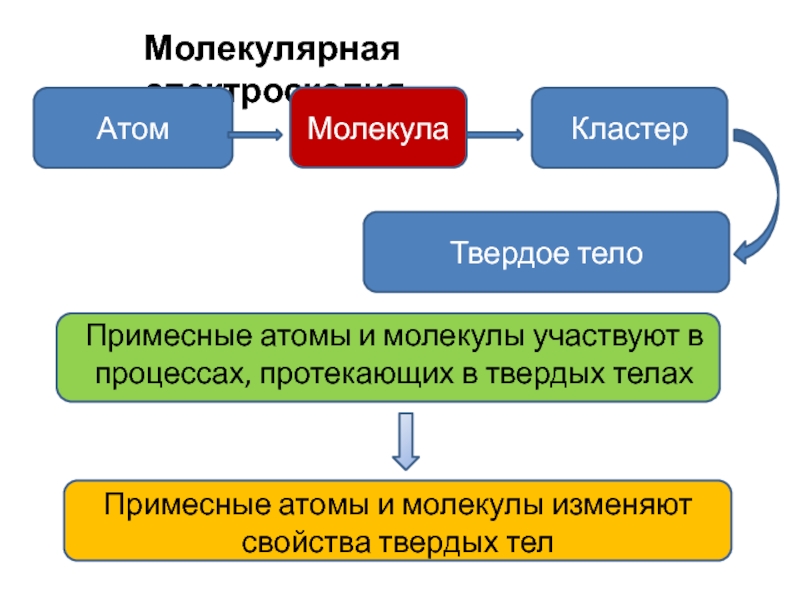
Слайд 2Молекулярная спектроскопия
Молекула
Примесные атомы и молекулы изменяют свойства твердых тел
Примесные атомы
и молекулы участвуют в процессах, протекающих в твердых телах
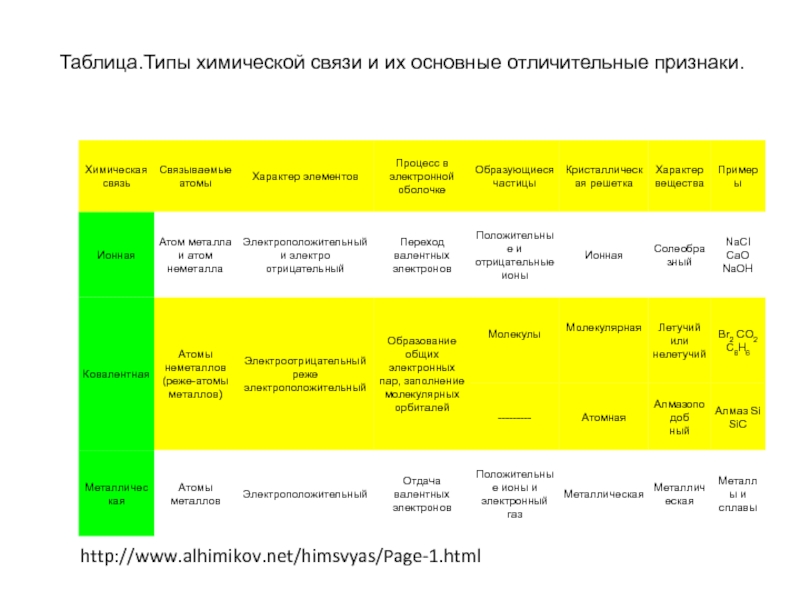
Слайд 3Таблица.Типы химической связи и их основные отличительные признаки.
http://www.alhimikov.net/himsvyas/Page-1.html
Слайд 4КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар,
возникающих
в оболочках связываемых атомов.
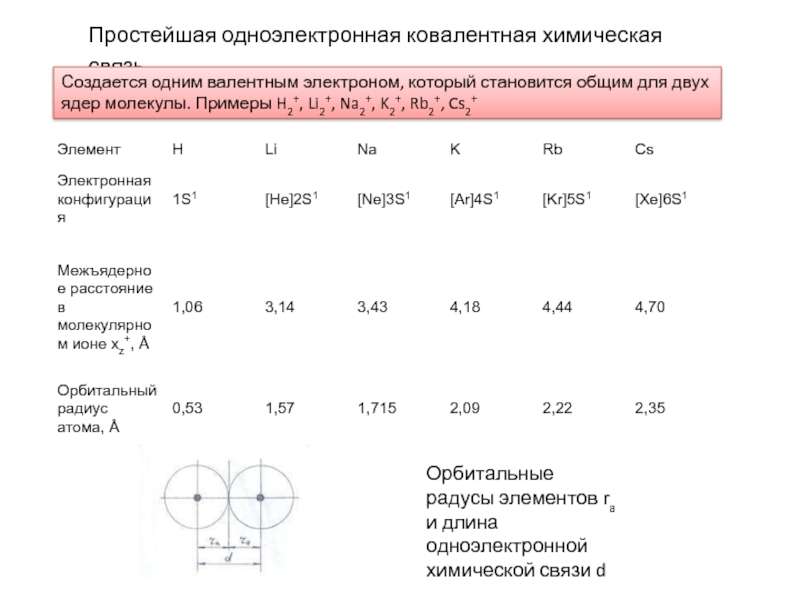
Слайд 5Простейшая одноэлектронная ковалентная химическая связь
Создается одним валентным электроном, который
становится общим для двух ядер молекулы. Примеры H2+, Li2+, Na2+,
K2+, Rb2+, Cs2+Орбитальные радусы элементов ra и длина одноэлектронной химической связи d
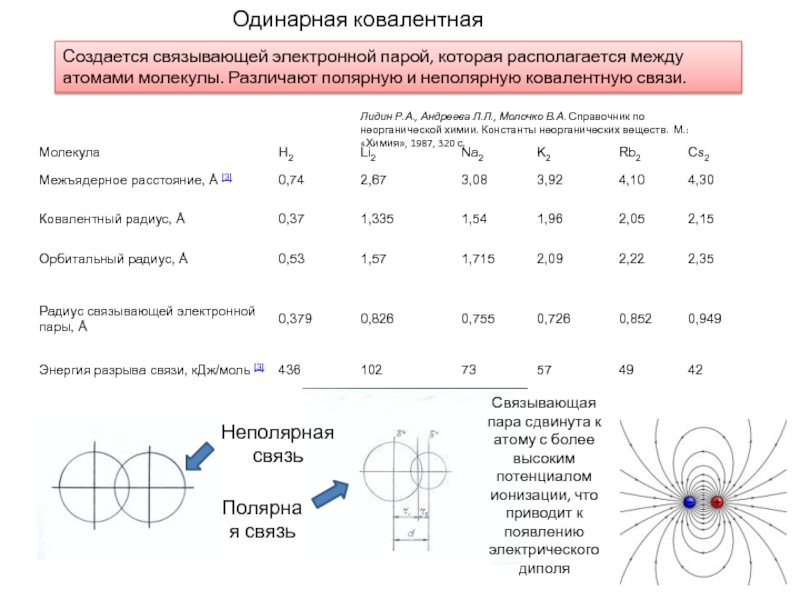
Слайд 6Одинарная ковалентная связь
Создается связывающей электронной парой, которая располагается между атомами
молекулы. Различают полярную и неполярную ковалентную связи.
Связывающая пара сдвинута к
атому с более высоким потенциалом ионизации, что приводит к появлению электрического диполяЛидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. М.: «Химия», 1987, 320 с.
Слайд 7Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности
атома в молекуле смещать к себе общие электронные пары.
Электроотрицательность
Теоретическое определение
электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А− до А+) и на этой основе предложил очень простое соотношение для электроотрицательности атома:χ = 1/2 (IA + EA )
где IA и EA — соответственно энергия ионизации атома и его сродство к электрону.
Шкалы электроотрицательности: шкала Малликена, шкала Полинга, шкала Сандерсона.
Слайд 10Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности
и объясняет свойства молекул. В этой теории квантовомеханические зависимости для
атома распространены на более сложную систему — молекулу.По аналогии с атомными s-, p-, d- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-. МО образуются при комбинировании атомных орбиталей при достаточном сближении.
Молекулярные орбитали
Н.Ф. Степанов Химическая связь в простых двухатомных молекулах, Химия, Соросовский образовательный журнал №10, 1998, с. 37
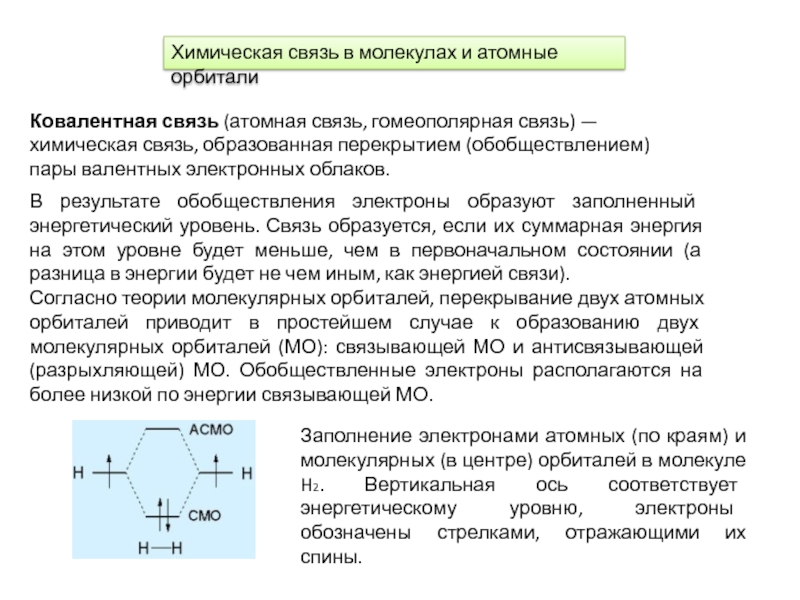
Слайд 11Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием
(обобществлением) пары валентных электронных облаков.
Химическая связь в молекулах и атомные
орбиталиВ результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет не чем иным, как энергией связи).
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
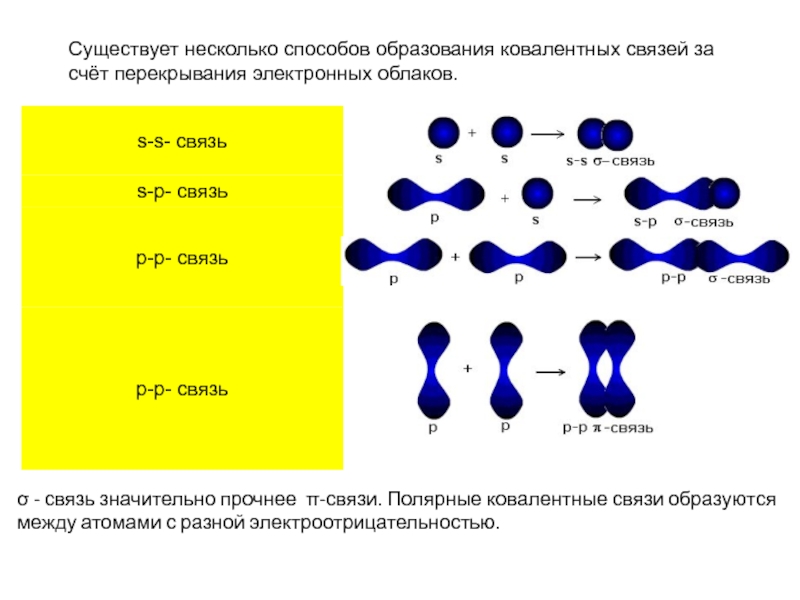
Слайд 12Существует несколько способов образования ковалентных связей за счёт перекрывания электронных
облаков.
σ - связь значительно прочнее π-связи. Полярные ковалентные связи
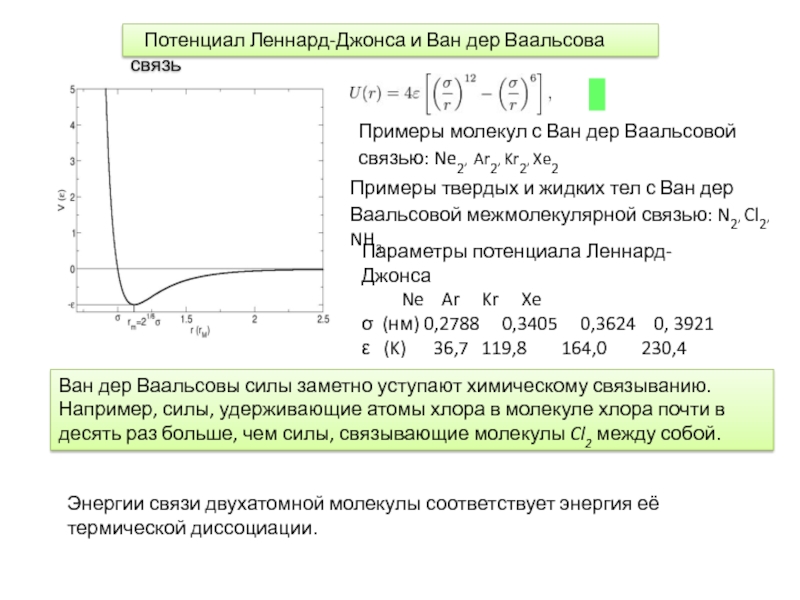
образуются между атомами с разной электроотрицательностью. Слайд 13 Потенциал Леннард-Джонса и Ван дер Ваальсова связь
Энергии
связи двухатомной молекулы соответствует энергия её термической диссоциации.
Примеры молекул с
Ван дер Ваальсовой связью: Ne2, Ar2, Kr2, Xe2Параметры потенциала Леннард-Джонса
Ne Ar Kr Xe
σ (нм) 0,2788 0,3405 0,3624 0, 3921
ε (K) 36,7 119,8 164,0 230,4
Ван дер Ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой.
Примеры твердых и жидких тел с Ван дер
Ваальсовой межмолекулярной связью: N2, Cl2, NH3
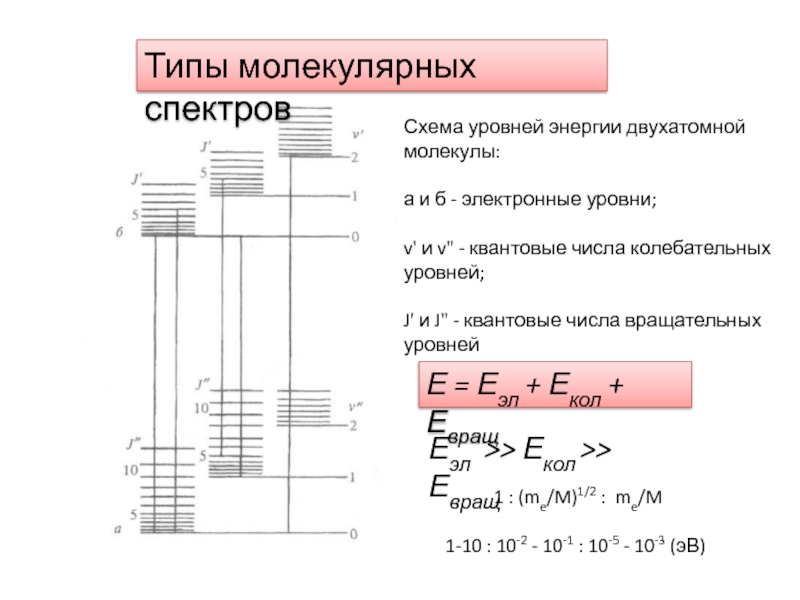
Слайд 14Схема уровней энергии двухатомной молекулы:
а и б - электронные
уровни;
v' и v" - квантовые числа колебательных уровней;
J'
и J" - квантовые числа вращательных уровнейЕ = Еэл + Екол + Евращ
Типы молекулярных спектров
Еэл >> Екол >> Евращ
1 : (me/M)1/2 : me/M
1-10 : 10-2 - 10-1 : 10-5 - 10-3 (эВ)
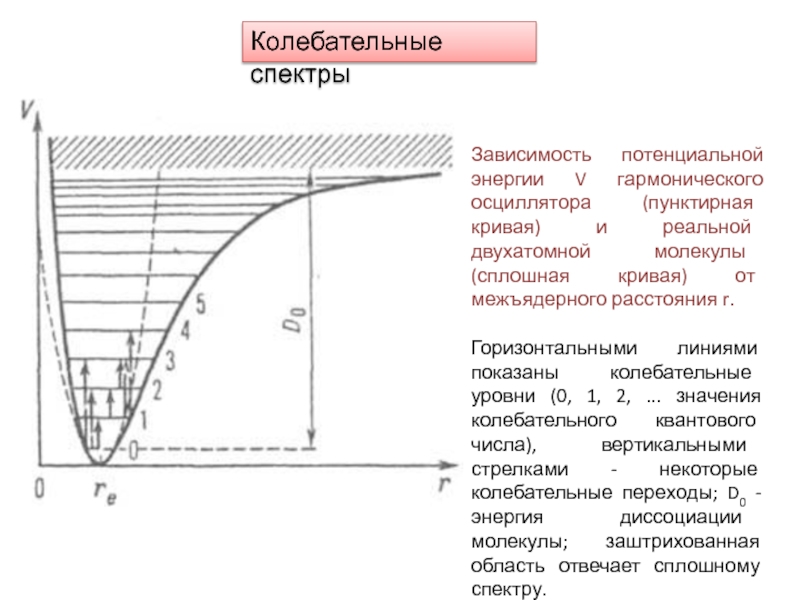
Слайд 16Колебательные спектры
Зависимость потенциальной энергии V гармонического осциллятора (пунктирная кривая) и
реальной двухатомной молекулы (сплошная кривая) от межъядерного расстояния r.
Горизонтальными
линиями показаны колебательные уровни (0, 1, 2, ... значения колебательного квантового числа), вертикальными стрелками - некоторые колебательные переходы; D0 - энергия диссоциации молекулы; заштрихованная область отвечает сплошному спектру. Слайд 17ν = 1/2π (Ке /μ)1/2 –
частота гармонического колебания
Δv =
1; ΔE = hνe
μ=m1m2/(m1+m2)]; Е=l/2(Keq2), где μ –приведенная масса,
q – колебательная координата, Ке=(d2V/dq2)q=0 - гармоническая силовая постоянная.Ангармоничность колебаний
Ev = ν (v +1/2) – νx(v+1/2)2, x – константа ангармоничности, здесь h опущено.
ΔE = Ev+1 – Ev = ν - 2νx(v+1) = ν [1-2x(v+1)]
0-1, 1-2, 2-3…
ν(1-2x), ν(1-4x), ν (1-6x)… ν0-1 = νe(1-2xe) = νe - 2νexe
В инфракрасном (ИК) спектре поглощения двухатомных молекул колебательные частоты наблюдаются только у гетероядерных молекул, например NO, CO, HCl, CN и т.п.
Гармонические колебания
Ev = l/2(Keq2) = hν (v+1/2)
E=1/2hνe – энергия нулевых колебаний
Слайд 18Потенциал Морзе:
построение потенциальных кривых
по экспериментальным данным
Ur = De {1-
exp[-β(r-re)]}2
β = 2πνe(μ/2 De)1/2
De, νe, re
Нижние потенциальные кривые
молекулы
водорода H2De = νe/4xe = νe2/4xeνe
Слайд 19Принцип Франка-Кондона
Pn’v’ n’’v’’ =
Pn’ n’’ ∫ψкол’(ρ) ψкол’’(ρ)dρ
Pn’ n’’ –
дипольный момент электронного перехода,
I v’v’’ = ∫ψкол’(ρ) ψкол’’(ρ)dρ –
Интеграл
перекрытия колебательных функций
Слайд 20Вероятностиь перехода пропорциональна квадрату модуля
соответствующих матричных элементов,
поэтому относительные вероятности
Wv’v’’ различных
колебательных переходов для заданного электронного перехода будут пропорциональны квадрату
интеграла перекрытия сǀ ∫ψкол’(ρ) ψкол’’(ρ)dρ ǀ2Вероятности переходов
Слайд 22Спектры молекулярного кислорода в матрице криптона – лазерно-индуцированная рекомбинационнаяэмиссия
Слайд 23Спектры молекулярного
кислорода в матрице ксенона – термостимулированная
рекомбинационная эмиссия
Слайд 26Эмиссионные спектры молекулярного азота в марице неона
Эмиссионные спектры молекулярного азота
в марице аргона
Слайд 27Комбинационное рассеяние света
В спектрах комбинационного рассеяния (КР) колебательные частоты наблюдаются
для любых двухатомных молекул, как гомоядерных (N2, O2, H2), так
и гетероядерных ( CN, NO, CO, HCl, и т.п.)Это связано с тем, что для таких спектров правила отбора определяются изменением поляризуемости молекул при колебаниях.
Эффект комбинационного рассеяния КР был открыт в 1928 Л. И. Мандельштамом и Г. С. Ландсбергом для кристаллов и независимо от них Ч. В. Раманом и К. С. Кришнаном для жидкостей.
Слайд 28Колебательные спектры позволяют изучать не только внутримолекулярную динамику, но и
межмолекулярные взаимодействия. Из них получают данные о поверхностях потенциальной энергии,
вращении молекул, движении атомов с большими амплитудами.По колебательным спектрам исследуют ассоциацию молекул и структуру комплексов различной природы.
Колебательные спектры зависят от агрегатного состояния вещества, что позволяет получать информацию о структуре различных фаз конденсированного состояния.
Некоторые применения
колебательной спектроскопии
Слайд 29Электронно-колебательная спектроскопия применяется для исследования строения молекул веществ в газовой
и жидкой фазах с низким давлением насыщенных паров, а также
в твердой фазе.Электронно-колебательная спектроскопия
Благодаря тому, что метод электронно-колебательной спектроскопии исследует переходы между различными электронными уровнями, в то время как в колебательной спектроскопии ИК или КР исследуются колебательные переходы с одного и того же уровня, то становится возможным исследование переходов, не наблюдаемых в обычных ИК или КР-спектрах, запрещенных правилами отбора для колебательных переходов, но не запрещенных правилами отбора для электронно-колебательных спектров.
Слайд 30Научное открытие "Явление возникновения линейчатых спектров вещества". Формула открытия: "Установлено
неизвестное ранее явление возникновения линейчатых молекулярных спектров вещества в условиях
матричной изоляции молекул или их групп в растворителе при низкой температуре". Авторы: Э. В. Шпольский, Л. А. Климова, А. А. Ильина. Номер и дата приоритета: № 152 от 28 сентября 1952 г.Открытое явление широко используется для высокочувствительного и селективного качественного и количественного спектрального анализа. Метод линейчатых спектров дает возможность определять сверхмалые (до 10–11 граммов на грамм образца) количества индивидуальных веществ, одновременно присутствующих в сложной смеси, что ставит его вне конкуренции с другими спектральными методами.
Электронно-колебательные спектры
Исследовались спектры сложных органических молекулв н-парафиновых матрицах
Слайд 31Матричная изоляция
Техника матричной изоляции различных соединений в низкотемпературных химически инертных
матрицах была развита в 1950-х годах Дж. Пименталом.
В качестве матриц
использовались отвердевшие газы – инертные (Xe, Kr, Ar, Ne) и твердый азот N2.Дальнейшее развитие низкотемпературной техники позволило развернуть исследования в квантовых матрицах – твердом водороде H2 и жидком гелии He.
Если на начальном этапе исследования были сфокусированы на характеризации примесных центров, то в настоящее время акцент сместился на взаимодействие примесных центров с матрицей и исследование эффектов, присущих конденсированной фазе.
http://www.chem.mun.ca/mi/mide.php
Слайд 32Литература:
1. М.А. Ельяшевич, Атомная и молекулярная спектроскопия, Физ-мат Гиз, Москва,
1962.
2. Г. Герцберг, Спектры и строение двухатомных молекул,
Издательство иностранной литературы, Москва, 1949.3. http://www.xumuk.ru
4. Ian R. Dunkin, Matrix Isolation Techniques: A Practical Approach, Oxford University Press, UK, 1998.
5. Physics and Chemistry at Low Temperatures,
Leonid Khriachtchev, Ed., Pan Stanford Publishing, 2011.




![Физическое материаловедение
Молекулярная спектроскопия ν = 1/2π (Ке /μ)1/2 – частота гармонического колебанияΔv = 1; ν = 1/2π (Ке /μ)1/2 – частота гармонического колебанияΔv = 1; ΔE = hνe μ=m1m2/(m1+m2)]; Е=l/2(Keq2), где](/img/thumbs/dc24cecbde26eebb8852974ec0ed6d96-800x.jpg)
![Физическое материаловедение
Молекулярная спектроскопия Потенциал Морзе:построение потенциальных кривых по экспериментальным даннымUr = De {1- exp[-β(r-re)]}2β Потенциал Морзе:построение потенциальных кривых по экспериментальным даннымUr = De {1- exp[-β(r-re)]}2β = 2πνe(μ/2 De)1/2 De, νe, re](/img/thumbs/92c4bfd7b204e42e44b839e17c631aef-800x.jpg)