Слайд 1ФОРМАЛЬНАЯ КИНЕТИКА
Предмет химической кинетики
Термодинамика позволяет с большой точностью предсказать принципиальную
возможность протекания процесса и конечное состояние системы, однако она не
дает никаких сведений о способах фактической реализации процесса и времени его протекания. В действительности же некоторые процессы протекают настолько быстро, что представляются мгновенными, другие идут настолько медленно, что практически какие-либо изменения в системе не наблюдаются.
Так, согласно термодинамике, смесь газообразных водорода и кислорода при обычной температуре должна практически полностью превращаться в воду (для этой реакции Go = –450 кДж), однако в эксперименте образование воды практически не наблюдается. Химический потенциал алмаза в обычных условиях больше химического потенциала графита и, следовательно, алмаз должен самопроизвольно превращаться в графит, в действительности же такое превращение не происходит.
Слайд 2Такое кажущееся противоречие между теоретическими предсказаниями и практическими результатами обусловлено
тем, что в термодинамике учитывается только начальное и конечное состояния
системы, но не рассматривается механизм перехода и не фигурирует такой практически важный фактор как время.
Реально всякое превращение связано с преодолением некоторого энергетического барьера – разрыв связей в молекулах реагирующих веществ, перестройка структуры кристаллической решетки и т.д. Если энергетический барьер высок, то теоретически возможная реакция протекает настолько медленно, что за практически ограниченный промежуток времени каких-либо изменений не наблюдается (реакция “не идет”).
Таким образом, кроме термодинамического подхода, громадное значение приобретает и другой аспект исследования химических реакций – изучение их с точки зрения скоростей. Исследование закономерностей протекания процессов во времени и является предметом химической кинетики.
Слайд 3Можно выделить две главные задачи химической кинетики, определяющие ее практическое
и теоретическое значение:
экспериментальное исследование скорости реакций и ее зависимость
от условий протекания (концентрации реагирующих веществ, температуры, присутствия других веществ и т.д.)
установление механизма реакции, т.е. числа элементарных стадий и состава образующихся промежуточных продуктов.
Строгое теоретическое рассмотрение кинетических параметров в настоящее время возможно лишь для простейших реакций в газовой фазе. Весьма ценные сведения о течении реакций дает эмпирический макроскопический подход. Количественное описание скорости реакции в зависимости от концентрации реагирующих веществ базируется на основном постулате химической кинетики и составляет предмет формальной кинетики.
Слайд 8В связи с этим для элементарных реакций вводится понятие молекулярность
– число молекул, принимающих участие в элементарном акте химического взаимодействия.
Если в элементарном акте участвует одна молекула (например, происходит распад молекулы), реакция является мономолекулярной.
Если в элементарном акте взаимодействуют две молекулы, реакция называется бимолекулярной, например, приведенные выше реакции водорода с бромом или йодом.
В тримолекулярных реакциях принимают участие три частицы, как например, в реакции рекомбинации атомов водорода в молекулу:
Н + Н + М = Н2 + М,
где М – молекула водорода или любая другая частица.
Слайд 11Простые необратимые реакции
В системе одновременно и независимо могут протекать реакции
с различной скоростью, но в противоположных направлениях. Через некоторое время
после начала скорости прямой и обратной реакций становятся одинаковыми, и система достигает состояния равновесия. Такие реакции называются кинетически обратимыми.
Это понятие следует отличать от обратимости процесса в термодинамическом смысле. Термодинамически обратимый процесс характеризуется тем, что в нем скорости прямого и обратного процессов различаются на бесконечно малую величину, а в любой момент времени состояние системы бесконечно мало отличается от равновесного.
Таким образом, понятия кинетической и термодинамической обратимости совпадают лишь вблизи к состоянию химического равновесия, поэтому кинетически обратимые реакции более точно следовало бы называть двусторонними.
В принципе все химические реакции являются двусторонними, в действительности же некоторые из них в определенных условиях протекают лишь в одном направлении до практически полного исчезновения исходных веществ, т.е. равновесие в таких случаях очень сильно смещено в сторону образования продуктов. Такие реакции называются кинетически необратимыми, или односторонними.

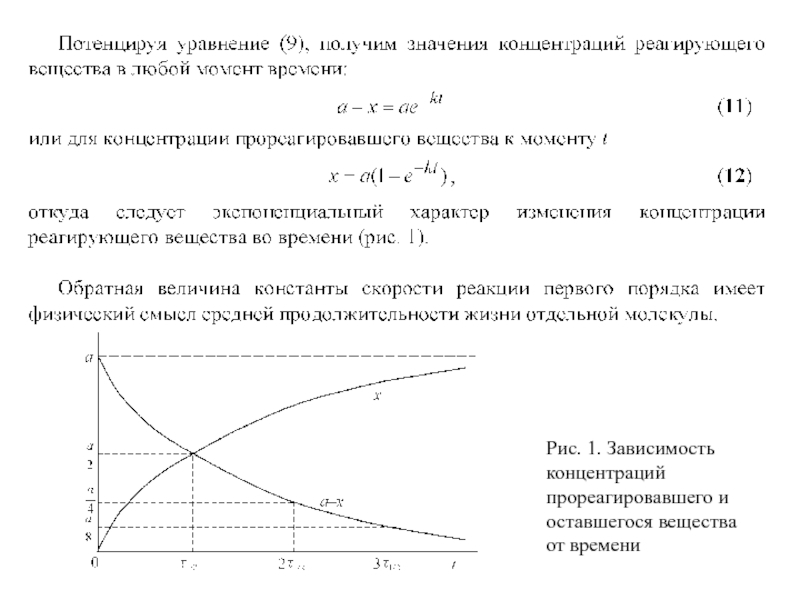
Слайд 14Рис. 1. Зависимость концентраций
прореагировавшего и оставшегося вещества
от времени
Слайд 26Методы определения порядка реакции
При определении порядка реакции вначале находят порядок
по каждому из реагирующих веществ. Для этого концентрации всех веществ,
кроме рассматриваемого, берутся в большом избытке, так, что их можно считать постоянными и ввести в константу скорости.
Используя какие-либо методы анализа, определяют концентрации исследуемого вещества через различные промежутки времени. Для того, чтобы концентрация вещества не изменилась во время взятия пробы и проведения анализа, реакцию затормаживают (“замораживают”) – охлаждают реакционную смесь, вводят специальные реактивы и т.п.
Существует много различных способов определения порядка, наиболее распространенные из которых мы рассмотрим.
Слайд 27Метод графического подбора.
Как следует из уравнения (10) для реакции
первого порядка выполняется линейная зависимость в координатах логарифм концентрации –
время.
Для реакций второго порядка такая зависимость наблюдается в координатах 1/(a – x) – t (уравнение (17)), а для реакций n-ого порядка прямая получается в координатах 1/(a – x) – время (уравнение (30)).
Таким образом, используя полученные в эксперименте значения концентраций в различные моменты времени, строят графики в тех или иных координатах до получения линейной зависимости.
Рис.2. Определение порядка реакции методом графического подбора
Слайд 282. Метод аналитического подбора уравнения заключается в том, что проводится
расчет константы скорости путем подстановки экспериментальных данных в различные кинетические
уравнения.
Если уравнение выбрано правильно, константа скорости должна оставаться постоянной в пределах ошибок опыта не зависимо от времени; систематический ход константы скорости свидетельствует о том, что уравнение выбрано неверно.
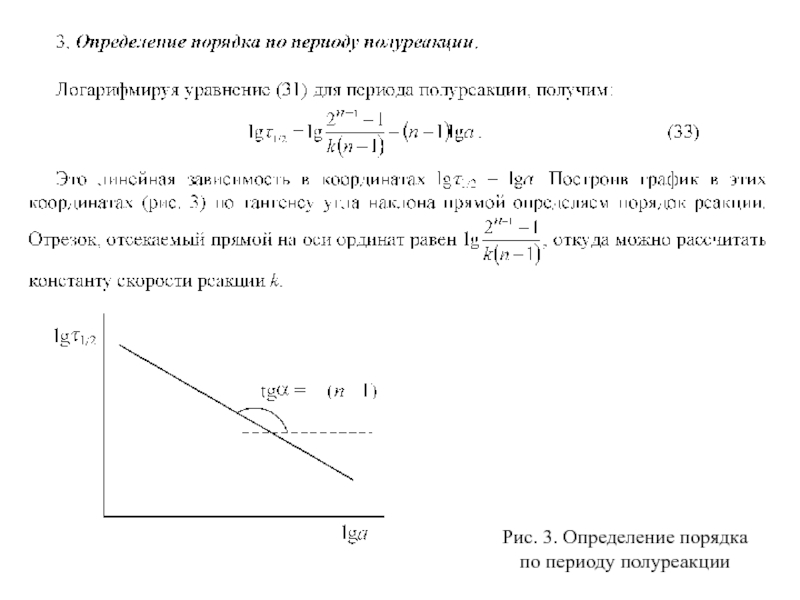
Слайд 29Рис. 3. Определение порядка
по периоду полуреакции
Слайд 304. Графический метод определения порядка.
Скорость реакции n-ого порядка по
данному веществу равна
v = kcn или
lgv = lgk + nlgc, (34)
где c – текущая концентрация реагирующего вещества.
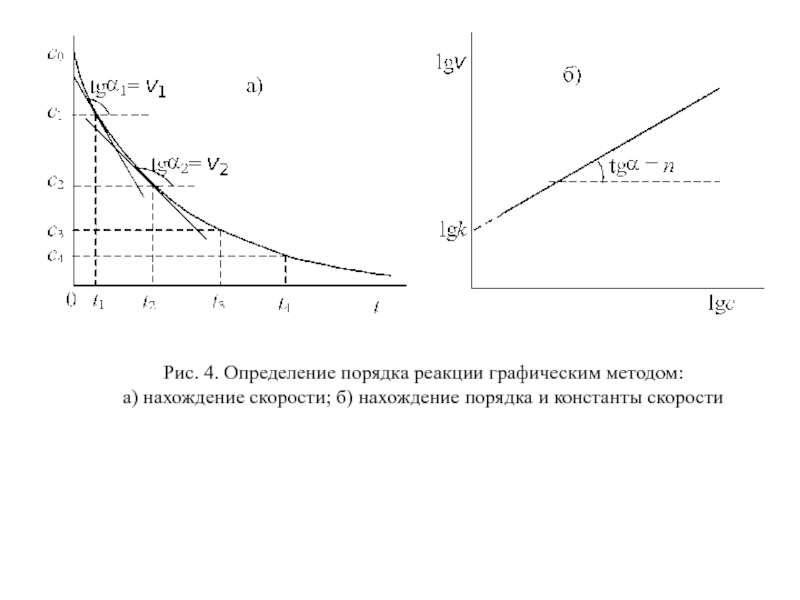
Для определения порядка вначале строят график зависимости концентрация – время. Проводя касательные к кривой в точках, соответствующим различным моментам времени t1, t2, …, находят по тангенсу угла наклона касательных скорости реакции v1, v2, … в эти моменты времени (рис. 4 a). Затем логарифмы скоростей откладывают как функции логарифмов соответствующих концентраций c1, c2,....
Согласно уравнению (25) должна получиться прямая, тангенс угла наклона которой равен порядку реакции, а отсекаемый на оси ординат отрезок – логарифму константы скорости (рис. 4 б).
Слайд 31Рис. 4. Определение порядка реакции графическим методом:
a) нахождение скорости; б)
нахождение порядка и константы скорости
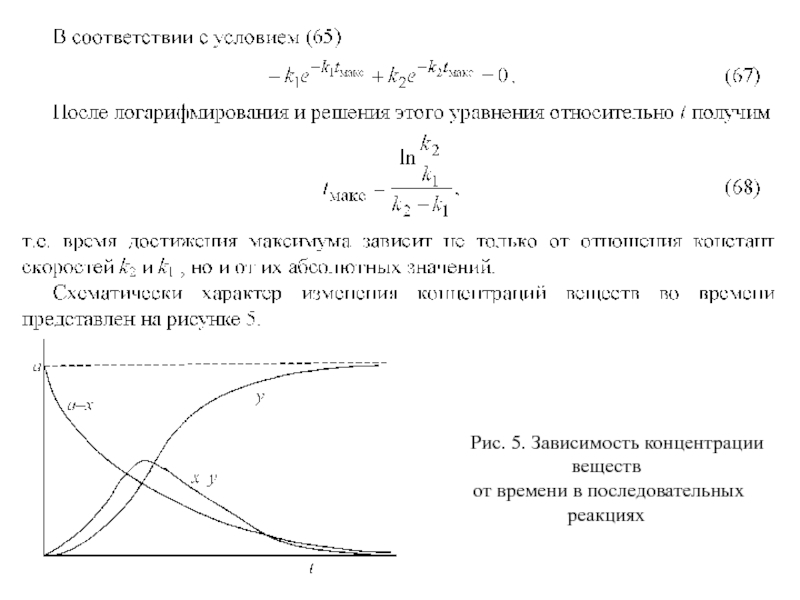
Слайд 44Рис. 5. Зависимость концентрации веществ
от времени в последовательных реакциях
Слайд 48Метод стационарных концентраций
В рассмотренном выше простейшем случае двух последовательных реакций
первого порядка получены уравнения для концентрации промежуточного и конечного продуктов,
которые нельзя строго решить относительно констант скорости, т.е. невозможно рассчитывать последние непосредственно из экспериментальных данных о зависимости концентрации от времени.
В более сложных случаях нескольких последовательных реакций разного порядка строгое математическое описание кинетики часто оказывается невозможным.
Для описания кинетики многостадийных реакций можно использовать приближенный метод стационарных концентраций Боденштейна.
В основе метода лежит положение о том, что через некоторое небольшое время после начала реакции скорость образования промежуточного продукта становится примерно равной скорости его распада и суммарную скорость изменения концентрации неустойчивого промежуточного продукта можно считать приблизительно равной нулю в течение достаточно длительного времени, т.е. в течение этого времени устанавливается стационарная концентрация неустойчивого продукта.
Слайд 53В заключение заметим, что метод стационарных концентраций не является совершенно
строгим, его применение ограничивается выполнением условий типа (78), (79), т.е.
образованием очень неустойчивых промежуточных продуктов, концентрация которых в ходе реакции оказывается небольшой.
Однако на практике такие случаи встречаются очень часто (образование в качестве промежуточных продуктов атомов, свободных радикалов), поэтому метод стационарных концентраций получил широкое распространение при изучении кинетики и механизма различных реакций.
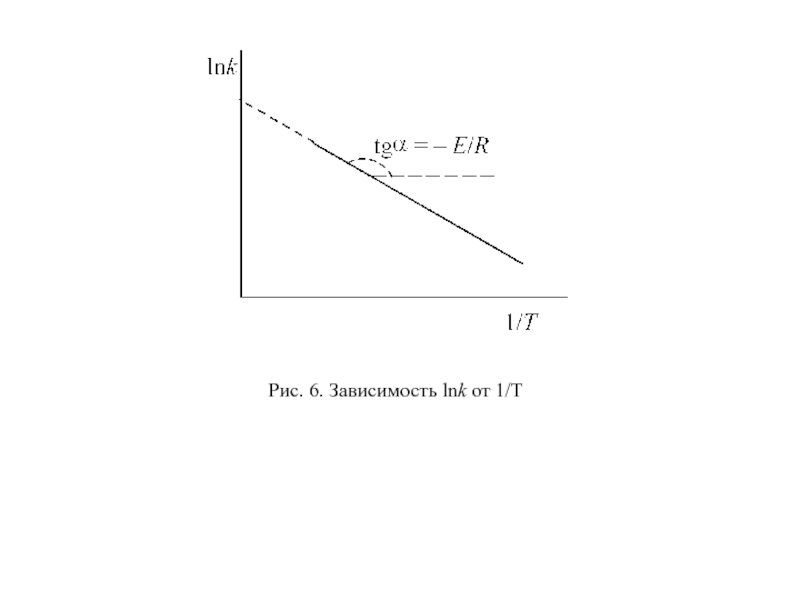
Слайд 60Как видно из уравнения (97), логарифм константы скорости является линейной
функцией обратной температуры. Поэтому для экспериментального определения EA находят константы
скорости реакции при нескольких температурах и строят зависимость в координатах lnk – 1/T (рис. 6).
Отрезок, отсекаемый прямой на оси ординат, равен константе С, а энергия активации вычисляется по тангенсу угла наклона прямой.
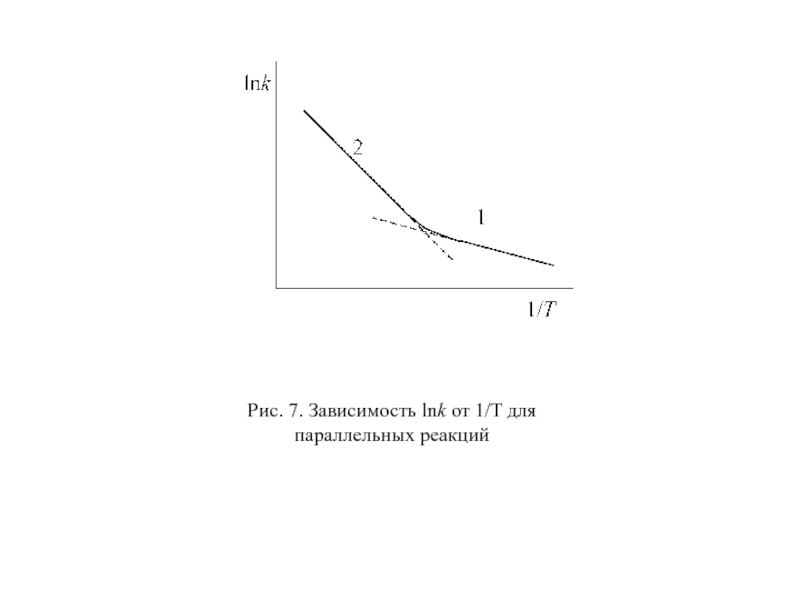
Слайд 63Рис. 7. Зависимость lnk от 1/T для параллельных реакций
Слайд 69Величина ED небольшая (5 10 кДж/моль), т.е. ED
EA , поэтому экспериментально определяемая энергия активации примерно в два
раза меньше истинной энергии активации химической реакции.
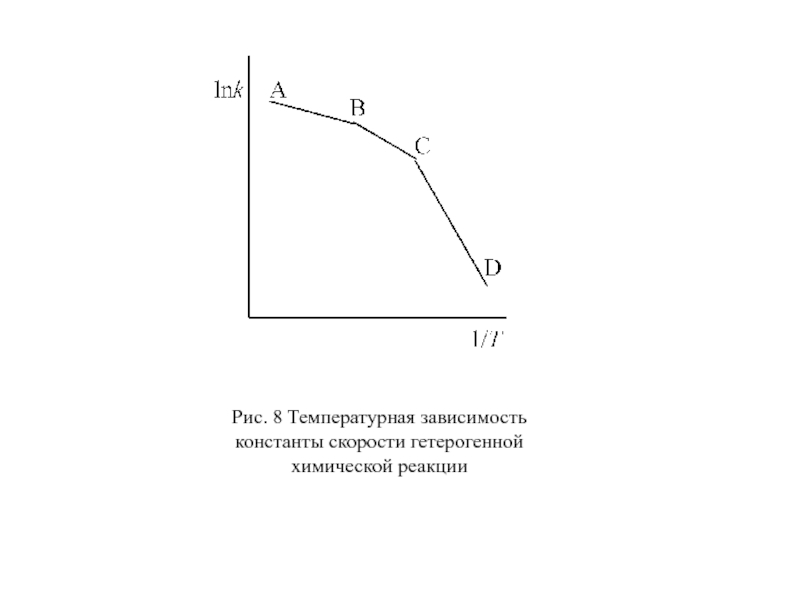
Так как энергия активации диффузии невелика, то при изменении температуры на 10 скорость диффузии изменяется в 1,1 – 1,2 раза, в то время как скорость химической реакции меняется в 2 – 4 раза. Поэтому при определениях скорости реакции в широком диапазоне температур наблюдается сложный характер зависимости lnk от 1/T (рис. 8).
При низких температурах реакция идет обычно в кинетической области (участок CD) и скорость сильно зависит от температуры. При высоких температурах скорость диффузии обычно значительно меньше скорости химической реакции, процесс идет в диффузионной области с мало изменяющейся скоростью (участок AB). Участок BC соответствует переходной области.
Значительную роль в кинетике гетерогенных реакций может играть скорость отвода продуктов реакции. Если, например, в реакции образуются труднорастворимые вещества, то, осаждаясь на поверхности, они блокируют ее, и реакция практически прекращается.

Слайд 70Рис. 8 Температурная зависимость константы скорости гетерогенной
химической реакции