Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор и его соединения
Содержание
- 1. Фосфор и его соединения
- 2. Фосфор — химический элемент 5-й группы третьего
- 3. Нахождение в природеОдин из распространённых элементов земной
- 4. Историческая справкаДокументированное открытие фосфора состоялось в 1669
- 5. Открытие фосфора изображено на картине английского художника Дж. Райта («Райт из Дерби», 1734–1797 гг.)
- 6. Аллотропные модификации и физические св-ваФосфор в обычных
- 7. Слайд 7
- 8. Химические свойстваБелый фосфор Р4 значительно активнее красного
- 9. Химические свойства 1)С неметаллами 4P + 5O2
- 10. 2)С активными металлами 2P + 3Ca
- 11. 3)С водой при t0C4P + 6H2O
- 12. Получение фосфораПолучение фосфора в промышленностиСырьем для промышленного
- 13. Слайд 13
- 14. УдобрениеПростой суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4Двойной суперфосфат -- Ca(H2PO4)2•H2O
- 15. Химия и литература«Да! Это была собака, огромная,
- 16. PH3 Фосфин Фосфин - «мерцающий свет, появляющийся
- 17. Получение фосфина1)Фосфин получают при взаимодействии белого фосфора
- 18. Химические свойства фосфинаХимические свойства похожи на аммиак,
- 19. Кислородсодержащие соединения фосфораHPO3 – метафосфорная кислотаH3PO4 –
- 20. Применение фосфинаВ сельском хозяйстве для обеззараживания зернохранилищ
- 21. P2O3 - Фосфористый ангидрид (оксид фосфора (III).Белые
- 22. P2O5 Фосфорный ангидрид (оксид фосфора (V).Белые кристаллы.
- 23. 4)P2O5 - сильное водоотнимающее средство: P2O5+ 2HNO3
- 24. Фосфорные кислоты КислотыПолучение фосфорной кислотыP2O5 + 3H2O
- 25. Химические свойства фосфорной кислотывзаимодействие с индикаторами
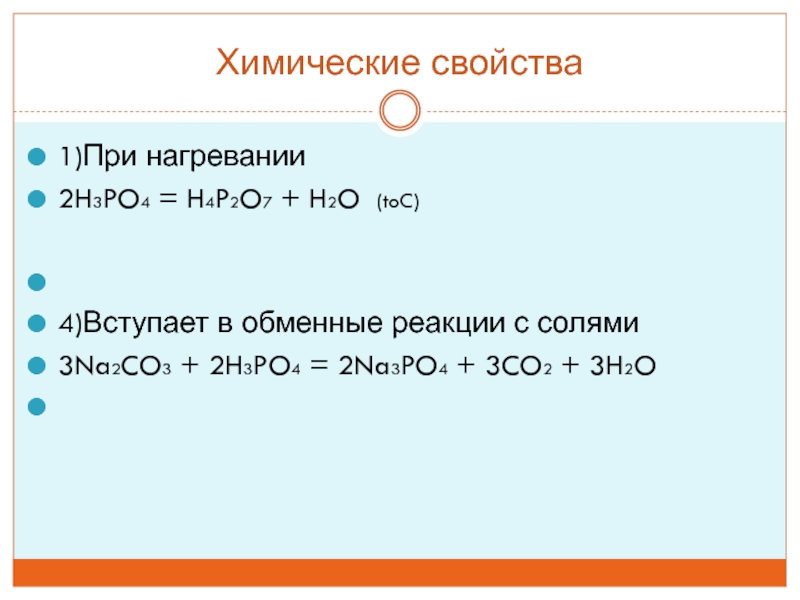
- 26. Химические свойства1)При нагревании2H3PO4 = H4P2O7 + H2O
- 27. Скачать презентанцию
Фосфор — химический элемент 5-й группы третьего периода, атомный номер 15. Электронная конфигурация 3s23p3Степени окисления -3, 0, +1, +3, +5 3 не спаренных электрона, может быть возбужденное состояние, 5 не спаренных электроновФосфор
Слайды и текст этой презентации
Слайд 1Название элемента фосфор (светоносец) происходит от латинского фосфорус (светящий) и
связано с его открытием – получением белого фосфора
соединенияСлайд 2Фосфор — химический элемент 5-й группы третьего периода, атомный номер
15.
Электронная конфигурация 3s23p3
Степени окисления -3, 0, +1, +3, +5
3
не спаренных электрона, может быть возбужденное состояние,
5 не спаренных электронов
Фосфор P или P4
Слайд 3Нахождение в природе
Один из распространённых элементов земной коры. В свободном
состоянии не встречается из-за высокой химической активности.
С фосфором знакомы
все, кто хотя бы раз держал в руках коробку спичек. Более того, каждый из нас носит в себе приблизительно (4,5 кг) этого элемента, но, конечно, в виде химических соединений. Он входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни. Фосфорсодержащие белки присутствуют в мышцах, мозговой ткани и нервах животных и человека, так же фосфор содержится во всех частях зеленых растений.
Но особенно много фосфора содержат кости и зубы: их химический состав почти точно совпадает с формулой минерала фосфорита Ca3(PO4)2.
Слайд 4Историческая справка
Документированное открытие фосфора состоялось в 1669 г., немецким алхимиком
Хённиг Брандом.
Отставной солдат Хённиг Бранд из Гамбурга, подобно другим
алхимикам, упорно пытался отыскать волшебный философский камень, который возвращал бы больным старикам молодость и здоровье, а все металлы обращал в золото. Как и другие алхимики, Бранд действовал вслепую, подвергая разнообразные вещества химическим операциям – перегонке, выпариванию, прокаливанию. Однажды ему пришло в голову выпарить воду из мочи, которая в большом количестве скапливалась в ямах около солдатских казарм. Сказано – сделано. И вот получен сухой остаток от выпаривания. Бранд смешивает его с углем и песком, прокаливает и... в реторте оказывается удивительное светящееся в темноте вещество, которое он назвал «холодным огнем».Слайд 5Открытие фосфора изображено на картине английского художника Дж. Райта («Райт
из Дерби», 1734–1797 гг.)
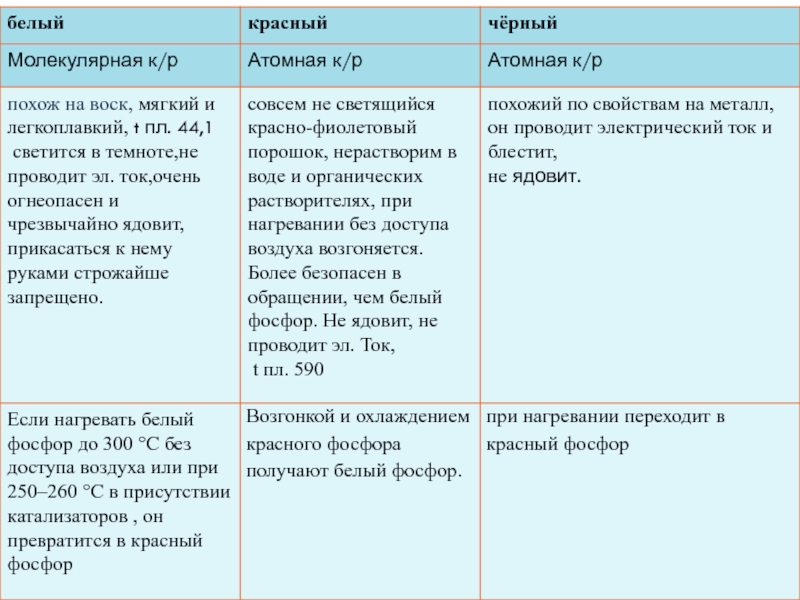
Слайд 6Аллотропные модификации и физические св-ва
Фосфор в обычных условиях представляет собой
несколько устойчивых аллотропических модификаций. Обычно выделяют три аллотропные модификации простого
вещества – белую, красную, черную и металлический фосфор.Слайд 8Химические свойства
Белый фосфор Р4 значительно активнее красного фосфора: так, температура
вспышки белого фосфора 34 °С (часто самовозгорается на воздухе), а
красного фосфора 240 °С.В уравнениях реакций фосфор для упрощения записывают как P. Красный фосфор на воздухе загорается только при нагревании, реагирует с фтором, хлором и серой.
Свечение на воздухе характерно только для белого фосфора P4. Белый фосфор светится за счет того, что при медленном окислении из Р4 получается оксид фосфора(III).
Слайд 9Химические свойства
1)С неметаллами
4P + 5O2 2P2O5
4P + 3O2
2P2O3 (мало O2)
2P + 3H2 2PH3 фосфин практически
не реагируют2P + 3S P2S3
2P + 5Cl2 2PCl5 реакция протекает с выделением большого кол-ва тепла
При температурах выше 2000°С Фосфор реагирует с углеродом с образованием карбида РС3
Из соединений Фосфора с азотом известны нитриды PN, P2N3, P3N5 - твердые, химически устойчивые вещества, полученные при пропускании азота с парами фосфора через электрическую дугу
Слайд 102)С активными металлами
2P + 3Ca Ca3P2
фосфид кальция
Ca3P2 + H2O = Ca(OH)2 + PH3 гидролиз
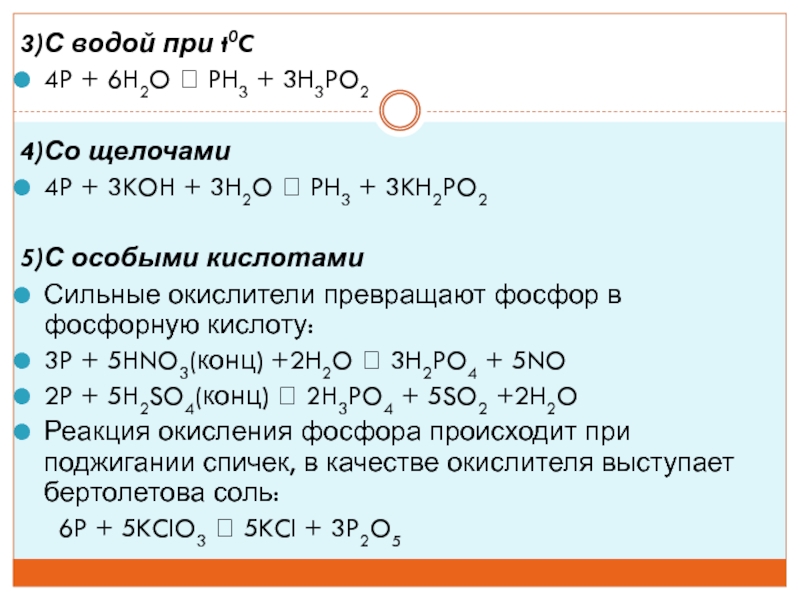
фосфидовСлайд 113)С водой при t0C
4P + 6H2O PH3 + 3H3PO2
4)Со
щелочами
4P + 3KOH + 3H2O PH3 + 3KH2PO2
5)С особыми
кислотами Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO3(конц) +2H2O 3H2PO4 + 5NO
2P + 5H2SO4(конц) 2H3PO4 + 5SO2 +2H2O
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO3 5KCl + 3P2O5
Слайд 12Получение фосфора
Получение фосфора в промышленности
Сырьем для промышленного получения фосфора служит
минерал фосфорит Ca3(PO4)2. Его смешивают с углем и кварцевым песком
и прокаливают при высокой температуре.Ca3(PO4)2 +3SiO2+5C=3CaSiO3+2P+5CO (2000 °C)
4HPO3 +10C = P4 + 2H2O+10CO
Слайд 13
Применение фосфора и его соединений
Фосфор используется для изготовления спичек, производства
зажигательных смесей.
Много фосфора используется в производстве фосфорорганических ядохимикатов –
таких, как хлорофос, карбофос, дихлофос. Другие фосфорорганические соединения помогают извлекать из растворов ценные металлы.
Главный потребитель ортофосфорной кислоты H3PO4 – производство минеральных удобрений. Суперфосфат (простой и двойной), преципитат, аммофос, нитрофоска – все это вещества, необходимые для повышения урожайности.
Слайд 14Удобрение
Простой суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4
Двойной суперфосфат -- Ca(H2PO4)2•H2O
Слайд 15Химия и литература
«Да! Это была собака, огромная, черная, как смоль.
Но такой собаки еще никто не видывал. Из ее пасти
вырывалось пламя, глаза метали искры, по морде и загривку мерцал переливающийся огонь. Ни в чьем воспаленном мозгу не могло возникнуть виденее более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана…. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами.Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
- Фосфор, - сказал я»
Вопрос: В этом отрывке из «Собаки Баскервилей» А. Конан Дойл допустил существенную химическую ошибку. Назовите ее.
Слайд 16PH3 Фосфин
Фосфин - «мерцающий свет, появляющийся на болотах (знаменитые «блуждающие
огни») — результат самопроизвольного воспламенения фосфина»
фосфин, или фосфористый водород (PH3)
— это бесцветный газ с неприятным запахом гниющей рыбы или чеснока.Плохо растворяется в воде, не реагирует с ней.Фосфин сильно ядовит, действует на
нервную систему.
Фосфин способен к самовозгоранию при контакте с кислородом воздуха.
Слайд 17Получение фосфина
1)Фосфин получают при взаимодействии белого фосфора с горячей щёлочью
8P
+ 3Ca(OH)2 + 6H2O = 2PH3 + 3Ca(H2PO2)2
2)воздействием воды или
кислот на фосфиды Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2
Ca3P2 + 6HCl = 2PH3 + 3CaCl2
3)Разложение йодида фосфония
PH4I = PH3 + HI (800С)
Слайд 18Химические свойства фосфина
Химические свойства похожи на аммиак, проявляет слабые основные
св-ва.
PH3 + HCl = PH4Cl (t 30С)
PH3 + O2 =
H3PO42PH3 = 2P + 3H2 (t 0C)
Соли фосфина и сам фосфин, являются сильными восстановителями.
PH3 + H2SO4 = H3PO2+ SO2+ H2O
PH3+HNO3= H3PO4+ NO2+ H2O
PH3+I2+ H2O= H3PO2+ HI
Слайд 19Кислородсодержащие соединения фосфора
HPO3 – метафосфорная кислота
H3PO4 – ортофосфорная кислота
H4P2O7 –
пирофосфорная кислота
H3PO3 – фосфористая кислота
H3PO2 – фосфорноватистая кислота (одноосновная)
P2O3 оксид
фосфора lllP2O5 оксид фосфора V
Слайд 20Применение фосфина
В сельском хозяйстве для обеззараживания зернохранилищ и защите от
клещей и других вредителей при транспортировке урожая, особенно зерновых культур.
Раньше
его активно применяли против крыс и мышей в амбарах. В Австралии к его помощи прибегают даже в борьбе с чрезмерно быстро размножающимися кроликами.
Ряд гербицидов и инсектицидов содержат фосфорорганические соединения на основе фосфина и его производных.
химическое оружие: зарина и зомана — на основе производных фосфина.
Слайд 21P2O3 - Фосфористый ангидрид (оксид фосфора (III).
Белые кристаллы, в парах
состоит из молекул P4O6. Кислотный оксид.
Получение.
Окисление фосфора при недостатке кислорода:
4P + 3O2 2P2O3
Химические свойства.
1)Кислотный оксид фосфористой кислоты:
P2O3 + 3H2O 2H3PO3
P2O3+ 4NaOH 2Na2HPO3+ H2O
P2O3+ 6NaOH 2Na3PO3+ 3H2O
P2O3 + K2O K3PO3
2)Сильный восстановитель:
O2+ P2O3 P2O5
Слайд 22P2O5 Фосфорный ангидрид (оксид фосфора (V).
Белые кристаллы. В парах состоит
из молекул P4H10, очень гигроскопичен (используется как осушитель газов и
жидкостей).Получение:
4P + 5O2 2P2O5
Химические свойства.
1)С водой
P2O5 + H2O 2HPO3 (мало H2O)
P2O5 + 3H2O 2H3PO4
2)С основным и амфотерным оксидом
P2O5 + 3BaO Ba3(PO4)2
3)C щелочью
P2O5 + 6KOH 2K3PO4+ 3H2O
P2O5 + KOH KH2PO4 + H2O
P2O5 + KOH K2HPO4 + H2O
Слайд 234)P2O5 - сильное водоотнимающее средство:
P2O5+ 2HNO3 2HPO3 +
N2O5
P2O5+ 2HClO4 2HPO3+ Cl2O7
P2O5 + H2SO4 H2PO4 +
SO35)c солями
P2O5 + 2K3PO4+ H2O KH2PO4
Слайд 24Фосфорные кислоты Кислоты
Получение фосфорной кислоты
P2O5 + 3H2O 2H3PO4
Ca3(PO4)2 +
3H2SO4(конц) 2H3PO4 + 3CaSO4
3P + 5HNO3 + 2H2O
3H3PO4 + 5NO Слайд 25Химические свойства фосфорной кислоты
взаимодействие с индикаторами
Лакмус
– красный
Метилоранж – красный
Фенолфталеин – бесцветныйРеагирует с металлами до H
3Mg + 2H3PO4 = Mg3(PO4)2 + H2
Реагирует с оксидами металлов
3MgO + 2H3PO4 = Mg3(PO4)2 + 3H2O
Реагирует с гидроксидами металлов
3 Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 + 6H2O