Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогены
Содержание
- 1. Галогены
- 2. ГалогеныПоложение в ПСХЭ Д.И. Менделеева Строение атомов
- 3. Слайд 3
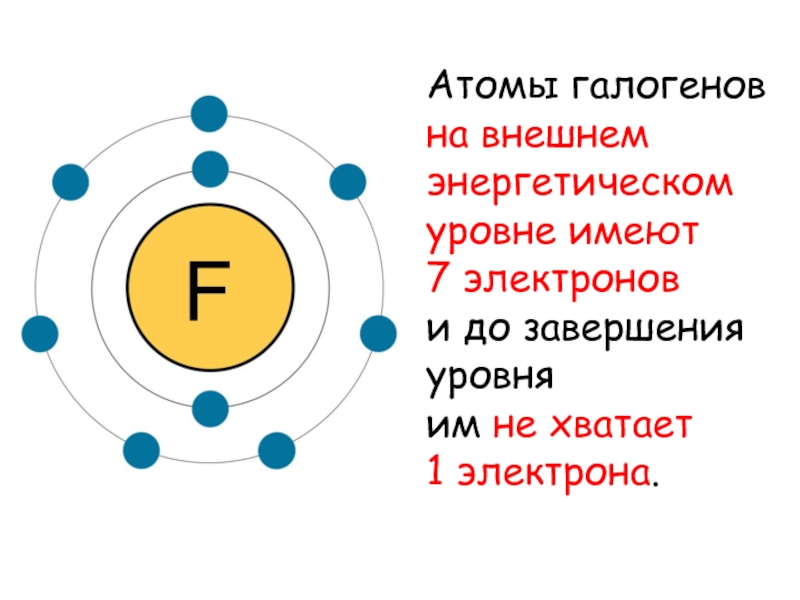
- 4. Атомы галогенов на внешнем энергетическом уровне имеют
- 5. Галогены – сильные окислители. Фтор проявляет только
- 6. Фтор - бледно-жёлтыйгаз с резкимраздражающимзапахом.Очень ядовит.
- 7. Впервые получил фтор в свободном виде в
- 8. Использование хлора как отравляющего вещества в Первой мировой войне
- 9. Хлор - газ жёлто-зеленогоцветас резкимзапахом.Ядовит.
- 10. Открыл хлор в 1774 г. шведский химик
- 11. Слайд 11
- 12. Бром - красно-бураялетучаяжидкость с резкимнеприятнымзапахом
- 13. Французский химик Антуан Жером Балар открыл бром
- 14. ЙодЧерно-серые кристаллы с металлическимблеском (пары - фиолетовые).Пары
- 15. Французский химик Бернар Куртуа получил йод в
- 16. Нахождение галогенов в природеВвиду большой реакционной способности
- 17. Галит NaCl
- 18. Сильвин KCl
- 19. Сильвинит — осадочная горная порода, состоящая из чередующихся слоев галита и сильвина KCl·NaCl
- 20. Карналлит KCl·MgCl2·6H2O
- 21. Флюорит (плавиковый шпат) CaF2
- 22. Флюорит (плавиковый шпат) CaF2
- 23. Флюорит (плавиковый шпат) CaF2
- 24. Бром и йод своих минералов не
- 25. Ламинария
- 26. Химические свойства галогенов 1. Взаимодействие галогенов
- 27. 2. Взаимодействие галогенов с водородом: Н2
- 28. 3. Взаимодействие галогенов со сложными веществами:Cl2
- 29. Соединения галогенов
- 30. Галогеноводородные кислотыHF - фтороводородная (плавиковая) кислотаHCl
- 31. Получение хлороводорода В промышленности: H2
- 32. Соляная кислота — это бесцветная жидкость, которая дымится на воздухе.
- 33. Химические свойства соляной кислотыВзаимодействие с металлами:
- 34. Применение брома и его соединенийВ химииВещества на
- 35. Применение брома и его соединений в
- 36. Применение брома и его соединенийВ медицине бромид натрия и бромид
- 37. Йод и его соединения применяют в
- 38. Применение при лечении атеросклерозаЙод влияет на белковый
- 39. Интернет-ресурсы:https://pp.vk.me/c636222/v636222978/2827b/X-DfS6XUnmU.jpghttps://bugaga.ru/uploads/posts/2014-03/1394013226_izobreteniya-8.jpghttps://ru.wikipedia.org/wiki/%D0%91%D1%80%D0%BE%D0%BC#/media/File:Bromine_vial_in_acrylic_cube.jpghttps://upload.wikimedia.org/wikipedia/commons/a/ac/Antoine_J%C3%A9r%C3%B4me_Balard_1870s.jpghttps://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80#/media/File:Chlorine_liquid_in_an_ampoule.jpghttps://regnum.ru/uploads/pictures/news/2016/02/12/regnum_picture_145525356770271_normal.jpghttp://finesell.ru/images/articles/gornije-porodi-minerali/silvin-1.jpghttp://favera.ru/img/2014/05/19/453361_1400511547.jpg
- 40. school-collection.edu.ru1. Получение водорода в лаборатории 2. Использование
- 41. Скачать презентанцию
ГалогеныПоложение в ПСХЭ Д.И. Менделеева Строение атомов и возможные степени окисленияФизические свойства галогеновНахождение галогенов в природеХимические свойства галогеновПрименение галогенов
Слайды и текст этой презентации
Слайд 4Атомы галогенов
на внешнем энергетическом уровне имеют
7 электронов
и
до завершения уровня
им не хватает
1 электрона.
Слайд 5Галогены – сильные окислители.
Фтор проявляет только окислительные свойства,
для
него характерна степень окисления -1.
Остальные галогены могут проявлять
и окислительные (ст.
окисления -1),и восстановительные свойства (степени окисления +1, +3, +5 или +7)
Слайд 7Впервые получил фтор в свободном виде в 1886 г.
французский химик
Анри Муассан,
за что был удостоен Нобелевской премии.
Название «фторос»
в
переводе с греческого значит разрушающий, было дано из-за большой токсичности фтора. Слайд 10Открыл хлор
в 1774 г. шведский химик Карл Шееле.
Своё
название хлор получил благодаря цвету простого вещества,
в переводе
с
греческого «хлорос» значит жёлто-зелёный.Слайд 13Французский химик Антуан Жером Балар открыл бром
в 1826 г.
В переводе с греческого «бромос» значит зловонный,
что соответствует невыносимому запаху
простого вещества брома.Слайд 14Йод
Черно-серые кристаллы с металлическим
блеском (пары - фиолетовые).
Пары йода ядовиты и
раздражают
слизистые оболочки.
На кожу йод оказывает прижигающее и
обеззараживающее действие.
Слайд 15Французский химик Бернар Куртуа получил йод в 1811 г. Своё
название йод получил за свою фиолетовую окраску (в переводе с
греческого «иодэс» означает фиолетовый)Слайд 16Нахождение галогенов в природе
Ввиду большой реакционной способности галогенов в природе
они встречаются исключительно в виде соединений
Самыми распространенными среди галогенов являются
хлор, который составляет 0,19% от массы земной коры,
и фтор – 0,03%.
Слайд 19Сильвинит — осадочная горная порода, состоящая из чередующихся слоев галита и
сильвина KCl·NaCl
Слайд 24Бром и йод своих минералов не образуют. Их соединения по большей
части
концентрируются
в морских и подземных водах, накапливаются в морских водорослях.
Слайд 26
Химические свойства галогенов
1. Взаимодействие галогенов с металлами:
Ag + F2 =
Fe
+ Cl2 =
Cu + Br2 =
Al + I2 =
Слайд 272. Взаимодействие галогенов
с водородом:
Н2 + F2 =
H2 +
Cl2 =
H2 + Br2 =
H2 + I2 =
Галогеноводороды —
бесцветные газы, с резким запахом, токсичны. Слайд 30Галогеноводородные кислоты
HF - фтороводородная (плавиковая) кислота
HCl - хлороводородная (соляная)
кислота
HBr - бромоводородная кислота
HI - йодоводородная кислота
Степень диссоциации и сила
кислотувеличиваются от плавиковой
к йодоводородной
Слайд 31
Получение хлороводорода
В промышленности:
H2 + Cl2 = 2HCl
В лаборатории:
NaCl + H2SO4 =
конц. Слайд 33Химические свойства соляной кислоты
Взаимодействие с металлами:
HCl + Al
=
Взаимодействие с основными оксидами:
HCl + CuO =
Взаимодействие с
основаниями:HCl + Cu(OH)2 =
Взаимодействие с солями:
HCl + Na2CO3 =
Слайд 34Применение брома и его соединений
В химии
Вещества на основе брома широко
применяются в основном органическом синтезе.
«Бромная вода» применяется как реагент для
качественного определения непредельных органических соединений.Слайд 35Применение брома и его соединений
в технике
Бромид серебра AgBr применяется в фотографии как
светочувствительное вещество.
Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине,
текстильным материалам.1,2-дибромэтан применяют как антидетонирующую добавку в моторном топливе.
Слайд 36Применение брома и его соединений
В медицине
бромид натрия и бромид калия применяют как успокаивающие средства.
В
производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Слайд 37Йод и его соединения применяют
в медицине
Препараты, содержащие йод, обладают
антибактериальными, противовоспалительными и противогрибковыми свойствами;
их применяют наружно для обеззараживания
ран, подготовки операционного поля. При приеме внутрь препараты йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы.
Слайд 38Применение при лечении атеросклероза
Йод влияет на белковый и жировой (липидный)
обмен,
снижает содержание холестерина в крови
Для диагностических целей
используют рентгеноконтрастные вещества,
содержащие иод.Слайд 39Интернет-ресурсы:
https://pp.vk.me/c636222/v636222978/2827b/X-DfS6XUnmU.jpg
https://bugaga.ru/uploads/posts/2014-03/1394013226_izobreteniya-8.jpg
https://ru.wikipedia.org/wiki/%D0%91%D1%80%D0%BE%D0%BC#/media/File:Bromine_vial_in_acrylic_cube.jpg
https://upload.wikimedia.org/wikipedia/commons/a/ac/Antoine_J%C3%A9r%C3%B4me_Balard_1870s.jpg
https://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80#/media/File:Chlorine_liquid_in_an_ampoule.jpg
https://regnum.ru/uploads/pictures/news/2016/02/12/regnum_picture_145525356770271_normal.jpg
http://finesell.ru/images/articles/gornije-porodi-minerali/silvin-1.jpg
http://favera.ru/img/2014/05/19/453361_1400511547.jpg
Слайд 40school-collection.edu.ru
1. Получение водорода в лаборатории
2. Использование хлора как отравляющего
вещества в Первой мировой войне
3. Хлор
4. Бром
5. Пары йода
6. Фтор
7.
Качественные реакции на галогенид-ионы8. Получение хлороводорода