Слайд 1Геохимические процессы в системе природная вода – горная порода
(2)
Продолжение
Слайд 2Гидратация-дегидратация
Процесс гидратации заключается во вхождении молекул воды в структуру
минералов в виде координационно связанных молекул (минералы типа гипса) или
не связанных с решеткой молекул (цеолиты).
На долю воды приходится значительная часть объема минерала. При гидратации происходит перестройка кристаллической структуры минерала (уплотнение) и возрастание объема минералов, обусловленное связыванием в минералах воды.
Объемный эффект гидратации поэтому может быть отрицательным, близким к нулю и положительным. Наибольшим объемным эффектом (до 20—30 см3 на моль Н2О) обладают реакции цеолитизации.
Слайд 3Одной из наиболее простых гидратирующих систем является пара гипс—ангидрит.
CaSO4
+ H2O CaSO4. 2H2O;
ангидрит
гипс
гипсы и ангидриты в природных условиях четко гипсометрически локализованы: основные массы ангидрита приурочены к участкам, находящимся на глубине более 460 м от дневной поверхности, а гипсы - к верхним частям разреза.
Слайд 4Аналогичные равновесия – мирабилит-тенардит, содовые минералы
Гидрогели:
SiO2 + nH2O SiO2.nH2O
(опал)
Агаты. Интересные свойства кремней (бактериофаг).
Слайд 5Поглощение воды цеолитами
связано со свойствами кристаллической решетки. Алюминиевые и
кремниевые тетраэдры образуют рыхлый каркас с каналами, достигающими нескольких ангстрем
в поперечнике. Эти каналы обеспечивают легкую доступность молекул воды во внутренние участки структуры.
Na2 Al2 Si3 O10.2H2O или Na16 Al16 Si24 O80.16H2O – натролит
Слайд 6Вхождение воды в состав цеолитных минералов в первую очередь связано
с увеличением гидростатического давления, вывод ее обусловливается увеличением температуры до
400оС
Использование цеолитов для очистки питьевых и сточных вод, сушки. Отдают и принимают воду без разрушения крист. решетки; ионообменники; сорбенты. Использование в корме скота, рыб (до 6%) – свх. Тихоокеанский; свиноматки увеличили вес на 30%.
Слайд 7Особо следует остановиться на глинистых минералах, ряд которых содержит межслоевую
воду (смектиты, вермикулиты, галлуазиты). Ее удаление, так же как и
для других минералов, связано с повышением температуры. Наиболее важна дегидратация монтмориллонита, приводящая к образованию гидрослюд на глубинах более 2000—3000 м.
Слайд 8Таким образом, процессы, возникающие на границе раздела горных пород и
подземных вод, приводят во многих случаях к проникновению молекул воды
в кристаллическую решетку минералов. В результате при определенных термодинамических параметрах образуются новые минералы и может произойти полное замещение прежних горных пород новыми.
Слайд 9Сорбция, ионный обмен
Сорбция – избирательное поглощение твердых веществ и газов.
Мера: удельная поверхность – м2/г.
На раздробление вещества и образование коллоидов
затрачивается энергия, которая частично превращается в геохимическую энергию сорбции. Суммарная поверхность 1 г коллоидной фракции в сотни тысяч и миллионы раз больше поверхности 1 г частиц, видимых простым глазом (поверхность 1 г бентонитовых глин колеблется от 40 до 96 м2, каолиновых - от 17 до 65 м2).
Слайд 10Поэтому значительна и поверхностная энергия природных коллоидов
Неполярная сорбция состоит в
поглощении из раствора целых молекул, например газов и паров, молекул
органических веществ. В зоне гипергенеза многие глинистые минералы сорбируют из вод органические молекулы.
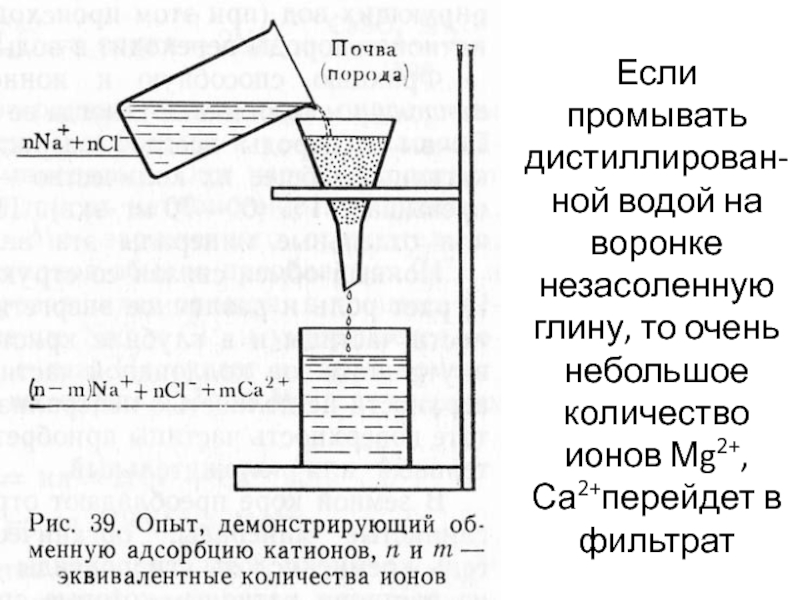
Слайд 11Полярная сорбция - ионный обмен
Истолкование ионного обмена было дано выдающимся
русским ученым К.К. Гедройцем (1872 - 1932).
Он доказал, что
каждая почва, глина, всякая мелкоземистая порода содержит катионы, которые, не растворяясь в дистиллированной воде, переходят в раствор нейтральной соли.
При этом часть катионов нейтральной соли в эквивалентных количествах поглощается твердой фазой. Количество аниона нейтральной соли в большинстве случаев не меняется.
Слайд 12Если промывать дистиллирован-ной водой на воронке незасоленную глину, то очень
небольшое количество ионов Мg2+, Са2+перейдет в фильтрат
Слайд 13Если вместо воды применить раствор соли, например NаСl, то количество
Сl- в фильтрате почти не изменится, содержание Nа+ уменьшится и
появятся Мg2+, Са2+ в количестве, эквивалентном исчезнувшему Nа+.
Следовательно, глина поглотила Nа+ и взамен выделила в раствор эквивалентное количество Мg2+, Са2+, т. е. глины способны обменивать ионы.
Слайд 14Катионы породы, способные обмениваться на катионы раствора, Гедройц назвал обменными
катионами.
Наиболее энергично поглощаются многовалентные катионы (R), т. е. энергия
поглощения R3+ >R2+ >R+.
Среди ионов с одинаковой валентностью энергия поглощения растет с ростом атомной массы и радиуса нона (Li+< Nа+ Поэтому K+ поглощается энергичнее Nа+.
Слайд 15Обменная сорбция подчиняется закону действия масс, она тем интенсивнее, чем
выше концентрация катионов в водах
Ряды: H
+>Fe 3+>Al 3+>Ba 2+> Sr 2+>Ca 2+>Mg 2+>K +>NH4+>Na +>Li +
J ->Br ->Cl ->OH -
Наиболее распространенный процесс:
2Naтв + Сa2+ р-р <===> Caтв + 2Na+р-р
На отрыв натрия 11,6 кал, кальция – 74,2 кал; реакция легче идет вправо
Слайд 16SО4 - Са (или SО4 - Мg) подземные воды мигрируют
среди глинистых пород морского происхождения, обычно содержащих обменный Nа+
наблюдается
следующая реакция:
глина = 2Nа++ СаSО4 ↔ Na2SО4 + глина = Са2+
глина = 2Nа++ МgSО4 ↔ Na2SО4+ глина = Мg2+
Символом глина = Са2+ обозначена глина, содержащая обменный Са2+, глина = Мg2+ - обменный Мg2+.
Слайд 17Постепенно весь обменный натрий глин переходит в раствор, воды из
сульфатных кальциевых (магниевых) превращаются в сульфатные натриевые, а поглощающий комплекс
из типично морского натриевого становится типично континентальным кальциево - магниевым.
Слайд 18Возможны и обратные реакции: сульфатные-натриевые воды, мигрируя среди горных пород,
поглощающий комплекс которых насыщен Са2+, обменивают Nа+ на обменный Са2+
породы. Кальций, соединяясь с SО42-раствора, образует труднорастворимый гипс.
глина = Са2+ + 2Nа+ + SО42- + 2Н2О ↔ глина = 2Nа+ + Ca SО4.2Н2О (гипс)
Таково происхождение некоторых гипсовых аккумуляций в глинах и почвах
Слайд 19Менее распространены положительно заряженные коллоиды, к которым относятся гидроксиды Fе,
Аl, Тi, Sr и др.
Они способны обменивать SО42-, С1-,
PО43-, VО43- и другие анионы.
Так, в осадочных железных рудах нередко повышено содержание Р, V, Аs, сорбированных положительно заряженными гелями гидроксидов Fе.
Слайд 20Емкость поглощения (обменная емкость) – мг-экв/ 100 г породы
Почвы и
породы всегда содержат некоторое количество обменных катионов. Общее их количество
- емкость поглощения - обычно не превышает 1 % (60—70 мг.экв). При расчете на коллоидную фракцию или отдельные минералы эта величина возрастает в несколько раз.
Слайд 21Некоторые показатели
Обменная емкость глинистых минералов (мг-экв/100 г):
> 80
монтморилонит, нонтронит, бейделлит (трехслойная решетка)
15-80 гидрослюды
галлуазит (пакетная решетка)
Изоэлектрические точки (значение рН, выше которого начинаеся обмен)
кремнезем – 2; монтмориллонит – 2,5; каолинит –3,5; гидроокись железа – 6,9; гидроокись алюминия – 9,0.
Слайд 22Ионный обмен характерен не только для коллоидов
он известен и
у макрокристаллических силикатов.
Еще в ХIХ в. подобные свойства были
обнаружены у анальцима, шабазита, гарматома, гейландита, натролита и других цеолитов. В их кристаллической решетке часть Si4+ замещена Al3+, недостающий положительный заряд компенсирован катионами щелочных и щелочноземельных металлов, которые не связаны со строго определенным положением в решетке и способны к обмену.
Слайд 23в гидротермальных и надкритических условиях
к ионному обмену способны полевые
шпаты, фельдшпатоиды, слюды, некоторые титано- и цирконосиликаты, танталониобаты, сульфиды и
другие минералы.
Эксперименты при t 400—500оС и давлении 105 кПа показали, что Nа+ и K+ санидина (полевой шпат) и нефелина могут взаимно замещаться. Максимальная обменная емкость калиевого полевого шпата 347 мг.экв на 100 г.
Слайд 24Ионный обмен K+, Nа+, Li+, Rb+, Cs+ экспериментально установлен у
поллуцита, сподумена, слюды. Возможность ионного обмена в этих условиях была
доказана также для апатита (Са2+, Nа+, Sr2+, Lа3+, Y3+) пирохлора (Nа+, Са2+, Lа3+, Y3+), сфалерита (Zn2+, Fe2+, Cd2+).
С ионным обменом связывают альбитизацию калиевых полевых шпатов, нефелинизацию, гранитизацию гнейсов и другие процессы метасоматоза.
Слайд 25Итак, с ростом температуры ионный обмен возможен у таких минералов,
как полевые шпаты и фельдшпатоиды.
Рост давления уменьшает обменную емкость.
Предполагают, что именно рост давления ограничивает возможность ионного обмена глубинами первых километров от земной поверхности.