Выполнил: Ефименко Д.А.
Студент группы ХЕМО-01-17
Министерство образования и науки Российской Федерации
Московский
технологический университетИнститут тонких химических технологий







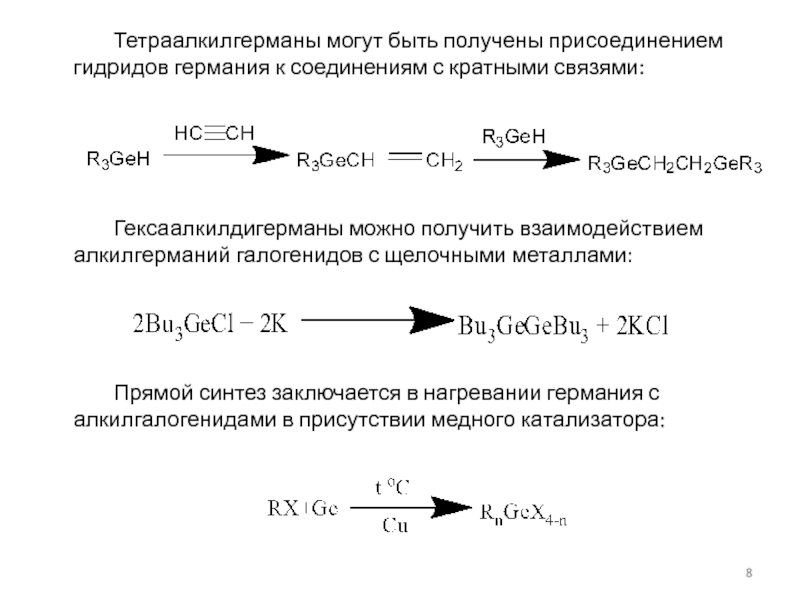
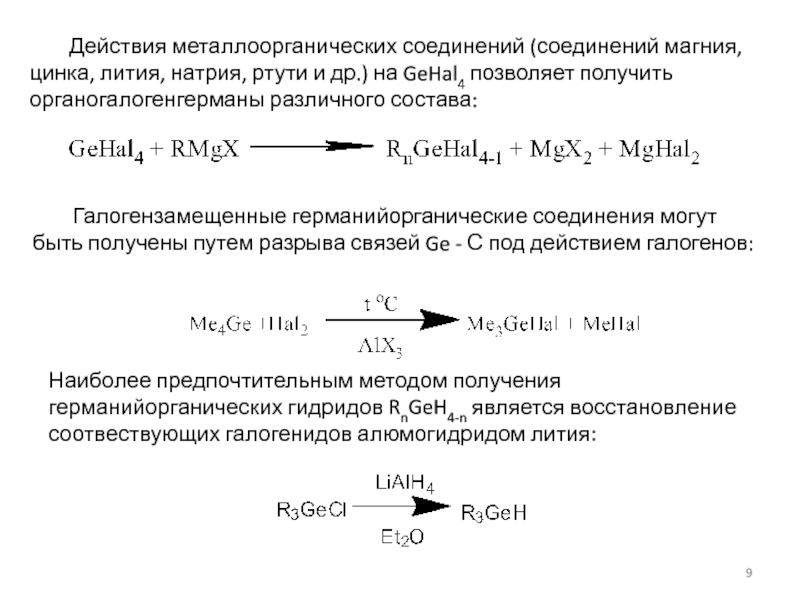
![Германий, его характеристика, способы получения органопроизводных, химические Германий реагирует с кислотами:Ge + H2SO4 (конц) = Ge(SO4)2 + 2SO2↑ Германий реагирует с кислотами:Ge + H2SO4 (конц) = Ge(SO4)2 + 2SO2↑ + 4H2O,Ge + 6HF = H2[GeF6]](/img/thumbs/d3f9af2e49abb4c6c668c737d7b66016-800x.jpg)
























