Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей
Содержание
- 1. Гидролиз солей
- 2. Типы солей, подвергающихся гидролизу Гидролизу, подвергаются три типа
- 3. Гидролиз по аниону Гидролиз солей этого типа идет
- 4. Полная ионная и молекулярная формы уравнений реакций
- 5. Гидролиз по катиону 2. Второй тип солей, которые
- 6. Полная ионная и молекулярная формы уравнений реакций
- 7. Гидролиз и по катиону и по аниону3.
- 8. Реакция среды в растворах солей, образованных слабой
- 9. Гидролиз солей с многозарядными ионами Соли, в
- 10. Три ступени гидролиза Гидролиз протекает в три ступени. 1-я
- 11. Третья ступень гидролиза 3-я ступень гидролиза: Fe(OH)2+ +
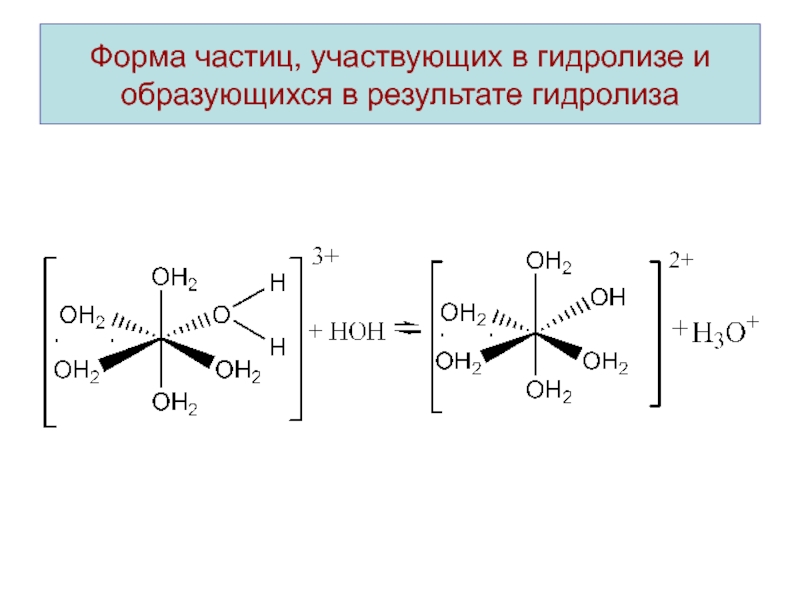
- 12. Форма частиц, участвующих в гидролизе и образующихся в результате гидролиза
- 13. Соли, которые не подвергаются гидролизу Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются.
- 14. Константа гидролиза Гидролиз как правило протекает обратимо.
- 15. Степень гидролиза Степень гидролиза – отношение концентрации
- 16. Необратимый гидролиз Если хотя бы один из
- 17. Скачать презентанцию
Типы солей, подвергающихся гидролизу Гидролизу, подвергаются три типа солей:Соли, образованные слабой кислотой и сильным основанием. Например: нитрит натрия NaNO2. Она образуется при взаимодействии слабой азотистой кислоты и сильного основания – гидроксида натрия: HNO2 +
Слайды и текст этой презентации
Слайд 1Гидролиз солей
Гидролиз соли – это взаимодействие ионов соли с водой,
приводящее к образованию слабой кислоты или слабого основания.
Слайд 2Типы солей, подвергающихся гидролизу
Гидролизу, подвергаются три типа солей:
Соли, образованные слабой
кислотой и сильным основанием. Например: нитрит натрия NaNO2.
Она образуется при
взаимодействии слабой азотистой кислоты и сильного основания – гидроксида натрия:HNO2 + NaOH = NaNO2 + H2O (реакция нейтрализации)
Соль – сильный электролит. При ее диссоциации образуется катион сильного основания и анион слабой кислоты:
NaNO2 Na+ + NO2- (нитрит-ион)
Слайд 3Гидролиз по аниону
Гидролиз солей этого типа идет по аниону. Нитрит-ион
взаимодействует с молекулой воды, отщепляет от нее катион водорода и
образует слабую азотистую кислоту:NO2- + H+OH- ⇄ HNO2 + OH-
Это сокращенная ионная форма записи уравнения реакции гидролиза.
Она является наиболее наглядной и показывает:
1. по какому иону идет гидролиз (в данном случае – по нитрит-иону);
2. какой слабый электролит образуется (в данном случае – слабая азотистая кислота);
3. какова реакция среды (в данном случае – среда щелочная, потому что образуются гидроксид-ионы ОН-).
Слайд 4Полная ионная и молекулярная формы уравнений реакций гидролиза
Чтобы получить уравнение
реакции в полной ионной форме, нужно в левую и правую
части уравнения в сокращенной ионной форме добавить противоионы:Na+ + NO2- + HOH ⇄ HNO2 + OH- + Na+ (уравнение в полной ионной форме)
Противоионы не испытывают никаких изменений в процессе гидролиза (в данном случае противоионы – это катионы натрия Na+).
Соединяя ионы в соответствии со знаком заряда, получаем молекулярную форму уравнения:
Na+ + NO2- + HOH ⇄ HNO2 + OH- + Na+
NaNO2 + HOH ⇄ HNO2 + NaOH (уравнение в молекулярной форме)
Слайд 5Гидролиз по катиону
2. Второй тип солей, которые подвергаются гидролизу, -
это соли образованные слабым основанием и сильной кислотой.
Например, соль хлорид
аммония NH4Cl образуется при взаимодействии слабого основания – гидроксида аммония и сильной хлороводородной кислоты:NH4OH + HCl = NH4Cl + H2O (реакция нейтрализации)
При диссоциации этой соли образуется катион аммония NH4+ и хлорид-ион Cl-:
NH4Cl = NH4+ + Cl-
Гидролиз солей этого типа идет по катиону. Положительно заряженный катион аммония взаимодействует с молекулой воды, отщепляет от нее отрицательно заряженный гидроксид-ион и образует молекулу слабого основания – гидроксида аммония:
NH4+ + H+OH- = NH4OH + H+
Какова реакция среды в растворе этой соли?
Кислая, так как образуются катионы водорода Н+
Слайд 6Полная ионная и молекулярная формы уравнений реакций гидролиза по катиону
Добавяя противоионы (Cl-) в левую и правую части уравнения реакции
гидролиза в сокращенной ионной форме, получаем уравнение реакции в полной ионной форме:Cl- + NH4+ + HOH ⇄ NH4OH + H+ + Cl-
Соединяя ионы в соответствии со знаком заряда, получаем уравнение реакции в молекулярной форме:
NH4Cl + HOH ⇄ NH4OH + HCl
Слайд 7Гидролиз и по катиону и по аниону
3. Третий тип солей,
которые подвергаются гидролизу – это соли, образованные слабой кислотой и
слабым основанием.Такие соли испытывают гидролиз и по катиону и по аниону.
Например, нитрит аммония NH4NO2, соль образованная слабым основанием – гидроксидом аммония NH4OH и слабой азотистой кислотой HNO2, испытывает гидролиз и по катиону и по аниону:
NH4+ + NO2- + H+OH- ⇄ NH4OH + HNO2
В результате гидролиза образуются два слабых электролита.
Слайд 8Реакция среды в растворах солей, образованных слабой кислотой и слабым
основанием
Реакция среды в растворах таких солей зависит от соотношения
констант диссоциации образующихся слабых электролитов.Если константа диссоциации слабой кислоты больше константы диссоциации слабого основания,
Ккисл Косн
то реакция среды кислая.
Если константа диссоциации слабого основания больше, чем константа диссоциации слабой кислоты
Ккисл Косн
то среда щелочная.
Если константы диссоциации слабых кислоты и основания равны, то среда нейтральная.
Слайд 9Гидролиз солей с многозарядными ионами
Соли, в состав которых входят
катионы слабых многокислотных оснований (Fe3+, Al3+, Fe2+, Zn2+) и анионы
многоосновных слабых кислот (PO43-, SO32-, S2-, CO32-), гидролизуются ступенчато.Например, хлорид железа (III) FeCl3 – соль слабого многокислотного основания гидроксида железа (III) и сильной хлороводородной кислоты подвергается гидролизу по катиону Fe3+.
Слайд 10Три ступени гидролиза
Гидролиз протекает в три ступени.
1-я ступень гидролиза:
Fe3+ +
HOH ⇄ FeOH2+ + H+ (сокращенная ионная форма)
3Cl- + Fe3+
+ HOH ⇄ FeOH2+ + H+ +3Cl- (полная ионная форма)FeCl3 + HOH ⇄ FeOHCl2 + HCl (молекулярная форма)
2-я ступень гидролиза:
FeOH2+ + HOH ⇄ Fe(OH)2+ + H+ (сокращенная ионная форма)
2Cl- + FeOH2+ + HOH ⇄ Fe(OH)2+ + H+ +2Cl- (полная ионная форма)
FeOHCl2 + HOH ⇄ Fe(OH)2Cl + HCl (молекулярная форма)
Слайд 11Третья ступень гидролиза
3-я ступень гидролиза:
Fe(OH)2+ + HOH ⇄ Fe(OH)3
+ H+ (сокращенная ионная форма)
Cl- + Fe(OH)2+ + HOH ⇄
Fe(OH)3 + H+ +Cl- (полная ионная форма)Fe(OH)2Cl+ HOH ⇄ Fe(OH)3 + HCl (молекулярная форма)
Такая запись является сильно упрощенной.
Слайд 13Соли, которые не подвергаются гидролизу
Соли, образованные сильной кислотой и
сильным основанием, гидролизу не подвергаются.
Слайд 14Константа гидролиза
Гидролиз как правило протекает обратимо.
В результате реакций
гидролиза в растворах устанавливается равновесие, которое характеризуется константами гидролиза, которые
отличаются от обычных констант равновесия тем, что равновесная концентрация молекул воды, которая должна присутствовать в знаменателе константы равновесия, принимается постоянной величиной, переносится в левую часть уравнения и включается в константу гидролиза. Например, для реакцииNO2- + HOH ⇄ HNO2 + OH-
Кравн =
Слайд 15Степень гидролиза
Степень гидролиза – отношение концентрации соли, подвергшейся гидролизу,
к общей концентрации соли в растворе:
Слайд 16Необратимый гидролиз
Если хотя бы один из продуктов гидролиза уходит
из раствора в виде газа или осадка, то гидролиз протекает
необратимо.Соли, подвергающиеся необратимому гидролизу, нельзя получить в водных растворах при помощи реакций обмена.
Например, при смешивании растворов хлорида алюминия и карбоната натрия вместо ожидаемого карбоната алюминия образуются осадок гидроксида алюминия и выделяется углекислый газ:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2