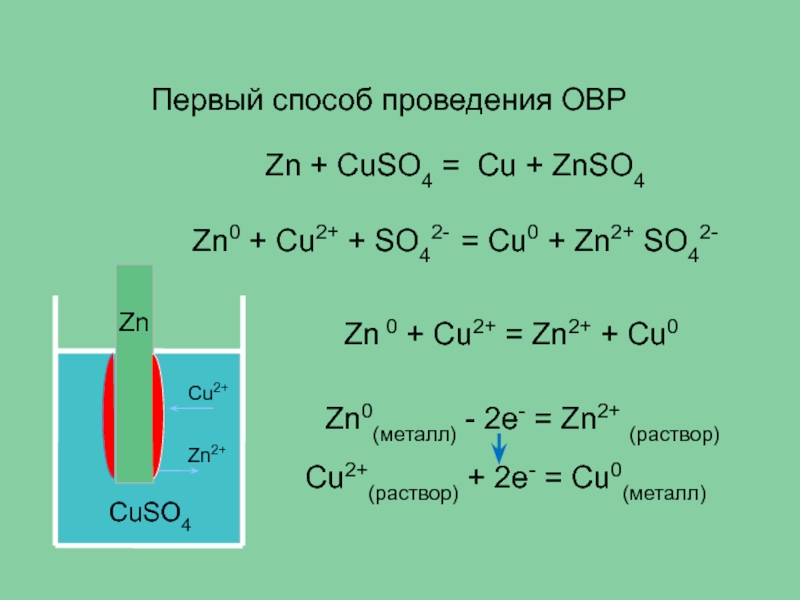
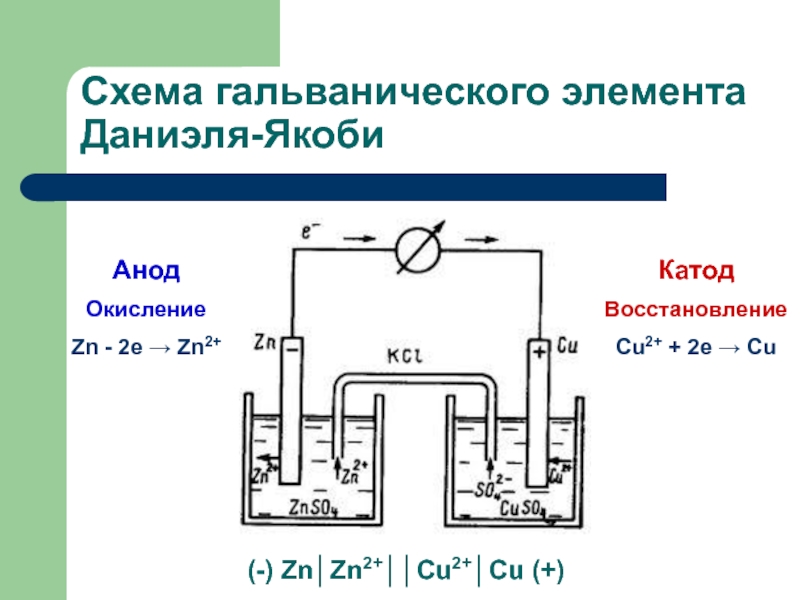
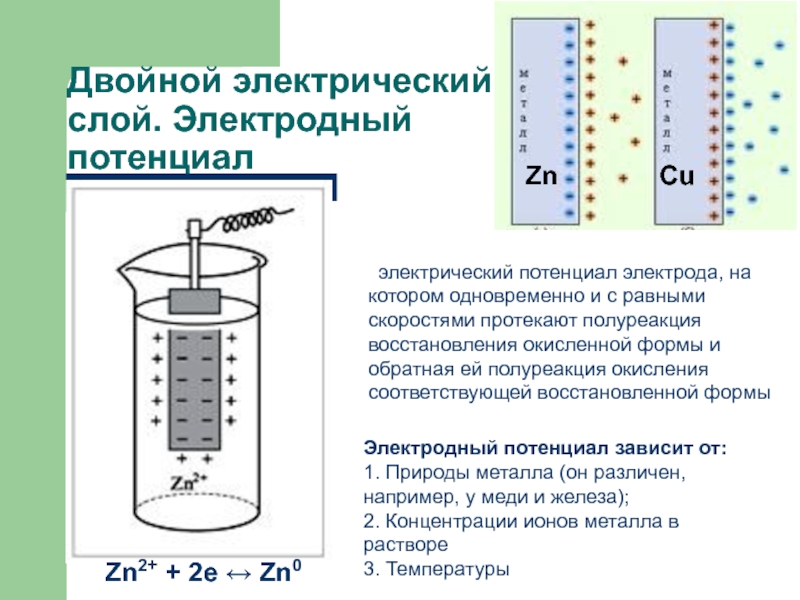
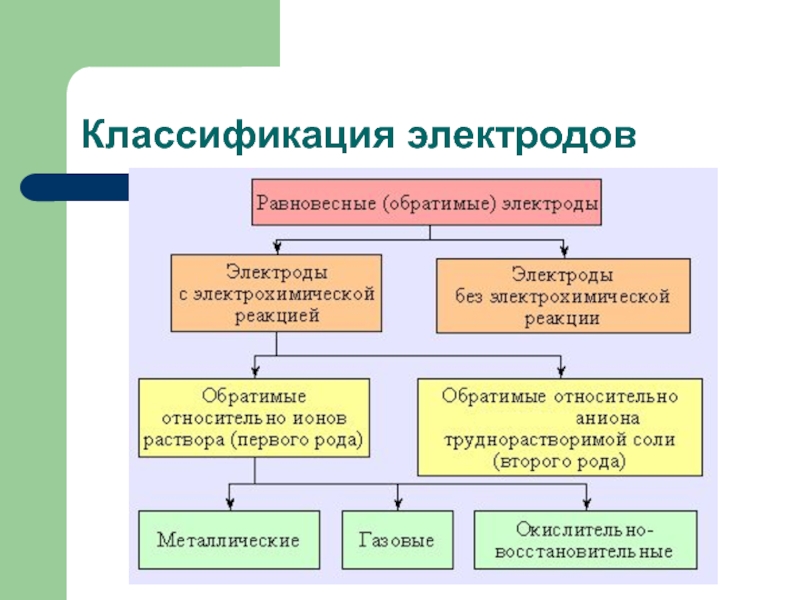
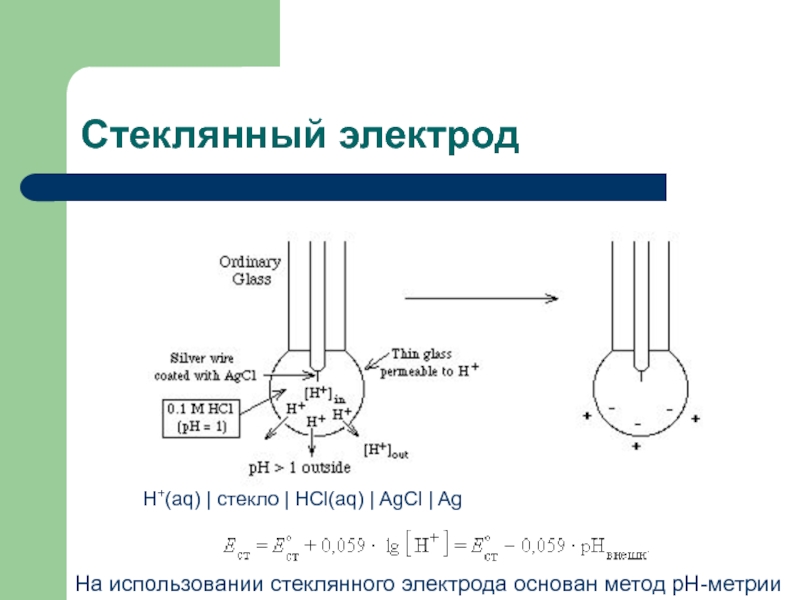
осуществлять двумя способами:
при прямом контакте окислителя и восстановителя,
когда электроны переходят от восстановителя к окислителю непосредственно. при пространственном разделении окислителя и восстановителя, когда электроны переходят по проводнику электрического тока - по внешней цепи.