Слайд 1ХИМИКО-ТЕХНОЛОГИЧЕСКАЯ СИСТЕМА (ХТС)
Кафедра ОХТ
Слайд 2Современное химическое производство, состоящее из большого числа аппаратов и связей
между ними рассматривается как химико-технологическая система (ХТС).
Цель разработки ХТС –
создание высокоэффективного химического производства.
СОДЕРЖАНИЕ ПРОЕКТА ХТС
Определение технологической топологии – характер и порядок соединения отдельных аппаратов в технологической схеме;
Определения значений входных переменных(Т, Р, Сi)
Выбор и установление значений технологических параметров потоков и в аппаратах (ХА; ηR; φ; степени разделения потоков; КР; β; КТ и т.д.)
Определение конструкционных параметров ХТС (V; h; L и т.д.)
Слайд 3Основной метод исследования ХТС – математическое моделирование, опирающееся на широкое
использование ЭВМ. При моделировании ХТС, наряду с моделями отдельных аппаратов,
используют модель всей системы.
В основе разработки ХТС лежит системный подход.
Система – объект, взаимодействующий с внешней средой, обладающий сложным внутренним строением.
Условно системы делятся на малые и большие. Малые системы обычно ограничены одним типовым процессом, большие системы представляют собой совокупность малых.
Слайд 4ЭЛЕМЕНТЫ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ
СИСТЕМЫ
Под элементом понимают самостоятельную и условно неделимую единицу
ХТС. В химическом производстве это отдельный аппарат.
В зависимости от
процессов, протекающих в аппаратах, различают: механические, физические, химические, энергетические и элементы контроля и управления( см. начало курса).
Между элементами системы существуют функциональные связи в виде технологических потоков.
Технологический поток – это перемещение в пространстве массы и энергии. Потоки между элементами ХТС передают вещество, энергию, информацию для управления процессом. В связи с этим различают:
материальные потоки, переносящие вещества и материалы;
энергетические потоки, переносящие энергию в любом её проявлении – тепловую, механическую, электрическую, топливо;
информационные потоки, используемые в системах контроля и управления процессами и производством.
Слайд 5СВЯЗИ ХТС
(характер соединения аппаратов в технологической схеме)
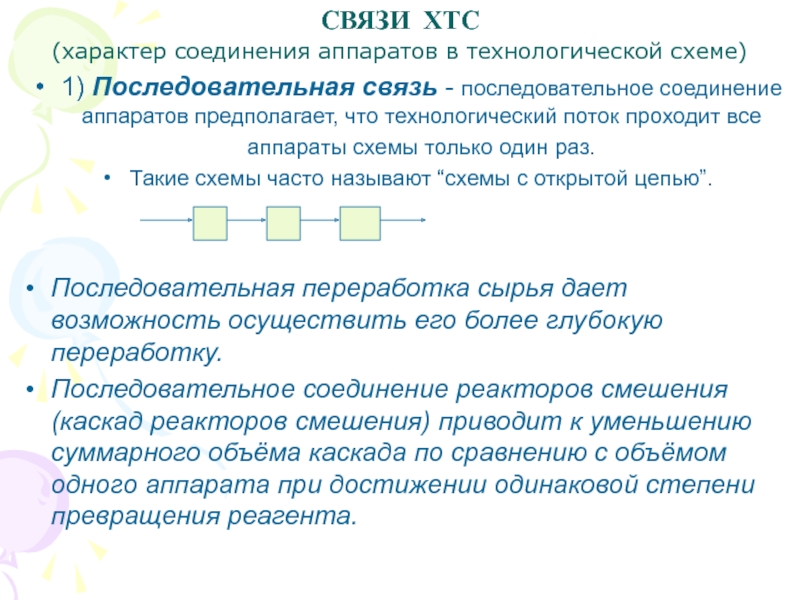
1) Последовательная связь
- последовательное соединение аппаратов предполагает, что технологический поток проходит все
аппараты схемы только один раз.
Такие схемы часто называют “схемы с открытой цепью”.
Последовательная переработка сырья дает возможность осуществить его более глубокую переработку.
Последовательное соединение реакторов смешения (каскад реакторов смешения) приводит к уменьшению суммарного объёма каскада по сравнению с объёмом одного аппарата при достижении одинаковой степени превращения реагента.
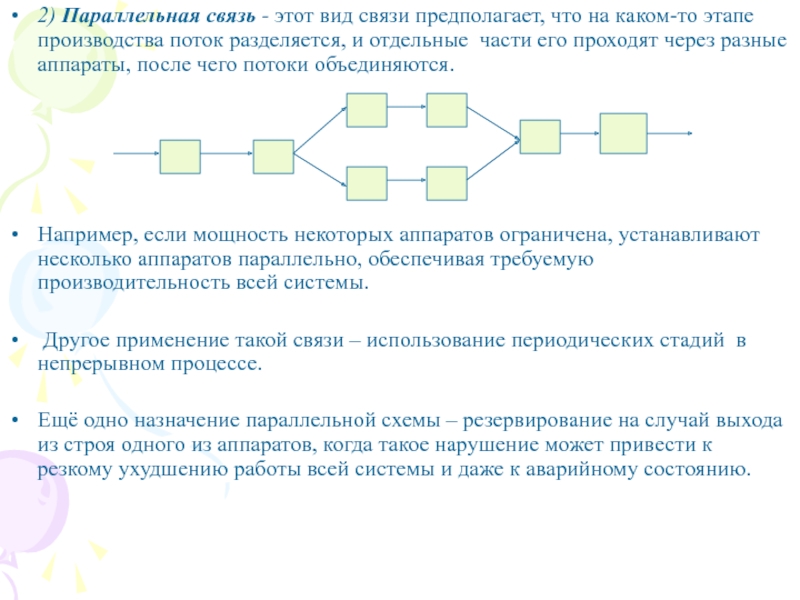
Слайд 62) Параллельная связь - этот вид связи предполагает, что на
каком-то этапе производства поток разделяется, и отдельные части его проходят
через разные аппараты, после чего потоки объединяются.
Например, если мощность некоторых аппаратов ограничена, устанавливают несколько аппаратов параллельно, обеспечивая требуемую производительность всей системы.
Другое применение такой связи – использование периодических стадий в непрерывном процессе.
Ещё одно назначение параллельной схемы – резервирование на случай выхода из строя одного из аппаратов, когда такое нарушение может привести к резкому ухудшению работы всей системы и даже к аварийному состоянию.
Слайд 7
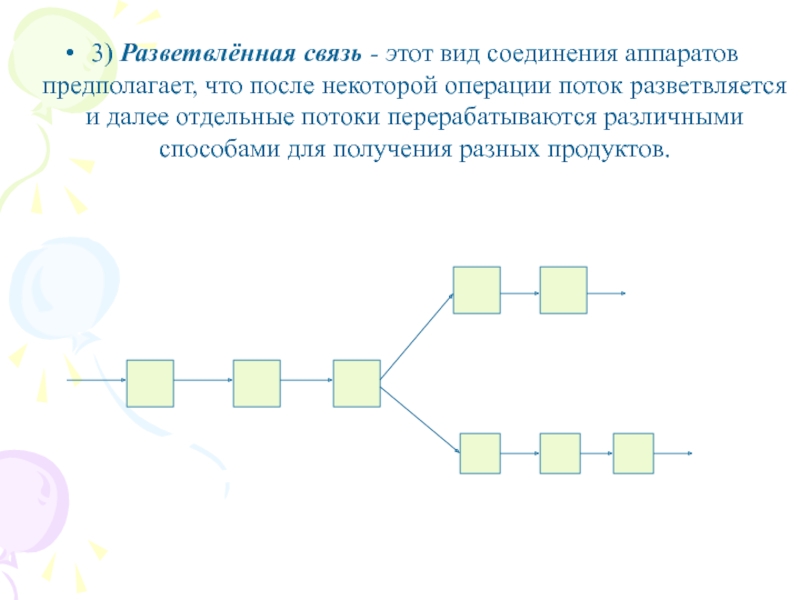
3) Разветвлённая связь - этот вид соединения аппаратов предполагает, что
после некоторой операции поток разветвляется и далее отдельные потоки перерабатываются
различными способами для получения разных продуктов.
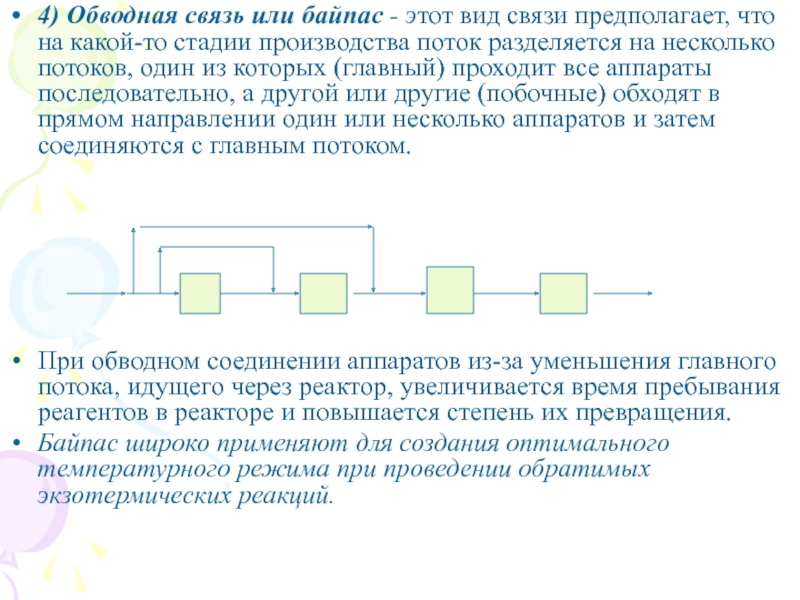
Слайд 84) Обводная связь или байпас - этот вид связи предполагает,
что на какой-то стадии производства поток разделяется на несколько потоков,
один из которых (главный) проходит все аппараты последовательно, а другой или другие (побочные) обходят в прямом направлении один или несколько аппаратов и затем соединяются с главным потоком.
При обводном соединении аппаратов из-за уменьшения главного потока, идущего через реактор, увеличивается время пребывания реагентов в реакторе и повышается степень их превращения.
Байпас широко применяют для создания оптимального температурного режима при проведении обратимых экзотермических реакций.
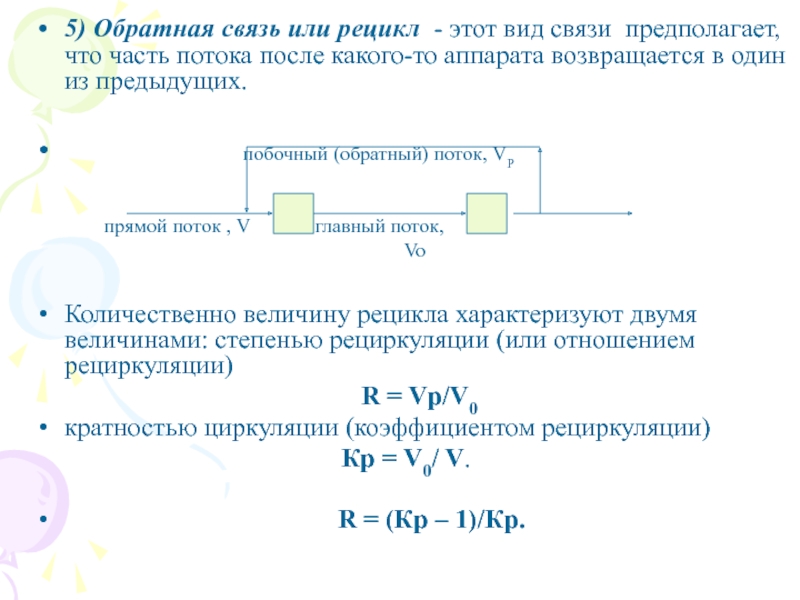
Слайд 95) Обратная связь или рецикл - этот вид связи предполагает,
что часть потока после какого-то аппарата возвращается в один из
предыдущих.
побочный (обратный) поток, VP
прямой поток , V главный поток,
Vo
Количественно величину рецикла характеризуют двумя величинами: степенью рециркуляции (или отношением рециркуляции)
R = Vр/V0
кратностью циркуляции (коэффициентом рециркуляции)
Кр = V0/ V.
R = (Кр – 1)/Кр.
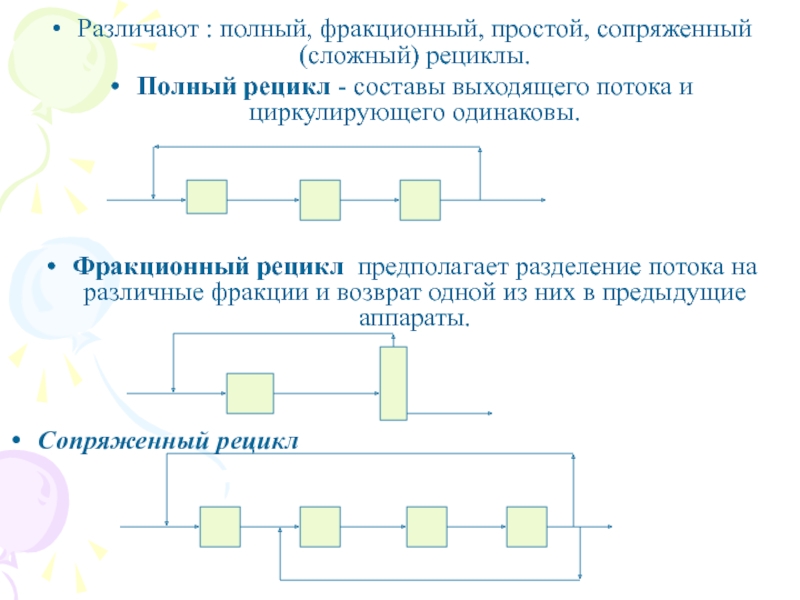
Слайд 10Различают : полный, фракционный, простой, сопряженный (сложный) рециклы.
Полный рецикл
- составы выходящего потока и циркулирующего одинаковы.
Фракционный рецикл предполагает
разделение потока на различные фракции и возврат одной из них в предыдущие аппараты.
Сопряженный рецикл
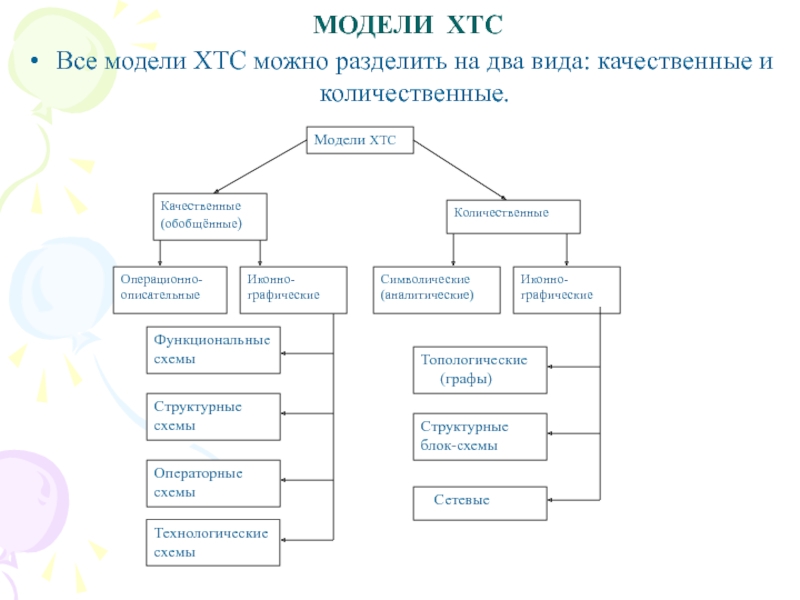
Слайд 11 МОДЕЛИ ХТС
Все модели ХТС можно разделить на два вида:
качественные и количественные.
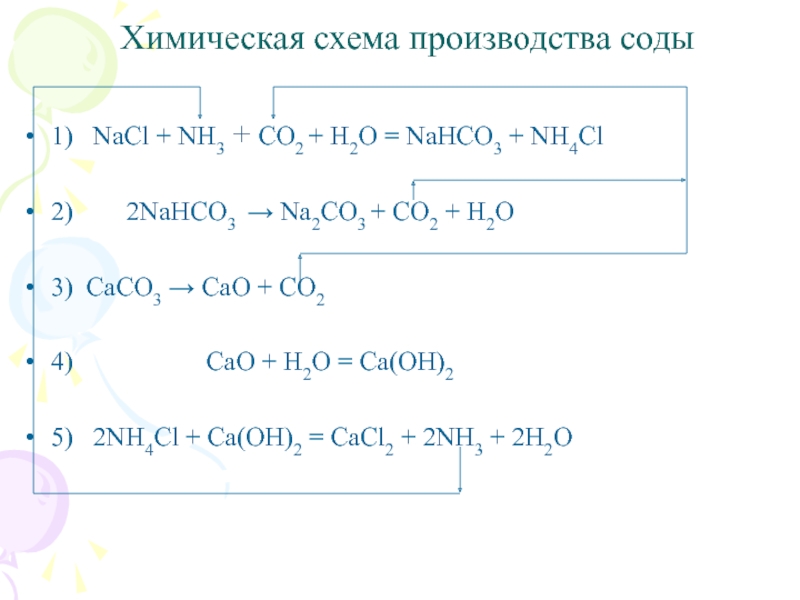
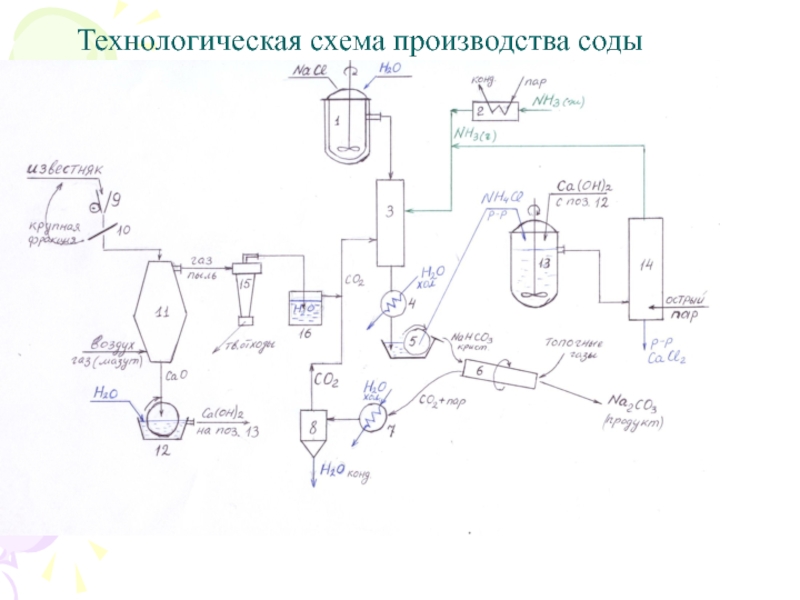
Слайд 12Химическая схема производства соды
1) NaCl + NH3 + CO2
+ H2O = NaHCO3 + NH4Cl
2) 2NaHCO3
→ Na2CO3 + CO2 + H2O
3) CaCO3 → CaO + CO2
4) CaO + H2O = Ca(OH)2
5) 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Слайд 13Технологическая схема производства соды
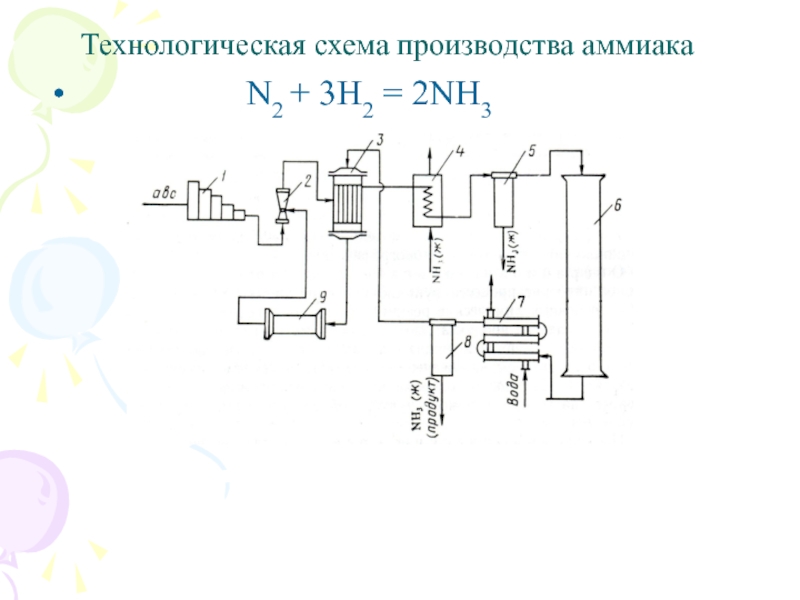
Слайд 14Технологическая схема производства аммиака
N2 + 3H2 = 2NH3
1 — компрессор;
2 – инжектор; 3 - теплообменник; 4 – испаритель жидкого аммиака; 5, 8 —сепараторы; 6 —колонна синтеза аммиака; 7- водяной холодильник; 9- циркуляционный компрессор.
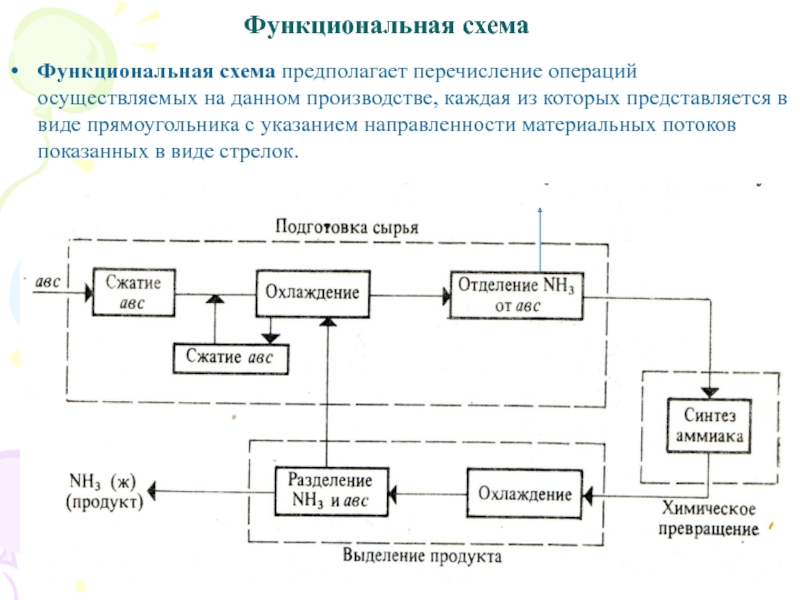
Слайд 15Функциональная схема
Функциональная схема предполагает перечисление операций осуществляемых на данном
производстве, каждая из которых представляется в виде прямоугольника с указанием
направленности материальных потоков показанных в виде стрелок.
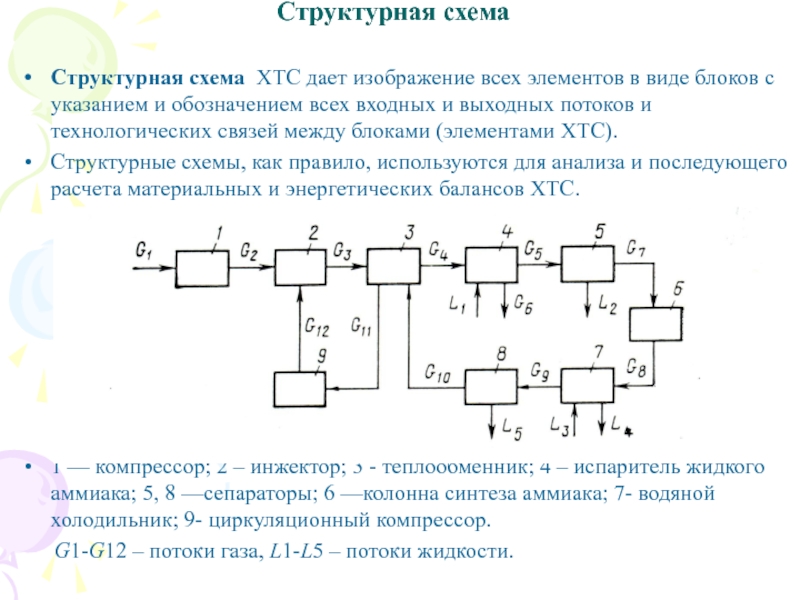
Слайд 16Структурная схема
Структурная схема ХТС дает изображение всех элементов в
виде блоков с указанием и обозначением всех входных и выходных
потоков и технологических связей между блоками (элементами ХТС).
Структурные схемы, как правило, используются для анализа и последующего расчета материальных и энергетических балансов ХТС.
1 — компрессор; 2 – инжектор; 3 - теплообменник; 4 – испаритель жидкого аммиака; 5, 8 —сепараторы; 6 —колонна синтеза аммиака; 7- водяной холодильник; 9- циркуляционный компрессор.
G1-G12 – потоки газа, L1-L5 – потоки жидкости.
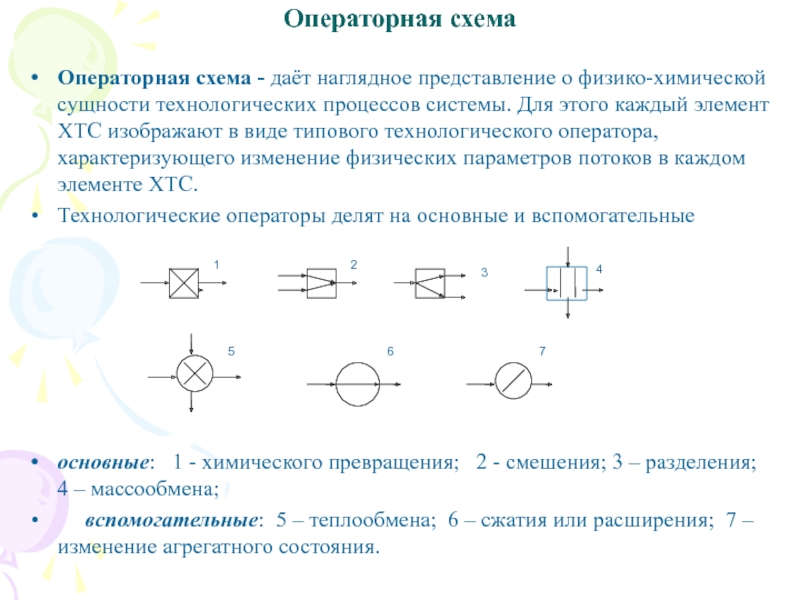
Слайд 17Операторная схема
Операторная схема - даёт наглядное представление о физико-химической
сущности технологических процессов системы. Для этого каждый элемент ХТС изображают
в виде типового технологического оператора, характеризующего изменение физических параметров потоков в каждом элементе ХТС.
Технологические операторы делят на основные и вспомогательные
основные: 1 - химического превращения; 2 - смешения; 3 – разделения; 4 – массообмена;
вспомогательные: 5 – теплообмена; 6 – сжатия или расширения; 7 – изменение агрегатного состояния.
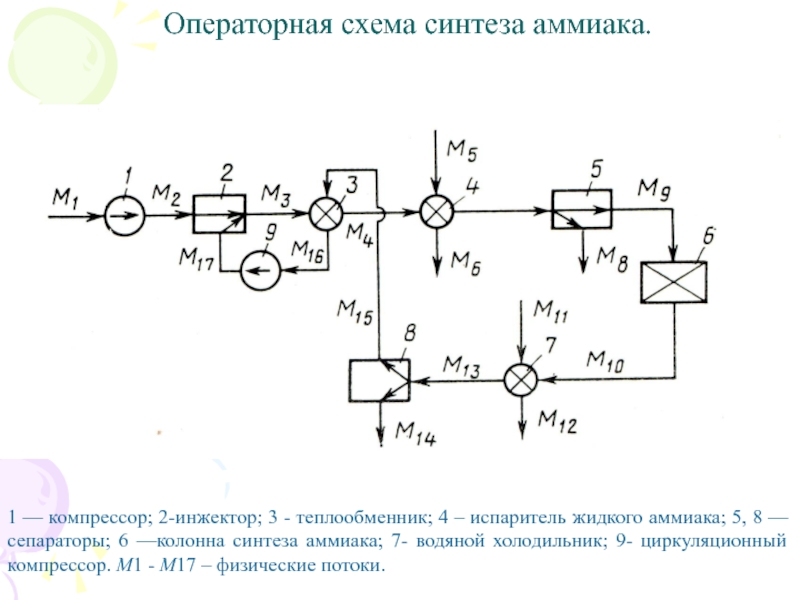
Слайд 18 Операторная схема синтеза аммиака.
1 — компрессор; 2-инжектор; 3
- теплообменник; 4 – испаритель жидкого аммиака; 5, 8 —сепараторы;
6 —колонна синтеза аммиака; 7- водяной холодильник; 9- циркуляционный компрессор. М1 - М17 – физические потоки.
Слайд 19Иконографические математические модели
Иконографические математические модели – наглядное графическое отображение
таких качественных свойств технологической структуры ХТС, по которым можно определить
количественные характеристики системы.
Они подразделяются на три группы: топологические модели (графы), структурные блок-схемы и сетевые модели.
Слайд 20Топологические модели представляют в виде графов.
Граф – это фигура
или конфигурация, образованная совокупностью некоторых точек (вершин или узлов), соединенных
отрезками прямых, ломаных или кривых линий.
Линии могут иметь направления (тогда они называются дугами) или не иметь его (рёбра). Для химико-технологического процесса обычно вершинами графа являются его элементы, а дуги показывают связь между элементами.
Слайд 21Материальный потоковый граф по общим расходам
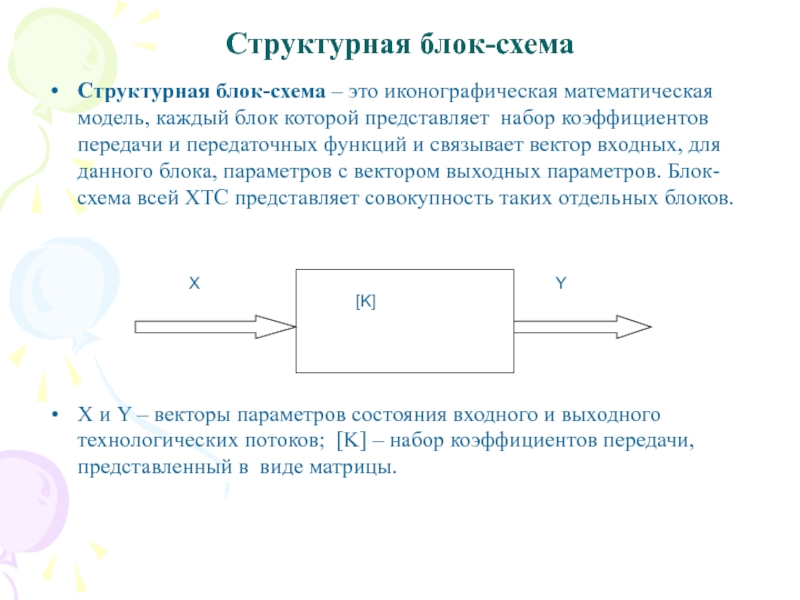
Слайд 22Структурная блок-схема
Структурная блок-схема – это иконографическая математическая модель, каждый
блок которой представляет набор коэффициентов передачи и передаточных функций и
связывает вектор входных, для данного блока, параметров с вектором выходных параметров. Блок-схема всей ХТС представляет совокупность таких отдельных блоков.
X и Y – векторы параметров состояния входного и выходного технологических потоков; [K] – набор коэффициентов передачи, представленный в виде матрицы.
Слайд 23
Сетевые модели – это иконографические модели, отображающие организационные процессы проектирования
и эксплуатации ХТС.
Слайд 24ОБЩАЯ СТРАТЕГИЯ СИСТЕМНОГО ИССЛЕДОВАНИЯ ХТС
Задача создания новых производств или
повышения эффективности функционирования уже существующих решается в несколько этапов, совершающихся
либо одновременно, либо последовательно.
Первым уровнем решения общей задачи создания ХТС на основе анализа химической схемы процесса, кинетики и термодинамики отдельных этапов, физических свойств исходных реагентов и продуктов реакций является: построение первоначальной топологии, выбор основных аппаратов, создание математических моделей отдельных элементов и всей схемы производства.
Слайд 25 Далее производится полный расчёт созданной модели и анализ
ее работоспособности. При этом наряду с расчётом выходных параметров ХТС
определяются и значения критериев эффективности функционирования системы. В качестве критериев эффективности работы ХТС используют технологические, экономические, эксплуатационные и социальные критерии.
Задачи второго и последующих уровней разработки ХТС - анализ, синтез и оптимизация - решаются в несколько этапов, совершающихся либо одновременно, либо последовательно.
Как правило, определяющими критериями эффективности производства являются экономические критерии.
Слайд 26АНАЛИЗ ХТС
Анализ ХТС заключается в получении сведений о состоянии
ХТС, показателях её эффективности и функционирования системы, а также о
влиянии на эти данные химической схемы, структуры технологических связей, свойств и состояния элементов и подсистем, условий эксплуатации.
Состояние или режим ХТС определяется параметрами (показателями) потоков (связей) и состоянием аппаратов (элементов).
Слайд 27
Первым шагом в анализе ХТС является определение параметров потоков ХТС
заданной структуры и заданного состояния её элементов на основе расчётов
материальных и тепловых балансов.
При получении положительных результатов осуществляют анализ работоспособности отдельных аппаратов, агрегатов и всей ХТС в целом.
Слайд 28ПРИМЕРЫ АНАЛИЗА РАБОТОСПОСОБНОСТИ ХТС
1) Зависимость режима одного аппарата (элемента)
от режимов других.
Изменение режима работы одного аппарата, т.е. изменение состояния
потоков, выходящих из него и входящих в последующий, изменяет условия работы последнего, а, следовательно, и всей схемы.
Режим аппарата может зависеть от режимов не только в предыдущем, но и в последующих аппаратах. Это возможно, например, при наличии рециклов, когда поток согласно схеме передаётся в предыдущий аппарат.
Слайд 292) Оптимальный режим работы одиночного аппарата и
в схеме могут
отличаться
В производстве азотной кислоты первая стадия –
окисление аммиака
4NH3 + 5O2 = 4NO + 6H2O
идёт в газовой фазе с большой скоростью и с небольшим увеличением объёма.
Повышение давления в этом случае казалось бы нецелесообразно. Однако следующая стадия 2NO + O2 = 2NO2
протекает значительно медленнее и с уменьшением объёма.
Для её ускорения и более глубокого превращения NO в NO2 повышение давления целесообразно.
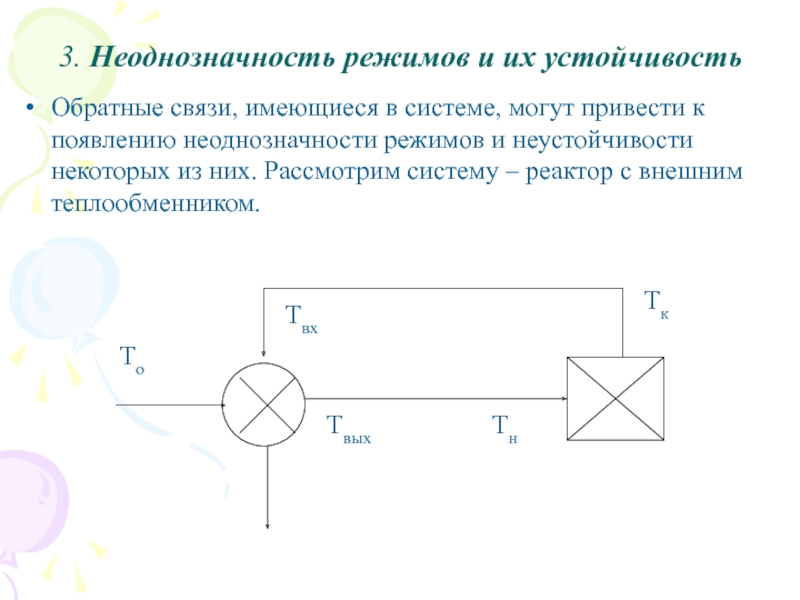
Слайд 303. Неоднозначность режимов и их устойчивость
Обратные связи, имеющиеся в системе,
могут привести к появлению неоднозначности режимов и неустойчивости некоторых из
них. Рассмотрим систему – реактор с внешним теплообменником.
Слайд 314. Возможность возникновения нестационарных режимов
Такая ситуация возможна для схем с
фракционным рециклом.
Р – реактор; Д – система выделения продукта;
П – продукт
Схема будет работать в стационарном режиме в том случае, если V0 – постоянно, а Со = Сн = Срец. В противном случае стационарного режима существовать не будет.
Слайд 32СИНТЕЗ ХТС
Синтез, или построение, ХТС заключается в определении основных
технологических операций и их последовательности, выборе аппаратов и установлении связей
между ними, определении параметров технологических режимов отдельных аппаратов и системы в целом, обеспечивающих наилучшие условия функционирования ХТС.
При синтезе ХТС для получения оптимальных значений используются некоторые наборы решений, обоснованных теорией химико-технологических процессов, созданных на основе инженерных проработок и проверенных практикой.
Слайд 33Научные подходы (принципы) синтеза ХТС.
Декомпозиционный принцип
Интегрально-гипотетический принцип
Эволюционный принцип
Эвристический принцип
Слайд 34Стандартные решения (концепции), используемые при синтезе ХТС
Слайд 35Концепция оптимального использования
сырьевых ресурсов
1. Выбор схемы процесса –
Позволяет получить
максимальное количество продукта наилучшего качества.
Винилхлорид получают в две стадии –
CH2 = CH2 + Cl2 +кат CH2Cl-CH2Cl Т CH2=CHCl + HCl.
выход винилхлорида по этилену – 90%, по хлору – 50%.
При одностадийной схеме окислительного гидрохлорирования
CH2 = CH2+ HCl +О2 кат → CH2 = CHCl + H2О
выход продукта 95% по обоим исходным.
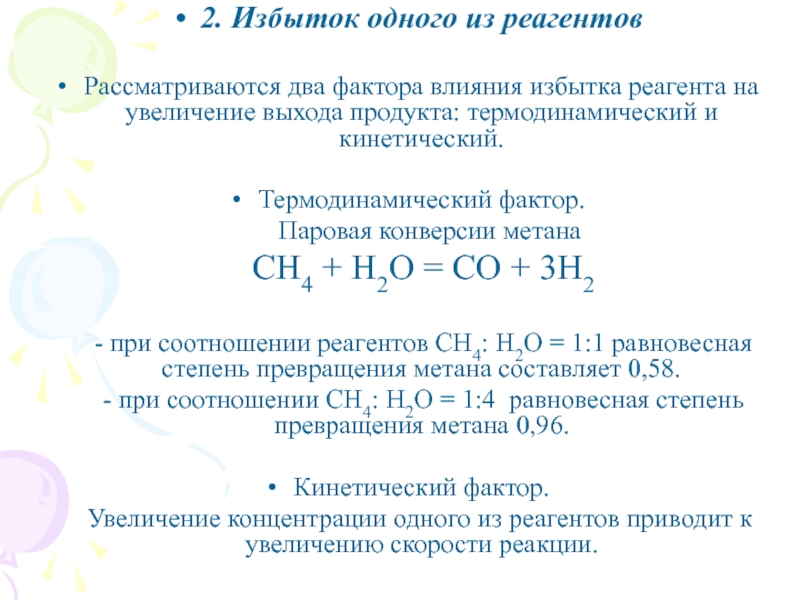
Слайд 362. Избыток одного из реагентов
Рассматриваются два фактора влияния избытка
реагента на увеличение выхода продукта: термодинамический и кинетический.
Термодинамический фактор.
Паровая конверсии метана
СН4 + Н2О = СО + 3Н2
- при соотношении реагентов СН4: Н2О = 1:1 равновесная степень превращения метана составляет 0,58.
- при соотношении СН4: Н2О = 1:4 равновесная степень превращения метана 0,96.
Кинетический фактор.
Увеличение концентрации одного из реагентов приводит к увеличению скорости реакции.
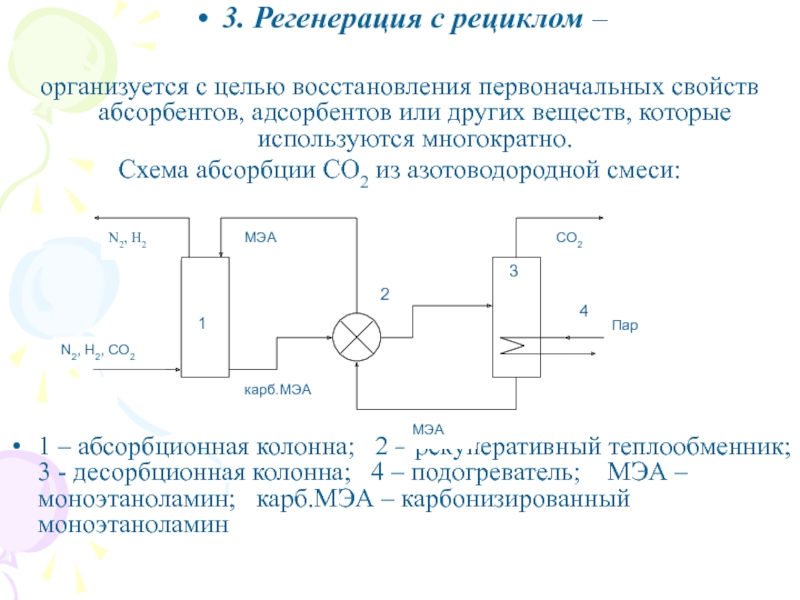
Слайд 373. Регенерация с рециклом –
организуется с целью восстановления первоначальных
свойств абсорбентов, адсорбентов или других веществ, которые используются многократно.
Схема абсорбции
СО2 из азотоводородной смеси:
1 – абсорбционная колонна; 2 – рекуперативный теплообменник; 3 - десорбционная колонна; 4 – подогреватель; МЭА – моноэтаноламин; карб.МЭА – карбонизированный моноэтаноламин
Слайд 385. Фракционный рецикл – используют при неполном превращении исходных реагентов.
6. Противоточный контакт фаз – решение, обеспечивающее максимальную движущую силу
гетерогенных процессов в идущих в диффузионной области.
7. Утилизация отходов – позволяет получить дополнительные полезные продукты из побочных продуктов реакции, практически всегда образующихся вместе с целевым продуктом.
8. Использование альтернативного сырья.
9. Комбинирование производств.
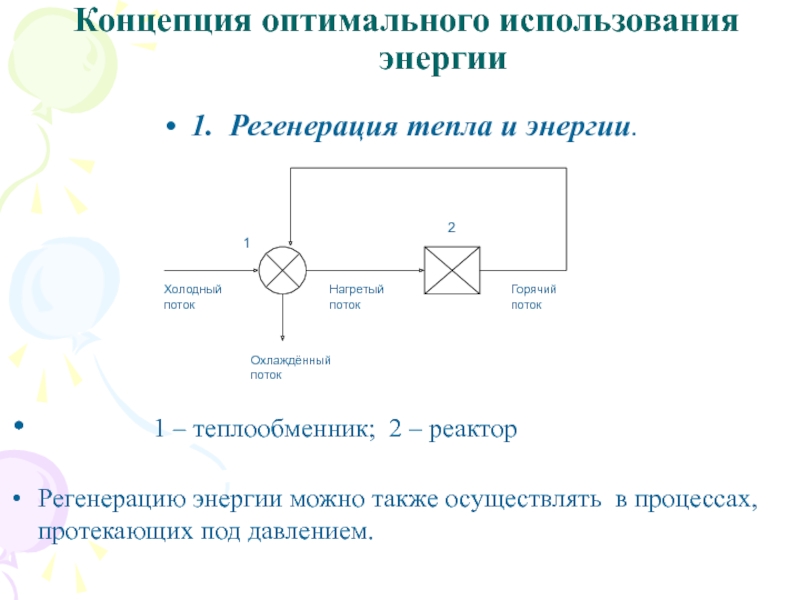
Слайд 39Концепция оптимального использования энергии
1. Регенерация тепла и энергии.
1 – теплообменник; 2 –
реактор
Регенерацию энергии можно также осуществлять в процессах, протекающих под давлением.
Слайд 40
2. УТИЛИЗАЦИЯ ТЕПЛА И ЭНЕРГИИ.
Речь идёт
о тепле или энергии потока используемых для выработки тепловых, электрических
и других энергетических ресурсов, применяемых в самом производстве.
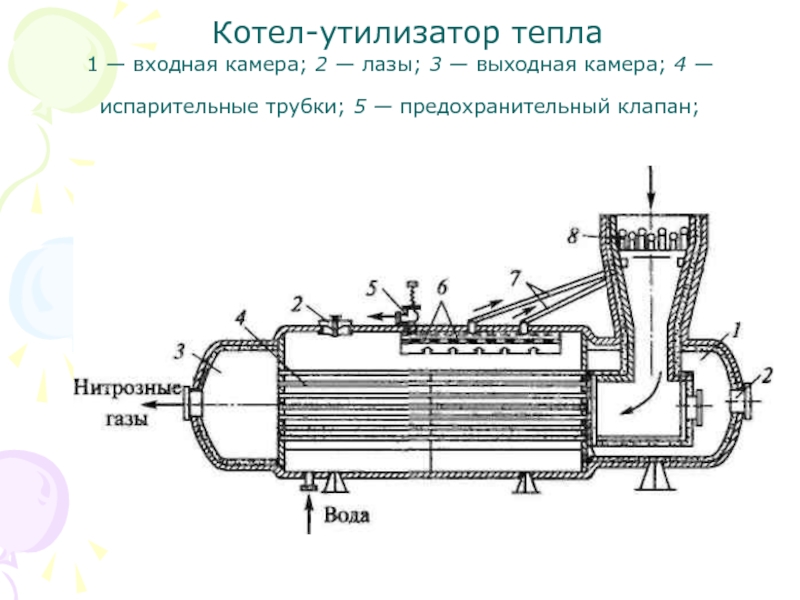
Слайд 41 Котел-утилизатор тепла
1 — входная камера; 2 — лазы; 3
— выходная камера; 4 — испарительные трубки; 5 — предохранительный
клапан;
Слайд 423. Альтернативные источники энергии.
Традиционные источники
энергии: пар, горячие теплоносители, электроэнергия, вырабатываемые при потреблении топливных ресурсов.
Перспективными (альтернативными) являются легко возобновляемые и более дешевые источники, такие, например, как тепло, вырабатываемое атомными станциями, солнечная энергия, энергия ветра и др.
Слайд 434. Энерготехнологические схемы.
Химико-технологическая схема, включающая
энергетический узел, потребляющий топливо и вырабатывающий энергию для компенсации необратимых
потерь с целью поддержания технологического режима и обеспечения функционирования ХТС, называется энерготехнологической схемой.
Такая система не потребляет энергию извне, энергетически она автономна, потребляя необходимое количество топлива.
Слайд 445. Вторичные энергетические ресурсы (ВЭР)
Вторичные энергетические ресурсы
(ВЭР) это энергетический потенциал продукции, отходов, промежуточных продуктов, который образуется
в технологических агрегатах и не используется в этом же производстве, но может быть частично или полностью применен для энегоснабжения других производств.
Слайд 45Виды ВЭР
Горючие (топливные) ВЭР
Тепловые ВЭР
ВЭР избыточного давления, или силовые
Слайд 46 Концепция эффективного использования
оборудования
1. Выбор процесса.
2. Оптимизация процесса.
3. Организация процесса в аппарате.
4. Конструктивные решения.
5. Увеличение единичной
мощности агрегата.
6. Совмещение процессов.
7. Перестраиваемая химико-
технологическая система.
Слайд 47Концепция минимизации отходов
1. Санитарная очистка и обезвреживание выбросов.
2. Уменьшение
или замена вспомогательных потоков.
3. Замкнутый водооборот.
4. Повышение надежности
оборудования и элементов ХТС.
5. Создание малоотходных производств.
Слайд 48ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
ПРИМЕРЫ СИНТЕЗА И АНАЛИЗА ХТС
И ПРИМЕНЕНИЯ ОПТИМАЛЬНЫХ ТЕХНОЛОГИЧЕСКИХ
РЕШЕНИЙ
Слайд 49Азотная кислота — одно из важнейших соединений азота: в больших
количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и
органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, и концентрированная—98 и 97%.
Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
Слайд 50Окисление аммиака
4NH3 +
5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
Реакция - сложная необратимая экзотермическая, протекает на платиновом катализаторе при 850-920оС с избирательностью 94-98% (в зависимости от условий процесса) при полном превращении аммиака. В промышленности для окисления аммиака используют кислород воздуха.
Слайд 51
Окисление оксида азота
2NO + O2 = 2NO2
Реакция - обратимая экзотермическая гомогенная (газофазная).
Снижение температуры и повышение давления благоприятствует сдвигу равновесия вправо.
Слайд 52Образование азотной кислоты (хемосорбция диоксида азота)
3NO2 + H2O = 2HNO3
+ NO
Реакция - гетерогенная газожидкостная экзотермическая.
Понижение температуры способствует более полному превращению NO2.
Выделяющийся NO быстро окисляется кислородом воздуха, так что происходит почти полное поглощение диоксида азота водой, и процесс можно описать следующим стехиометрическим уравнением
2NO2 + H2O + 0,5O2 = 2HNO3
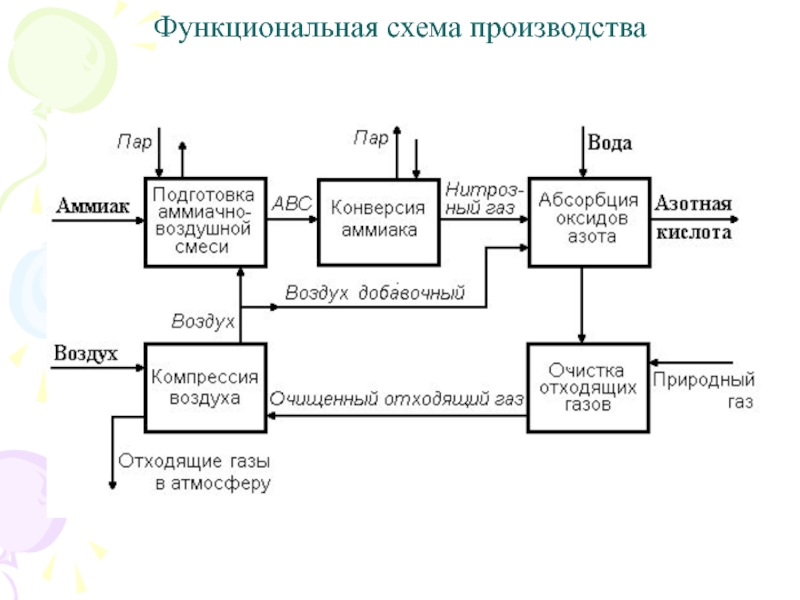
Слайд 53Функциональная схема производства
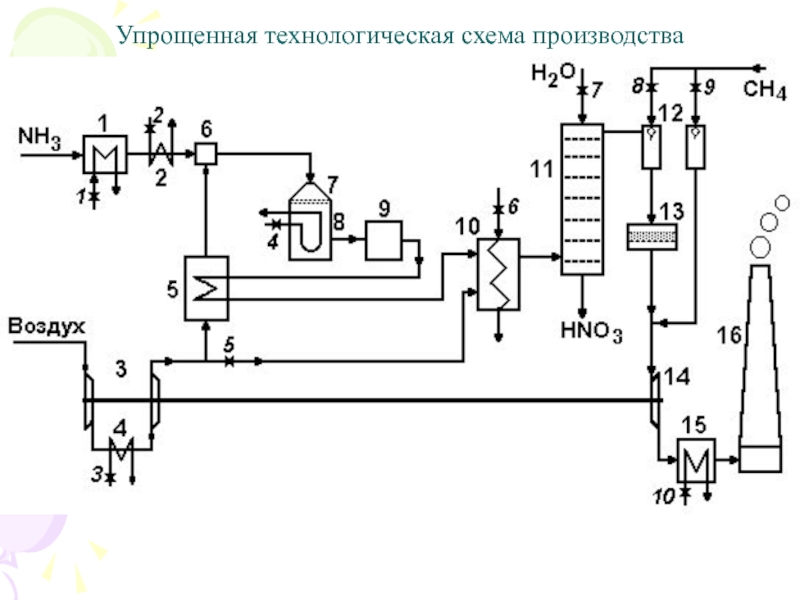
Слайд 54Упрощенная технологическая схема производства
Слайд 56СВОЙСТВА
В технике серной кислотой называют безводную Н2S04, ее водные растворы
(по сути дела, это смесь Н20, Н2S04 и соединений Н2S04
и Н20) и растворы триоксида серы в безводной Н2S04 -олеум (смесь Н2S04 и S03).
Безводная серная кислота — тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
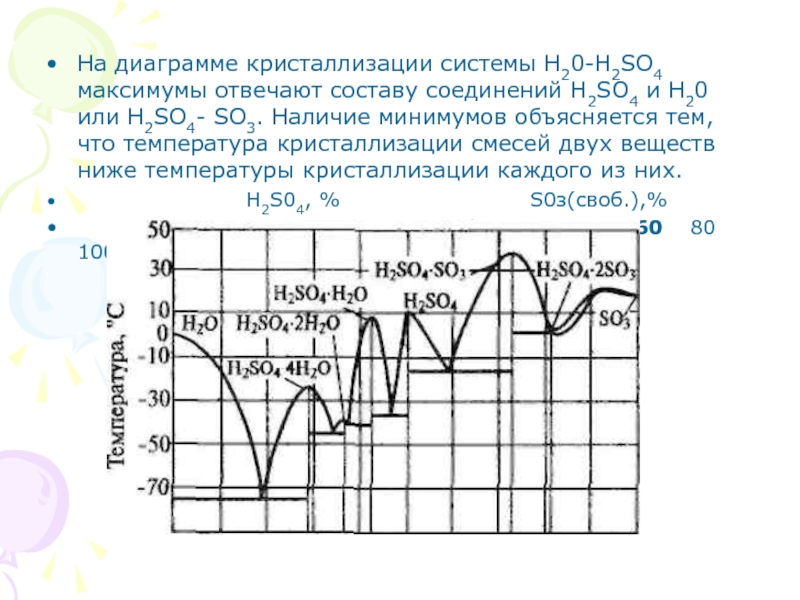
Слайд 57На диаграмме кристаллизации системы Н20-H2SO4 максимумы отвечают составу соединений H2SO4
и Н20 или H2SO4- SO3. Наличие минимумов объясняется тем, что
температура кристаллизации смесей двух веществ ниже температуры кристаллизации каждого из них.
Н2S04, % S0з(своб.),%
60 80 100 20 40 60 80 100
Слайд 58Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации (10,7
°С). Для уменьшения возможности замерзания товарного продукта при перевозке и
хранении концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Выпускают три вида товарной серной кислоты:
Температура
Концентрация кристаллизации, oС
Башенная кислота 75% -29,5
Контактная кислота 92,5% -22,0
Олеум 20% свободного S03 +2
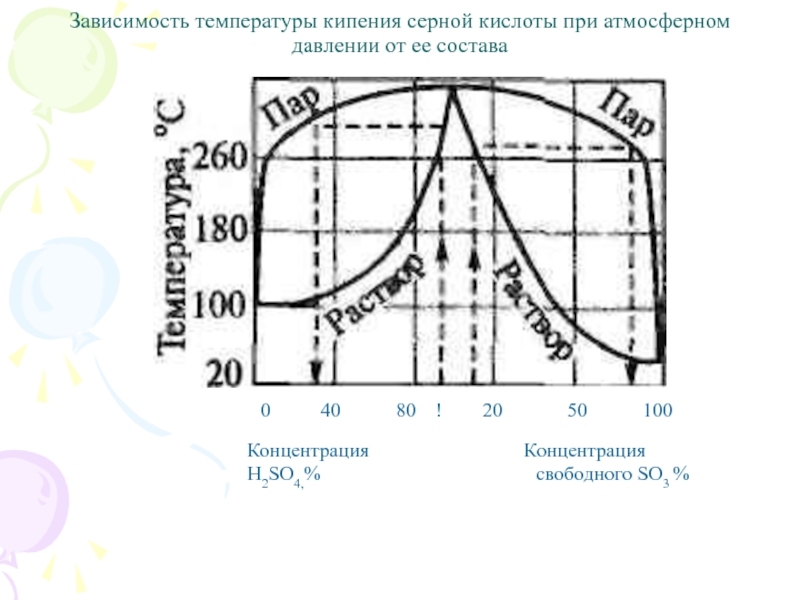
Слайд 59Зависимость температуры кипения серной кислоты при атмосферном давлении от ее
состава
0 40
80 ! 20 50 100
Концентрация Концентрация
H2SO4,% свободного SO3 %
Слайд 60Нижняя кривая диаграммы фазового равновесия отвечает составу жидкой фазы, верхняя
— составу паровой фазы, находящейся в равновесии с кипящей жидкой.
Из диаграммы следует, что серная кислота и вода образуют азеотропную смесь: 98,3% Н2S04 и 1,7% Н2О с максимальной температурой кипения (336,5 °С).
Состав находящихся в равновесии жидкой и паровой фаз для кислоты азеотропной концентрации одинаков.
У более разбавленных растворов кислоты в паровой фазе преобладают пары воды.
В паровой фазе над олеумом высока равновесная концентрация S03.
Слайд 61 В зависимости от того, как осуществляется процесс окисления S02
в S03, различают два основных метода получения серной кислоты —
контактный и нитрозный.
При получении серной кислоты по контактному методу процесс окисления S02 в S03 проводят на твердых катализаторах.
SO2 + 0,5O2 = SO3
При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
S03+N203 + Н20 = Н2S04 + 2NO
Слайд 62Контактный метод получения серной кислоты
При получении серной кислоты контактным методом
используется в основном два вида сырья: серный (железный) колчедан и
сера.
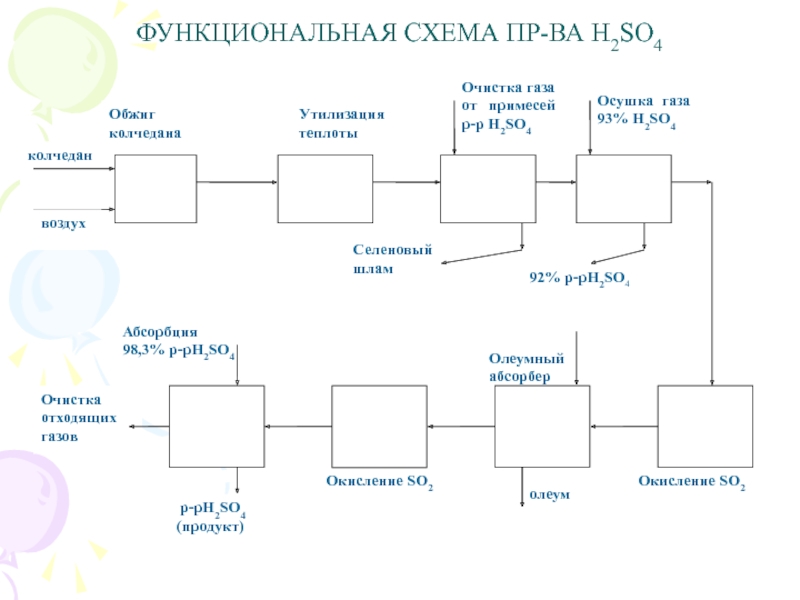
Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы. В зависимости от вида сырья протекают экзотермические химические реакции обжига:
4FеS2 +11O2 = 2Fе203 + 8S02 (I)
S + 02 = S02. (2)
Слайд 63При протекании реакции (I) помимо газообразного продукта реакции S02 образуется
твердый продукт Fе203, который может присутствовать в газовой фазе в
виде пыли.
Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), на которой помимо очистки от каталитических ядов выделяются пары воды (осушение), а также получаются побочные продукты (Sе и Те).
Слайд 64Если обжиговый газ получают сжиганием серы, то отпадает необходимость очистки
от примесей. Стадия подготовки будет включать в себя лишь осушку
газа и утилизацию теплоты.
На третьей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы
S02 + 0,5О2 = S03
Последняя стадия процесса — абсорбция триоксида серы концентрированной серной кислотой или олеумом.
Слайд 65ФУНКЦИОНАЛЬНАЯ СХЕМА ПР-ВА H2SO4