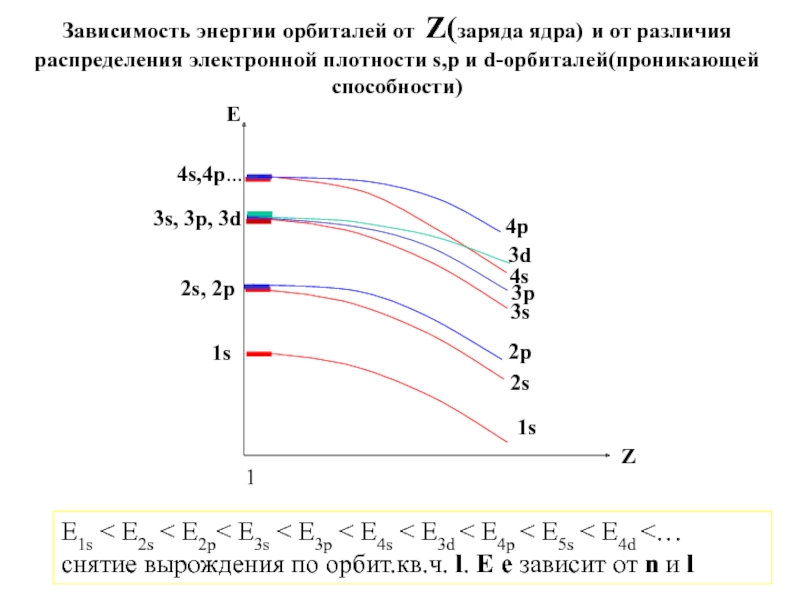
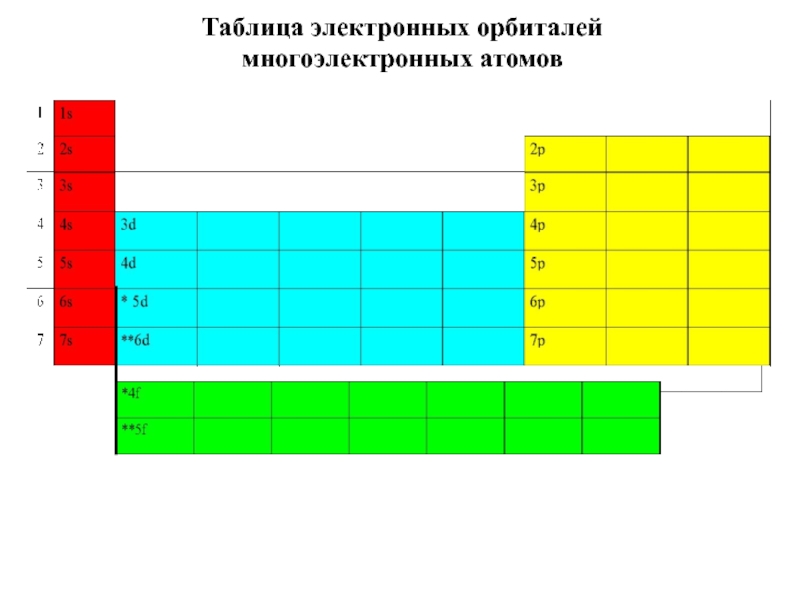
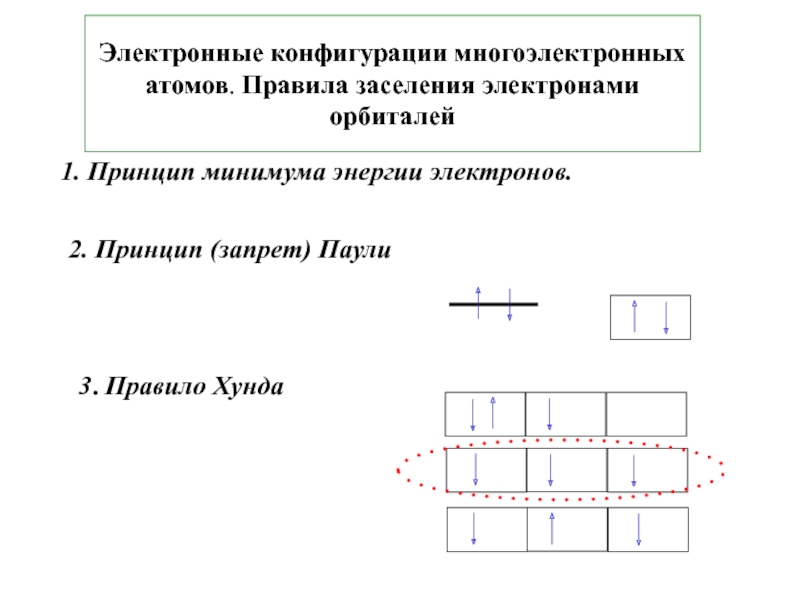
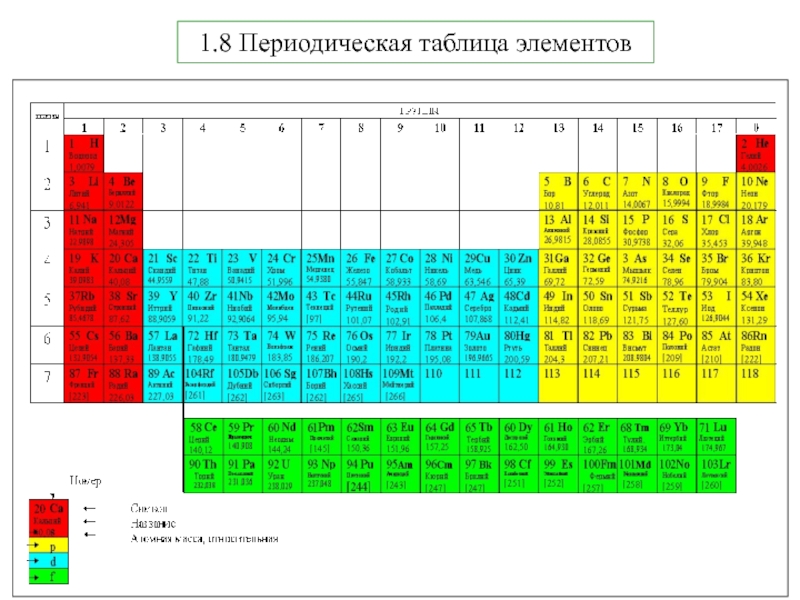
5. В.В.Фролов 6. Н.В.Коровин
Часть 1 Строение
вещества 2002 г.(552)Часть 2 Термодин.и кинетика химического процесса 2003 г.(599)
- теоретические основы
Часть 3 Электрохим. и коррозионные процессы 2007(837)
















![Химия
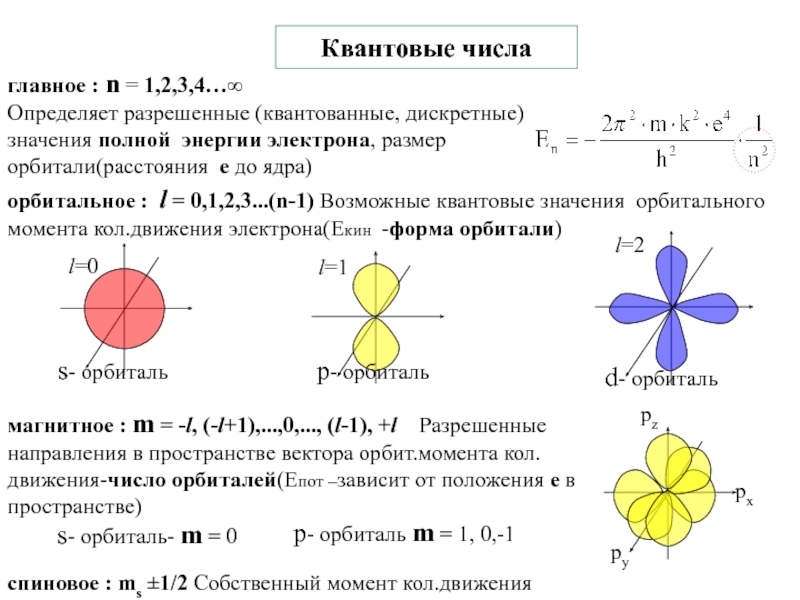
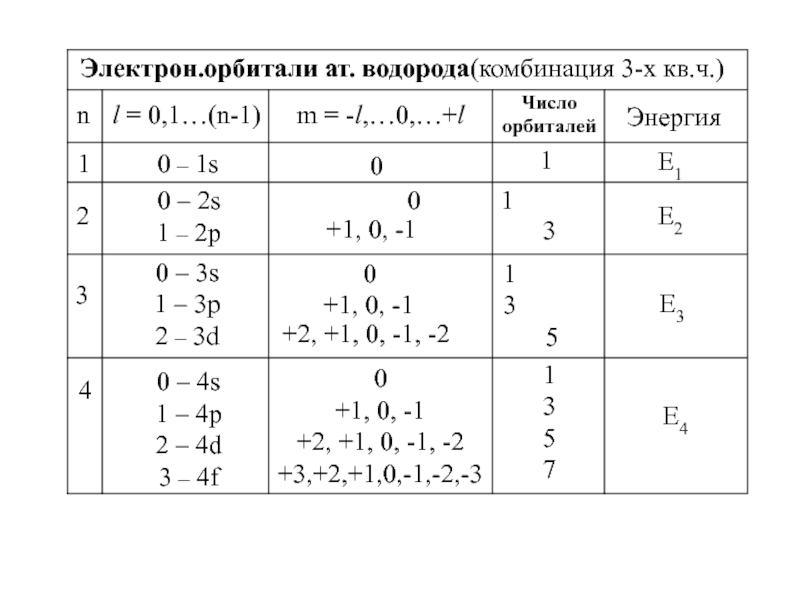
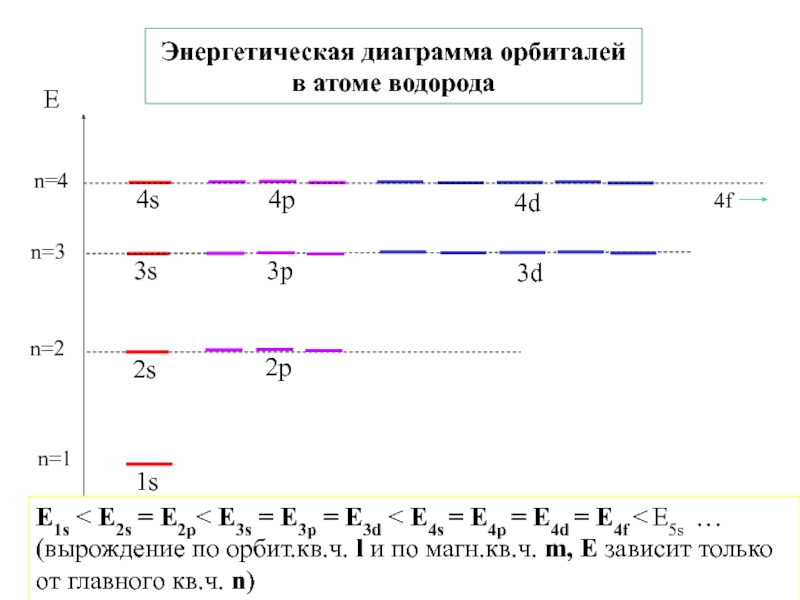
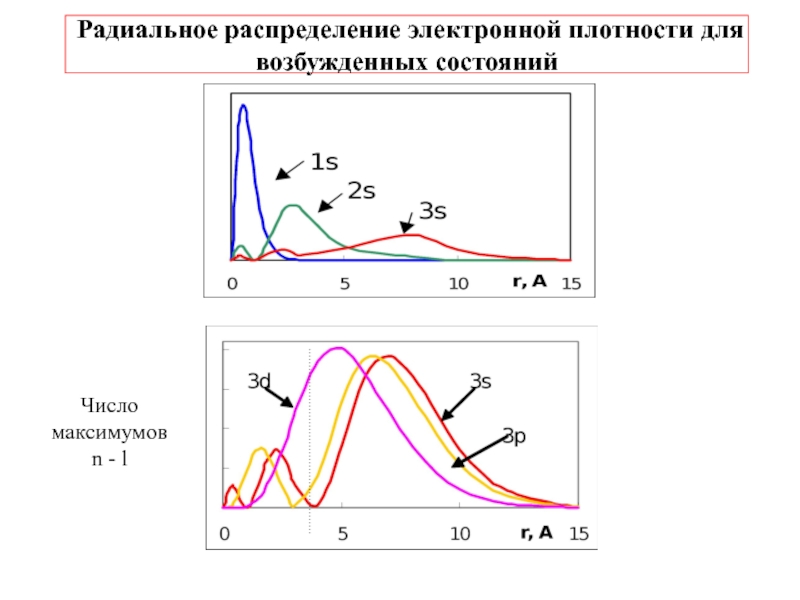
4.Физико-химические основы общей химии. Уч.пос.под ред. Б.Т.Плаченова 1.6 Возбужденные состояния атома водорода Общий вид волновой функции-(r,,) = R(r)Y(,)-[метод 1.6 Возбужденные состояния атома водорода Общий вид волновой функции-(r,,) = R(r)Y(,)-[метод разделения переменных]R(r)n, l -](/img/tmb/3/246733/8dace21c5fc25787e1cb063c6fe37eb4-800x.jpg)