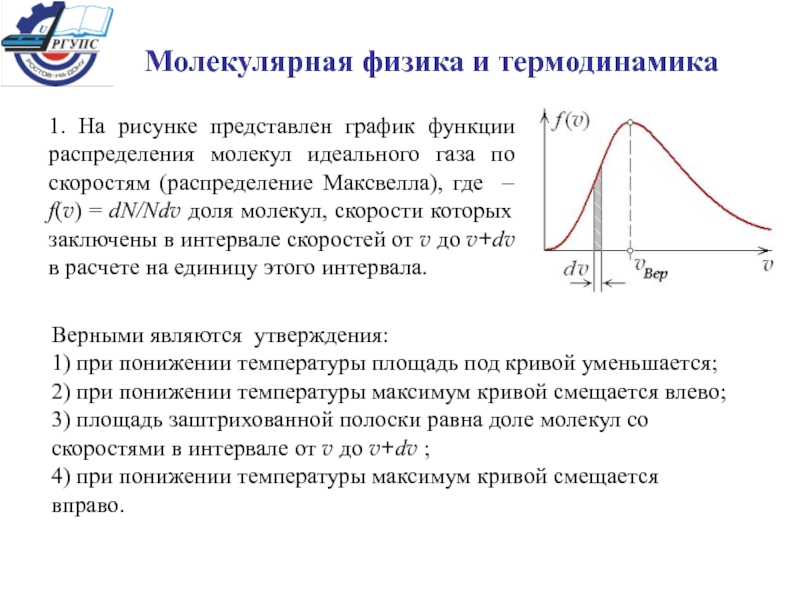
факторы, влияющие на них
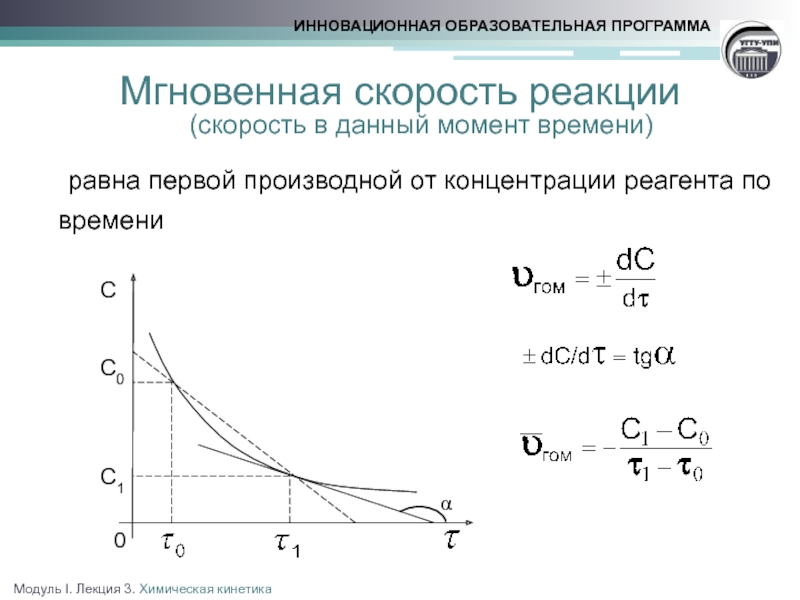
Скорость реакции ‑ изменение количества любого из
реагирующих веществ или продуктов реакции за единицу времени в единице реакционного пространства
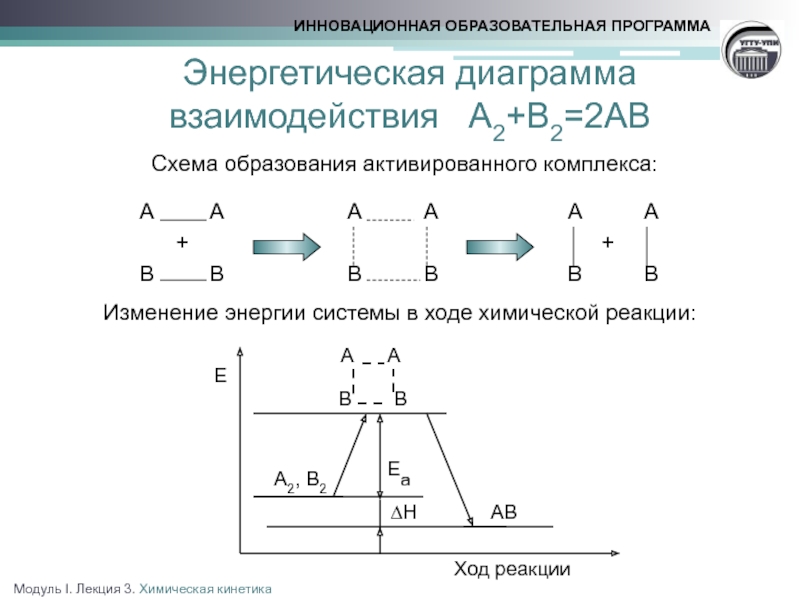
Энергия активации ‑ минимальная избыточная энергия частиц по сравнению со средним уровнем, необходимая для протекания реакции
Скорость реакции зависит от C, p, T и катализатора:
зависимость скорости от концентраций реагирующих веществ выражается экспериментально получаемым кинетическим уравнением;
изменение давления в системе приводит к пропорциональному изменению концентраций газообразных реагентов и соответствующему изменению скорости
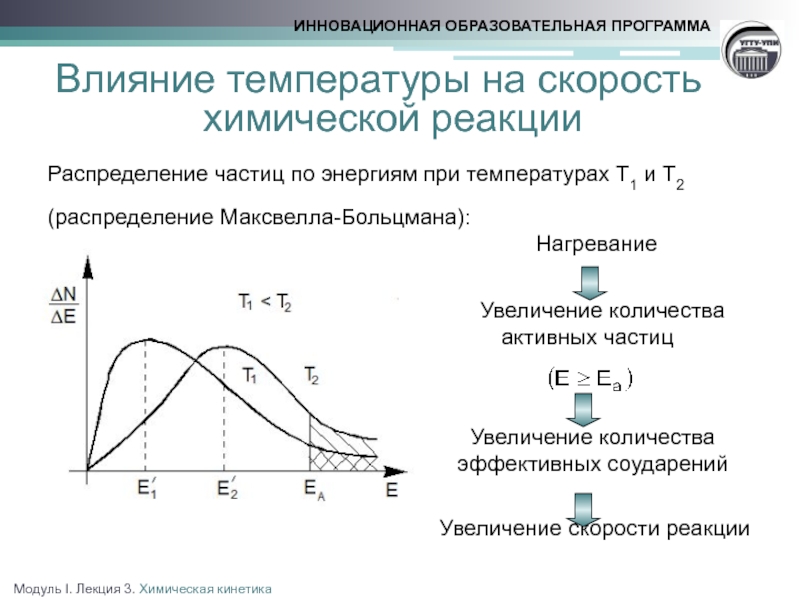
в соответствии с правилом Вант-Гоффа при повышении температуры на каждые 10о скорость большинства реакций увеличивается в 24 раза
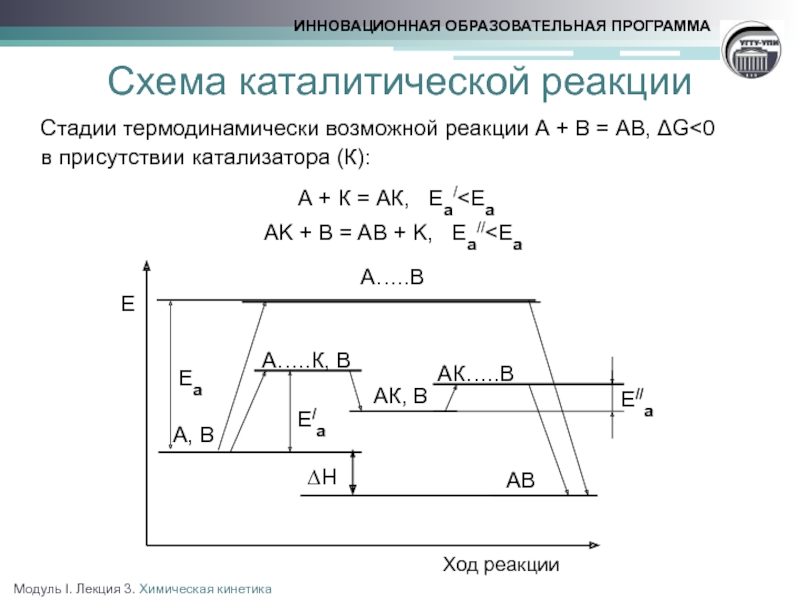
катализаторы ‑ вещества, увеличивающие скорость реакции за счет снижения энергии активации
Модуль I. Лекция 3. Химическая кинетика