Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Капиллярный электрофорез и электрохроматография Аналитический Центр химического
Содержание
- 1. Капиллярный электрофорез и электрохроматография Аналитический Центр химического
- 2. История и этапы развития методаЭлектрофорез – движение
- 3. Электрофоретическая подвижность = электрофоретическая подвижностьq = заряд частицы = вязкость раствораr = радиус частицы(см2 В-1 сек-1)
- 4. Схема прибора для капиллярного электрофореза
- 5. Скорость миграции по капилляруСкорость миграции: Где:v = скорость
- 6. Эффективность в электрофорезе не зависит от длины
- 7. Строение капилляра Трубка из плавленного кварца со
- 8. Электроосмотический поток и причины его возникновения
- 9. Скорость и направление движения ионов по капилляру
- 10. Профиль гидродинамического и электроосмотического потоковЭлектроосмотическийПлоский профильМинимизируется размывание
- 11. Выделение тепла капилляромКапилляр работает как сопротивление Чем
- 12. Ввод пробы в капиллярГидродинамическийДавлениеВакуум Гидростатический Электрокинетический
- 13. Детектирование в капиллярном электрофорезеКапилляр имеет малый объем,
- 14. Пределы обнаружения Объем пробы ~ 1нлДлина оптического пути ~ 50 мкмВещество с Mw = 100
- 15. Оптимизация в капиллярном электрофорезеpHПервое, что надо варьироватьВлияет
- 16. Достоинства капиллярного электрофорезаОчень высокая эффективность (до
- 17. Недостатки капиллярного электрофорезаЧасто недостаточная чувствительностьХуже воспроизводимость
- 18. Капиллярный зонный электрофорез (CZE) Мицеллярная электрокинетическая хроматография
- 19. Капиллярный зонный электрофорез
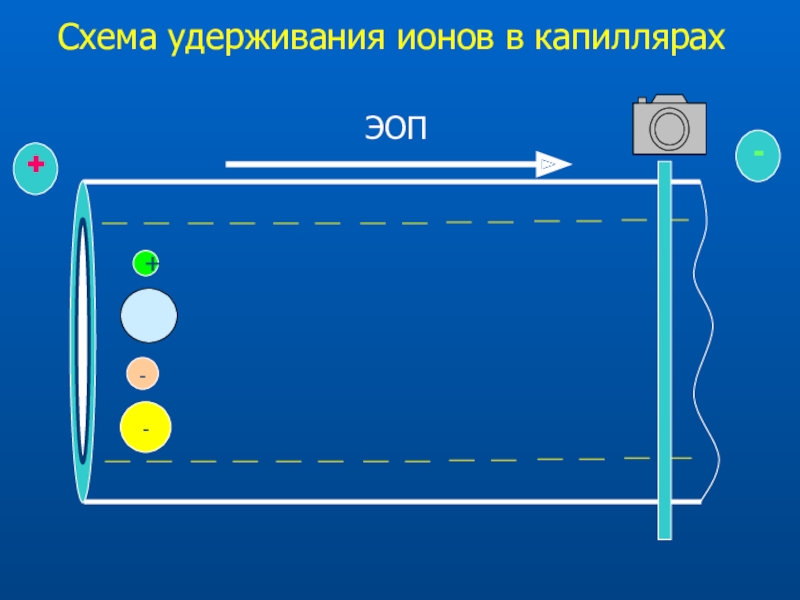
- 20. Схема удерживания ионов в капиллярах+--
- 21. Разделяются ТОЛЬКО заряженные соединения. Направления движения
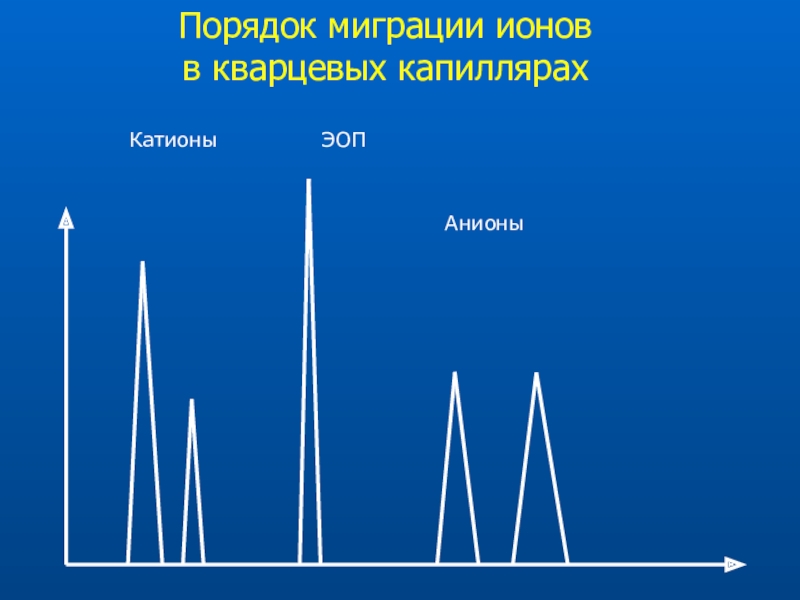
- 22. Порядок миграции ионов в кварцевых капиллярах
- 23. Определение катионов в сточных водах методом
- 24. Хорошие начальные условия для КЗЭ:Капилляр: 75 мкм
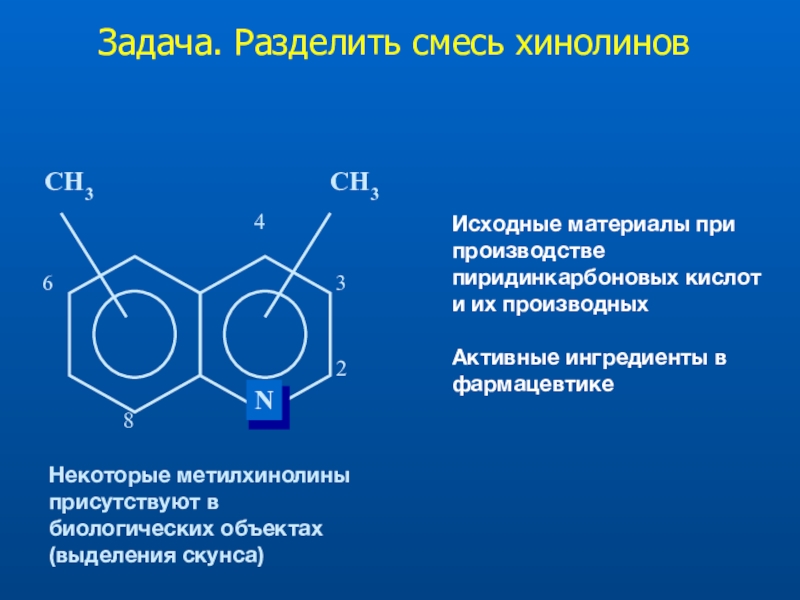
- 25. Задача. Разделить смесь хинолиновИсходные материалы при производстве
- 26. Разделение смеси хинолинов методом КЗЭЭлектролит: Ацетат натрия/уксусная кислота, pH 5.5
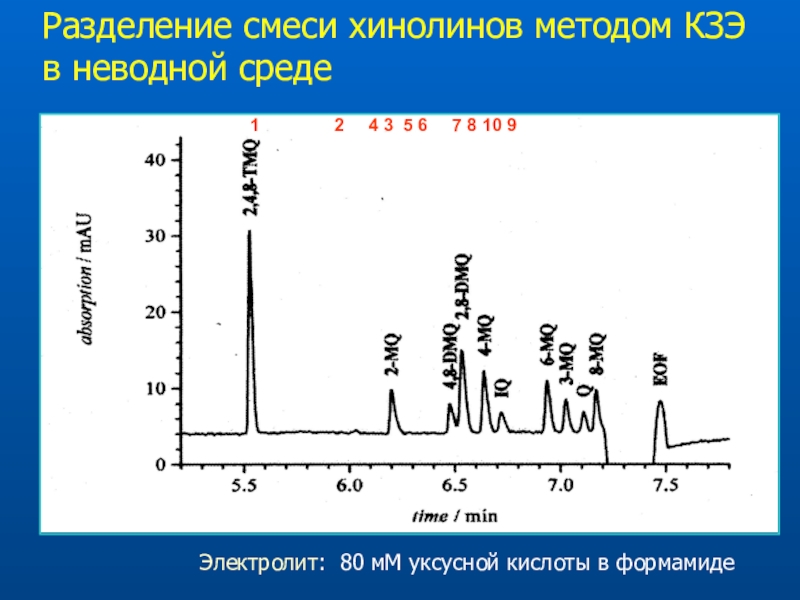
- 27. Разделение смеси хинолинов методом КЗЭ в неводной средеЭлектролит: 80 мМ уксусной кислоты в формамиде
- 28. Принцип образования полиэлектролитных комплексов Простой синтез
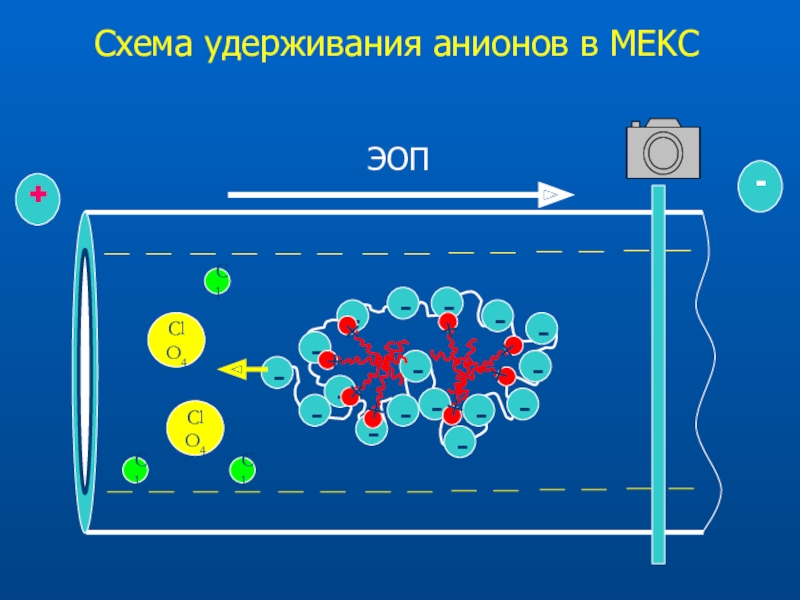
- 29. Схема удерживания анионов в модифицированных капиллярахClClO4
- 30. Порядок миграции ионов в модифицированных кварцевых капиллярах
- 31. Определение анионов в варианте КЗЭ с обращенным электроосмотическим потоком1-хлорид, 2-нитрит, 3-сульфат, 4-перхлорат, 5-молибдат, 6-формиат
- 32. Определение инициаторов взрывчатых веществ Модификатор: 2,4-ионен
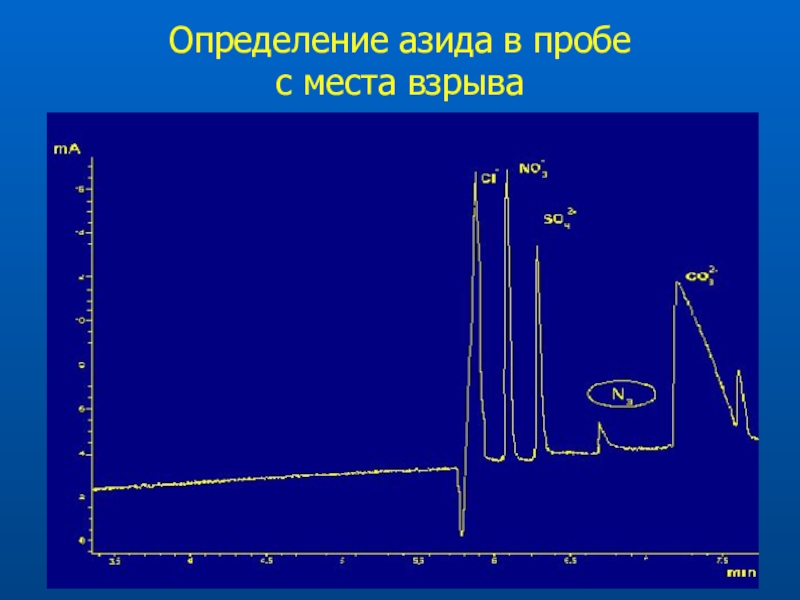
- 33. Определение азида в пробе с места взрыва
- 34. Анализ лекарственных композицийЦеребролизин Высокое качествоАминокислотыВитаминыАроматические консервантыПАВГетероциклыГормоныдругие веществаЦеребролизат ? качество
- 35. Структура 2,10-ионена
- 36. Запрещенная добавка в лекарство
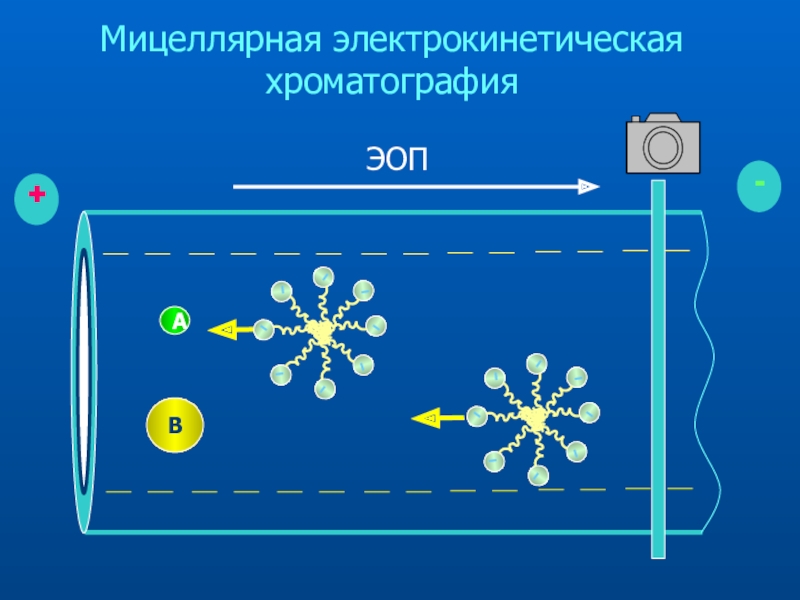
- 37. Мицеллярная электрокинетическая хроматография
- 38. ABМицеллярная электрокинетическая хроматография
- 39. Два механизма разделенияЭлектрофоретическая подвижность в свободном растворе
- 40. Порядок миграции веществ в МЕКС
- 41. Факторы, влияющие на селективность в МЕКСПрирода ПАВДлина
- 42. Хорошие начальные условия для МЕКС:Капилляр: 50 мкм
- 43. Структурные формулы ариламмониевых гербицидов
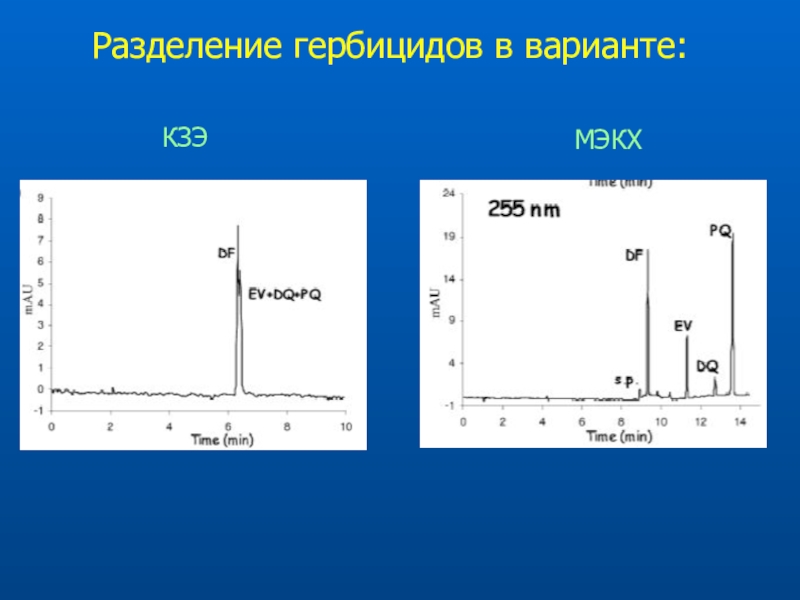
- 44. Разделение гербицидов в варианте:КЗЭ
- 45. Separation of nine PAHs in methanol:water (75:25
- 46. Разделение смеси хинолинов методом МЕКС с Brij-35
- 47. Разделение смеси хинолинов методом МЕКС с SDS
- 48. Строение водорастворимогополиэлектролитного комплекса
- 49. Схема удерживания анионов в МEKCClClO4ClO4ClCl
- 50. Определение DNS-производных аминокислотBuffer: 10 mM NaH2PO4, pH
- 51. Микроэмульсионная электрокинетическая хроматография
- 52. Принципы метода МEEKC В капилляре создается устойчивая
- 53. Эмульсия масло-вода Необходимы: масло, раствор электролита в
- 54. Хорошие начальные условия для МЕЕКС:Капилляр: 50 мкм
- 55. Разделение смеси хинолинов методом МЕEКС с Brij-35в
- 56. Разделение смеси хинолинов методом МЕEКС с SDS
- 57. Капиллярный гель-электрофорез
- 58. Особенности СGEРазделение основано на эксклюзииЭОП подавлен или
- 59. Механизм CGEРазделяемые вещества движутся по капилляру в
- 60. Разделение пептидов (с флуоресцентной меткой) методом CGE
- 61. Капиллярная электрохроматография в заполненных капиллярах
- 62. Принципы метода CЕС CEC является гибридным методомКомбинация
- 63. Профили потоков в -ВЭЖХ и CЕС Капилляры в СЕС могут быть: Заполнены сферическим сорбентомМонолитные
- 64. Теоретические предпосылки о преимуществах СЕСПлоский профиль
- 65. Теоретические предпосылки о преимуществах СЕС
- 66. Электрофореграммы ароматических кислот в вариантах КЗЭ (A) и СЕС (Б)(A)
- 67. АналитыMW>2000MW
- 68. Электрофорез на микрочипе
- 69. Схема производства микрочипаСтеклоПервый использованный материалОтработана технология травленияХрупкость
- 70. Электрофорез на чипе
- 71. Типичная электрофореграмма Приложенное напряжение 400 В
- 72. Типичная структура капилляра «песочные часы» Длина
- 73. Устройство для оттягивания микропипетокКонтролируются Температура Скорость нагрева
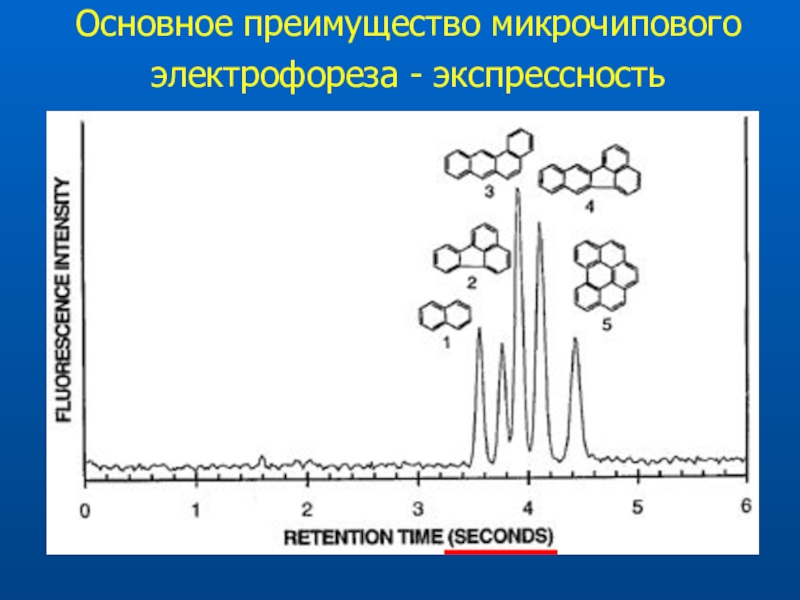
- 74. Основное преимущество микрочипового электрофореза - экспрессность
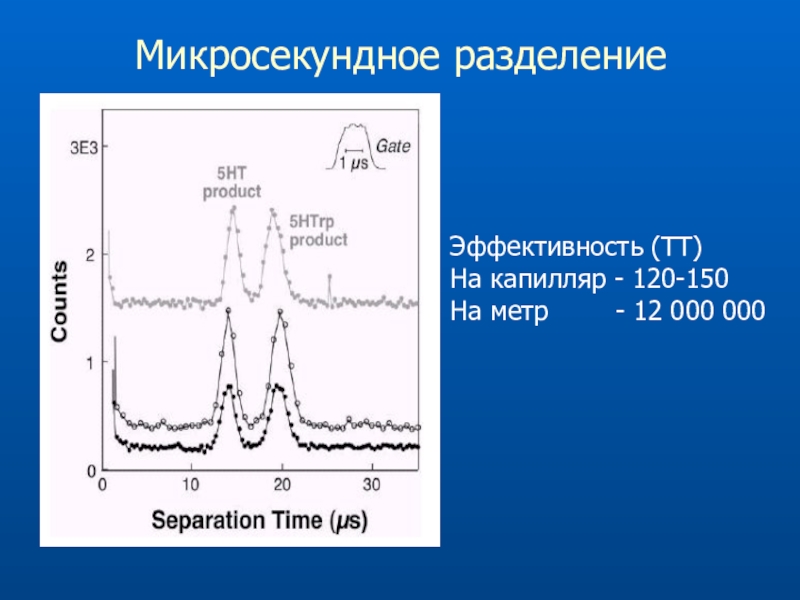
- 75. Микросекундное разделение Эффективность (ТТ)На капилляр -
- 76. Слайд 76
- 77. Приборы для капиллярного электрофореза
- 78. Agilent 3D
- 79. Капель 103-105
- 80. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Капиллярный электрофорез
и электрохроматография
Аналитический Центр химического факультета МГУ
Москва, Ленинские горы,
ГСП-1.
Слайд 2История и этапы развития метода
Электрофорез – движение заряженных частиц растворе
под действием электрического поля
История:
Начало 19-го века – открытие электрофореза
1937 –
Нобелевская премия (Тизелиус)1981-1983 – первые аналитические приборы капиллярного электрофореза (Джоргенсон, Лукас)
1990-2003 Расшифровка генома человека
Слайд 3Электрофоретическая подвижность
= электрофоретическая подвижность
q = заряд частицы
= вязкость
раствора
r = радиус частицы
(см2 В-1 сек-1)
Слайд 5Скорость миграции по капилляру
Скорость миграции:
Где:
v = скорость миграции иона в
электрическом поле (см сек -1)
ep = электрофоретическая подвижность (см2 В-1
сек-1)E = напряженность поля (В см -1)
V = приложенное напряжение (В)
L = длина капилляра (см)
Слайд 6Эффективность в электрофорезе не зависит от длины капилляра!
Уравнение Ван-Деемтера:
A
= 0 (капилляр узкий, нет турбулентности)
C = 0
(нет неподвижной фазы) Oстается только B
N = L/H
H = B/v = 2D/v
v = E = V/L
Следовательно, N = L/[2D/(V/L)] = V/2D
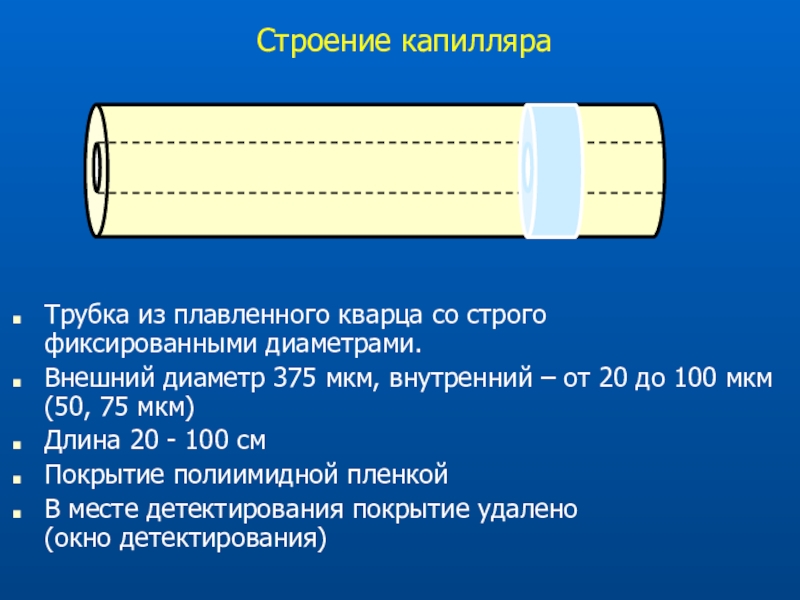
Слайд 7Строение капилляра
Трубка из плавленного кварца со строго
фиксированными диаметрами.
Внешний
диаметр 375 мкм, внутренний – от 20 до 100 мкм
(50, 75 мкм)Длина 20 - 100 см
Покрытие полиимидной пленкой
В месте детектирования покрытие удалено (окно детектирования)
Слайд 10Профиль гидродинамического и электроосмотического потоков
Электроосмотический
Плоский профиль
Минимизируется размывание зон
Зависит от свойств
поверхности капилляра
Гидродинамический
Параболический профиль
Большее размывание зоны
Не зависит от свойств поверхности
Слайд 11Выделение тепла капилляром
Капилляр работает как сопротивление
Чем больше ток, тем
больше выделение тепла
Зависимость силы тока от напряжения нелинейна
Чем меньше диаметр
капилляра, тем меньше токЧем концентрация буферного электролита, тем меньше ток
Желателен ток до <60 мA ( < 1 W)
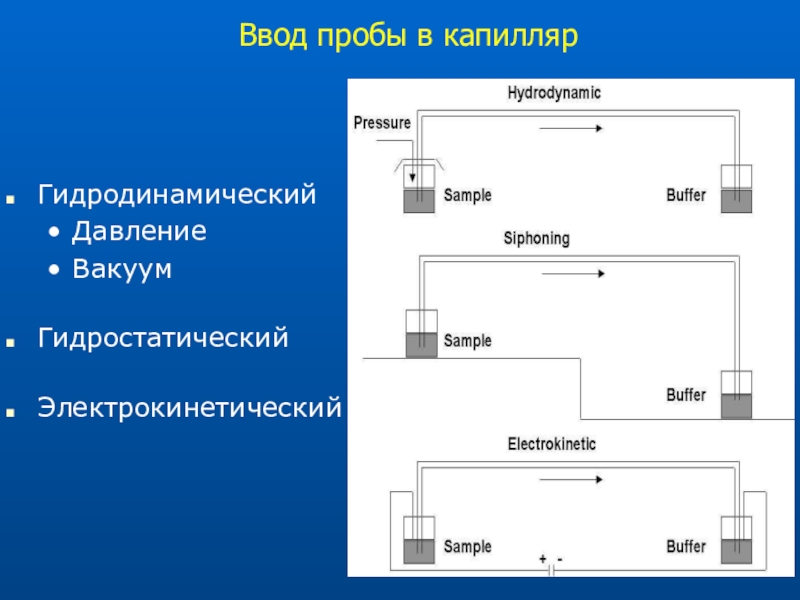
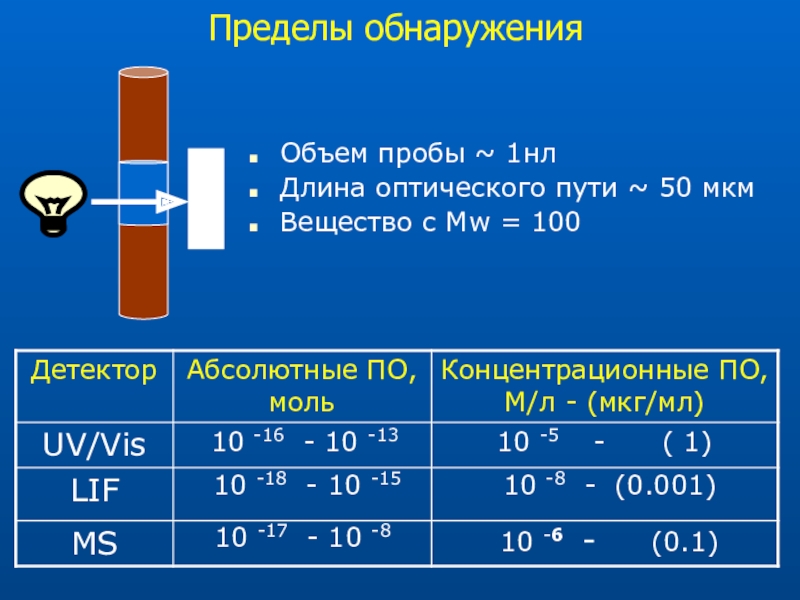
Слайд 13Детектирование в капиллярном электрофорезе
Капилляр имеет малый объем, следовательно объем вводимой
пробы очень мал (нанолитры)
Специальные приемы по минимизации мертвого объема
Должна
быть решена проблема высокого напряжения при анализе
Обычно используемые детекторы
UV/Vis – наиболее распространен
LIF (laser-induced fluorescence) - наиболее чувствителен
Mass spectrometry – наиболее перспективен
Бесконтактная кондуктометрия
Слайд 15Оптимизация в капиллярном электрофорезе
pH
Первое, что надо варьировать
Влияет на ЭОП и
подвижность (заряд)
Органический растворитель
Сольватация веществ
Концентрация и природа добавок
образование мицелл, ионных пар
и т.п.
Неводный электрофорез
Сольватация, заряд (но проблемы с током !)
Температура, напряжение
Сольватация, хим. равновесие, подвижность
Слайд 16Достоинства
капиллярного электрофореза
Очень высокая эффективность (до 6 млн. тт)
Требуемый объем пробы (1-10 мкл)
Быстрое разделение (1 - 30
мин) Предсказуемая селективность
Автоматизация
«Ненужные» компоненты матрицы пробы можно легко удалить из капилляра промывкой
Капилляр легко заменить
Совместимость с масс-селективным детектором
Слайд 17Недостатки
капиллярного электрофореза
Часто недостаточная чувствительность
Хуже воспроизводимость по сравнению с хроматографией
Сложно контролировать величину ЭОП
Свойства капилляров могут меняться от партии
к партииУзкий динамический диапазон (1 порядок концентраций)
Образование пузырьков газа в капилляре
Форма пиков часто несимметрична
Слайд 18Капиллярный зонный электрофорез (CZE)
Мицеллярная электрокинетическая хроматография (MEKC)
Микроэмульсионная электрокинетическая хроматография (MEEKC)
Капиллярная
электрохроматография с заполненными капиллярами (CEC)
Капиллярный гель-электрофорез (CGE)
Изотахофорез (ITP)
Капиллярная изоэлектрическая
фокусировка (CIEF) Основные виды электрофореза
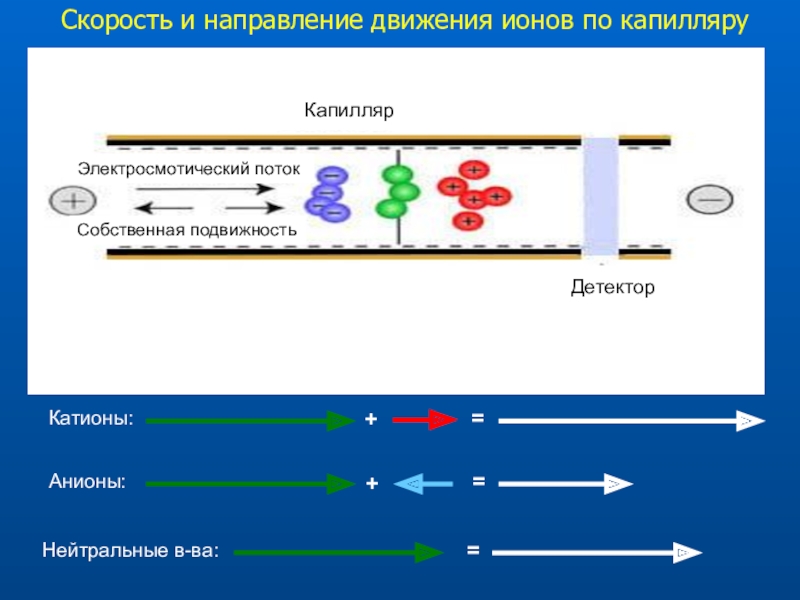
Слайд 21 Разделяются ТОЛЬКО заряженные соединения. Направления движения катионов и анионов
различны.
Подвижности ионов отличаются в зависимости от отношения их заряда
к размеру, что обусловливает разделение.
Общая подвижность зависит от направления и величины ЭОП
Механизм разделения
в капиллярном зонном электрофорезе
Слайд 23Определение катионов в сточных водах
методом капиллярного зонного электрофореза
Буферный электролит:
10 мМ бензимидазол, винная кислота, 18-краун-6
Напряжение: 13 кВ
Детектирование: Косвенное, 254
нм Слайд 24Хорошие начальные условия для КЗЭ:
Капилляр: 75 мкм внутренний диаметр, 60
см длина
Электролит: Фосфатный или боратный буферный раствор
с концентрацией около 50 мМ
Напряжение: +/- 20 kV (так, чтобы ток не более 100 µA)
Слайд 25Задача. Разделить смесь хинолинов
Исходные материалы при производстве пиридинкарбоновых кислот и
их производных
Активные ингредиенты в фармацевтике
Некоторые метилхинолины присутствуют в биологических объектах
(выделения скунса)Слайд 27Разделение смеси хинолинов методом КЗЭ в неводной среде
Электролит: 80 мМ
уксусной кислоты в формамиде
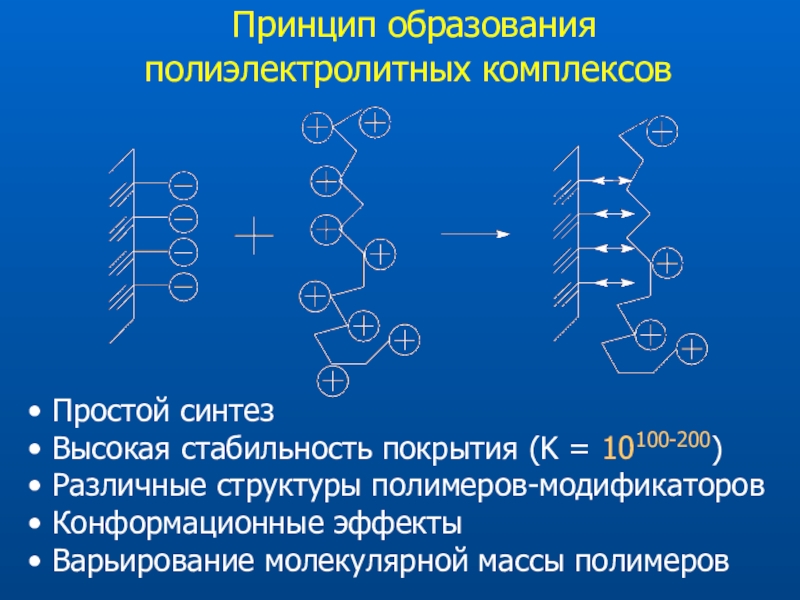
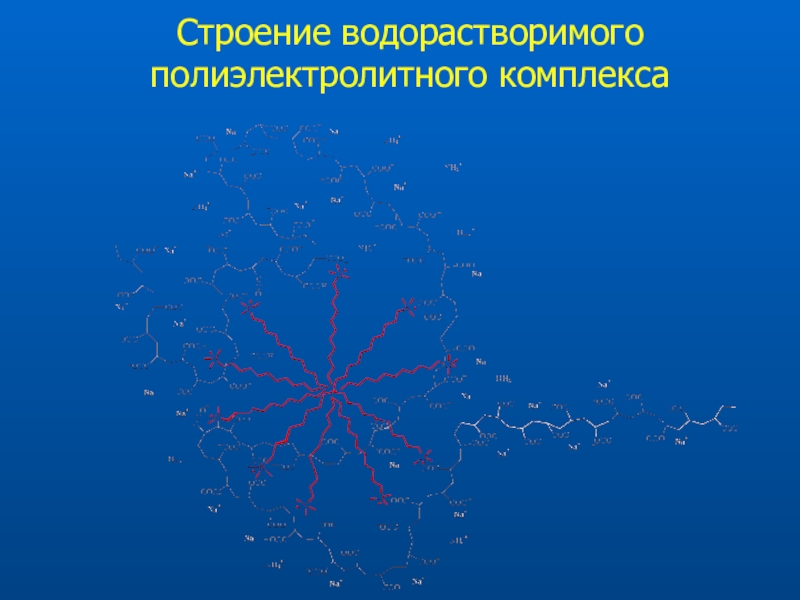
Слайд 28 Принцип образования полиэлектролитных комплексов
Простой синтез
Высокая стабильность покрытия
(K = 10100-200)
Различные структуры полимеров-модификаторов
Конформационные эффекты
Варьирование молекулярной
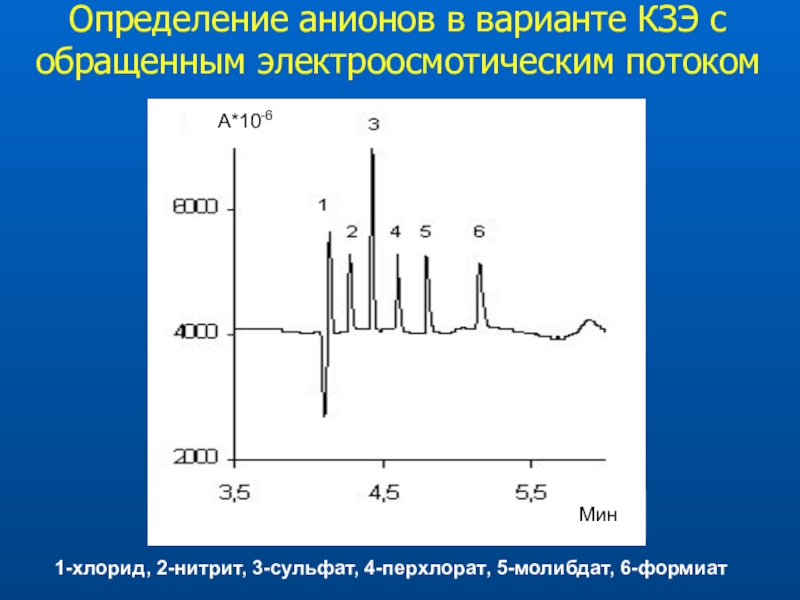
массы полимеровСлайд 31Определение анионов в варианте КЗЭ с обращенным электроосмотическим потоком
1-хлорид, 2-нитрит,
3-сульфат, 4-перхлорат, 5-молибдат, 6-формиат
Слайд 34Анализ лекарственных композиций
Церебролизин Высокое качество
Аминокислоты
Витамины
Ароматические консерванты
ПАВ
Гетероциклы
Гормоны
другие вещества
Церебролизат
? качество
Слайд 39Два механизма разделения
Электрофоретическая подвижность в свободном растворе электролита
Распределение между аналитом
и мицеллами
Мицеллы
Образуются в растворах при концентрации ПАВ выше ККМ
Имеют заряженную
поверхность и гидрофобное ядроДодецилсульфат натрия (SDS) наиболее распространен (ККМ ~ 15 мМ).
Механизм разделения в мицеллярной
электрокинетической хроматографии
Слайд 41Факторы, влияющие на селективность в МЕКС
Природа ПАВ
Длина гидрофобного «хвоста» и
природа гидрофильных ионогенных групп
Различное агрегатное число (SDS = 16)
Желчные
кислотыКатионные ПАВ обращают направление ЭОП
рК ионогенных групп
Буферный электролит
Добавки органических растворителей имеют большее влияние, чем в КЗЭ.
Большое кол-во орг. растворителей разрушает мицеллы
рН и рК аналитов
Температура
Сильное влияние на устойчивость и поведение мицелл
Необходимо тщательное термостатирование (2ºC критично)
Слайд 42Хорошие начальные условия для МЕКС:
Капилляр: 50 мкм внутренний диаметр, 60
см длина
Электролит: 20 мМ боратный буферный раствор с рН 9,
содержащий 50…100 мМ
додецилсульфата натрия (SDS)
Напряжение: + 20 kV
Слайд 45Separation of nine PAHs in methanol:water (75:25 v/v). Electrolyte is 10
mM H3PO4 with 70 mM sodium n–tetradecyl sulfate.
1, benzo[a]perylene;
2, perylene; 3, benzo[a]anthracene; 4, pyrene; 5, 9–methylanthracene; 6, anthracene; 7, fluorene; 8, napthalene; 9, benzophenone.
Разделение ПАУ в варианте МЕКС
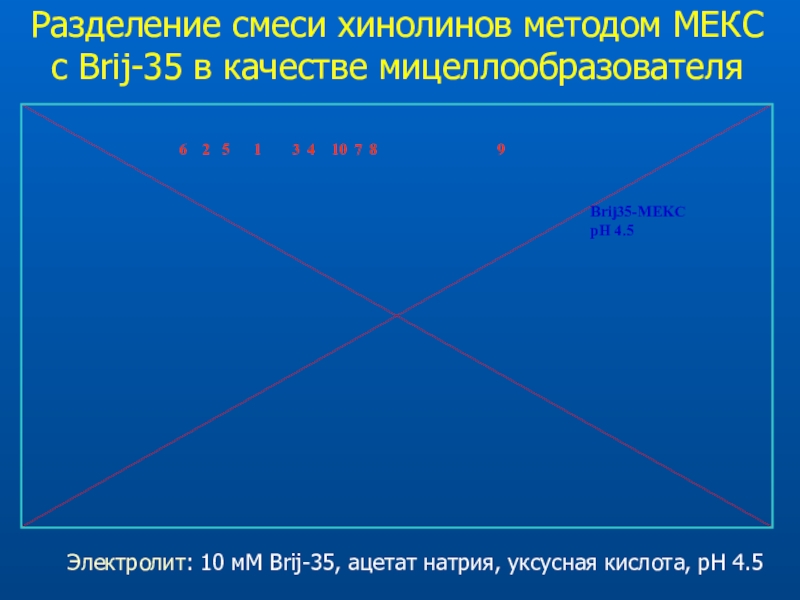
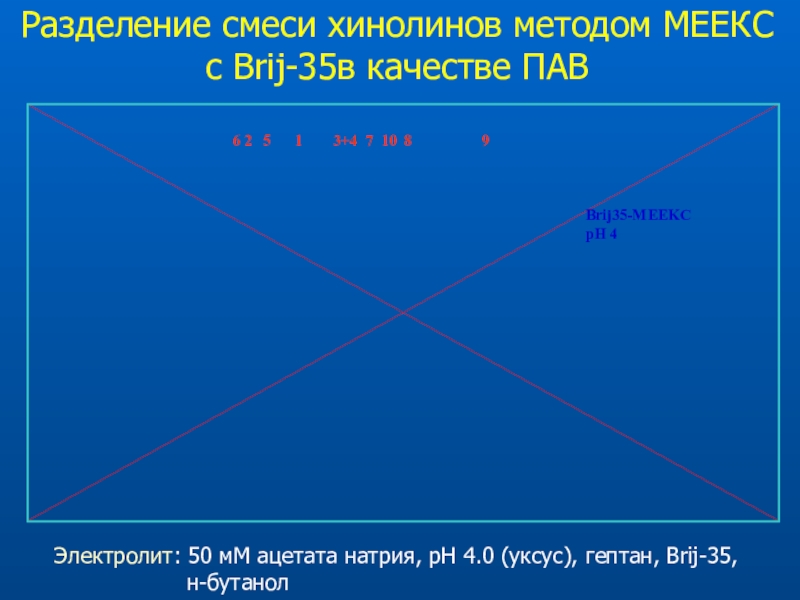
Слайд 46Разделение смеси хинолинов методом МЕКС с Brij-35 в качестве мицеллообразователя
Электролит:
10 мМ Brij-35, ацетат натрия, уксусная кислота, pH 4.5
Слайд 47Разделение смеси хинолинов методом МЕКС с SDS в качестве мицеллообразователя
Электролит:
50 мМ SDS, 25 мМ NaOH, борная кислота, pH 9.0
Слайд 50Определение DNS-производных аминокислот
Buffer: 10 mM NaH2PO4, pH 5.8.
Capillary: 50
cm (43 cm) * 100 m I.D. Voltage 15 kV.
Detection: 214 nm.Слайд 52Принципы метода МEEKC
В капилляре создается устойчивая микроэмульсия несмешивающейся в
водой жидкости (масло).
Вещества разделяются с соответствии с коэффициентами распределения
в системе масло-вода. Если они заряжены и не распределятся в масло, то двигаются в соответствии с их ионными подвижностями.
Слайд 53Эмульсия масло-вода
Необходимы: масло, раствор электролита в воде,
ионогенное ПАВ,
неионогенное ПАВСлайд 54Хорошие начальные условия для МЕЕКС:
Капилляр: 50 мкм внутренний диаметр, 60
см длина
Электролит: 0.81 g октана,
6.61 g н-бутанола,
3.31 g SDS,
89.27 g тетрабората натрия (ультразвук)Напряжение: + 20 kV
www.ceandcec.com
Слайд 55Разделение смеси хинолинов методом МЕEКС с Brij-35в качестве ПАВ
Электролит: 50
мМ ацетата натрия, рН 4.0 (уксус), гептан, Brij-35,
н-бутанолСлайд 56Разделение смеси хинолинов методом МЕEКС с SDS в качестве ПАВ
Электролит:
50 мМ борная кислота, рН 9.4 (NaOH), гептан, SDS, н-бутанол
Слайд 58Особенности СGE
Разделение основано на эксклюзии
ЭОП подавлен или изменен
Капилляры заполнены
полимером
Линейный полиакриламид
Сшитые полимеры (3-х мерная структура)
Смеси полимеров
Целесообразен для больших
молекул с подобными соотношениями m/zДНК
Белки
Слайд 59Механизм CGE
Разделяемые вещества движутся по капилляру в зависимости от собственной
подвижности и способности проникать в гель.
Малые молекулы мигрируют первыми
Большие молекулы
мигрируют последнимиpH буферного электролита
Необходимо ионизовать аналиты
Оставить поверхность капилляра незаряженной ( нет ЭОП)
Слайд 62Принципы метода CЕС
CEC является гибридным методом
Комбинация КЗЭ и ВЭЖХ
Электрофоретическое
движение подвижной фазы
Неподвижные фазы от ВЭЖХ
Цели
Получить селективность от ВЭЖХ (
1)Получить эффективность от КЗЭ (N ~ 500 000)
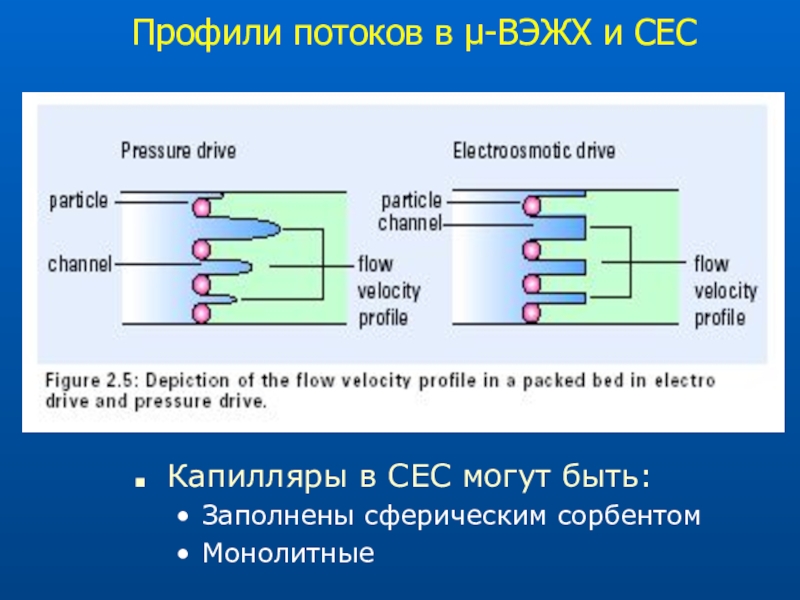
Слайд 63Профили потоков в -ВЭЖХ и CЕС
Капилляры в СЕС могут
быть:
Заполнены сферическим сорбентом
Монолитные
Слайд 64Теоретические предпосылки
о преимуществах СЕС
Плоский профиль потока подвижной фазы
Размер частиц
сорбента
Нет ограничений по давлению
Используют частицы размером < 1.5 мкм
Экспрессность
анализаБольшая поверхность приводит к коротким колонкам
Хорошо стыкуется с MS (можно использовать большие концентрации орг. растворителей для управления селективностью)
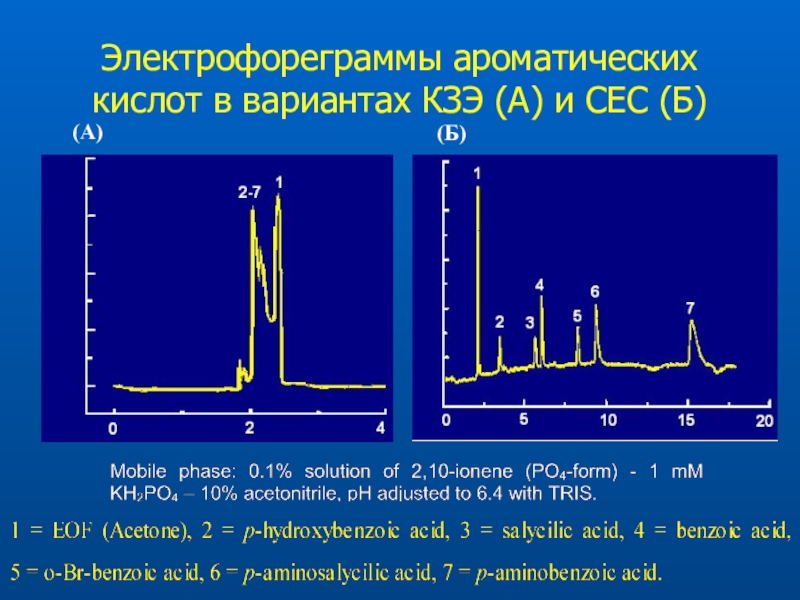
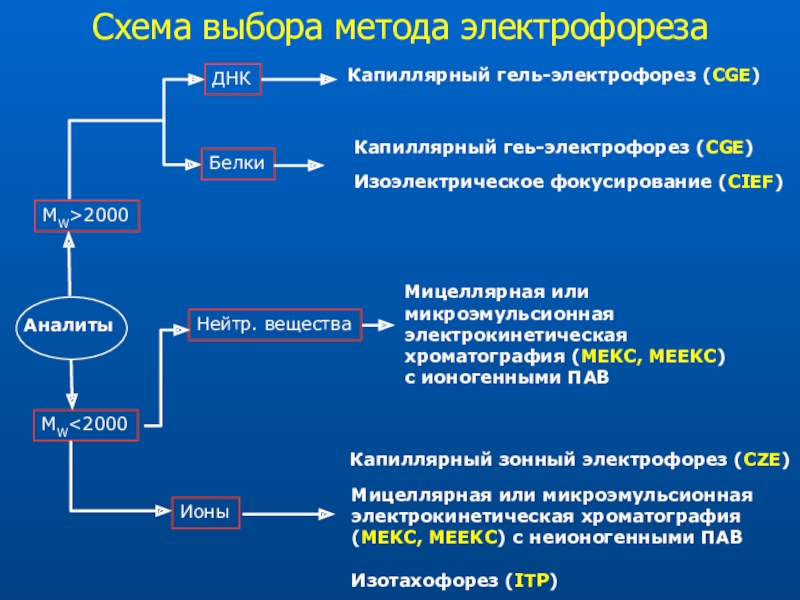
Слайд 67Аналиты
MW>2000
MW
ионогенными ПАВ
ДНК
Белки
Капиллярный геь-электрофорез (CGE)
Изоэлектрическое фокусирование (СIEF)
Капиллярный зонный электрофорез (CZE)
Мицеллярная или
микроэмульсионная электрокинетическая хроматография (MEKC, MEEKC) с неионогенными ПАВИзотахофорез (ITP)
Схема выбора метода электрофореза
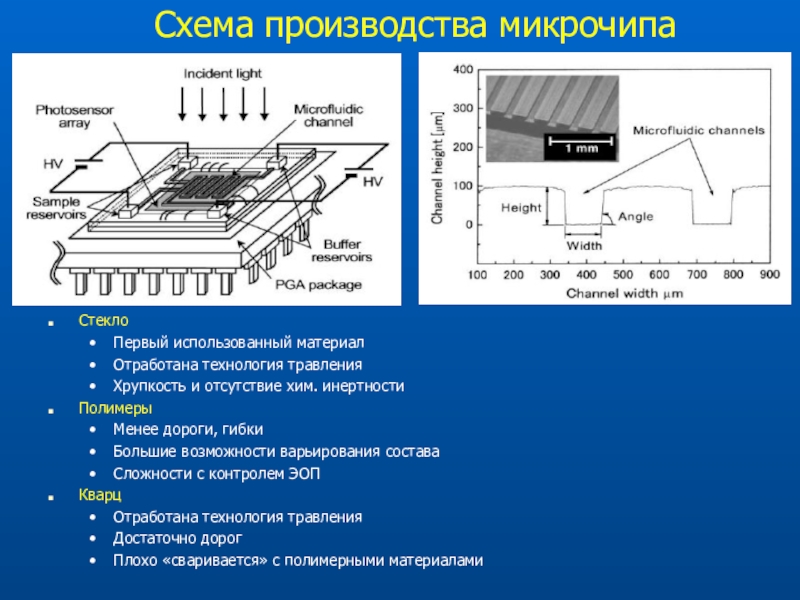
Слайд 69Схема производства микрочипа
Стекло
Первый использованный материал
Отработана технология травления
Хрупкость и отсутствие хим.
инертности
Полимеры
Менее дороги, гибки
Большие возможности варьирования состава
Сложности с контролем ЭОП
Кварц
Отработана технология
травленияДостаточно дорог
Плохо «сваривается» с полимерными материалами
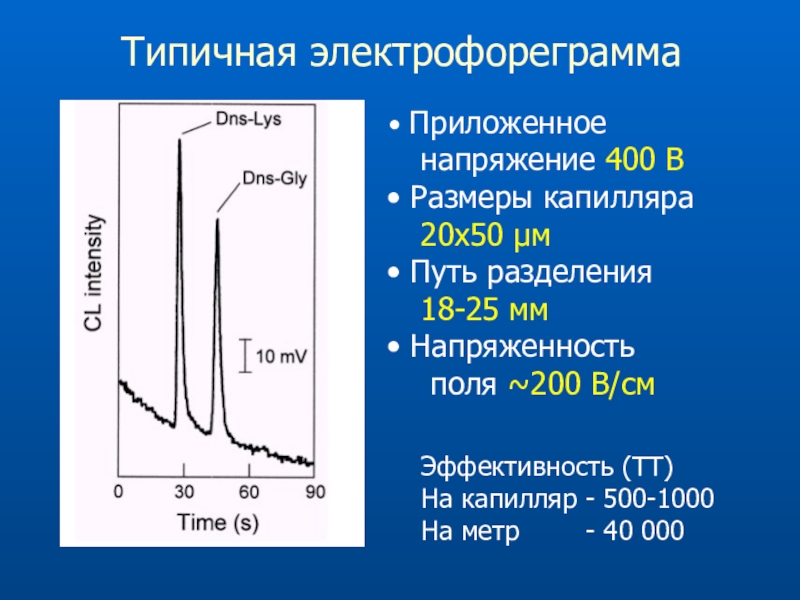
Слайд 71Типичная электрофореграмма
Приложенное
напряжение 400 В
Размеры капилляра
20х50 м
Путь разделения
18-25 мм
Напряженность
поля ~200 В/см
Эффективность
(ТТ)На капилляр - 500-1000
На метр - 40 000
Слайд 72Типичная структура капилляра
«песочные часы»
Длина пути «до разделения» 9м
Напряженность поля 100 кВ/см
Скорость переноса 1.3 м/сек
Время анализа
20 секПриложенное напряжение 20 кВ
Слайд 73Устройство для оттягивания микропипеток
Контролируются
Температура
Скорость нагрева
Зона нагрева
Величина растягивания
Получаемый диаметр
(до 0.1 мкм)
Подача газа
Влажность10 встроенных программ