Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексные (координационные) соединения
Содержание
- 1. Комплексные (координационные) соединения
- 2. Современная координационная химия связана с именем швейцарского
- 3. Вернер Альфред (12.XII.1866–15.XI.1919)
- 4. Комплексными называют соединения, содержащие
- 5. Слайд 5
- 6. Строение комплексных соединенийКалий гексацианоферрат (III)Fe3+CN-CN-CN-CN-CN-CN-K+K+K+
- 7. Центральный атом
- 8. Формула комплексного иона или молекулы
- 9. Система комплексообразователь–лиганды называется внутренней координационной
- 10. В комплексных ионах [Cu(NH3)4]2+,
- 11. ЛИГАНДЫЛигандами могут быть различные неорганические и органические
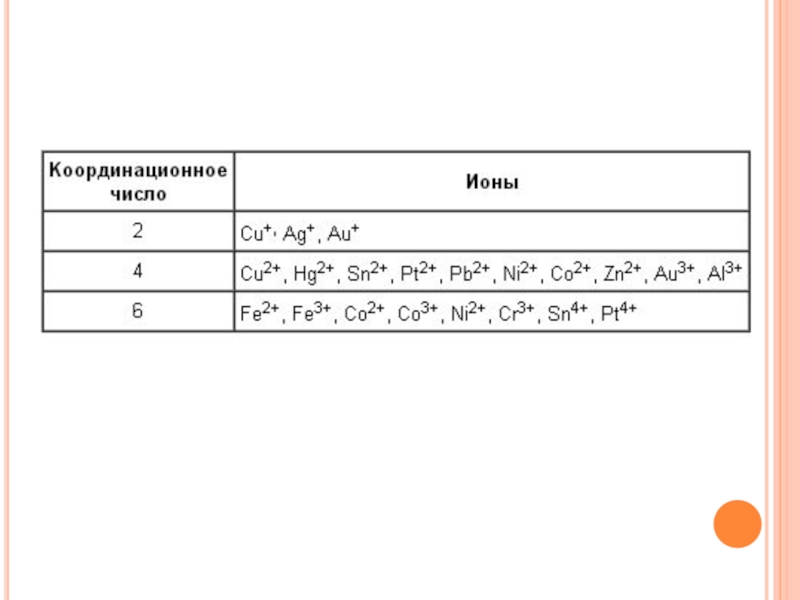
- 12. Координационным числом называют число атомов
- 13. Слайд 13
- 14. Номенклатура
- 15. Классификация комплексных соединенийПо заряду комплексаКатионные комплексы[Zn(NH3)4]Cl2[Co(NH3)6]Cl2Анионные комплексыK2[BeF4] Li[AlH4]Нейтральные комплексы[Ni(CO)4][Pt(NH3)2Cl2] По природе лигандаАммиакаты[Pt(NH3)6]Cl4 Аквакомплексы[Co(H2O)6]Cl2ГидроксокомплексыNa2[Zn(OH)4] АцидокомплексыK2[PtCl4]
- 16. Номенклатура1) В названии комплексного соединения первым указывают
- 17. 3) Затем называют комплексообразователь, используя корень его
- 18. Название комплексного соединения электролита начинается
- 19. Слайд 19
- 20. Слайд 20
- 21. K2[CuCl4]
- 22. Na3[Ag(S2O3)2][Ru(HSO3)2(NH3)4][CrCl2(NH3)4]ClK4[Ni(CN)4][Cu(NH3)2]OH[Co(H2O)6]Cl2K[AgF4]K[Au(OH)4]K2[Cr(CN)2O2(O2)NH3]
- 23. Напишите формулы комплексных соединений:Дицианоаргентат калияГексанитрокобальтат (III) калияХлорид
- 24. Виды Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
- 25. Положения метода валентных связей 1.
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Квадратный комплекс [Pt(NH3)2Cl2]
- 30. Октаэдрический комплексный ион [CoF6]3-
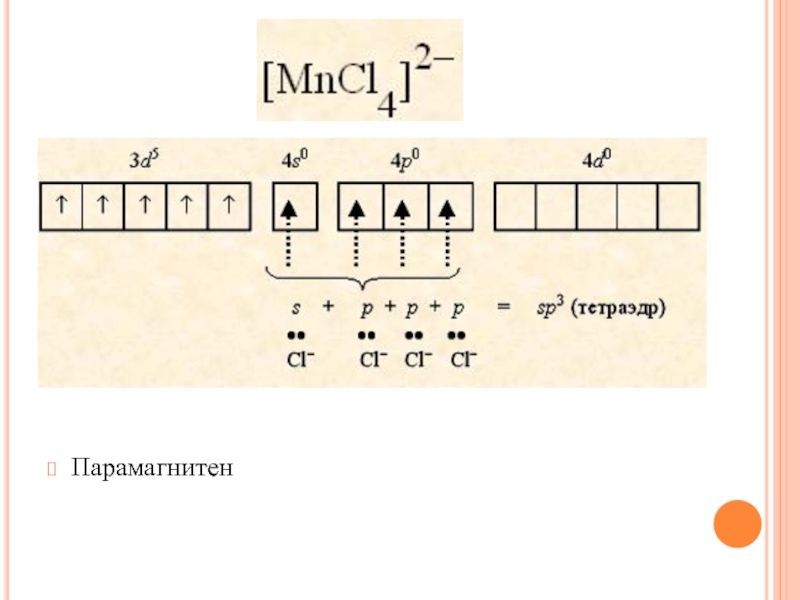
- 31. диамагнитен
- 32. Парамагнитен
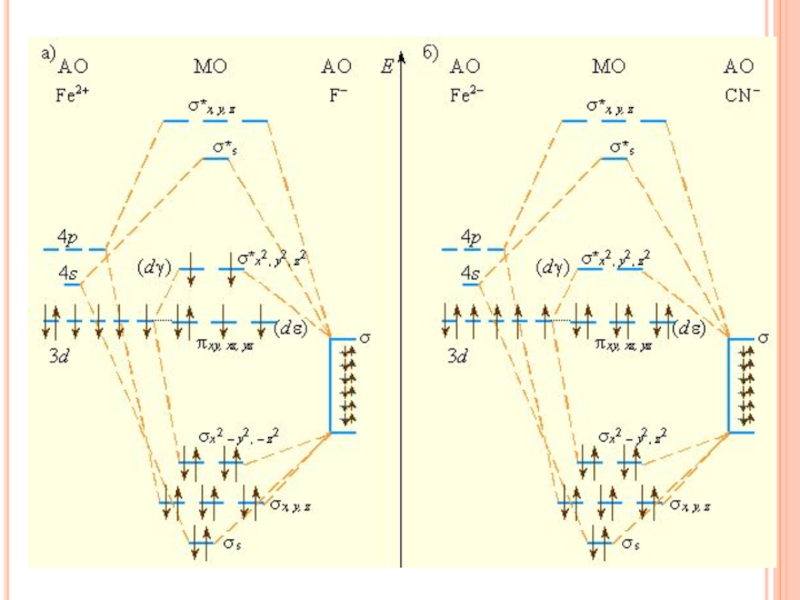
- 33. Химическая связь в координационных соединениях Образование парамагнитного иона [FeF6]4–
- 34. Химическая связь в комплексных соединенияхИоны CN– значительно
- 35. Слайд 35
- 36. Слайд 36
- 37. Изомерия комплексных соединений Гидратная (сольватная) изомерия
- 38. Изомерия комплексных соединений Ионизационная изомерия характеризуется
- 39. Изомерия комплексных соединений Координационная изомерия заключается
- 40. Изомерия комплексных соединений Геометрическая изомерия (цис-транс
- 41. Слайд 41
- 42. Изомерия комплексных соединений Оптическая изомерия. Оптическая
- 43. Слайд 43
- 44. Изомерия комплексных соединений Структурная изомерия. Структурными
- 45. Слайд 45
- 46. Устойчивость координационных соединений в растворах Химические
- 47. Слайд 47
- 48. K3[Fe(CN)6] ↔ K+ +
- 49. [Ag(NH3)2]+
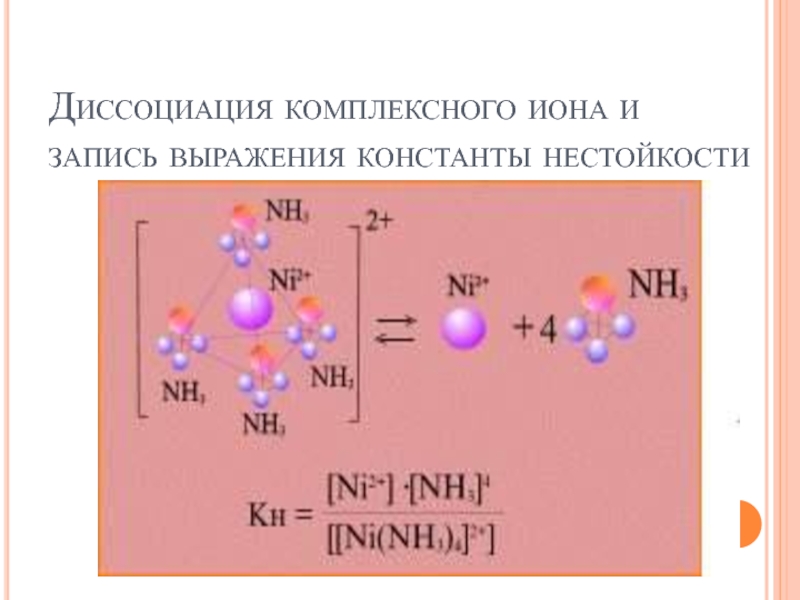
- 50. Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе
- 51. Диссоциация комплексного иона и запись выражения константы нестойкости
- 52. Реакции с участием комплексных соединений
- 53. Комплексные ионы участвуют в реакциях
- 54. Присоединение, замещение или отщепление лиганда1а. Присоединение лиганда
- 55. Изомеризации комплексных полиэдра Изомеризация – весьма распространенное явление среди геометрических и оптических изомеров:
- 56. Реакции связанного лигандаРеакции связанного лиганда многообразны и
- 57. Реакции электронного переноса Реакции электронного переноса
- 58. Процессы образования и разрушения комплексов используются:-
- 59. Скачать презентанцию
Современная координационная химия связана с именем швейцарского химика А. Вернера, сформулировавшего основные положения координационной теории (1893 г.).
Слайды и текст этой презентации
Слайд 2Современная координационная химия связана с именем швейцарского химика А. Вернера,
сформулировавшего основные положения координационной теории (1893 г.).
Слайд 3Вернер Альфред
(12.XII.1866–15.XI.1919)
Швейцарский химик. Основоположник химии
комплексных (координационных) соединений. Выдвинул и развил (1893) координационную теорию строения
комплексных соединений, опровергающую представления о постоянстве чисел валентности. Предсказал (1899) существование оптически активных изомеров, не имеющих асимметрического углеродного атома. Нобелевская премия (1913).Слайд 4 Комплексными называют соединения, содержащие в одном из
агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном
порядке размещенных (координированных) вокруг атома (иона) – комплексообразователя.Слайд 6Строение комплексных соединений
Калий гексацианоферрат (III)
Fe3+
CN-
CN-
CN-
CN-
CN-
CN-
K+
K+
K+
Ион комплексообразователя
лиганды
Внутренняя сфера
Внешняя сфера
[ (CN)6]
К3
Fe
→3K+
→
[Fe (CN)6]3-Слайд 8 Формула комплексного иона или молекулы записывается, как правило,
слева направо в следующей последовательности: центральный атом (ион), анионные, затем
нейтральные лиганды с указанем их числа в виде правого нижнего индекса: [MLmXn]q.Слайд 9 Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой
квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3, [PtCl2(NH3)2], [Cr(CO)6].
M
+ nL ↔ [MLn] где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома.
Слайд 10 В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4-
, [BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления. Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH4]+ и т.п. Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).Слайд 11ЛИГАНДЫ
Лигандами могут быть различные неорганические и органические ионы и молекулы.
Важнейшими лигандами являются ионы CN-, F- , Cl-, Br-, I-,
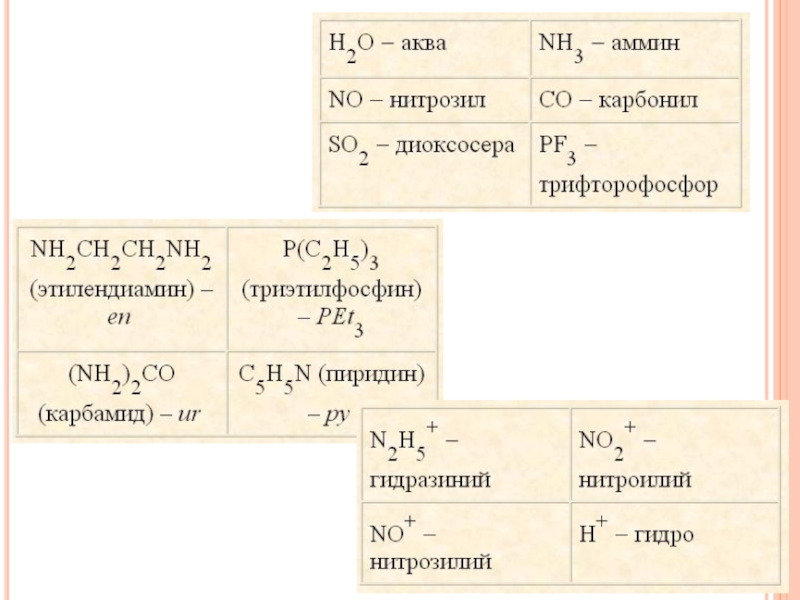
NO2-, OH-, SO3S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, карбамида (NH2)2CO, органических соединений – этилендиамина NH2CH2CH2NH2, a-аминоуксусной кислоты NH2CH2COOH и этилендиаминтетрауксусной кислоты (ЭДТА):Слайд 12 Координационным числом называют число атомов лигандов, непосредственно присоединенных
к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» –
зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин (py), другие полярные молекулы, однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют многодентатными: NH2–CH2–CH2–NH2 (en) – этилендиамин, NH2–CH2–COO– (gly) – глицинат.Слайд 15Классификация комплексных соединений
По заряду комплекса
Катионные комплексы
[Zn(NH3)4]Cl2
[Co(NH3)6]Cl2
Анионные комплексы
K2[BeF4] Li[AlH4]
Нейтральные комплексы
[Ni(CO)4]
[Pt(NH3)2Cl2]
По
природе лиганда
Аммиакаты
[Pt(NH3)6]Cl4
Аквакомплексы
[Co(H2O)6]Cl2
Гидроксокомплексы
Na2[Zn(OH)4]
Ацидокомплексы
K2[PtCl4]
Слайд 16Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть
— анион, затем положительную часть — катион.
2) Название комплексной части
прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl- - хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды - аква, для оксида углерода (II) — карбонил.
Слайд 173) Затем называют комплексообразователь, используя корень его латинского названия и
окончание -ат, после чего римскими цифрами указывают (в скобках) степень
окисления комплексообразователя.4) После обозначения состава внутренней сферы называют внешнюю сферу.
5) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
K3[Fe(CN)6]- гексоцианоферрат (III) калия
[Li(H2O)4]NO3 - нитрат тетрааквалития
[Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт
Слайд 18 Название комплексного соединения электролита начинается с аниона, употребляемого
в именительном падеже, затем следует название катиона в родительном падеже.
Число лигандов каждого вида обозначается греческими приставками ди-, три-тетра-, пента-, гекса-. Название комплексного аниона составляется из перечисления лигандов, корня латинского наименования центрального атома и суффикса -ат; в скобках римской цифрой обозначается степень его окисления или заряд координационного иона.Слайд 21K2[CuCl4]
[Cr(H2O)6]Cl3
[Co(NO2)2(NH3)4]Cl
[PtCl4(H2O)2]
[Cr(NH3)6][Fe(CN)6]
K3[AlF6]
К3[Fe(CN)6]
K4[Fe(CN)6]
[CoN3(NH3)5]SO4
Слайд 22Na3[Ag(S2O3)2]
[Ru(HSO3)2(NH3)4]
[CrCl2(NH3)4]Cl
K4[Ni(CN)4]
[Cu(NH3)2]OH
[Co(H2O)6]Cl2
K[AgF4]
K[Au(OH)4]
K2[Cr(CN)2O2(O2)NH3]
Слайд 23Напишите формулы комплексных соединений:
Дицианоаргентат калия
Гексанитрокобальтат (III) калия
Хлорид гексаамминникеля (II)
Гексацианохромат (III)
натрия
Бромид гексаамминкобальта (III)
Сульфат тетраамминкарбонатхрома (III)
Нитрат диакватетраамминникеля (II)
Трифторогидроксобериллат магния
Слайд 24Виды
Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные
[Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
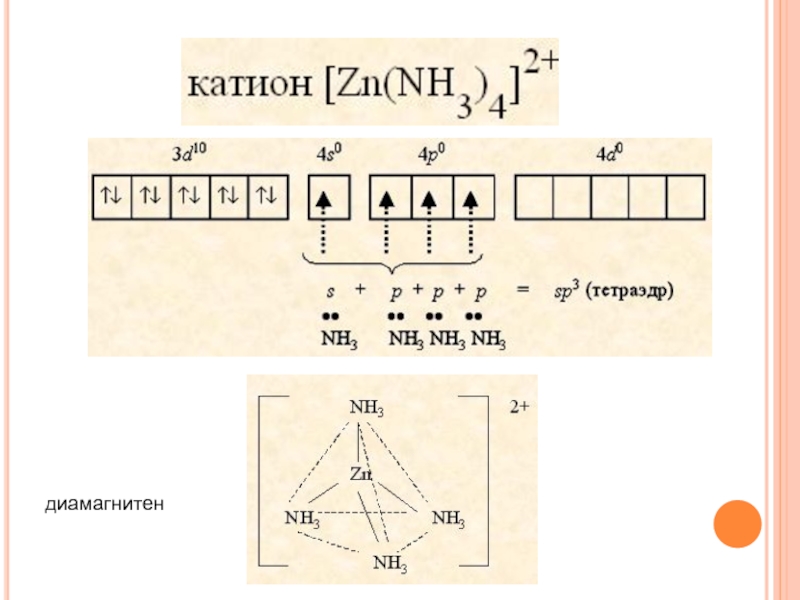
Слайд 25Положения метода валентных связей
1. В комплексе связь
между комплексообразователем
и лигандами координационная (ковалентная, донорно-
акцепторная).
Ионы
внешней и внутренней сферы связаны ионной связью.
Донор электронов - лиганд с неподеленными электронными парами.
Акцептор электронов – комплексообразователь со свободными орбиталями.
Степень перекрывания орбиталей - мера прочности связи.
2. В образовании связей участвуют гибридизованные
орбитали комплексообразователя, что определяет геометрию комплекса.
3. Магнитные свойства определяются наличием неспаренных электронов.
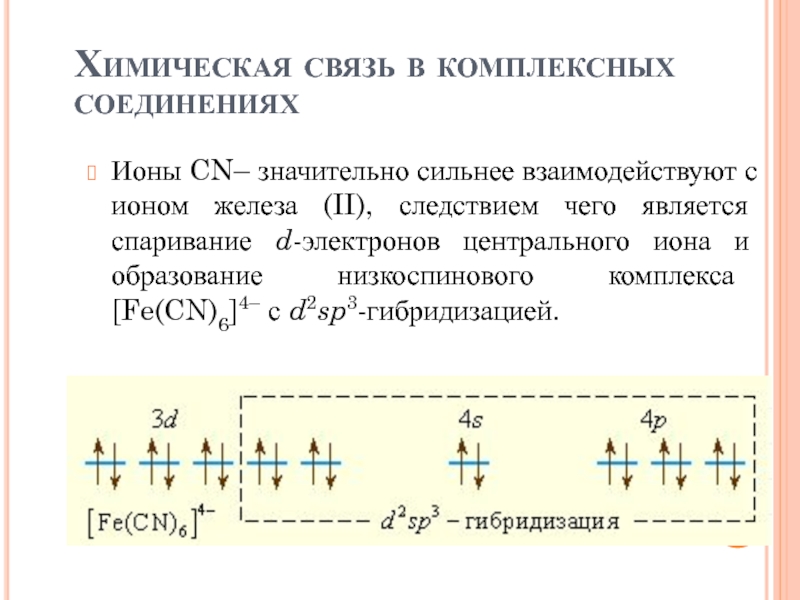
Слайд 34Химическая связь в комплексных соединениях
Ионы CN– значительно сильнее взаимодействуют с
ионом железа (II), следствием чего является спаривание d-электронов центрального иона
и образование низкоспинового комплекса [Fe(CN)6]4– с d2sp3-гибридизацией.Слайд 37Изомерия комплексных соединений
Гидратная (сольватная) изомерия обусловлена различным
расположением молекул воды и анионных лигандов между внутренней и внешней
сферами. Например, CrCl3∙6H2O существует по крайней мере в трех изомерных формах: [Cr(H2O)6]Cl3– фиолетового цвета, [CrCl(H2O)5]Cl2∙H2O –сине-зеленого цвета, [CrCl2(H2O)4]Cl∙2H2O –– зеленого цвета.Слайд 38Изомерия комплексных соединений
Ионизационная изомерия характеризуется различным распределением ионов
между внешними и внутренними сферами комплексных соединений и, как следствие
этого, различным характером диссоциации на ионы. Например, для соединения CoBrSO4∙5NH3 известны два изомера: [CoBr(NH3)5]SO4 – красно-фиолетового цвета и [CoSO4(NH3)5]Br – красного цвета.Слайд 39Изомерия комплексных соединений
Координационная изомерия заключается в различном распределении
лигандов во внутренних координационных сферах.
По-разному взаимодействуют с AgNO3 два
изомера – [Co(NH3)6]∙[Cr(CN)6] и [Cr(NH3)6]∙[Co(CN)6]. Первое соединение дает осадок Ag3[Cr(CN)6], а второе – осадок Ag3[Co(CN)6].Слайд 40Изомерия комплексных соединений
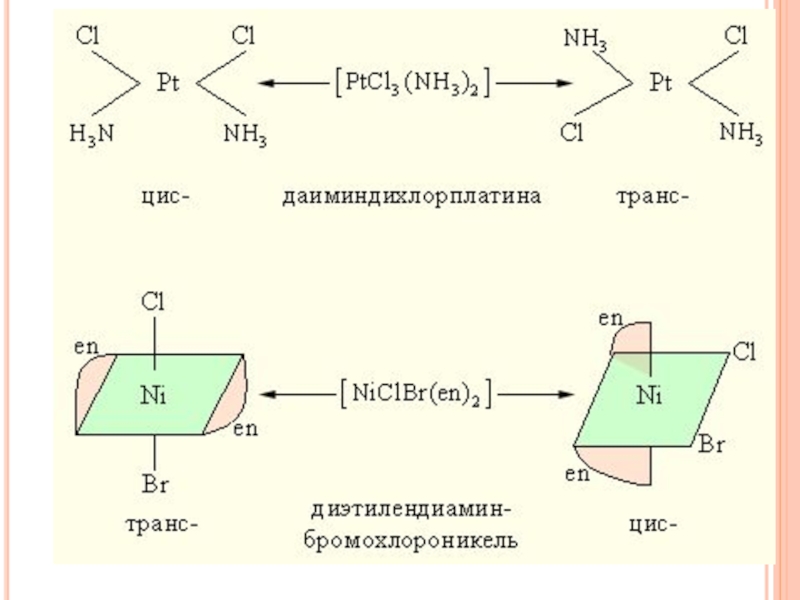
Геометрическая изомерия (цис-транс изомерия) состоит в
различном пространственном расположении лигандов вокруг центрального атома. Так, [PtCl2(NH3)2] существует
в виде двух изомерных форм, отличающихся друг от друга рядом свойств.Слайд 42Изомерия комплексных соединений
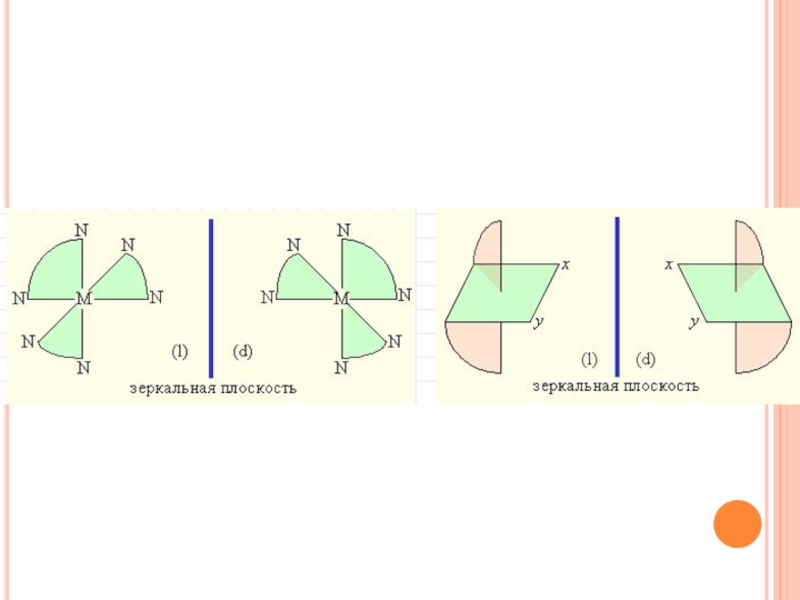
Оптическая изомерия. Оптическая изомерия характеризуется способностью
вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от
друга направлением вращения плоскости поляризации: один называют правым, другой – левым изомером. Правые и левые изомеры оказываются зеркальными изображениями друг друга и не могут быть совмещены в пространстве.Из двух геометрических изомеров диэтилендиаминбромохлороникеля (II) только цис-изомер может существовать в виде двух оптических модификаций. Изомеры такого рода называются энантиомерами.
Слайд 44Изомерия комплексных соединений
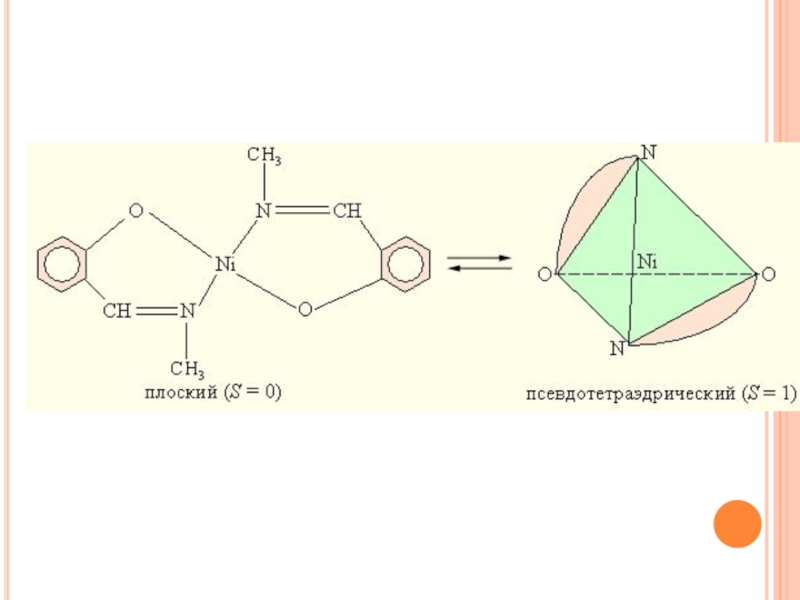
Структурная изомерия. Структурными называют такие координационные
изомеры, в которых происходит изменение симметрии (стереохимии) координационной сферы. Так,
у бис (N-метилсалицилиденамината) никеля (II) наблюдается равновесие между плоским и псевдотетраэдрическим строением.Слайд 46Устойчивость координационных соединений в растворах
Химические свойства комплексного
иона с известной электронной конфигурацией и геометрическим строением определяются двумя
факторами: а) способностью равновесной системы при определенных условиях к превращениям; б) скоростью, с которой могут происходить превращения, ведущие к достижению равновесного состояния системы.Слайд 48K3[Fe(CN)6] ↔ K+ + [Fe(CN)6]3-
[Ag(NH3)2]Cl
[Ag(NH3)2]+ + Cl-Диссоциация КС
по внешней сфере
(первичная диссоциация)
Слайд 49[Ag(NH3)2]+ [Ag(NH3)]+ + NH3
[Ag(NH3)2]+
Ag+ + 2 NH3
Диссоциация КС по внутренней
сфере(вторичная диссоциация)
Слайд 52Реакции с участием комплексных соединений
Реакции с
участием координационных соединений делятся на четыре основных типа: 1) присоединение, замещение
или отщепление лиганда; 2) изомеризации координационного полиэдра; 3) реакции связанного лиганда; и 4) реакции электронного переноса.Слайд 53 Комплексные ионы участвуют в реакциях обмена с образованием
более прочного или менее растворимого соединения:
Здесь M =
Ni2+, Cu2+, Fe2+.Слайд 54Присоединение, замещение или отщепление лиганда
1а. Присоединение лиганда сопровождается изменением степени
окисления реагирующих центрального атома и лигандов
или с их
сохранением
1б. Замещение лиганда с разрывом связи металл–донорный атом кинетически совпадает с повышением их констант образования.
1в. Отщепление лиганда с разрывом связи сопровождается внутримолекулярным окислительно-восстановительным взаимодействием
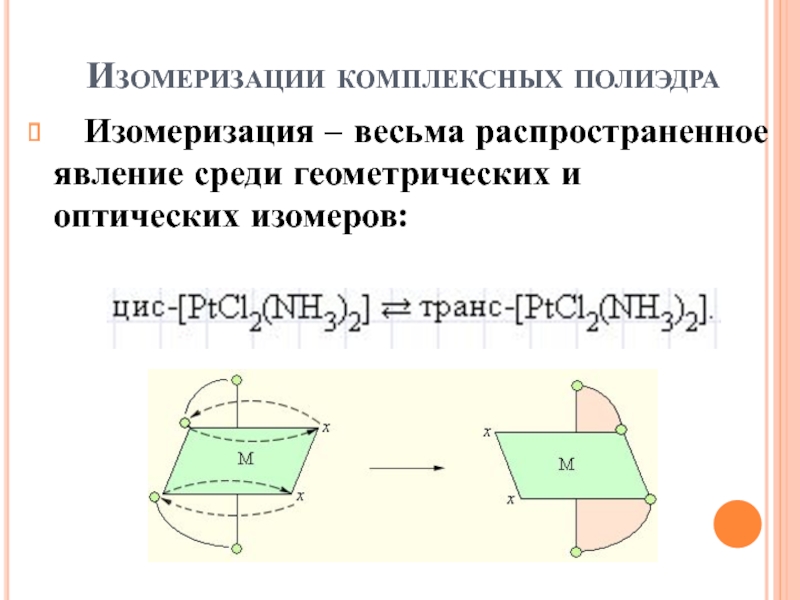
Слайд 55Изомеризации комплексных полиэдра
Изомеризация – весьма распространенное явление среди
геометрических и оптических изомеров:
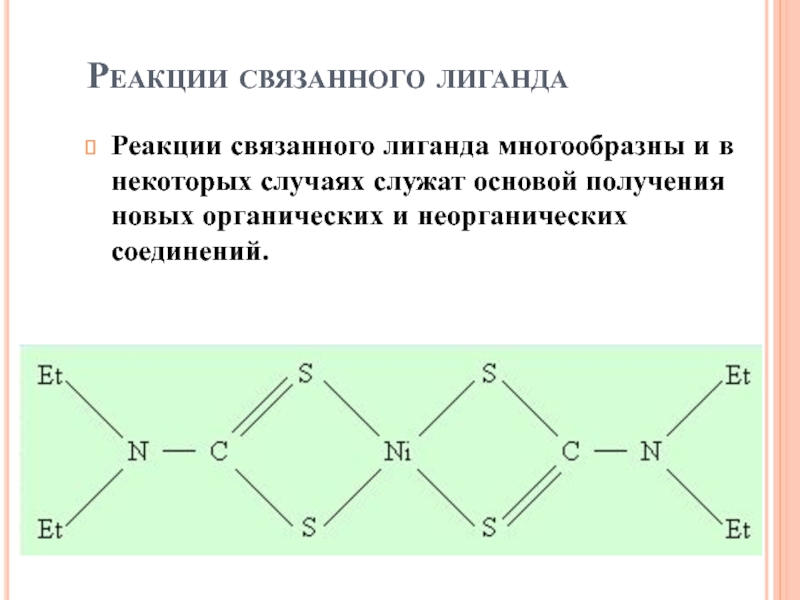
Слайд 56Реакции связанного лиганда
Реакции связанного лиганда многообразны и в некоторых случаях
служат основой получения новых органических и неорганических соединений.
Слайд 57Реакции электронного переноса
Реакции электронного переноса сопровождаются изменением степени
окисления центрального иона и вызваны образованием более устойчивых электронных конфигураций
за счет увеличения энергии стабилизации кристаллическим полем (ЭСКП).Слайд 58
Процессы образования и разрушения комплексов используются:
- в аналитической химии;
-
при выделении химических элементов;
- в гальванотехнике;
- в борьбе с коррозией
металлов;- в производстве ядерного горючего;
- в практике дезактивации;
- при индикации токсических соединений
при производстве веществ с заранее заданными свойствами в качестве катализаторов и т.д.





![Комплексные (координационные) соединения Строение комплексных соединенийКалий гексацианоферрат (III)Fe3+CN-CN-CN-CN-CN-CN-K+K+K+ Ион комплексообразователялигандыВнутренняя сфераВнешняя сфера[ (CN)6]К3Fe→3K+→ [Fe (CN)6]3- Строение комплексных соединенийКалий гексацианоферрат (III)Fe3+CN-CN-CN-CN-CN-CN-K+K+K+ Ион комплексообразователялигандыВнутренняя сфераВнешняя](/img/tmb/3/297384/001dce0fc55ad3f9c20b7efe5311e031-800x.jpg)


![Комплексные (координационные) соединения Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками Система комплексообразователь–лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6],](/img/tmb/3/297384/9a75bbe352fd733f40b62bf5625840e0-800x.jpg)
![Комплексные (координационные) соединения В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II),](/img/thumbs/97f983c6a9032b8ee6cba49c42b76e0c-800x.jpg)



![Комплексные (координационные) соединения Классификация комплексных соединенийПо заряду комплексаКатионные комплексы[Zn(NH3)4]Cl2[Co(NH3)6]Cl2Анионные комплексыK2[BeF4] Li[AlH4]Нейтральные комплексы[Ni(CO)4][Pt(NH3)2Cl2] По природе лигандаАммиакаты[Pt(NH3)6]Cl4 Аквакомплексы[Co(H2O)6]Cl2ГидроксокомплексыNa2[Zn(OH)4] АцидокомплексыK2[PtCl4] Классификация комплексных соединенийПо заряду комплексаКатионные комплексы[Zn(NH3)4]Cl2[Co(NH3)6]Cl2Анионные комплексыK2[BeF4] Li[AlH4]Нейтральные комплексы[Ni(CO)4][Pt(NH3)2Cl2] По природе лигандаАммиакаты[Pt(NH3)6]Cl4 Аквакомплексы[Co(H2O)6]Cl2ГидроксокомплексыNa2[Zn(OH)4] АцидокомплексыK2[PtCl4]](/img/thumbs/f9232b29e7e38d40880f22e72170cc97-800x.jpg)




![Комплексные (координационные) соединения K2[CuCl4] [Cr(H2O)6]Cl3 [Co(NO2)2(NH3)4]Cl [PtCl4(H2O)2] [Cr(NH3)6][Fe(CN)6] K3[AlF6]К3[Fe(CN)6]K4[Fe(CN)6][CoN3(NH3)5]SO4 K2[CuCl4] [Cr(H2O)6]Cl3 [Co(NO2)2(NH3)4]Cl [PtCl4(H2O)2]](/img/tmb/3/297384/96e40a33f451a6aa582fe2e97847457e-800x.jpg)
![Комплексные (координационные) соединения Na3[Ag(S2O3)2][Ru(HSO3)2(NH3)4][CrCl2(NH3)4]ClK4[Ni(CN)4][Cu(NH3)2]OH[Co(H2O)6]Cl2K[AgF4]K[Au(OH)4]K2[Cr(CN)2O2(O2)NH3] Na3[Ag(S2O3)2][Ru(HSO3)2(NH3)4][CrCl2(NH3)4]ClK4[Ni(CN)4][Cu(NH3)2]OH[Co(H2O)6]Cl2K[AgF4]K[Au(OH)4]K2[Cr(CN)2O2(O2)NH3]](/img/thumbs/2577476b1919f4faab05179612f36c87-800x.jpg)

![Комплексные (координационные) соединения Виды Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2]. Виды Комплексные соединения бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].](/img/thumbs/b3ca893e88a923b3520a72fd01040e3a-800x.jpg)




![Комплексные (координационные) соединения Квадратный комплекс [Pt(NH3)2Cl2] Квадратный комплекс [Pt(NH3)2Cl2]](/img/tmb/3/297384/497759afa99010bf52cde88ffa5c4c93-800x.jpg)
![Комплексные (координационные) соединения Октаэдрический комплексный ион [CoF6]3- Октаэдрический комплексный ион [CoF6]3-](/img/thumbs/13c8a0f4ee09bab6fd88d99f6967d586-800x.jpg)
![Комплексные (координационные) соединения Химическая связь в координационных соединениях Образование парамагнитного иона [FeF6]4– Химическая связь в координационных соединениях Образование парамагнитного иона [FeF6]4–](/img/thumbs/4ea06f8055f01f21c19672b22e2d72f0-800x.jpg)







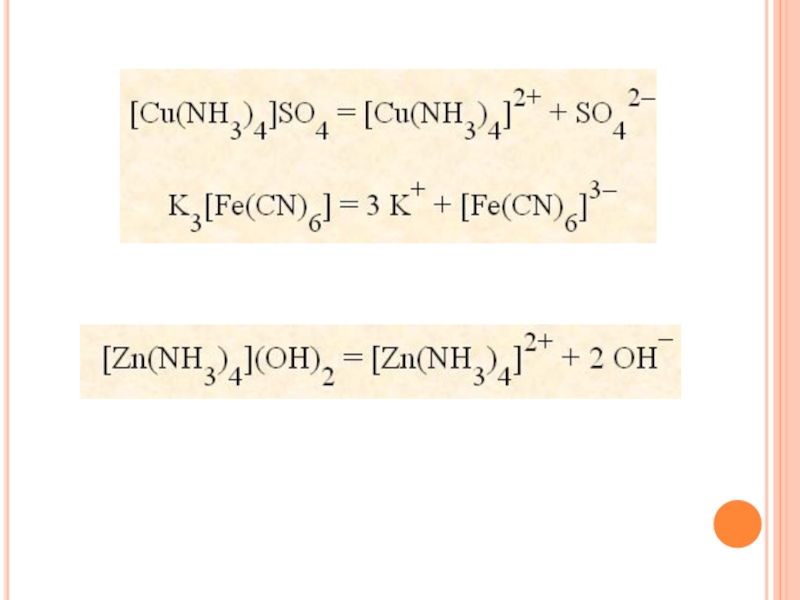
![Комплексные (координационные) соединения K3[Fe(CN)6] ↔ K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl K3[Fe(CN)6] ↔ K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl](/img/thumbs/150520baf741567a7797d3a04deb2e8d-800x.jpg)
![Комплексные (координационные) соединения [Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)2]+ Ag+ + 2 [Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)2]+ Ag+ + 2 NH3Диссоциация](/img/thumbs/a1157197c826765b445feed1b0aacbca-800x.jpg)
![Комплексные (координационные) соединения Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе](/img/tmb/3/297384/8d03b19faad3bca0efecbab2e306f68a-800x.jpg)