Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
Содержание
- 1. Комунальний заклад Бердянський медичний коледж Запорізької обласної ради
- 2. До головної підгрупи VІІ групи періодичної
- 3. Хлор застосовують для обеззараження води. Йод
- 4. Сполучення галогенів з киснем загальної формули Х2О,
- 5. Кислота хлороводнева концентрована (ДФУ)(Acidum hydrochloridum concentratum)Кислота хлористоводнева
- 6. Добування. Промисловий спосіб: прямий синтез з водню
- 7. Властивості. Обидві речовини — безбарвні прозорі
- 8. Ідентифікація. 1. Розчин лікарської речовини дає характерну
- 9. Хлориди взаємодіють з калію дихроматом у
- 10. Специфічні домішки. Вільний хлор. визначають за
- 11. Кількісне визначення. 1. Алкаліметрія, пряме титрування,
- 12. Натрію хлорид(Natrіi chloridum)NaCl
- 13. Добування. NaCl ─ єдиний з галогеноїдів,
- 14. Ідентифікація. 1. Реакції на іони Na+:а)
- 15. Випробування на чистоту. Броміди визначають спектрофотометрично
- 16. Оскільки іони натрію та калію є
- 17. 2. Аргентометрія за методом Мора, пряме
- 18. Точку еквівалентності також можна встановлювати
- 19. Дякую за увагу !
- 20. Скачать презентанцию
До головної підгрупи VІІ групи періодичної системи входять галогени: фтор, хлор,бром, йод. Вони зустрічаються у природі. Фтор, бром, йод у числі 15 мікроелементів входять в состав нашого організму. У молекулярній
Слайды и текст этой презентации
Слайд 1Комунальний заклад «Бердянський медичний коледж» Запорізької обласної ради лекція з ФАРМАЦЕВТИЧНОЇ
Слайд 2
До головної підгрупи VІІ групи періодичної системи входять галогени:
фтор, хлор,бром, йод. Вони зустрічаються у природі. Фтор, бром, йод
у числі 15 мікроелементів входять в состав нашого організму. У молекулярній формі жоден з галогенів в природі не зустрічається, тому що їх молекули мають дуже високу реакційну здатність.У більшості своїх сполучень галогени одновалентні. Являються окисниками. По мірі зростання атомної маси зменшуються окисні здібності.
Будучи окисниками, галогени застосовуються в медицині як дезінфікуючі речовини. Однак фтор і бром дуже токсичні і в медицині не застосовуються.
Слайд 3
Хлор застосовують для обеззараження води. Йод ─ єдиний з
галогенів є фармацевтичним препаратом і у вигляді спиртових розчинів (5
і 10 %) застосовується у медицині.Всі галогени мають дуже різкий, подразнюючий запах. Частіше галогени застосовується у медицині у вигляді сполучень з іншими елементами. З цих сполучень значення для медицини мають:
Сполучення галогенів з воднем ─ галогеноводні кислоти (HCl, HBr, HI). Значення для медицини має хлороводнева (соляна) кислота. Це єдина мінеральна кислота, яка постійно є у вільному стані в шлунковому соку людини та тварин, де її концентрація близько 0,3 %. Вона перетворює фермент ─ пепсин в активну форму, знищує патогенні та гнилісні бактерії.
Слайд 4
Сполучення галогенів з киснем загальної формули Х2О, тобто оксиди ,
які з водою дають відповідно хлорнуватисту, бромнуватисту, йоднуватисту кислоти:
Cl2O
2HClOBr2O + H2O 2HBrO
I2O 2HIO
Cолі цих кислот, головним чином хлорнуватистої (NaOCl, KOCl) являються фармацевтичними препаратами і називаються гіпохлоритами.
Сполучення галогенів з лужними металами ─ галогениди (NaCl, KCl, NaBr, KBr, NaI, KI).
Слайд 5Кислота хлороводнева концентрована (ДФУ)
(Acidum hydrochloridum concentratum)
Кислота хлористоводнева розведена (Eur. Ph.)
(Acidum
hydrochloridum dilutum)
Кислота хлоридна
HC1 М.м. 36,46Слайд 6
Добування. Промисловий спосіб: прямий синтез з водню та хлору, які
утворюються при електролізі розчину натрію хлориду:
Схему процесу
електролізу можна подати рівнянням:Обидва гази (водень і хлор) спалюють у контактних печах:
Отриманий хлороводень НС1 пропускають крізь поглинальні башти з водою, в результаті чого утворюється хлороводнева кислота з концентрацією 35—36 % (яка димить).
Слайд 7
Властивості. Обидві речовини — безбарвні прозорі рідини, зі своєрідним
запахом, кислим смаком; змішуються з водою та спиртом у всіх
співвідношеннях з утворенням розчинів сильно кислої реакції.Маючи однакові властивості, розрізняються лише за вмістом хлороводню й відповідно за густиною.
Кислота хлористоводнева концентрована повинна містити хлороводню в межах 35,0-39,0 %, відносна густина становить близько 1,18.
Кислота хлористоводнева розведена містить хлороводню в межах 9,5-10,5 %.
Слайд 8Ідентифікація.
1. Розчин лікарської речовини дає характерну реакцію на хлорид-іони:
Білий осад аргентуму хлориду розчиняється в розчині амоніаку:
2.
При нагріванні лікарського засобу з мангану диоксидом виділяється вільний хлор, який виявляють за запахом:3. Водний розчин субстанції повинен мати сильно кислу реакцію (за кольором індикатора).
4. Реакція сухої речовини з калію дихроматом і кислотою сульфатною - папір, просочений розчином дифенілкарбазиду, забарвлюється у фіолетово-червоний колір.
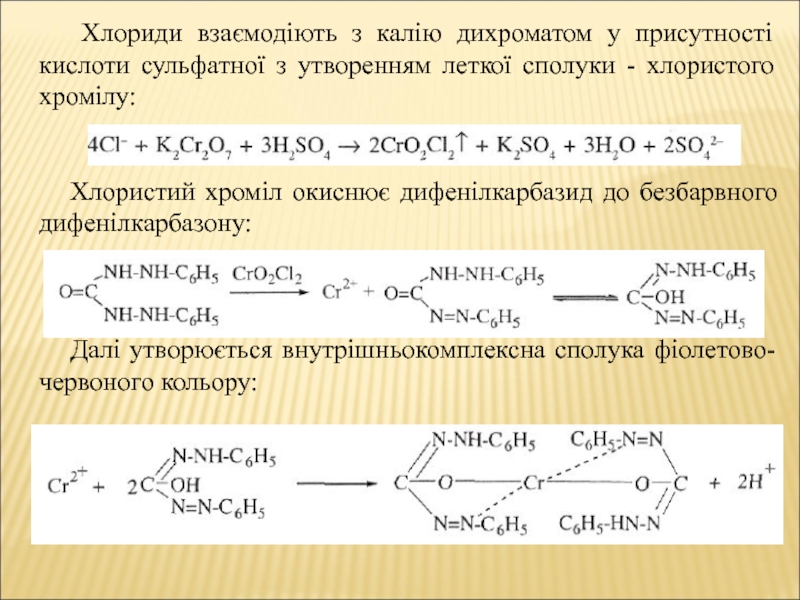
Слайд 9 Хлориди взаємодіють з калію дихроматом у присутності кислоти сульфатної
з утворенням леткої сполуки - хлористого хромілу:
Хлористий хроміл окиснює дифенілкарбазид
до безбарвного дифенілкарбазону:Далі утворюється внутрішньокомплексна сполука фіолетово-червоного кольору:
Слайд 10 Специфічні домішки.
Вільний хлор. визначають за реакцією з калію
йодидом у присутності розчину крохмалю:
Протягом 2 хвилин блакитне забарвлення розчину
має зникати при додаванні 0,2 мл 0,01 М розчину натрію тіосульфату.Сульфати. Субстанцію упарюють насухо з натрію гідрокарбонатом, після чого проводять випробування на сульфати.
Слайд 11
Кількісне визначення. 1. Алкаліметрія, пряме титрування, індикатор — метиловий
червоний, Е= М.м.:
2. Кількісний вміст хлороводню можна визначити також за
густиною.Зберігання. У склянках з притертими пробками при кімнатній температурі.
Застосування. Внутрішньо в краплях або у вигляді мікстури (частіше з пепсином) при недостатній кислотності шлункового соку.
Слайд 13
Добування. NaCl ─ єдиний з галогеноїдів, який широко розповсюджений
у природі у вигляді масивних відкладень каменої солі. Вона і
є основним джерелом для добування фармакопейного препарату. Водні розчини випаровують, після чого NaCl підвергають очищенню від супровідних його домішок. Далі NaCl перекристалізовують з води насиченою концентрованою хлороводневою кислотою, у котрій він погано розчинен.Властивості. Безбарвні кристали або білі кристалічні порошки без запаху, солоного смаку. Розчинні в 3 частинах води, нерозчинні в 95 %-ному спирті.
Слайд 14
Ідентифікація.
1. Реакції на іони Na+:
а) з розчином калію
піроантимонату (калію гексагідроксости-біату (V)) - утворюється білий осад:
б) з розчином
реактиву метоксифенілоцтової кислоти – утво-рюється об'ємний білий кристалічний осад:Осад розчиняється при додаванні розчину амоніаку розведеного і не випадає знову при наступному додаванні розчину амонію карбонату.
в) сіль натрію, змочена кислотою хлористоводневою розведеною і внесена в безбарвне полум'я, забарвлює його у жовтий колір.
2. Реакції на іони С1─(див. НCl)
Слайд 15
Випробування на чистоту.
Броміди визначають спектрофотометрично після окиснення хлораміном
у присутності фенолового червоного і натрію тіосульфату (у випадку присутності
йодидів). Оптична густина одержаного розчину не повинна перевищувати оптичну густину еталону.Йодиди визначають з розчином натрію нітриту в кислому середовищі у присутності крохмалю; не повинне з'являтися блакитне забарвлення:
Барій визначають за реакцією з розчином кислоти сульфатної розведеної. Опалесценція одержаного розчину не повинна перевищувати опалесценцію суміші розчину S і води дистильованої.
Слайд 16
Оскільки іони натрію та калію є антагоністами, то в
солях натрію визначають домішки калію, а в солях калію —
домішки натрію методом атомно-емісійної спектрометрії.Такі домішки, як кальцій, залізо, тяжкі метали, сульфати, миш’як ДФУ допускає в межах еталонів, тому що допустима межа цих домішок не впливає на терапевтичний ефект і не викликає ніяких побічних явищ.
Кількісне визначення.
Аргентометрія за методом Фольгарда, зворотне титрування в присутності дибутилфталату, індикатор — феруму (III) амонію сульфат (залізоамонієвий галун), Е = М. м.:
Слайд 17
2. Аргентометрія за методом Мора, пряме титрування, індикатор —
калію хромат, Е= М. м.
Меркуриметрія, пряме титрування, індикатор — дифенілкар-базон
або дифенілкарбазид, Е = 2 М. м.:Слайд 18
Точку еквівалентності також можна встановлювати за допомогою натрію
нітропрусиду:
Кількісне визначення можна провести потенціометричним титруванням 0,1 М р-ном AgNO3
Зберігання. У добре закупореній тарі з темного скла.
Застосування. Для приготування ізотонічного розчину та інших сольових плазмозамінних розчинів для забезпечення постійного осмотичного тиску крові.