Слайд 1Кружок «Основы молекулярной генетики»
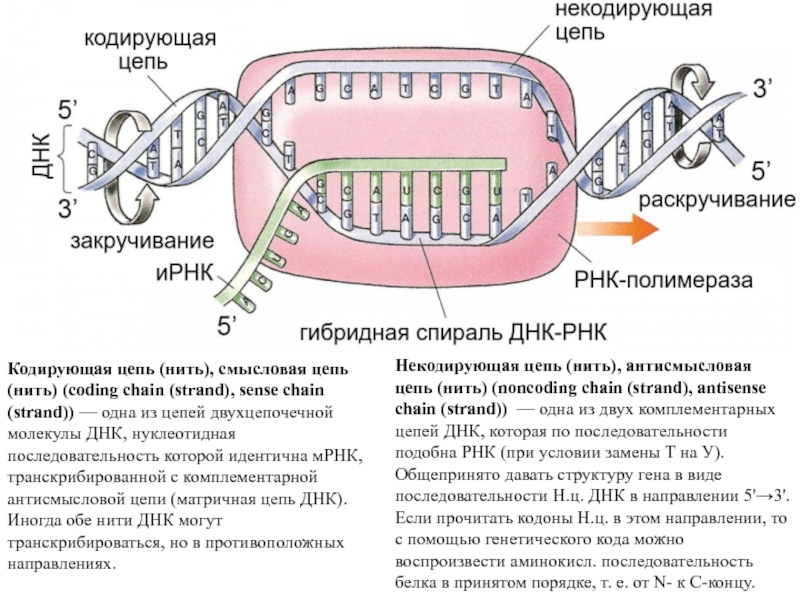
Слайд 2Некодирующая цепь (нить), антисмысловая цепь (нить) (noncoding chain (strand), antisense
chain (strand)) — одна из двух комплементарных цепей ДНК, которая
по последовательности подобна РНК (при условии замены T на У). Общепринято давать структуру гена в виде последовательности Н.ц. ДНК в направлении 5'→3'. Если прочитать кодоны Н.ц. в этом направлении, то с помощью генетического кода можно воспроизвести аминокисл. последовательность белка в принятом порядке, т. е. от N- к С-концу.
Кодирующая цепь (нить), смысловая цепь (нить) (coding chain (strand), sense chain (strand)) — одна из цепей двухцепочечной молекулы ДНК, нуклеотидная последовательность которой идентична мРНК, транскрибированной с комплементарной антисмысловой цепи (матричная цепь ДНК). Иногда обе нити ДНК могут транскрибироваться, но в противоположных направлениях.
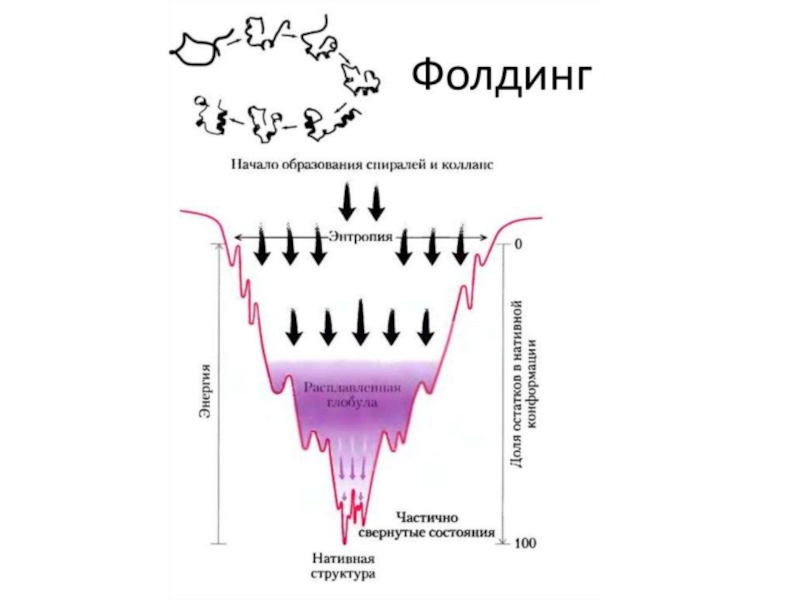
Слайд 4Общие представление о фолдинге белков
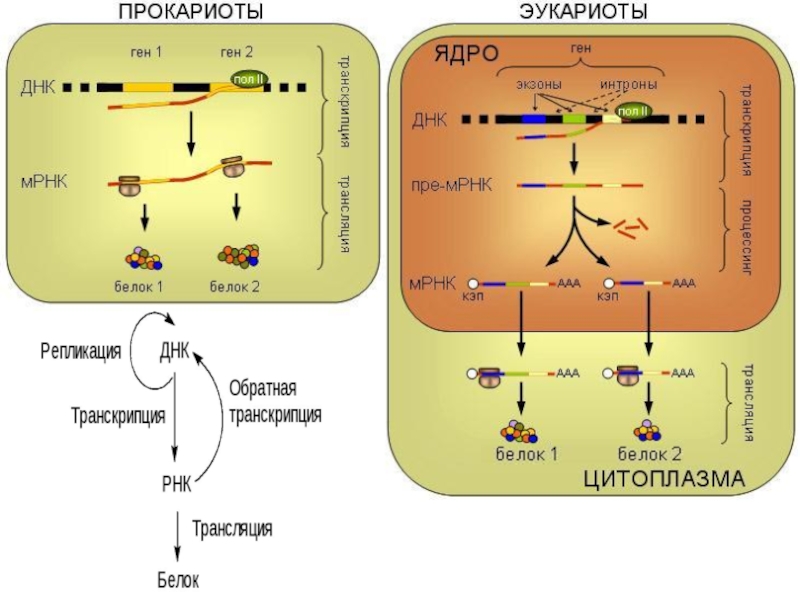
Трансляция мРНК приводит к образованию пептидной
цепи со строго определенной последовательностью аминокислот.
Далее происходит формирование белка- фолдинг,
т.е сворачивание пептидной цепи в правильную трехмерную структуру.
Если белок состоит их нескольких субъединиц, то фолдинг включает и объединение их в единую макромолекулу.
Слайд 5
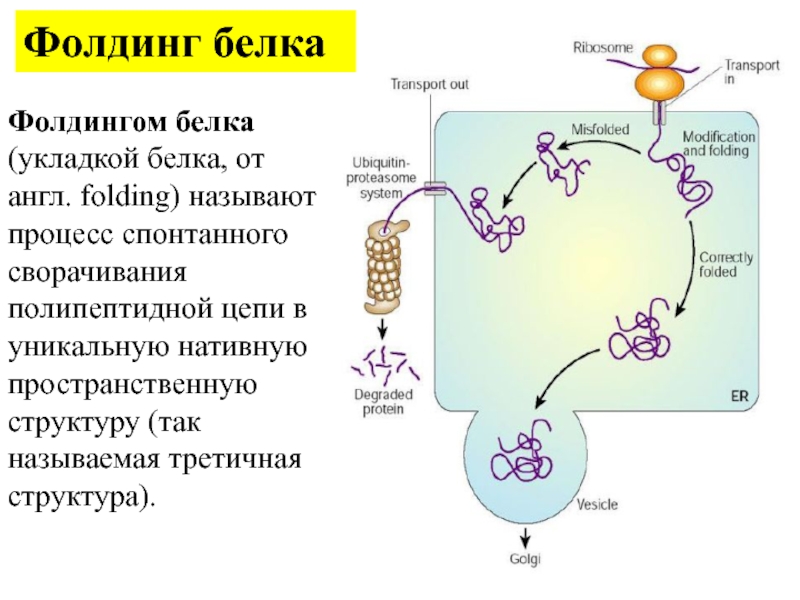
Фолдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного
сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая
третичная структура).
Фолдинг белка
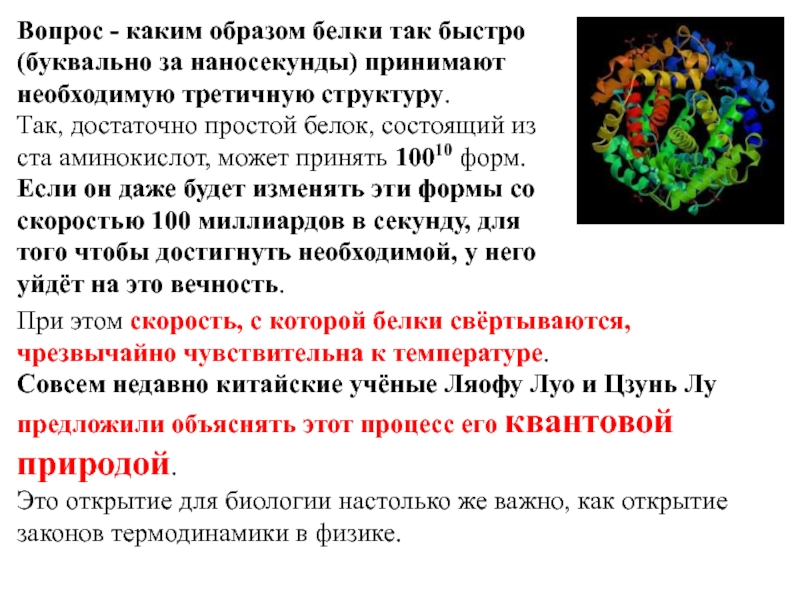
Слайд 6Вопрос - каким образом белки так быстро (буквально за наносекунды)
принимают необходимую третичную структуру.
Так, достаточно простой белок, состоящий из ста
аминокислот, может принять 10010 форм. Если он даже будет изменять эти формы со скоростью 100 миллиардов в секунду, для того чтобы достигнуть необходимой, у него уйдёт на это вечность.
При этом скорость, с которой белки свёртываются, чрезвычайно чувствительна к температуре.
Совсем недавно китайские учёные Ляофу Луо и Цзунь Лу предложили объяснять этот процесс его квантовой природой.
Это открытие для биологии настолько же важно, как открытие законов термодинамики в физике.
Слайд 8
•В фолдинге участвуют белки-шапероны.
•Большинство только что синтезированных белков может
сворачиваться при отсутствии шаперонов
•Шапероны — класс белков, главная функция
которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов.
Слайд 9•Многие шапероны являются белками теплового шока, то есть белками, экспрессия
которых начинается в ответ на рост температуры или другие клеточные
стрессы
•Белки теплового шока – Hsp (heat shock protein). Hsp60, Hsp70
•Шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы.
•Другие шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков
Слайд 10Деградация белков проходит по убиквитин-протеасомному пути (Аарон Чехоновер, Аврам Гершко
и Ирвин Роуз, 2004)
Деградация белка
Слайд 11•Убиквити́н (от англ. ubiquitous — вездесущий) — небольшой консервативный белок
•Убиквитинилирование — это посттрансляционное присоединение ферментами убиквитин-лигазами одного или нескольких
молекул убиквитина с помощью ковалентной связи к ε-NH2 группе остатков Лиз белка-мишени.
•Присоединение убиквитина влияет на внутриклеточную локализацию и функцию белков.
•Самым первым открытием стала деградация белков, помеченных мультиубиквитиновыми цепями, с помощью 26S- протеасомы.
•Система убиквитинилирования вовлечена в такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
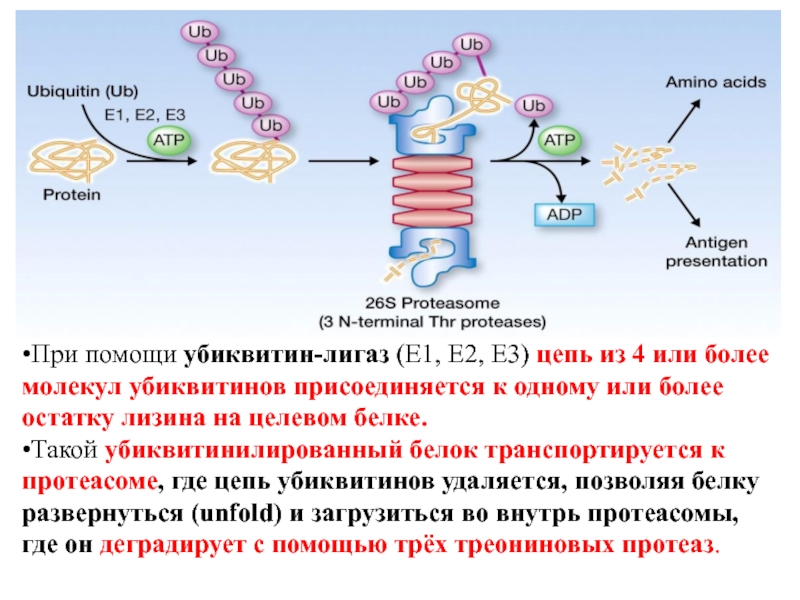
Слайд 12•При помощи убиквитин-лигаз (E1, E2, E3) цепь из 4 или
более молекул убиквитинов присоединяется к одному или более остатку лизина
на целевом белке.
•Такой убиквитинилированный белок транспортируется к протеасоме, где цепь убиквитинов удаляется, позволяя белку развернуться (unfold) и загрузиться во внутрь протеасомы, где он деградирует с помощью трёх треониновых протеаз.
Слайд 13•Протеасома (от англ. protease — протеиназа и лат. soma —
тело) — мультисубъединичная протеаза, присутствующая в клетках эукариот, архей и
некоторых бактерий.
•У эукариот протеасомы присутствуют в цитозоле и ядрах
•Протеасомы выделяют в виде индивидуальных частиц с коэффициентами седиментации 20S и 26S
•В человеческой клетке насчитывается около 30,000 протеасом
•Они неспецифично расщепляют белки до пептидов длинной 7-9 аминокислот.
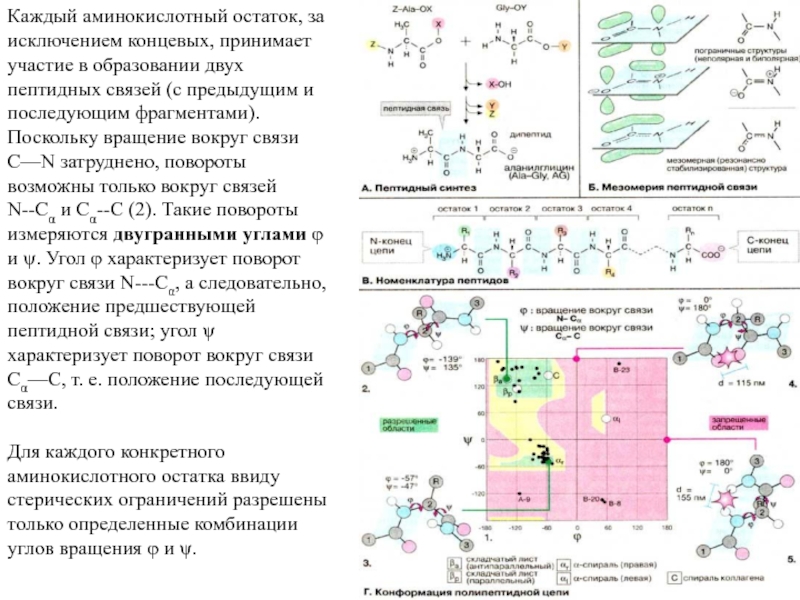
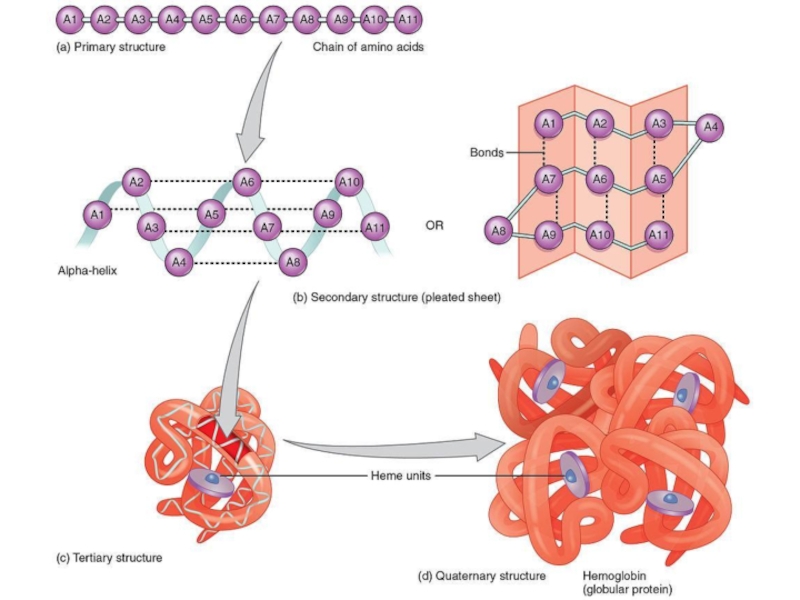
Слайд 14Каждый аминокислотный остаток, за исключением концевых, принимает участие в образовании
двух пептидных связей (с предыдущим и последующим фрагментами). Поскольку вращение
вокруг связи C—N затруднено, повороты возможны только вокруг связей N--Cα и Cα--C (2). Такие повороты измеряются двугранными углами φ и ψ. Угол φ характеризует поворот вокруг связи N---Cα, а следовательно, положение предшествующей пептидной связи; угол ψ характеризует поворот вокруг связи Сα—С, т. е. положение последующей связи.
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определенные комбинации углов вращения φ и ψ.
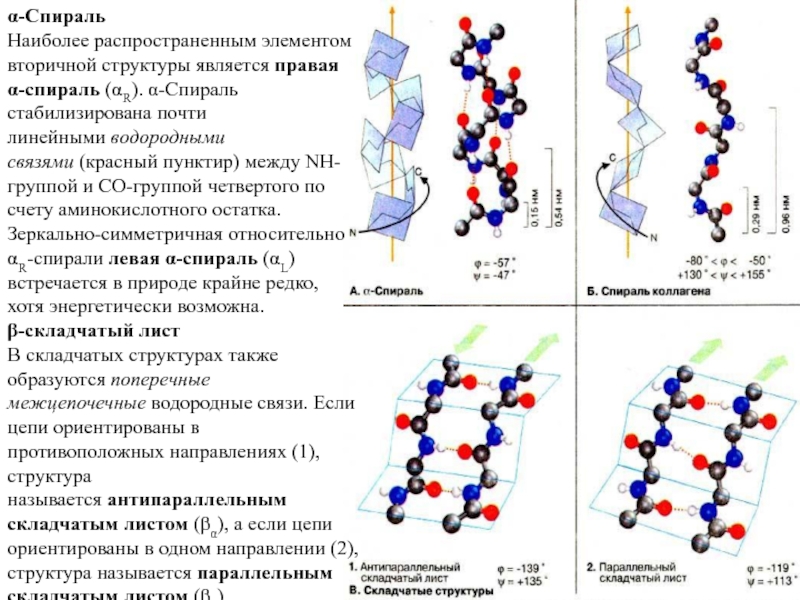
Слайд 15α-Спираль
Наиболее распространенным элементом вторичной структуры является правая α-спираль (αR). α-Спираль стабилизирована почти
линейными водородными связями (красный пунктир) между NH-группой и СО-группой четвертого по счету
аминокислотного остатка.
Зеркально-симметричная относительно αR-спирали левая α-спираль (αL) встречается в природе крайне редко, хотя энергетически возможна.
β-складчатый лист
B складчатых структурах также образуются поперечные межцепочечные водородные связи. Если цепи ориентированы в противоположных направлениях (1), структура называется антипараллельным складчатым листом (βα), а если цепи ориентированы в одном направлении (2), структура называется параллельным складчатым листом (βn).
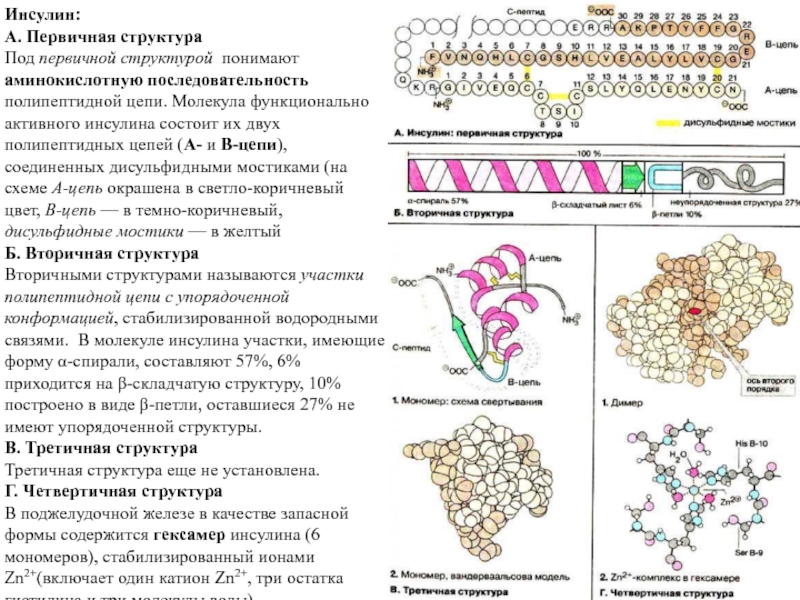
Слайд 16Инсулин:
А. Первичная структура
Под первичной структурой понимают
аминокислотную последовательность
полипептидной цепи. Молекула функционально
активного инсулина состоит их двух полипептидных цепей (А- и В-цепи), соединенных дисульфидными
мостиками (на схеме А-цепь окрашена в светло-коричневый цвет, B-цепь — в темно-коричневый,
дисульфидные мостики — в желтый
Б. Вторичная структура
Вторичными структурами называются участки полипептидной цепи с упорядоченной конформацией, стабилизированной водородными связями. В молекуле инсулина участки, имеющие форму α-спирали, составляют 57%, 6% приходится на β-складчатую структуру, 10% построено в виде β-петли, оставшиеся 27% не имеют упорядоченной структуры.
В. Третичная структура
Третичная структура еще не установлена.
Г. Четвертичная структура
В поджелудочной железе в качестве запасной формы содержится гексамер инсулина (6 мономеров), стабилизированный ионами Zn2+(включает один катион Zn2+, три остатка гистидина и три молекулы воды).
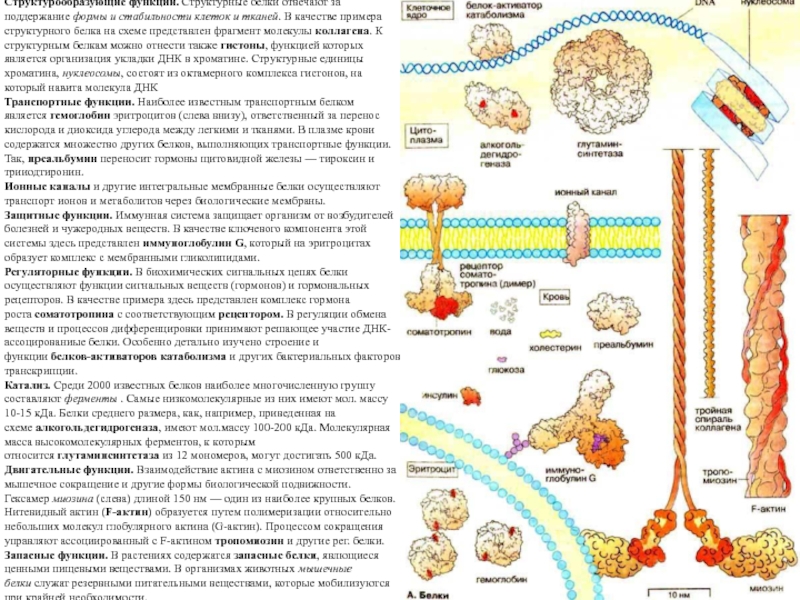
Слайд 18Структурообразующие функции. Структурные белки отвечают за поддержание формы и стабильности клеток и
тканей. В качестве примера структурного белка на схеме представлен фрагмент
молекулы коллагена. К структурным белкам можно отнести также гистоны, функцией которых является организация укладки ДНК в хроматине. Структурные единицы хроматина, нуклеосомы, состоят из октамерного комплекса гистонов, на который навита молекула ДНК
Транспортные функции. Наиболее известным транспортным белком является гемоглобин эритроцитов (слева внизу), ответственный за перенос кислорода и диоксида углерода между легкими и тканями. В плазме крови содержатся множество других белков, выполняющих транспортные функции. Так, преальбумин переносит гормоны щитовидной железы — тироксин и трииодтиронин.
Ионные каналы и другие интегральные мембранные белки осуществляют транспорт ионов и метаболитов через биологические мембраны.
Защитные функции. Иммунная система защищает организм от возбудителей болезней и чужеродных веществ. В качестве ключевого компонента этой системы здесь представлен иммуноглобулин G, который на эритроцитах образует комплекс с мембранными гликолипидами.
Регуляторные функции. В биохимических сигнальных цепях белки осуществляют функции сигнальных веществ (гормонов) и гормональных рецепторов. В качестве примера здесь представлен комплекс гормона роста соматотропина с соответствующим рецептором. В регуляции обмена веществ и процессов дифференцировки принимают решающее участие ДНК-ассоцированиые белки. Особенно детально изучено строение и функции белков-активаторов катаболизма и других бактериальных факторов транскрипции.
Катализ. Среди 2000 известных белков наиболее многочисленную группу составляют ферменты . Самые низкомолекулярные из них имеют мол. массу 10-15 кДа. Белки среднего размера, как, например, приведенная на схеме алкогольдегидрогеназа, имеют мол.массу 100-200 кДа. Молекулярная масса высокомолекулярных ферментов, к которым относится глутаминсинтетаза из 12 мономеров, могут достигать 500 кДа.
Двигательные функции. Взаимодействие актина с миозином ответственно за мышечное сокращение и другие формы биологической подвижности. Гексамер миозина (слева) длиной 150 нм — один из наиболее крупных белков. Нитевидный актин (F-актин) образуется путем полимеризации относительно небольших молекул глобулярного актина (G-актин). Процессом сокращения управляют ассоциированный с F-актином тропомиозин и другие рег. белки.
Запасные функции. В растениях содержатся запасные белки, явлющиеся ценными пищевыми веществами. В организмах животных мышечные белки служат резервными питательными веществами, которые мобилизуются при крайней необходимости.
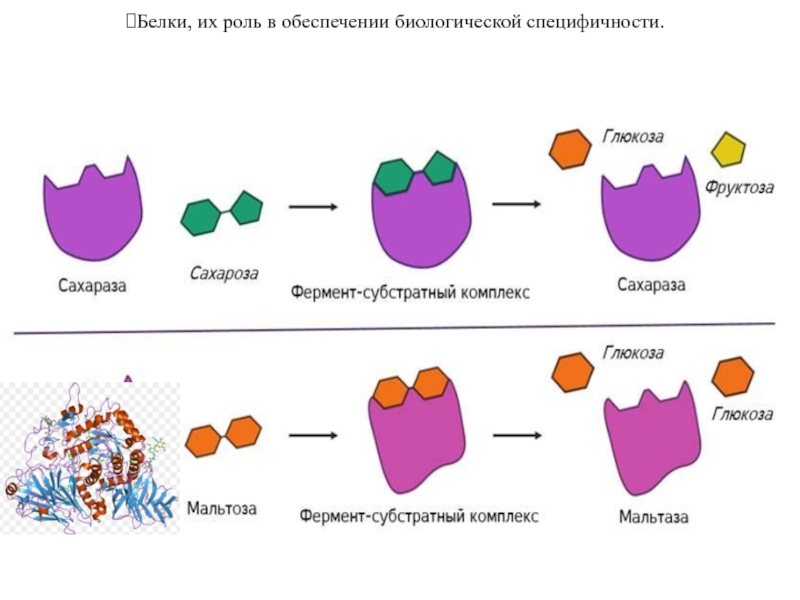
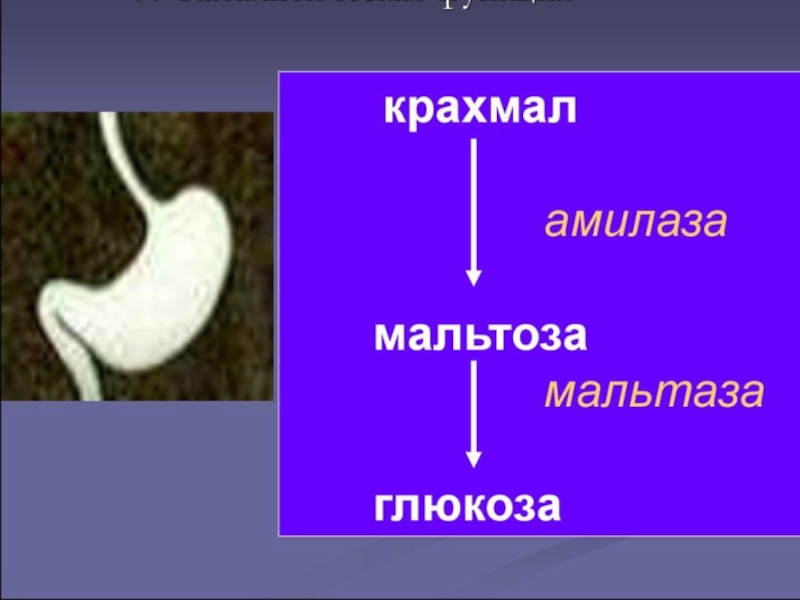
Слайд 20Белки, их роль в обеспечении биологической специфичности.
Слайд 28Генотип — это совокупность всех генов организма, являющихся его наследственной основой.
Фенотип —
совокупность всех признаков и свойств организма, которые выявляются в процессе
индивидуального развития в данных условиях и являются результатом взаимодействия генотипа с комплексом факторов внутренней и внешней среды.
Слайд 32ИЗУЧЕНИЕ ВКЛАДА ГЕНОВ СЕМЕЙСТВА ИНТЕРЛЕЙКИНА-1 (IL1RN, IL1B) НА ПРИМЕРЕ РАЗЛИЧНЫХ
МОДЕЛЕЙ ВОСПАЛЕНИЯ В ДЕТСКОМ ВОЗРАСТЕ