Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс лекций по дисциплине ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА Кафедра общей и
Содержание
- 1. Курс лекций по дисциплине ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА Кафедра общей и
- 2. 1. Коржуков Н.Г. Общая химия. 2001 г.2.
- 3. Лекция №1ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
- 4. ЗАКОН СОХРАНЕНИЯ МАССЫ ( открытие принадлежит М.В.Ломоносову
- 5. ЗАКОН ПОСТОЯНСТВА СОСТАВА (открыт французским химиком Прустом
- 6. Кислород (О) ~ 47% по массе;Кремний
- 7. Атомные и молекулярные массы 1
- 8. Относительная молекулярная масса равна сумме относительных масс
- 9. NA =12/(120,16610-23) = 6,022 1023 частиц
- 10. Количество вещества или число молей вещества ()
- 11. Стехиометрические соотношения в химииСтехиометрия – раздел химии,
- 12. Что такое эквивалент ?МэквО = 8 г/мольМэквН
- 13. NaOH
- 14. Газовые законыЗакон АвогадроНормальные условия (н.у.):Т°= 273,15К (0
- 15. Объединенный (универсальный) газовый законPV/ T= constPVм /
- 16. Определение молекулярной массы газа или пара2. Приводим
- 17. Закон парциальных давлений (закон Дальтона)Робщее =
- 18. Более подробные сведения о том, что такое
- 19. Дополнительные материалык лекциям по курсу«Химические основы производства»Лектор доценткандидат технических наукБрагазина Ольга Александровна
- 20. Лекция № 1ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
- 21. Эквивалент элемента (Э) – это такая масса
- 22. Массы реагирующих веществ относятся как их
- 23. H2SO4 + 2NaOH = Na2SO4 + 2H2OH2SO4
- 24. Cr(OH)3 + 3HCl = CrCl3 + 3H2OCr(OH)3
- 25. Na2CO3 + HCl = NaHCO3 + NaClNa2CO3
- 26. CO2 + NaOH = NaHCO3СО2 + 2NaOH
- 27. Современная трактовка понятия «Эквивалент»Эквивалентом называют реальную или
- 28. “Моль эквивалентов” (моль экв.) и “молярная масса
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Курс лекций по дисциплине
«ХИМИЧЕСКИЕ ОСНОВЫ ПРОИЗВОДСТВА»
Кафедра общей и неорганической химии
Читает
доцент, кандидат технических наук
Слайд 21. Коржуков Н.Г. Общая химия. 2001 г.
2. Коржуков Н.Г. Общая
и неорганическая химия. 2004 г.
3. Глинка Н.Л. Общая химия.
4. Неорганическая
химия. Сборник задач (№ 1996).5. Неорганическая химия. Лабораторный практикум (№698).
Литература
Слайд 4ЗАКОН СОХРАНЕНИЯ МАССЫ
( открытие принадлежит М.В.Ломоносову и Лавуазье)
2.
В химической реакции
H2 + Cl2 = 2HCl
Примеры:
1. В доменном процессе
m руды + топлива + воздуха =
= m чугуна + шлака + пыли + газа
В химико-металлургических процессах закон не знает отклонений
Слайд 5ЗАКОН ПОСТОЯНСТВА СОСТАВА
(открыт французским химиком Прустом в 1799
г.)
Пример:
ТiO2:
ТiO1,9-2,0.
Дальтониды и бертоллиды
2 H2 + O2 = 2 H2O
CuSO4
5H2O CuSO4 + 5H2OCH4 + 2O2 CO2 + 2H2O
H2O
11% Н
89% О
· · · · · · · · · · · ·
Слайд 6Кислород (О) ~ 47% по массе;
Кремний (Si) ~ 27%
Далее следуют: Al, Fe, Ca, Na, K, Mg, H
Распространенность элементов в природе
98 %
Все остальные элементы – 2 %
Например:
С –0,15 %; N – 0,04 %; S – 0,05 %
Слайд 7 Атомные и молекулярные массы
1 а.е.м. = 1/12
mC = 0,166 10-23 г
Абсолютная масса атома равна: Аr
· 1 а.е.м. Относительная атомная масса (Аr)
mAl = 4,5 10-23 г
mC = 2 10-23 г
mH2O = 3 10-23 г
Аr Аl = (4,510-23)/(0,166 10-23) = 27 а.е.м.
Слайд 8Относительная молекулярная масса равна сумме относительных масс атомов, входящих в
состав молекулы
Абсолютная масса молекулы равна: Мr · 1 а.е.м.
Относительная
молекулярная масса вещества (Мr)Мr Н2О = (3,010-23)/(0,166 10-23) = 18 а.е.м.
Mr(Н2О) = 2·1 + 16 = 18
Mr(Н2SО4) = 98
Слайд 9NA =12/(120,16610-23) = 6,022 1023 частиц -
- число (или постоянная) Авогадро моль-1
Что такое моль?
Молярная
масса (М) –масса 1 моля в-ва г/мольМ = Мr
M (Н2О) = 18 г/моль
M (Н2SО4) = 98 г/моль
m(молекулы Н2О) = М / NA = 18 / 6,02 · 1023 = 3 · 10-23 г
m(атома Al) = M / NA = 27 / 6,02 · 1023 = 4,5 · 10-23 г
Слайд 11Стехиометрические соотношения в химии
Стехиометрия – раздел химии, изучающий объемные и
массовые соотношения между реагирующими веществами.
4FeS + 7O2 = 2
Fе2O3 + 4 SO2Основной закон стехиометрии
Отношение количеств реагирующих веществ (в моль) равно отношению соответствующих коэффициентов в уравнении реакции
Слайд 12Что такое эквивалент ?
МэквО = 8 г/моль
МэквН = 1 г/моль
Мэкв
= Аr / B
9 е.м. Al – 1 е.м. H
Мэкв(Al)
= 9 г9 г Be – 25 г оксида Be
9 г Be — (25 – 9) г О
х г Вe — 8 г (О)
{
1моль экв. Ве — 4,5 г
FeCl2
Мэкв(Fe) = 56/2 = 28
FeCl3
Мэкв(Fe) = 56/3 19
SO2
8 : 8
Мэкв(S) = 8
SO3
5,3 : 8
Мэкв(S) = 5,3
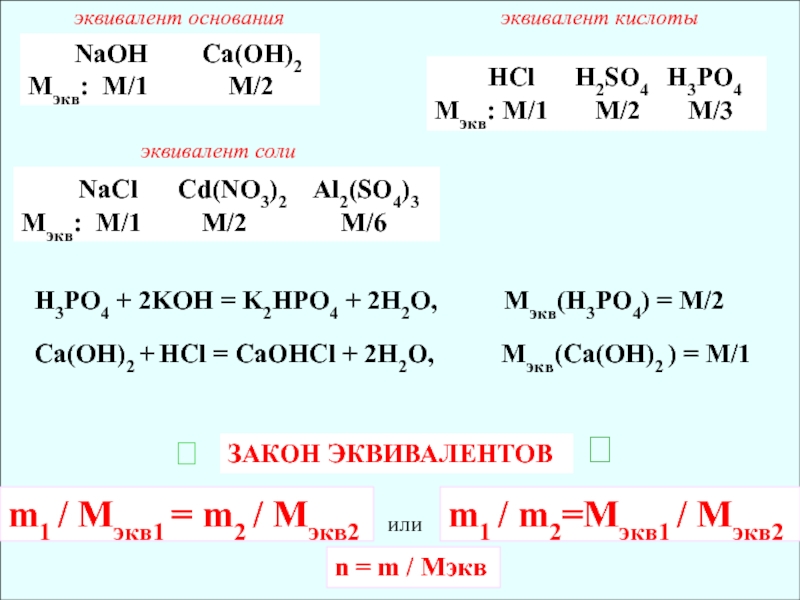
Слайд 13 NaOH Са(ОН)2
Мэкв: М/1
М/2
НCl
Н2SO4 H3PO4Мэкв: М/1 М/2 М/3
NaCl Сd(NO3)2 Al2(SO4)3
Мэкв: М/1 М/2 М/6
H3PO4 + 2KOH = K2HPO4 + 2H2O, Мэкв(H3PO4) = M/2
Са(ОН)2 + НCl = СаОНCl + 2H2O, Мэкв(Са(ОН)2 ) = M/1
ЗАКОН ЭКВИВАЛЕНТОВ
m1 / Мэкв1 = m2 / Мэкв2
m1 / m2=Мэкв1 / Мэкв2
или
эквивалент основания
эквивалент кислоты
эквивалент соли
n = m / Мэкв
Слайд 14Газовые законы
Закон Авогадро
Нормальные условия (н.у.):
Т°= 273,15К (0 C)
Р°= 101325 Па
101,325 105кПа 105 Па (1 атм.)
Мольный объем
газа (VM) = 22,4 дм3/моль (л/моль)n = V/ 22,4
- число молей вещества
Эквивалентный объём Н2 и О2 при н.у.:
2 г Н2 22,4 л
1 г Н2 11,2 л
32 г О2 22,4 л
8 г О2 5,6 л
Слайд 15Объединенный (универсальный) газовый закон
PV/ T= const
PVм / T= R
R =
(10522,4103)/273 = 8,31 Дж/(мольK)
Уравнение Клапейрона-Менделеева
PV = RT
Подставляя
= (m/Mr)pV = (m/Mr)RT
PV/T = poVo/To
Уравнение Клапейрона
PVм = RT
Vo = (PV To) /(T Po)
Слайд 16Определение молекулярной массы газа или пара
2. Приводим объем газа (V)
к н.у. (V) по у-ю Клапейрона
m — Vo х — 22,4 л,
х = Mr
1. По ур-ю Клапейрона-Менделеева
Mr = mRT/(PV)
3. По относительной плотности
D1-2 = m1 / m2 при P,V,T = const
D1-2 = M1 / M2
M1= 2 D(водород) M1 = 29 D(воздух)
Слайд 17 Закон парциальных давлений (закон Дальтона)
Робщее = Р1 + Р2
+ …+ Рі ,
где Р1, Р2 ,… Рі - парциальные
давления газовДавление, которое производит одна из составных частей газовой смеси, называется парциальным давлением данной составной части
Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений ее составляющих частей
Что такое парциальное давление ?
Слайд 18Более подробные сведения о том, что такое эквивалент и закон
эквивалентов смотрите на сайте кафедры
Дополнительные материалы к
лекциям по курсу «Химические основы производства»Лекция № 1
Слайд 19Дополнительные материалы
к лекциям по курсу
«Химические основы производства»
Лектор
доцент
кандидат технических наук
Брагазина
Ольга Александровна
Слайд 21Эквивалент элемента (Э) – это такая масса его, которая соединяется
с единицей (точнее 1,008) массы водорода или с 8 единицами
массы кислорода или замещает эти количества в их соединениях.ЭН = 1 ЭО = 8
Эквивалент элемента в соединении находится как атомная масса, деленная на валентность элемента или его степень окисления
Как находятся эквиваленты сложных веществ (кислот, оснований, солей) – дано на лекции
Эквивалент
Слайд 22 Массы реагирующих веществ относятся как их эквиваленты
m1 / m2=
Э1 / Э2
Вещества реагируют между собой в
эквивалентных количествах или число эквивалентов участников процесса есть постоянная величинаn1 = n2 = n3 =…соnst
где
n = m / Э - число г-экв.
m – масса вещества,
Э – эквивалент вещества
Закон эквивалентов
Слайд 23H2SO4 + 2NaOH = Na2SO4 + 2H2O
H2SO4 + NaOH =
NaHSO4 + H2O
Как рассчитать эквивалент кислоты в химической реакции ?
Слайд 24Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 2HCl =
CrOHCl2 + 2H2O
Как рассчитать эквивалент основания в химической реакции ?
Слайд 25Na2CO3 + HCl = NaHCO3 + NaCl
Na2CO3 + 2HCl =
2NaCl + H2CO3
Как рассчитать эквивалент соли в химической реакции ?
Слайд 26CO2 + NaOH = NaHCO3
СО2 + 2NaOH = Na2CO3 +
H2O
Э оксида в обменных и кислотно-основных реакциях
Слайд 27Современная трактовка понятия «Эквивалент»
Эквивалентом называют реальную или условную частицу, соответствующую
одному протону (Н+), или одному гидроксилу (ОН-), или одному единичному
заряду в данной обменной реакцииФактор эквивалентности (f) показывает, какую часть составляет эквивалент от молекулы.
0 < f < 1
HCl: Э = М/1 f = 1
H2SO4: Э = М/2 f = 1/2
H3PO4: Э = М/3 f = 1/3
Слайд 28“Моль эквивалентов” (моль экв.) и “молярная масса эквивалента” Мэкв.
1 моль
экв. содержит 6,02 · 1023 эквивалентов
Масса 1 моль экв., выраженная
в граммах, называется молярной массой эквивалента (Мэкв)Мэкв = fэкв · М [г/моль экв]
Число моль экв.: nэкв = m / Mэкв