Слайд 2
Сложные реакции
Сложными называют реакции, состоящие из двух или большего числа
простых реакций.
Кинетика сложных реакций зависит от форм связи между простыми
реакциями, от соотношения их скоростей и основывается на принципе независимости простых реакций.
Согласно этому принципу, если в системе протекают одновременно несколько реакций, то каждая из них независима от других и ее скорость определяется кинетическим уравнением простых реакций.
Слайд 3
Параллельные реакции
Параллельными называют реакции, идущие одновременно по нескольким направлениям, с
образованием различных продуктов.
Рассмотрим простой случай параллельных реакций:
например, реакция разложения бертолетовой
соли
имеется две одновременные мономолекулярные стадии, каждая из которых протекает по первому порядку. В более сложных случаях таких стадий может быть и больше, а их порядок может отличаться от единицы.
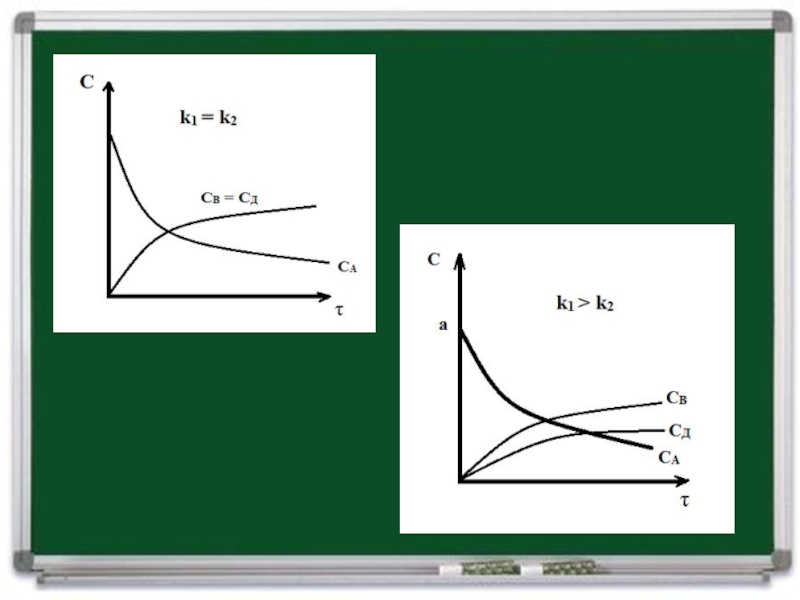
Слайд 4Пусть К1 и К2 - константы скорости этих стадий. Выберем
отсчет времени так, чтобы при t = 0 концентрации продуктов
Пусть
Кинетические уравнения отдельных стадий:
Скорость суммарной реакции:
Из уравнения реакции следует, что число молекул продуктов В и Д равно числу распавшихся молекул исходного вещества А.
Слайд 5Следовательно, для параллельной реакции, стадии которой значительно различаются по скорости,
определяющей является более быстрая стадия.
Если V1 >> V2, то
V = V1. Подставим V1 и V2 в формулу суммарной скорости:
после интегрирования и подстановки пределов имеем:
Отсюда следует, что закономерности протекания рассматриваемой параллельной реакции аналогичны закономерностям простой реакции первого порядка, у которой К = К1 + К2.
Для расчета
Слайд 7Обратимые реакции
Обратимыми называют реакции, протекающие одновременно в двух противоположных направлениях.
В этом смысле почти все химические реакции являются двусторонними. В
ходе их протекания исходные вещества образуют продукты, которые, вступая во взаимодействие между собой, образуют снова молекулы исходных веществ. Пока эти скорости неодинаковы, происходят заметные изменения количеств реагентов. Если V прямого и обратного процессов становятся равными, то наступает динамическое равновесие. Прямой и обратный процесс полностью компенсируют друг друга.
В этом случае концентрации реагентов перестают изменяться и подчиняются термодинамическому закону действующих масс.
Иногда химическая реакция практически может быть обусловлена лишь односторонним процессом. Это может произойти, если продукты быстро удаляются из зоны реакции и не успевают вступать во взаимодействие.
Например, выделение газа или выпадение осадка из растворов.
Слайд 8В этом случае скорость обратной реакции несоизмеримо меньше скорости прямой.
Заметим, что понятие двусторонних реакций не соответствует термодинамическому термину «обратный
процесс». Двусторонние химические реакции могут быть названы термодинамически обратимыми только в близи равновесия, когда скорости прямой и обратной реакции лишь бесконечно мало отличаются друг от друга.
Рассмотрим простой тип двусторонних реакций:
Эта схема описывает реакции изомеризации в газовой фазе или растворе:
Пусть существует только исходное вещество, а концентрация продукта равнялась бы нулю:
Слайд 9Учтем, что в данной реакции исчезновение определенного количества молекул исходного
вещества вызывает образование точно такого же количества молекул продукта реакции,
а поэтому сумма концентраций обоих реагентов в ходе реакции не изменяется
а - начальная концентрация исходного вещества
х - концентрация продукта В в момент времени .
Пусть dx = dx1 + dx2
dx1 и dx2 - изменение концентрации продукта реакции в прямой и обратной реакциях соответственно.
В случае равновесия скорости прямого и обратного процессов равны:
где хр - концентрация продукта реакции в состоянии равновесия.
Слайд 10Запишем кинетические уравнения прямой и обратной стадий, используя концентрацию вещества
В:
скорость суммарной реакции:
после интегрирования:
Слайд 11Выделенные уравнения показывают, что двусторонние реакции с мономолекулярными стадиями протекают
по законам односторонних мономолекулярных реакций, у которых К = К1
+ К-1
Скорость обратимой реакции равна разности между скоростями прямой и обратной реакции.
Кинетические кривые для обратимых реакций первого порядка:
Слайд 12Сопряженные реакции
Сопряженными называют реакции типа:
из которых одна, например, вторая, протекает
лишь совместно с первой.
В таких реакциях вещество В случит индуктором
второй реакции. Вещество С называют акцептором. Общее для обоих реакций вещество А получило название актора. примером таких реакций могут служить окисление сульфата железа и йодоводорода пероксидом водорода.
Сульфат железа окисляется пероксидом независимо от присутствия йодоводорода, но йодоводород пероксидом не окисляется. Однако при одновременном окислении сульфата железа он окисляется вместе с ним.
В этой реакции Н2О2 – акцетор, FeSO4 - индуктор, НJ - акцептор.
FeSO4 + Н2О2→ НJ + Н2О2→
Слайд 13Это явление, называемое химической индукцией изучал Шилов (1905 г.)
Во многих
сопряженных реакциях индуктор выступает как катализатор и процесс протекает с
образованием нестойких химических соединений.
Изучение отношения, в котором актор распределяется между индуктором и акцептором, позволяет выяснить характер сопряжения данных реакций.
Шилов разделил сопряженные реакции на три группы по зависимости концентрации индуктора во времени:
1) концентрация индуктора во время реакции убывает;
2) концентрация индуктора не меняется (каталитические реакции);
3) концентрация индуктора возрастает (автокаталитические реакции).
Слайд 14Примером сопряженных реакций может служить реакция между бромноватой кислотой и
смесью сернистой и мышьяковистой кислот. Кислота НBrO3 непосредственно окисляет Н3AsO3,
но не окисляет Н3AsO3. При действии НBrO3 на смесь Н2SO3 и Н3AsO3 окисляются обе последние кислоты.
Промежуточные вещества НBrO2 и НBrO окисляют мышьяковистую кислоту до мышьяковой (Н3AsO4).
В реакции НBrO3 - актор, Н2SO3 - индуктор, Н3AsO3 - акцептор.
Одно и то же вещество, в зависимости от партнеров, может играть роль актора, индуктора или акцептора.
Пример:
Слайд 15Пример: синтез амидов в водном растворе из кислоты и амина.
Сама
по себе не идет с измеримой скоростью. Но если добавить
карбодиимид - соединение, способное присоединять воду с образованием соответствующей замещенной мочевины
то одновременно с гидратацией карбодиимида пойдет синтез амида.
Йодистоводородная кислота не окисляется непосредственно хромовой кислотой. Однако если в систему ввести окись железа (II) FeO, которая непосредственно может взаимодействовать с хромовой кислотой по реакции:
то одновременно с окислением FeO начинаетсяокисление HJ (акцептор).
Слайд 16Явление, состоящее в том, что самопроизвольно протекающая в системе химическая
реакция вызывает (индуцирует) протекание в этой же системе другой химической
реакции, неосуществимой в отсутствии первой, называется химической индукцией. Две реакции, одна из которых индуцирует протекание другой, называются сопряженными.
Явление химической индукции возможно только в случае, если обе сопряженные реакции являются сложными, т. е. состоят из нескольких элементарных стадий. Элементарная реакция не может быть индуцирована другой реакцией. Это вытекает из положения о независимом протекании реакций, согласно которому константа скорости элемента реакции не зависит от того, протекают одновременно в той же системе другие химические реакции.
Слайд 17В общем случае предельное значение фактора индукции равно отношению стехиометрического
коэффициента акцептора и индуктора в итоговом уравнении индуцируемого маршрута
и фактор
индукции может измениться от 0 до 2.
В качестве меры эффективности химической индустрии обычно используют величину, называемую фактором индукции, которая представляет собой отношение скорости расходования акцептора к скорости расходования индуктора
Слайд 18Цепные реакции
Цепными называются химические реакции, в которых появление активной частицы
вызывает большое число превращений неактивных молекул вследствие регенерации активной частицы
в каждом элементарном акте реакции. В ходе цепной реакции активирование одной частицы приводит к образованию продуктов реакции и новые активны частиц. Активными частицами могут быть свободные атомы, ионы, радикалы и возбуждаемые молекулы. Свободные радикалы представляют собой частицы, содержащие один неспаренный электрон и обладающие ненасыщенными валентностями.
Исчезновение свободной валентности может произойти при взаимодействии свободного радикала со стенкой сосуда, молекулой примеси или растворителем, другими свободными радикалами. В цепных реакциях превращение исходных веществ в продукты реакции осуществляется путем чередования нескольких реакций с участием свободных радикалов.
Слайд 19К цепным реакциям относятся реакции сгорания топлива, окисление молекулярным кислородом,
хлорирование и бромирование, многие процессы полимеризации, крекинг тяжелых нефтепродуктов, процессы
получения ядерной энергии.
Цепная реакция начинается с зарождения цепи, то есть с образования свободных радикалов. Зарождение цепи может произойти в результате гетерогенной реакции на стенках сосуда или при действие hν, излучений и т.д.
Далее идет развитие цепи, характеризуется длиной цепи.
Длиной цепи называется число молекул данного исходного вещества, которые прореагировали в результате одного элементарного акта зарождения цепи.
Обрыв цепи – процесс, в результате которого активные частицы либо исчезают, либо дезактивируются. Обрыв может произойти в результате удара о стенки сосуда и (или) в результате адсорбции на стенки или взаимодействия с другой активной частицей при тройном столкновении:
Слайд 20Для течения цепных реакций, в особенности с длинными цепями очень
важное значение имеет форма реакционного сосуда. Например в узких длинных
трубках реакция может идти очень медленно, а в шарообразных сосудах интенсивнее, так как в узких трубах цепи могут чаще обрываться при столкновении активных частиц со стенками трубки.
Для цепных реакций характерна зависимость их скорости от присутствия инертных веществ и от удельной поверхности реакционного сосуда, под которой понимается отношение площади поверхности сосуда к его объему.
Слайд 21Основы теории кинетики цепных реакций
Различают реакции с неразветвленными и разветвленными
цепями. Неразветвленная цепь: одна активная частица при своем взаимодействие вызывает
образование только одной новой активной частицы.
Кинетическое уравнение таких реакций может быть получено при помощи метода стационарных концентраций.
Слайд 22Теоретическое уравнение для определения скорости образования фосгена
Если в результате
одного элементарного акта регенерируются одна или более активных частиц, то
происходит цепная реакция с разветвленными цепями.
Пример: реакция окисления водорода кислородом:
При этом только в одной стадии (второй) образуется молекула продукта (вода) и одна активная частица (Н), а в двух других (первой и третьей) образуется по 2 активные частицы (ОН, О и ОН и Н), то есть происходит разветвление цепи.
Цепь 1 состоит из чередующихся стадий 1,2,1,2.
Цепь 2 состоит из стадий 3,2,1;3,2,1…
Слайд 23Образовавшиеся активные частицы в результате разветвленной цепной реакции вызывают превращение
большой массы исходных веществ в конечные продукты, что может привести
к взрыву или воспламенению.
Для регулирования скорости и торможения разветвленных цепных реакций в реакционную смесь добавляют вещества, называемые замедлителями или ингибиторами, обрывая цепь, они уменьшают скорость процесса. Таким образом, например, ведет себя тетраэтилсвинец, прибавляемый в небольших количествах к авиационным и автомобильным бензинам (сейчас используют современные ингибиторы, так как тетраэтилсвинец очень опасен). Переходя вместе с бензином в парообразное состояние в камере двигателя, тетраэтилсвинец обрывает цепь при горении топлива. При хранении мономеров часто добавляют ингибиторы, чтобы предотвратить цепную реакцию самопроизвольной полимеризации.
Слайд 24Рассмотрим элементарную вероятностную теорию цепных реакций. Цепная реакция – неразветвленная.
τ
– время между двумя последовательными стадиями. Число молекул продукта, которое
образуется в единицу времени из одной активной частицы, равно 1/τ Если концентрация активных частиц в момен времени τ равна n, то скорость цепной (неразветвленной) реакции (по продукту)
.
Если известна зависимость от времени числа активных частиц n=f(t), то можно найти временную зависимость скорости неразветвленной цепной реакции. Найдем скорость изменения концентрации активных частиц dn/dt. Пусть m0 – скорость возникновения активных частиц в единице объема реакционной смеси, то есть это число активных частиц, которое возникает в единицу времени в единице объема под влиянием внешних факторов.
Слайд 25Пусть концентрация исходных веществ поддерживается const, а продукты убираются из
сферы реакции. Условия изотермические,
m0 = const.
Скорость исчезновения активных частиц
определяется выражением n/V τ, где V - среднее число звеньев в цепи.
Скорость изменения концентрации активных частиц равна
Обозначим и запишем в виде
Для решения дифференциального уравнения умножаем обе его части на и преобразуем к виду:
Слайд 26получим зависимость скорости цепной неразветвленной реакции от времени:
Слайд 27Для разветвленной цепи вероятность обрыва цепи будет меньше.
Слайд 28t → ∞, скорость реакции V неограниченно увеличивается по экспоненциальному
закону и заканчивается взрывом при постоянной температуре.