Слайд 1Лабораторно-практическое занятие по TBL
Специальность: Общая медицина
Дисциплина: Химия
Кафедра: Биохимии и
химических дисциплин
Курс: 1
Тема № 10 «Альдегиды и кетоны. Карбоновые
и дикарбоновые кислоты»
Занятие проводит ассоциированный профессор,
кандидат химических наук
Болысбекова Салтанат Манарбековна
Слайд 2Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты
Цель
Задачи обучения:
Студент должен знать:
Студент должен уметь:
Владеть навыками:
Основные вопросы темы :
Методы обучения и преподавания:
Контроль:
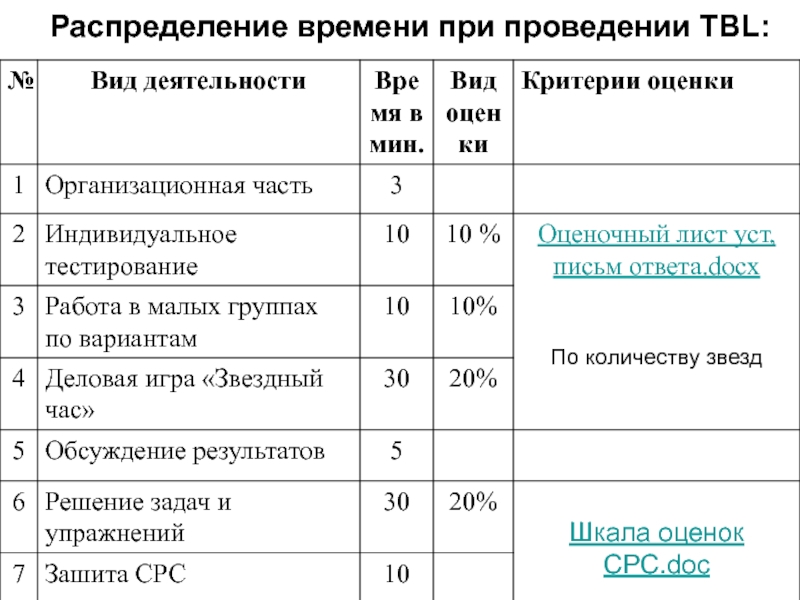
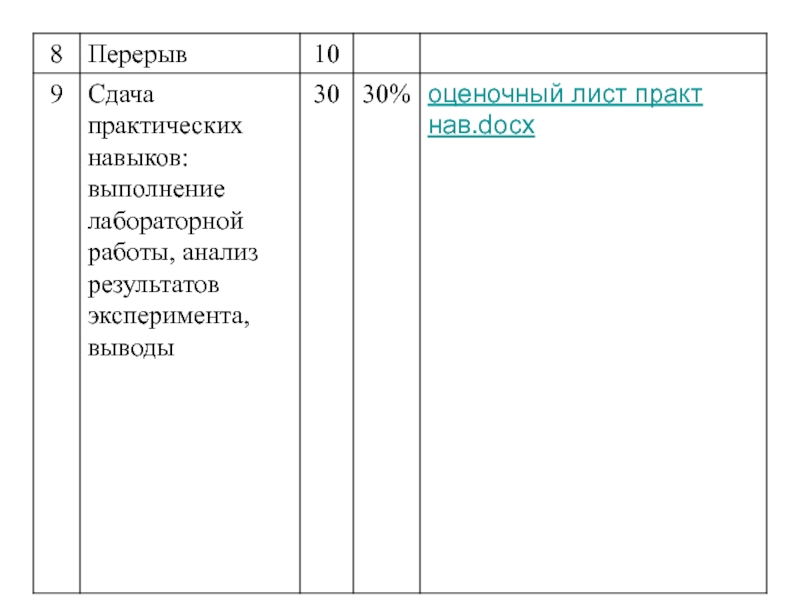
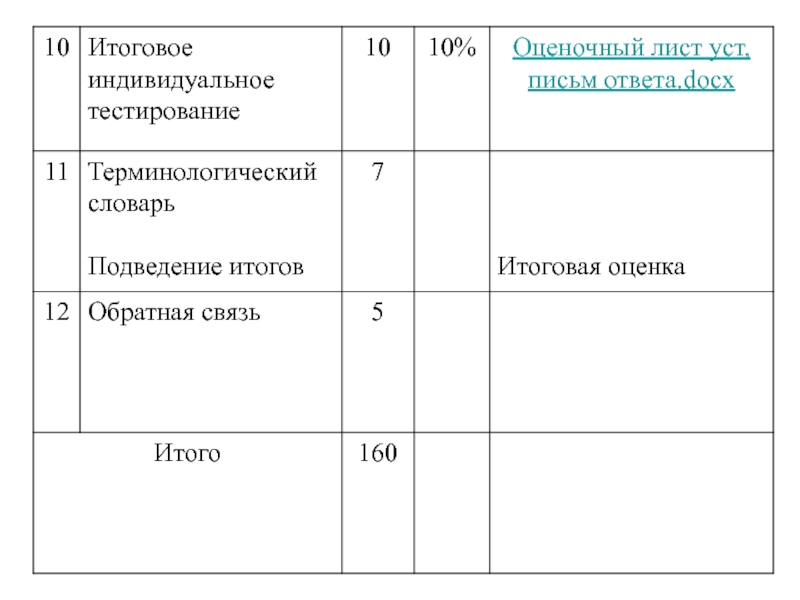
Слайд 3Распределение времени при проведении TBL:
Слайд 6Опыт №1. Окисление альдегидов окисью серебра
В чистую пробирку вносят 5-6
капель аммиачного раствора серебра и прибавляют 1-2 капли 10% раствора
формальдегида или уксусного альдегида. Пробирку слегка подогревают. Выделяется металлическое серебро в виде блестящего зеркального налета на стенках пробирки или образуется черный осадок металлического серебра.
Химизм реакции:
2 Ag(NH3)2OH + 3H2O Ag2O + 4 NH4OH
Сделать вывод.
Слайд 7Опыт №2. Окисление альдегидов гидратом окиси меди
В пробирку вносят 5-6
капель 10 % раствора формальдегида или уксусного альдегида, 2-3 капли
10% раствора едкого натра и добавляют по каплям раствор сернокислой меди CuSO4 до образования легкой неисчезающей мути. Пробирку слегка нагревают в верхней части раствора. В начале появляется желтый осадок гидрата закиси меди CuOH, а затем красный осадок закиси меди Cu2O. Химизм реакции:
CuSO4 + 2 NaOH Cu(OH)2↓ + Na2SO4
Голубой осадок
2 CuOH Cu2O + H2O
красный осадок
Слайд 8Опыт № 3. Диспропорционирование формальдегида в водных растворах.
Поместите в
пробирку 2-3 капли 40% формалина и добавьте 1 каплю 0,2%
раствора индикатора метилового красного. Покраснение показывает на кислую среду. Записать уравнение реакции диспропорционирования формальдегида. Сделать вывод.
Слайд 9Опыт №4. Открытие щавелевой кислоты в виде кальциевой соли
В пробирку
помещают 10-12 капель натриевой соли щавелевой кислоты и добавляют 2-3
капли 2% раствора СаС12. Выпадает белый кристаллический осадок щавелевокислого кальция:
Затем осадок разделяют на две пробирки. В одну пробирку наливают 5-6 капель 10% раствора СН3СООН. Осадок не растворяется. Во вторую пробирку вносят столько же 10% соляной кислоты. Наблюдается растворение осадка. Сделать вывод.
Слайд 10В заключении – рефлексивный тест.
Рефле́ксия (от позднелат. reflexio — обращение
назад) — обращение субъекта на себя самого, свою личность (ценности, интересы,
мотивы, эмоции, поступки), на свое знание или на свое собственное состояние.
Узнал(а) много нового.
Мне это пригодится в жизни.
Было над чем подумать.
На возникшие вопросы я получил(а) ответ.
Поработал(а) добросовестно, цель достигнута.
На доске два рисунка с рожицами (с улыбкой и без).
Предлагается прикрепить магнитные фигурки к тому рисунку, который отражает Ваше отношение к проведенному занятию.
Слайд 12Цель:
Закрепить знания об электронном строении карбонильной и карбоксильной групп;
изучить химические свойства альдегидов, кетонов и карбоновых кислот.
Слайд 13Студент должен знать:
классификацию, общие формулы основных классов карбонильных соединений;
взаимосвязь особенностей
строения и химических свойств органических соединений с их биологической активностью;
Слайд 14Студент должен уметь:
классифицировать органические соединения по строению углеродного скелета
и природе функциональных групп;
связывать биологические функции органических молекул с их
строением и реакционной способностью;
проводить качественные реакции на карбонильные соединения ;
анализировать результаты эксперимента;
работать в химической лаборатории, соблюдать технику безопасности при работе с едкими, ядовитыми, легколетучими органическими соединениями, спиртовками, нагревательными приборами;
Слайд 15Владеть навыками:
классификации органических соединений и использования правил химической номенклатуры;
составления
уравнении химических реакций;
проведения качественных реакций на функциональные группы.
Слайд 16Основные вопросы темы :
Общая характеристика реакционной способности карбонильных соединений.
Реакции
нуклеофильного присоединения альдегидов и кетонов.
а) получение и гидролиз ацеталей.
б) реакция
альдольного присоединения
3. Окислительно-восстановительные реакции альдегидов. Дисмутация альдегидов.
4. Карбоновые и дикарбоновые кислоты.
5. Электронное строение карбоксильной группы и карбоксилат (ацилат) иона. СН-кислотность -углеродного атома.
6. Реакции нуклеофильного замещения у sр2-гибридизованного атома углерода:
а) реакции ацилирования – образование ангидридов.
б) реакции сложных эфиров, тиоэфиров, амидов. Гидролиз этих соединений.
7. Особенности химических свойств дикарбоновых кислот.
8. Понятие о производных карбоновых кислот.
Слайд 17Методы обучения и преподавания:
проведение лабораторно-практического занятия №10 по методике
TBL.
Слайд 18Контроль:
№ 1. Какие соединения получаются при взаимодействии пропаналя с метиловым
спиртом? Напишите уравнение реакции.
№2. Напишите реакцию альдольной конденсации. Почему эта
реакция свойственна только альдегидам, имеющим водородный атом у -углерода?
№3. Записать уравнение реакции получения этилацетат из этилового спирта и уксусной кислоты. Объясните механизм реакции.
№4. Сложный эфир фенилсалициалат применяется внутрь при кишечных заболеваниях и гидролизуется в щелочной среде кишечника. Напишите уравнение гидролитического расщепления фенилсалицилата.
№5. Напишите реакции 1) декарбоксилирования малоновой кислоты, 2) образования ангидрида малоновой кислоты.