Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 10 Дисперсные системы. Дисперсное состояние вещества
Содержание
- 1. Лекция 10 Дисперсные системы. Дисперсное состояние вещества
- 2. Дисперсные системы – это системы, состоящие из
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТОсобенности коллоидного состояния Высокая степень
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Гетерогенность - это наличие
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ1. Классификация дисперсных систем по
- 6. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Зависимость величины удельной поверхности (Sуд)
- 7. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ2. Классификация дисперсных систем по
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ3. По интенсивности межмолекулярных взаимодействий
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Получение лиофобных коллоидных систем I.
- 10. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 2. Методы химической конденсацииПодбор условий
- 11. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: Образование золя кремниевой кислотыNa2SiO3 (изб.) + 2 HCl = H2SiO3↓ + 2 NaCl
- 12. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Например: Образование золя кремниевой кислотыNa2SiO3 + 2 HCl(изб.) = H2SiO3↓ + 2 NaCl
- 13. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПравило Фаянса – Панета: Потенциалопределяющими ионами
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ На поверхности твердого тела при
- 15. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТТеория Гельмгольца (1879 г) Суть: ДЭС
- 16. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Потенциал φ в такой системе
- 17. Теория ДЭС Гуи-Чепмена (1910 – 1913 гг.)
- 18. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТВ теории Гуи-Чепмена использовали следующие
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТОсновные положения теории ШтернаИоны, образующие
- 20. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 21. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТЗависимость электрокинетического потенциала от концентрации
- 22. Методы определения электрокинетического ξ потенциала:Электрокинетические;Метод подвижной границы;Микроскопические и ультрамикроскопические методы;Электроосмотические.СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 23. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДействие индифферентных электролитов на ДЭС:Индифферентные
- 24. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 25. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТДействие неиндифферентных электролитов на ДЭС: Неиндифферентные
- 26. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 27. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 28. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТСедиментационная устойчивость – это устойчивость
- 29. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТПроцесс слипания частиц дисперсной фазы
- 30. Порог коагуляции - это
- 31. Правило Шульце-Гарди:Коагулирующее действие оказывает ион, имеющий тот
- 32. Устойчивость коллоидных систем увеличивается в присутствии молекул
- 33. Спасибо за внимание!Вопросы?СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Дисперсные системы – это системы, состоящие из частиц
дисперсной фазы (раздробленного вещества) и дисперсионной
не коллоидные вещества, а коллоидное состояние веществ!Слайд 3СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Особенности коллоидного состояния
Высокая степень раздробленности вещества (дисперсности
D):
Количественной мерой дисперсности служат:
а) размеры
частиц (а) – это наименьший размер частицы полюбой оси координат;
б) дисперсность (D) – степень раздробленности:
, [см-1, м-1]
в) удельная поверхность границы раздела фаз (Sуд):
, [м2·см-3; м2·г-1], где
S – суммарная поверхность дисперсной фазы, м2;
V – общий объем дисперсной фазы, см3;
m – общая масса дисперсной фазы, г..
Слайд 4СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
2. Гетерогенность - это наличие 2-х, как минимум
фаз: дисперсная фаза и дисперсионная среда.
Фазы образуют границу раздела и
взаимодействуют между собой определенным образом.3. Высокие значения свободной поверхностной энергии.
Эта энергия накапливается на границе раздела фаз за счет разрыва межмолекулярных связей при образовании новой поверхности, т.е. при диспергировании (дроблении) вещества.
4. Неустойчивость коллоидных систем, как следствие высокой поверхностной энергии.
5. Индивидуальность и невоспроизводимость коллоидных систем.
Слайд 5СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
1. Классификация дисперсных систем по дисперсности:
а) Грубодисперсные системы
см;
б) Микрогетерогенные:
см;в) Коллоидные растворы: см;
г) Истинные растворы: см.
Слайд 6СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
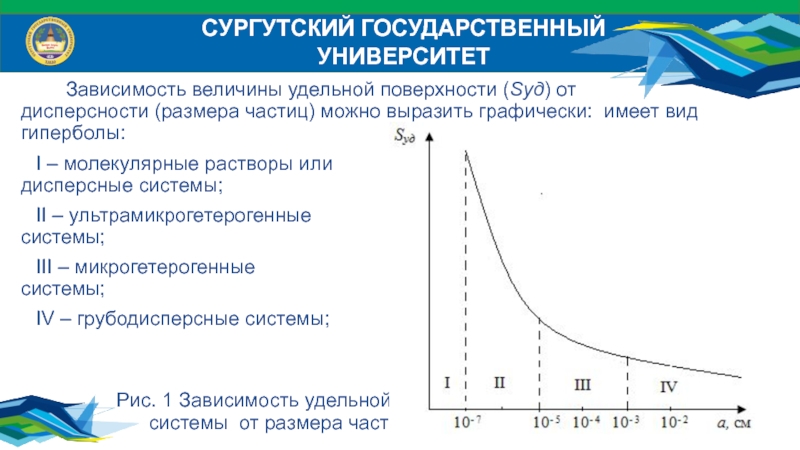
Зависимость величины удельной поверхности (Sуд) от дисперсности (размера
частиц) можно выразить графически: имеет вид гиперболы:
I – молекулярные растворы
или молекулярно-дисперсные системы;II – ультрамикрогетерогенные (коллоидные, нано-) системы;
III – микрогетерогенные (среднедисперсные) системы;
IV – грубодисперсные системы;
Рис. 1 Зависимость удельной поверхности
системы от размера частиц
Слайд 7СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
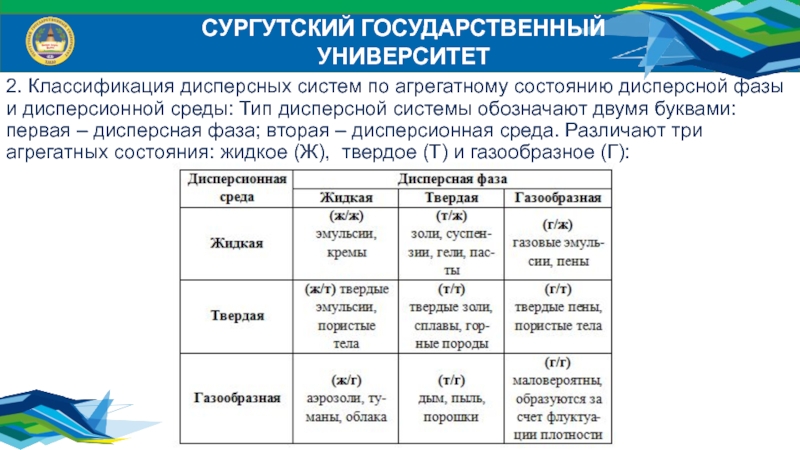
2. Классификация дисперсных систем по агрегатному состоянию дисперсной
фазы и дисперсионной среды: Тип дисперсной системы обозначают двумя буквами:
первая – дисперсная фаза; вторая – дисперсионная среда. Различают три агрегатных состояния: жидкое (Ж), твердое (Т) и газообразное (Г):Слайд 8СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
3. По интенсивности межмолекулярных взаимодействий на границе раздела
фаз:
а) Лиофильные коллоидные системы (любящий растворение) – это система, в
которой наблюдается сильное межмолекулярное взаимодействие между молекулами дисперсной фазы и дисперсионной среды и при определенных условиях способна растворяться в ней .б) Лиофобные коллоидные системы – это системы в которых дисперсная фаза не взаимодействует с дисперсионной средой, т.е. проявляется слабое межфазное взаимодействие и имеет избыток свободной поверхностной энергии на межфазной поверхности.
Слайд 9СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Получение лиофобных коллоидных систем
I. Методы диспергирования (диспергационные
методы) – дробление крупных тел на более мелкие частицы:
1. механическое измельчение (дробилки, мельницы,ступки, вальницы, краскотерки, встряхиватели);
2. диспергирование ультразвуковыми колебаниями;
3. электрическое диспергирование под действием
переменного и постоянного тока.
II. Методы конденсации:
1. Методы физической конденсации:
а. Метод конденсации паров;
б. Метод замены растворителя;
в. Метод пептизации.
Слайд 10СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
2. Методы химической конденсации
Подбор условий химической конденсации:
В результате
химической реакции должно образоваться труднорастворимое соединение;
Должно образоваться большое количество зародышей
твердой фазы (частиц агрегата, на поверхности которых идет адсорбция вех остальных участников процесса);Один из компонентов берется в большей концентрации.
Эти условия лежат в основе образования мицелл.
Слайд 11СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Например: Образование золя кремниевой кислоты
Na2SiO3 (изб.) + 2
HCl = H2SiO3↓ + 2 NaCl
Слайд 12СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Например: Образование золя кремниевой кислоты
Na2SiO3 + 2 HCl(изб.)
= H2SiO3↓ + 2 NaCl
Слайд 13СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
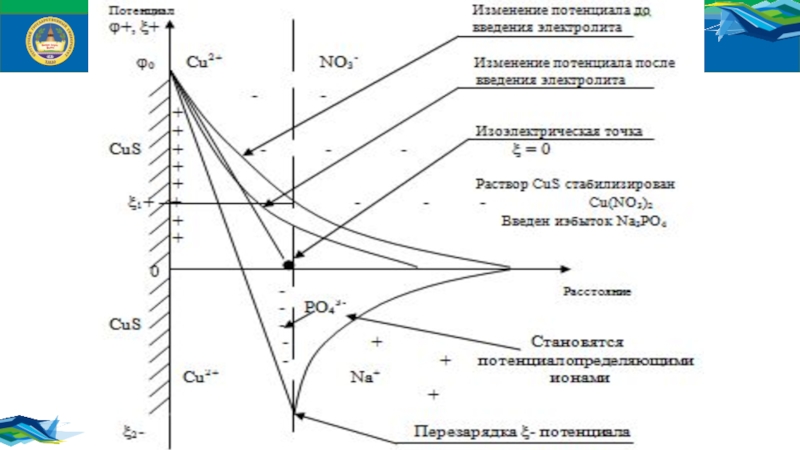
Правило Фаянса – Панета:
Потенциалопределяющими ионами (ПОИ) будут ионы,
входящие в состав агрегата и находящиеся в избытке в растворе.
или
На
поверхности кристалла, выросшего из данного раствора, преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки и присутствуют в избытке в растворе. Вместе с ними или вместо них могут адсорбироваться ионы изморфные ионам решетки кристалла.Слайд 14СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
На поверхности твердого тела при контакте с жидкостью
самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате
на границе раздела фаз ТВ – Ж формируется двойной электрический слой (ДЭС). ДЭС возникает, как результат стремления поверхностной энергии к минимуму и связано с особыми свойствами границы раздела ТВ – Ж.Слайд 15СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
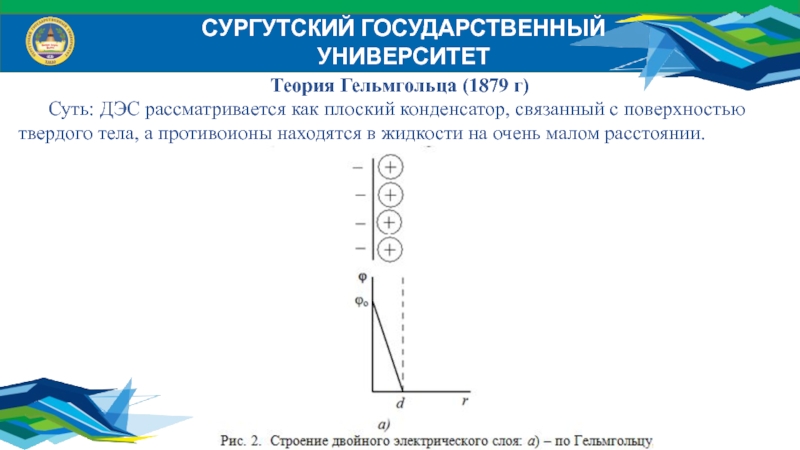
Теория Гельмгольца (1879 г)
Суть: ДЭС рассматривается как плоский
конденсатор, связанный с поверхностью твердого тела, а противоионы находятся в
жидкости на очень малом расстоянии.Слайд 16СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Потенциал φ в такой системе резко падает, а
значение поверхностного заряда определяется формулой:
(1)
где ε – абсолютная диэлектрическая проницаемость
среды;φо – разность потенциалов между дисперсной фазой и
дисперсионной средой;
d – расстояние между слоями.
Слайд 18СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
В теории Гуи-Чепмена использовали следующие допущения:
Размеры ионов не
учитываются, т.е. рассматриваются как простые точечные
заряды;
Диэлектрическая проницаемость
среды не зависит от расстояния от поверхности раздела фаз.
Данная теория в большинстве случаев правильно описывает ДЭС, но не учи-
тывается специфическая адсорбция ионов поверхностью, а рассматривается
лишь кулоновское взаимодействие между заряженными частицами.
Эти недостатки были устранены в теории Штерна.
Слайд 19СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Основные положения теории Штерна
Ионы, образующие ДЭС имеют конечные
размеры;
Между ионами и поверхностью твердой фазы идет электростатическое
и адсорбционное взаимодействие, что характеризуется соответственно φ и ξ потенциалом.
Слайд 21СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Зависимость электрокинетического потенциала от концентрации электролита:
Рис. 4
С3 > С2 > С1 при этом ξ3
ξ2 < ξ1Слайд 22Методы определения электрокинетического ξ потенциала:
Электрокинетические;
Метод подвижной границы;
Микроскопические и ультрамикроскопические методы;
Электроосмотические.
СУРГУТСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 23СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Действие индифферентных электролитов на ДЭС:
Индифферентные (безразличные) электролиты –
электролиты, не имеющие ионов, способных достраивать кристаллическую решетку коллоидной частицы.
Такие электролиты снижают электрокинетический потенциал в результате увеличения концентрации противоионов и сжатия двойного электрического слоя (ДЭС).
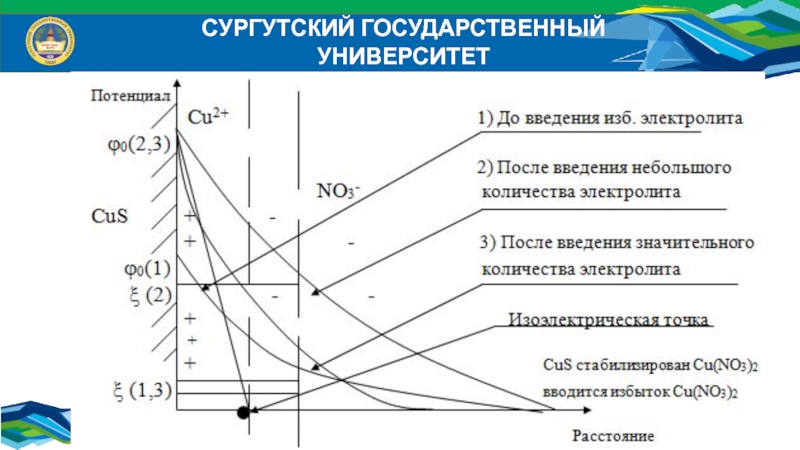
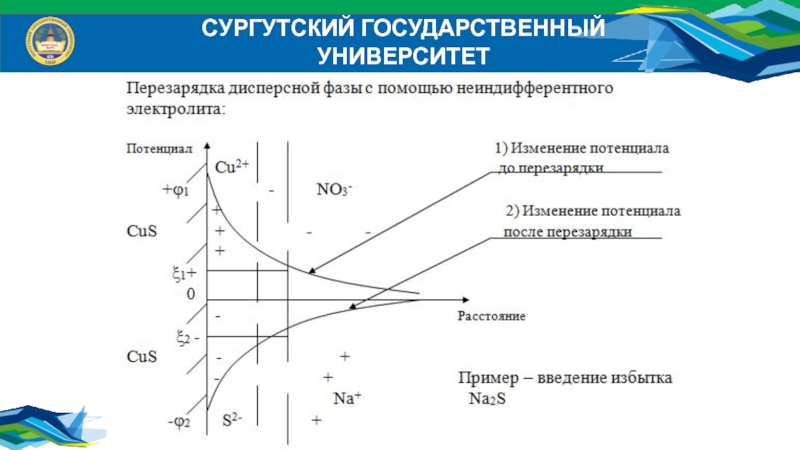
Слайд 25СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Действие неиндифферентных электролитов на ДЭС:
Неиндифферентные электролиты – электролиты,
один из ионов которых способен достраивать кристаллическую решетку дисперсной фазы.
Потенциалопределяющий ион этого электролита может повышать потенциал 0 и , а находящийся с ним в паре противоион способен сжимать двойной электрический слой (ДЭС).
Слайд 28СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Седиментационная устойчивость – это устойчивость системы по отношению
к силе тяжести, т.е. к оседанию.
Собственно коллоиды седиментационно устойчивы.
Седиментационно неустойчивы только грубодисперсные системы.Агрегативная устойчивость – это способность системы к сохранению дисперсности индивидуальных частиц дисперсной фазы.
Потеря агрегативной устойчивости сопровождается объединением частиц с их последующим осаждением, т.е. сопровождается разделением фаз, разрушением коллоидной системы.
Процесс слипания частиц в более крупные агрегаты с потерей агрегативной и, в дальнейшем, седиментационной устойчивости, называется коагуляцией.
Устойчивость коллоидных систем
Слайд 29СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Процесс слипания частиц дисперсной фазы в более крупные
агрегаты с потерей агрегативной устойчивости и далее седиментационной называется коагуляцией.
При этом получаются осадки, отличающиеся природой (плотные, творожистые, хлопьевидные и т.п.) называют коагулятами.Слайд 30Порог коагуляции - это минимальная концентрация электролита,
способная вызывать коагуляцию.
Многочисленные исследования показали, что коагулирующим является ион, заряд
которого по знаку совпадает со знаком противоионов в ДЭС и коагуляция наступает в тот момент, когда заряд частицы становится равным нулю, т.е. в изоэлектрической точке.Величина, обратная порогу коагуляции называется коагулирующей способностью :
- это объем золя, скоагулированный одним моль-ионом электролита.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 31Правило Шульце-Гарди:
Коагулирующее действие оказывает ион, имеющий тот же знак заряда,
что и противоионы в двойном электрическом слое мицеллы. Коагулирующая способность
возрастает пропорционально некоторой высокой степени его заряда.Дерягин и Ландау установили, что эта степень равна (6) шести.
Т.о., если принять порог коагуляции одновалентного иона за единицу, то соотношение порогов коагуляции в зависимости от заряда коагулирующего иона можно выразить в виде соотношения:
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Слайд 32Устойчивость коллоидных систем увеличивается в присутствии молекул ПАВ, полимеров (белков),
действие которых характеризуется защитным числом – это масса полимера в
мг, защищающего 10 мл золя при добавлении 1 мл 10% раствора электролита хлорида натрия.Например: Золотое число; железное число, что означает тип золя.
Желатин обладает высоким защитным действием,
поскольку З.Ч. = 0,01 – 0,1 мг.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ