комплексы или комплексные ионы, способные к самостоятельному существованию
Чугаев Л.А.
Комплексные соединения
(КС) – это продуктсочетания простых соединений, способных
к самостоятельному существованию


![лекция 12. Комплексные соединения Примеры реакций комплексообразованияHgI2 + 2KI = K2[HgI4]KF + BF3 = K[BF4]Al(OH)3+ NaOH = Na[Al(OH)4]AgCl + 2NH3=[Ag(NH3)2]Cl Примеры реакций комплексообразованияHgI2 + 2KI = K2[HgI4]KF + BF3 = K[BF4]Al(OH)3+ NaOH = Na[Al(OH)4]AgCl + 2NH3=[Ag(NH3)2]Cl](/img/thumbs/e2e05b2d4777359d052c5245162cd8b7-800x.jpg)
![лекция 12. Комплексные соединения Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 Н2О Кристаллогидраты: CuSO4•5H2O [Cu(H2O)4]SO4 Н2О](/img/thumbs/eda9252dc0a99b06667ee4b5ab160201-800x.jpg)

![лекция 12. Комплексные соединения Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3ЦентральныйатомЛигандыВнутреняя сфера Внешняя сфера Координационное число Составные части комплексных соединений [Co+3 (NH3) 6]3+Cl3ЦентральныйатомЛигандыВнутреняя сфера Внешняя сфера Координационное число](/img/thumbs/e4f19ac437ce89a87597310d9e4cb4d7-800x.jpg)


![лекция 12. Комплексные соединения Степень окисленияПоложительнаяK3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4]Отрицательная [N -3H4 ] ClНулевая [Cl2(H2O)4] Степень окисленияПоложительнаяK3[Fe3+(CN)6], K4[Fe2+(CN)6], Cs[Xe+6F7], К[BF4]Отрицательная [N -3H4 ] ClНулевая [Cl2(H2O)4]](/img/thumbs/99991e50b48f42265a98c88887d56129-800x.jpg)


![лекция 12. Комплексные соединения Na[BF4] Na3[AlF6]rB3+ = 0,02 нмrAl3+ = 0,057 нм Na[BF4] Na3[AlF6]rB3+ = 0,02 нмrAl3+ = 0,057 нм](/img/thumbs/6f45e6baff8a3067422d2a18c551d39f-800x.jpg)
![лекция 12. Комплексные соединения Na3[AlF6] Na [AlCl4] Al3+rF_ = 0,133 нмrCl- = 0,181 нм Na3[AlF6] Na [AlCl4] Al3+rF_ = 0,133 нмrCl- = 0,181](/img/thumbs/149c8ffb9c793564f340961aab7ce16a-800x.jpg)


![лекция 12. Комплексные соединения Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6]- концентрации исходных компонентов : Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 +3 NaOH= Na3[Al(OH)6]- концентрации исходных компонентов :](/img/thumbs/c2f45537d2e5efc12a138d5f8865eea3-800x.jpg)

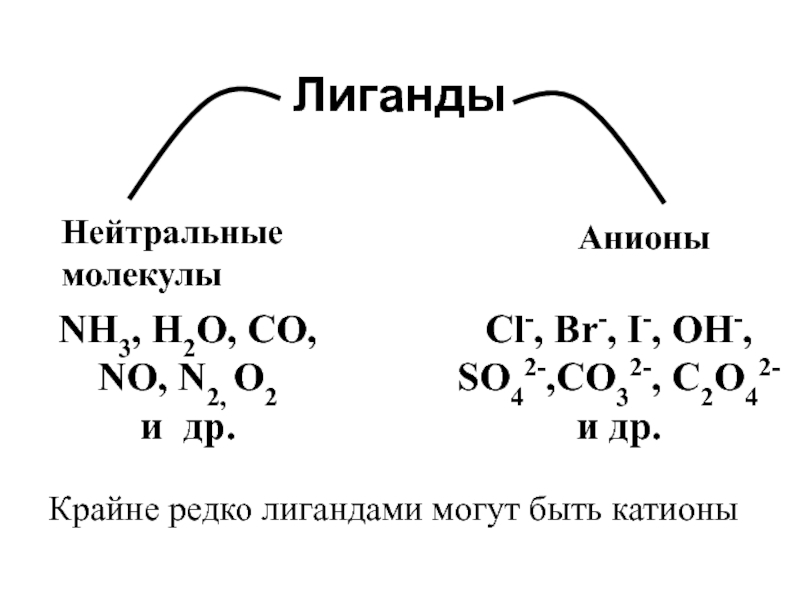


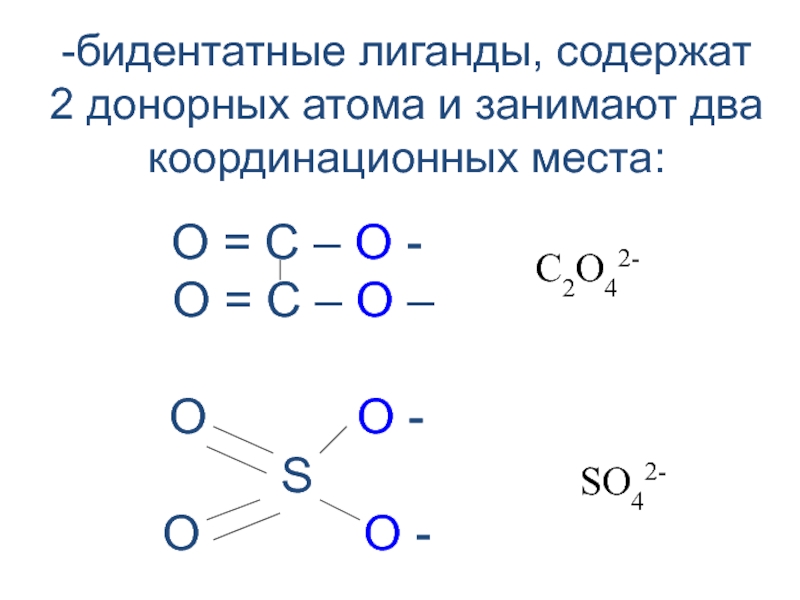
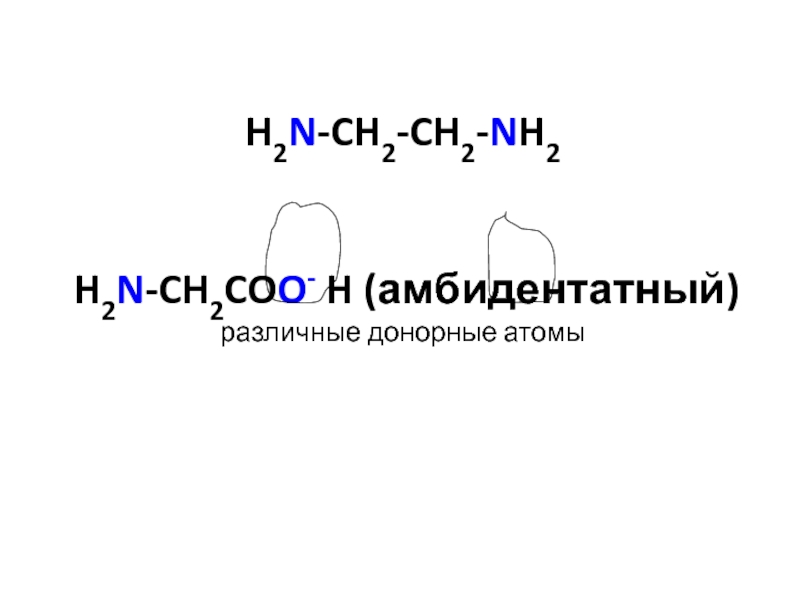
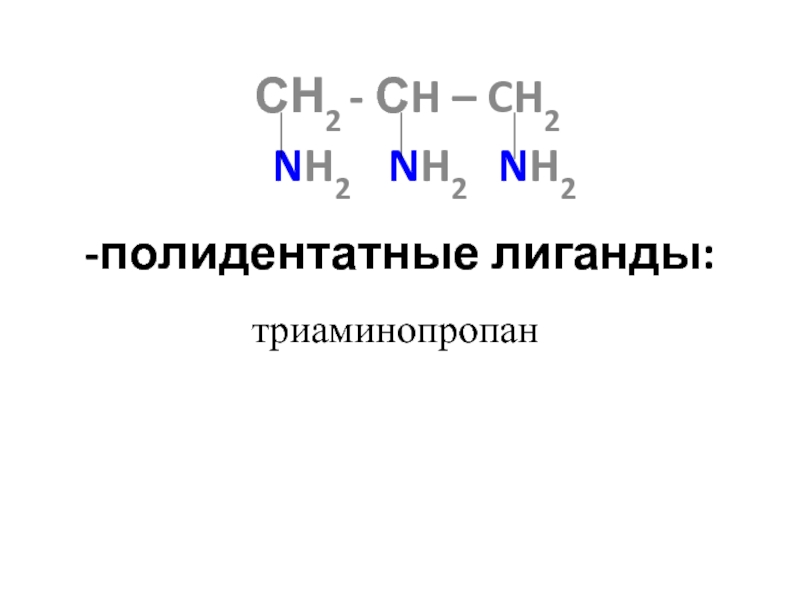
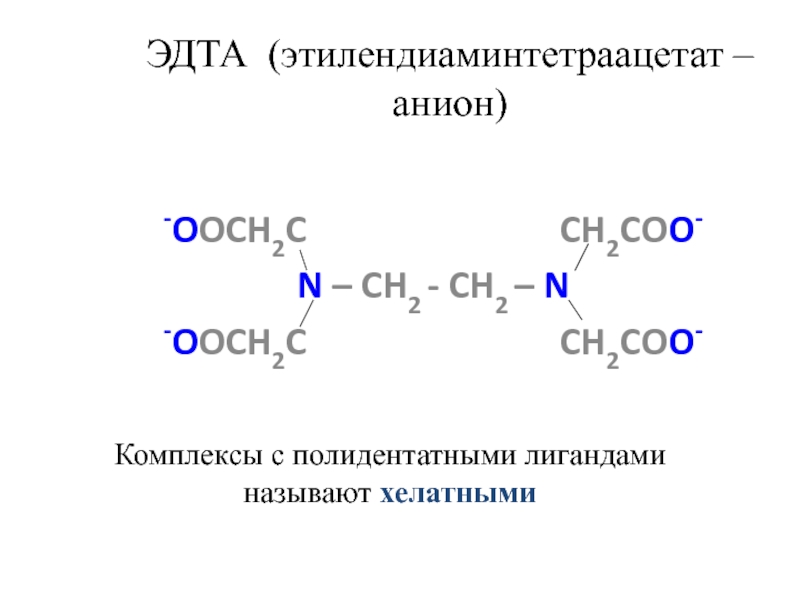

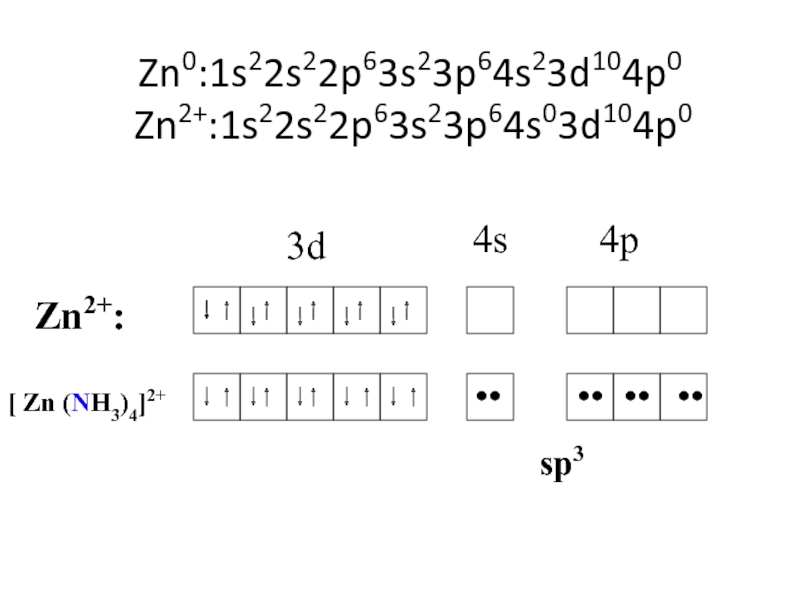
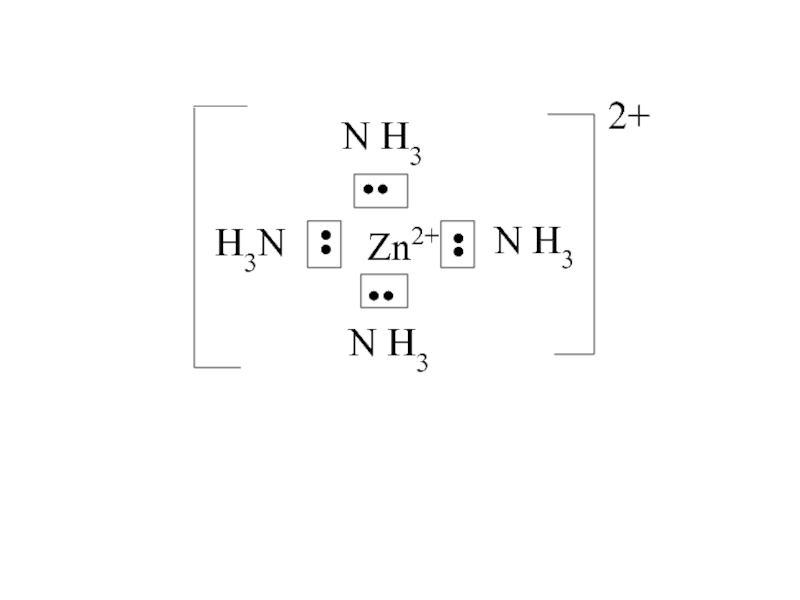
![лекция 12. Комплексные соединения Zn2+ + 4 NH3 [Zn(NH3)4]2+ Zn2+ + 4 NH3 [Zn(NH3)4]2+](/img/thumbs/4343ae679bbc2101235e15cf6fe5c840-800x.jpg)
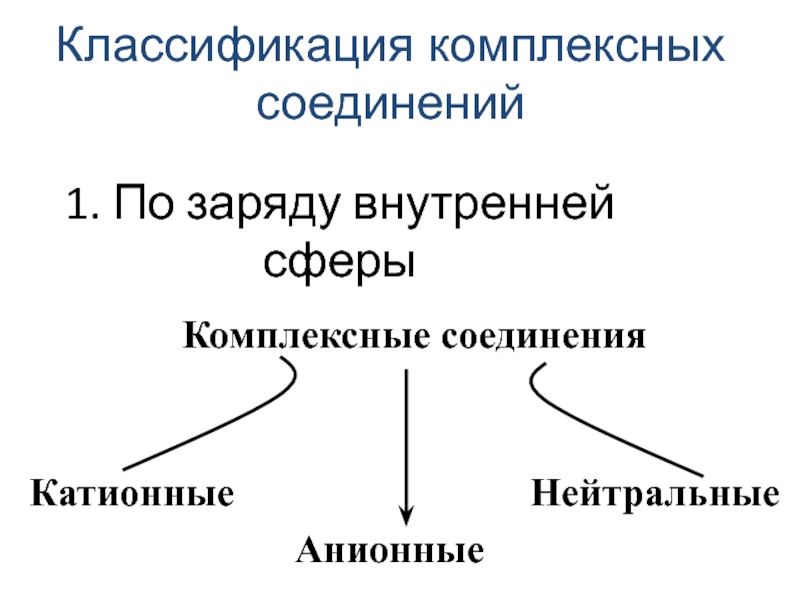
![лекция 12. Комплексные соединения [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2]](/img/thumbs/1ee0ed51000beafb968074455dafb9f3-800x.jpg)


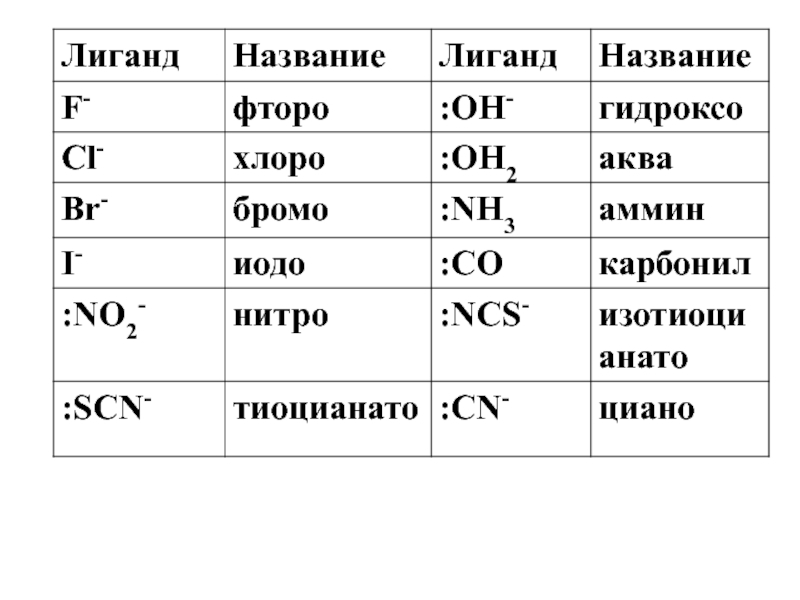
![лекция 12. Комплексные соединения [Cu(NH3)4]SO4Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2Сульфат тетраамминмеди (II)Гексанитрокобальтат (III) натрияДихлородиамминплатинаБромид хлородиакватриамминхрома (III) [Cu(NH3)4]SO4Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2Сульфат тетраамминмеди (II)Гексанитрокобальтат (III) натрияДихлородиамминплатинаБромид хлородиакватриамминхрома (III)](/img/thumbs/d9fbde80bac9ad1a19655f018a42084d-800x.jpg)

![лекция 12. Комплексные соединения K4 [Fe(CN)6]Ионная связь (диссоциация по типу сильного электролита) K4 [Fe(CN)6]Ионная связь (диссоциация по типу сильного электролита)](/img/thumbs/fd477410f5261bb620cf659a62639e1c-800x.jpg)
![лекция 12. Комплексные соединения K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](/img/thumbs/9eac1825a9081e3f77f8049e72006ac6-800x.jpg)
![лекция 12. Комплексные соединения [Fe(CN)6 ] 4- Fe2+ +6(CN)- вторичная диссоциацияКонстанта нестойкости (Кн):Kн = 1∙10-31 (очень прочный комплекс) [Fe(CN)6 ] 4- Fe2+ +6(CN)- вторичная диссоциацияКонстанта нестойкости (Кн):Kн = 1∙10-31 (очень прочный комплекс)](/img/thumbs/d8072382eb334c6d03e48eb45c54fba9-800x.jpg)
![лекция 12. Комплексные соединения [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)Куст.=1/ Кн [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)Куст.=1/ Кн](/img/thumbs/0bb243fcc611969b3def89eb5a7be9a1-800x.jpg)

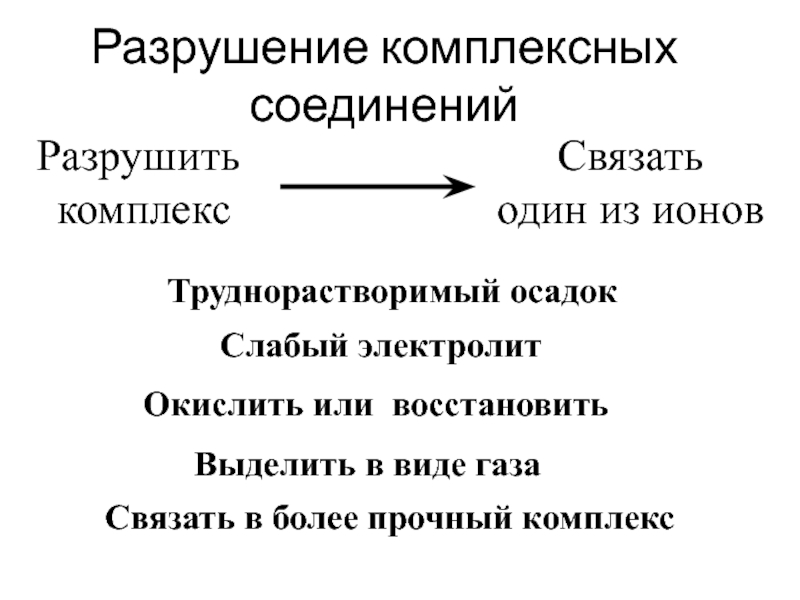
![лекция 12. Комплексные соединения [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8 [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8](/img/thumbs/4a80cb02001d11397aa1838eeabebcde-800x.jpg)
![лекция 12. Комплексные соединения [Ag (NH3)2]++ KI =AgI+ NH3 +K+ [Ag (NH3)2]++ KI =AgI+ NH3 +K+](/img/thumbs/5319188c66c86e3f38e6f07b4e09e88c-800x.jpg)
![лекция 12. Комплексные соединения [Ag (NH3)2]+ Ag+ + 2 NH3 [Ag (NH3)2]+ Ag+ + 2 NH3](/img/thumbs/0be1ccdaee3da1114409a3817dcde327-800x.jpg)

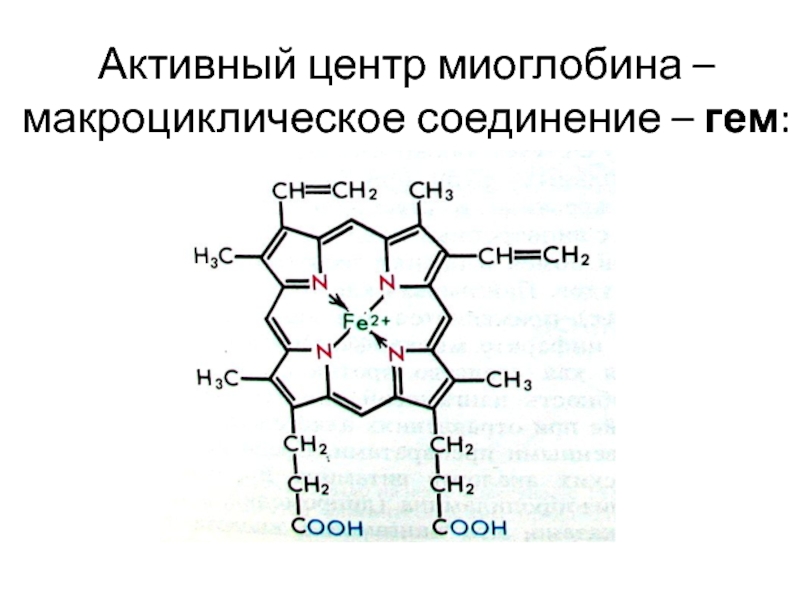
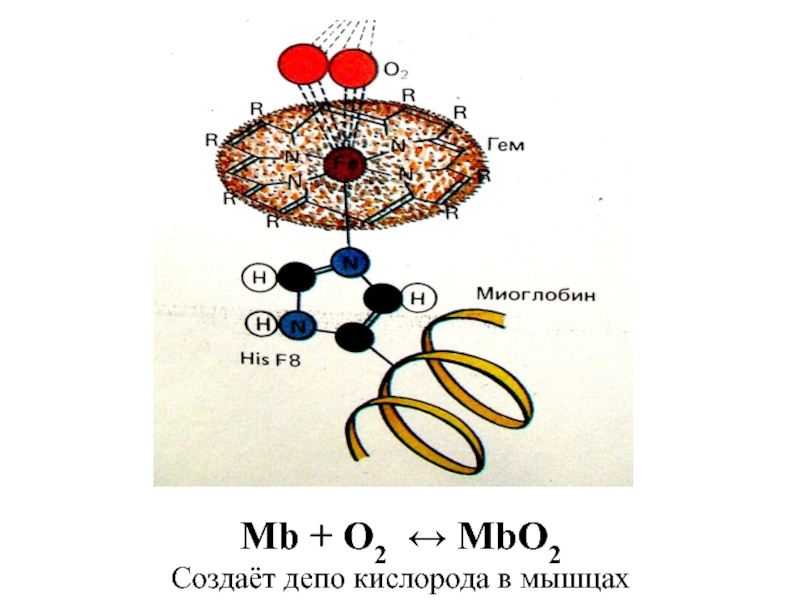
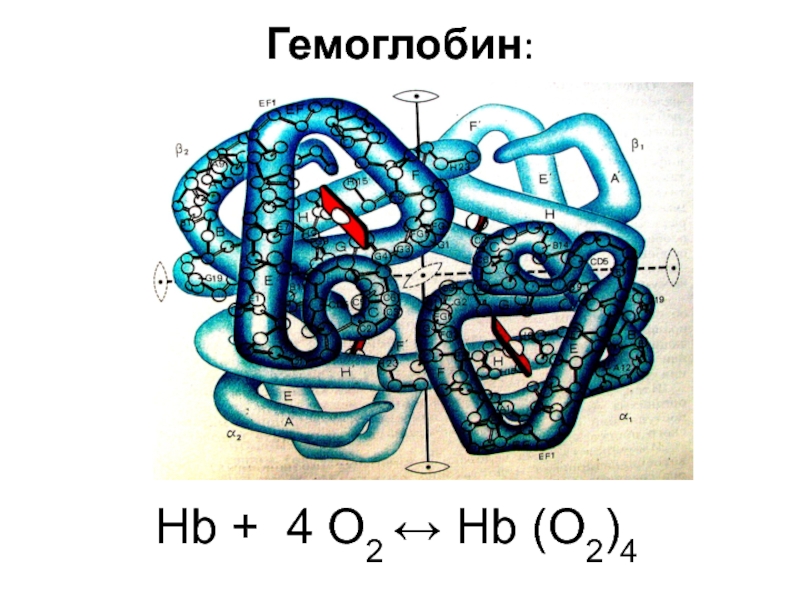
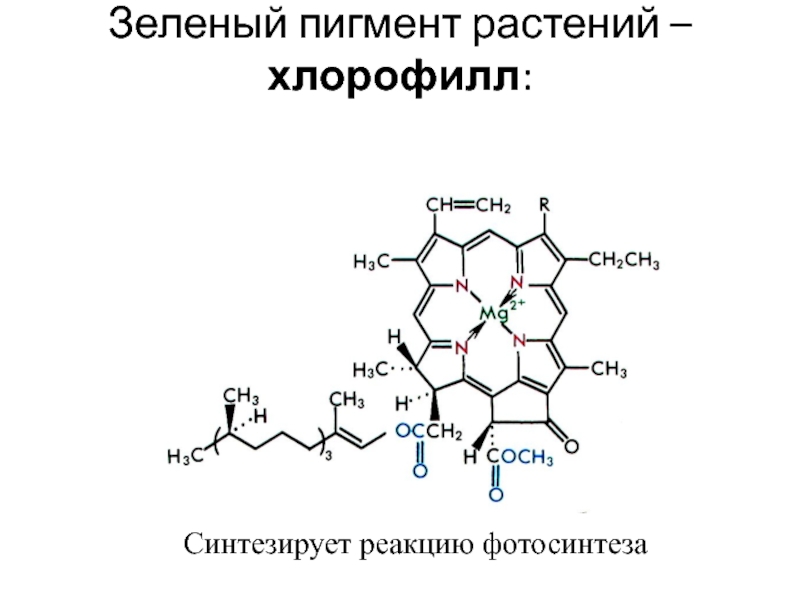
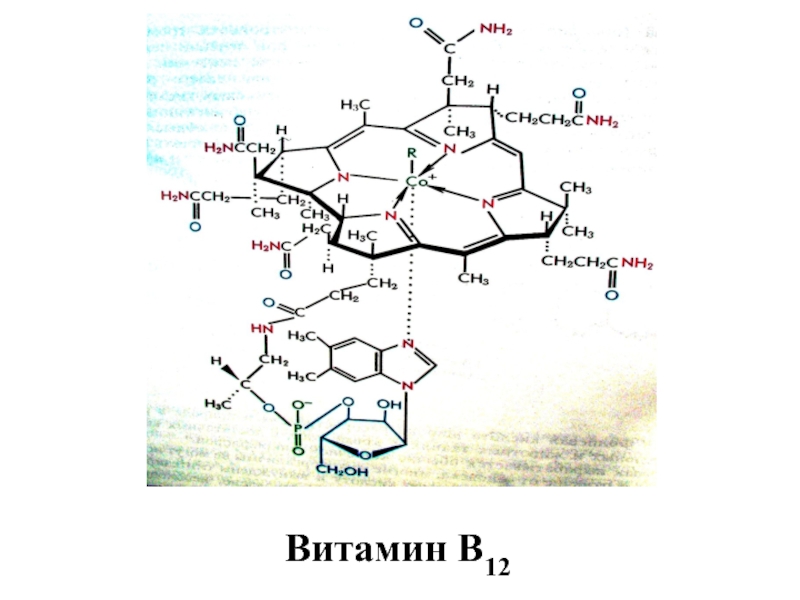

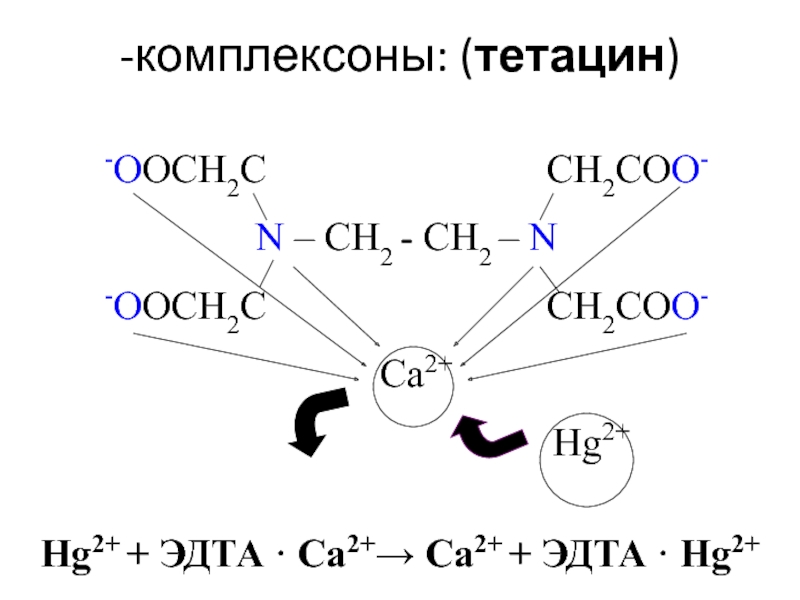
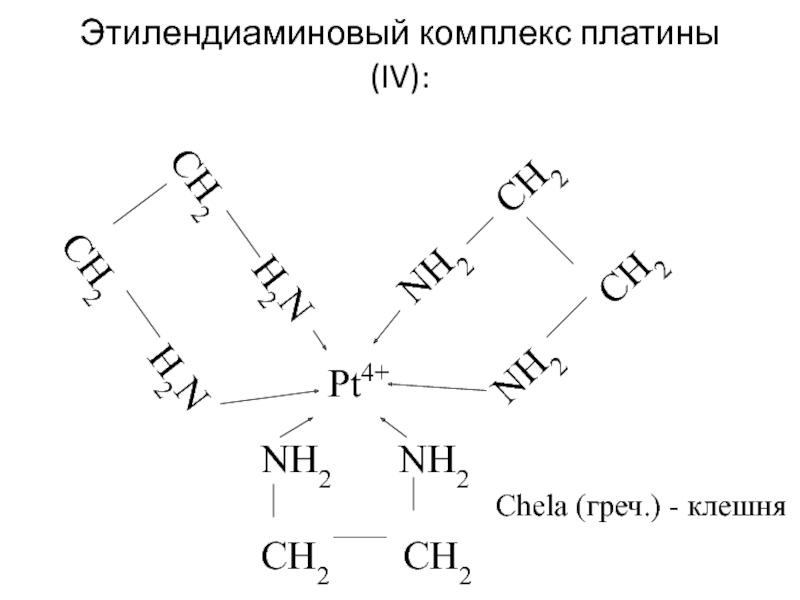
![лекция 12. Комплексные соединения -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2] -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]](/img/thumbs/29ebbe87536b84e9b08831f02746a560-800x.jpg)




















