Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 2 Термохимия. Второй закон термодинамики. Химическое равновесие Основные
Содержание
- 1. Лекция 2 Термохимия. Второй закон термодинамики. Химическое равновесие Основные
- 2. Раздел ТД, изучающий изменение энергии при протекании химических процессов, называется химической термодинамикой или термохимией. Термохимия
- 3. Особенности термохимических уравнений: 1. Уравнения
- 4. Частным выражением 1-го
- 5. Первое следствие закона Гесса ΔН0проц.
- 6. Закон Гесса Энтальпия сгорания, измеренная
- 7. ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]Второе
- 8. Закон Гесса
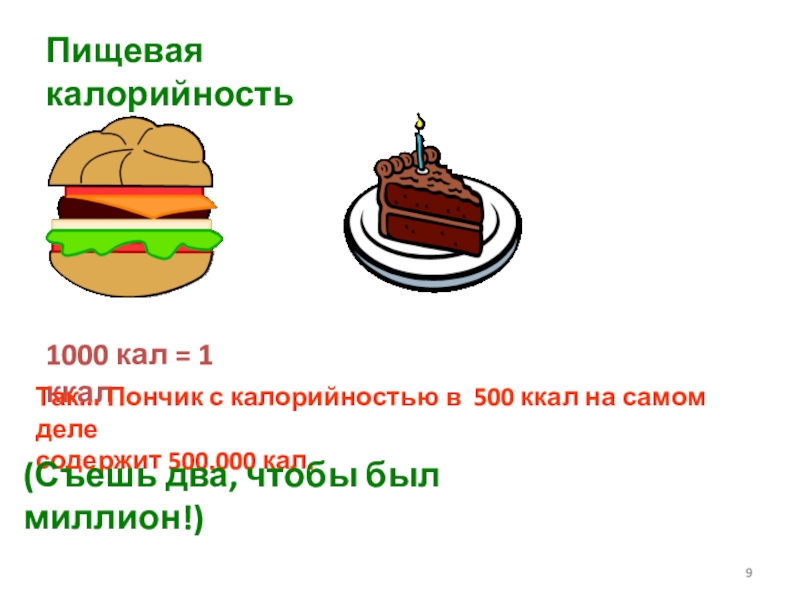
- 9. Пищевая калорийность1000 кал = 1 ккалТак... Пончик
- 10. Закон Гесса Коэффициенты калорийности основных компонентов
- 11. Закон Гесса
- 12. Второе начало термодинамикиСуществуют различные равнозначные по смыслу
- 13. Скачать презентанцию
Раздел ТД, изучающий изменение энергии при протекании химических процессов, называется химической термодинамикой или термохимией. Термохимия
Слайды и текст этой презентации
Слайд 1
Лекция 2
Термохимия. Второй закон термодинамики. Химическое равновесие
Основные понятия.
Закон
Гесса и его следствия.
Слайд 2Раздел ТД, изучающий изменение
энергии при протекании химических
процессов, называется
химической
термодинамикой или термохимией.
Термохимия
Слайд 3
Особенности термохимических уравнений:
1. Уравнения записываются с учетом ТД функций
состояния системы (ΔH, Δ S).
2. Учитывается 1 моль вещества, поэтому
возможны дробные коэффициенты.3. Указываются агрегатные состояния веществ.
4. С ТХ уравнениями могут производиться обычные алгебраические действия.
Пример: ½ N2(г)+ ½ O2(г)= NO(г),ΔH>0.
Слайд 4 Частным выражением 1-го начала термодинамики применительно
к химическим процессам является закон Гесса (1840 г):
Приращение энтальпии (тепловой
эффект) химического процесса в изобарно-изотермических условиях зависит только от природы и состояния реагентов и продуктов реакции и не зависит от пути протекания реакции.Закон Гесса
Слайд 5
Первое следствие закона Гесса
ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент),
ΔН0проц.[кДж ·моль-1].
Тепловой
эффект процесса равен алгебраической сумме энтальпий образования продуктов за вычетом
алгебраической суммы энтальпий образования реагентов с учетом их стехиометрических коэффициентов.Слайд 6Закон Гесса
Энтальпия сгорания, измеренная при стандартных условиях,
называется стандартной,
обозначается ΔН0сгор.(Х) [кДж · моль-1].
Энтальпии
сгорания высших оксидов равны 0.Слайд 7
ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]
Второе следствие закона Гесса:
Тепловой
эффект химического процесса равен алгебраической сумме энтальпий сгорания реагентов за
вычетом алгебраической суммы энтальпий сгорания продуктов с учетом их стехиометрических коэффициентов.Слайд 8Закон Гесса
Задача
2. Рассчитать тепловой эффект
реакции спиртового брожения глюкозы, исходя из стандартных энтальпий сгорания:С6Н12О6 (к) = 2С2Н5ОН(ж) + 2СО2 (г).
ΔН0сгор(С6Н12О6 (к)) = - 2815,78 кДж · моль-1
ΔН0сгор(С2Н5ОН(ж)) = - 1366,9 кДж · моль-1
Решение: по второму следствию закона Гесса:
ΔН0х.р. = ΔН0сгор(С6Н12О6 (к)) - 2ΔН0сгор(С2Н5ОН(ж)) = - 82 кДж · моль-1.
Реакция экзотермическая.
Слайд 9Пищевая калорийность
1000 кал = 1 ккал
Так... Пончик с калорийностью в
500 ккал на самом деле
содержит
500.000 кал.(Съешь два, чтобы был миллион!)
Слайд 10Закон Гесса
Коэффициенты калорийности основных компонентов пищи равны:
К (белков и углеводов) = 16,5 – 17,2
кДж · г-1,К (жиров) = 37,7 – 39,8 кДж · г-1.
Первое значение (16,5 и 37,7) – нижняя граница. Второе значение (17,2 - 39,8) – верхняя граница.
Слайд 11Закон Гесса
Задача
. Рассчитайте калорийность 300 граммов порции рыбы,
если известно, что в 100 г этого продукта содержится 12 г белка, 8 г жиров и 0,3 г углеводов. Коэффициенты калорийности возьмите по нижней границе.Решение:
К = 3·[16,5 m(б) + 16,5 m(у) + 37,7 m(ж)] [кДж]
К = 1514 кДж (336 кКал)



![Лекция 2
Термохимия. Второй закон термодинамики. Химическое равновесие
Основные Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж ·моль-1].Тепловой эффект процесса равен алгебраической](/img/tmb/7/616660/2b967a4787243990c866c9606aa44a92-800x.jpg)

![Лекция 2
Термохимия. Второй закон термодинамики. Химическое равновесие
Основные ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]Второе следствие закона Гесса:Тепловой эффект ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1]Второе следствие закона Гесса:Тепловой эффект химического процесса равен алгебраической сумме энтальпий](/img/tmb/7/616660/07ff8ae52f0998997088728537913bd8-800x.jpg)