Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 4 Свойства растворов Кубанский государственный аграрный
Содержание
- 1. Лекция 4 Свойства растворов Кубанский государственный аграрный
- 2. Раствор — гомогенная (однородная) смесь, образованная не
- 3. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
- 4. Молярная концентрация – число молей растворенного вещества,
- 5. Титр раствора – число единиц массы растворенного
- 6. Моляльная концентрация – число молей растворенного вещества,
- 7. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВРастворы неэлектролитов не проводят электрический ток
- 8. Свойства растворов неэлектролитов 1) Они обладают осмотическим
- 9. Свойства растворов неэлектролитов1) осмотическое давление Росм для
- 10. Свойства растворов неэлектролитов 2) Давление насыщенного пара
- 11. Свойства растворов неэлектролитов3) Растворы кипят при более
- 12. криоскопическая и эбуллиоскопическая постоянные для водыТемпература кипения
- 13. Сванте Аррениус (1859-1927)В 1903 г получил Нобелевскую премию за разработку теории электролитической диссоциации«Теория электролитической диссоциации»
- 14. Растворение и диссоциация хлороводорода в водеCl -
- 15. Растворение и диссоциация хлороводорода в водеH +H
- 16. Растворение и диссоциация NaCl в водеNa+Сl-Na+Na+Na+Na+Na+Сl-Сl-Сl-Сl-Сl-HHO-2O-22-OO-2H+H+H+H+H+H+NaCl Na+ + Cl-O-2H+H+O-2H+H+O-2H+H+O-2H+H+O-2H+H+O-2H+H+
- 17. Растворение и диссоциация NaCl в водеNa+Сl-Na+Na+Na+Na+Na+Сl-Сl-Сl-Сl-Сl-HHO-2O-22-OO-2H+H+H+H+H+H+NaCl + Н2О Na+•nH2O + Cl-•mH2OO-2H+H+O-2H+H+O-2H+H+O-2H+H+O-2H+H+O-2H+H+
- 18. 3. Основные положения теории электролитической диссоциацииВ момент
- 19. 4. Кислоты, основания, соли и амфотерные соединения
- 20. 4. Кислоты, основания, соли и амфотерные соединения
- 21. 4. Кислоты, основания, соли и амфотерные соединения
- 22. 4. Кислоты, основания, соли и амфотерные соединения
- 23. Влияние радиуса и заряда центрального иона на
- 24. Степень диссоциацииСтепень диссоциации α – число показывающее
- 25. Классификация электролитов по силе
- 26. Закон разбавления ОствальдаCH3COOH ↔ CH3COO- + H+Используя
- 27. Факторы, влияющие на степень диссоциации1. ТемператураСтепень диссоциации
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция 4
Свойства растворов
Кубанский государственный аграрный университет
Кафедра неорганической и аналитической
химии
230400.62 «Информационные системы и технологии»Слайд 2Раствор — гомогенная (однородная) смесь, образованная не менее чем двумя
компонентами, один из которых называется растворителем, а другой растворимым веществом,
это также система переменного состава, находящаяся в состоянии химического равновесия.По агрегатному состоянию растворы делят на твердые, жидкие и газообразные.
Растворение — переход молекул вещества из одной фазы в другую. .
Растворение происходит в результате взаимодействия атомов (молекул) раствори-теля и растворённого вещества и сопровождается увеличением энтропии. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворенного вещества сильно меняются и химические свойства.
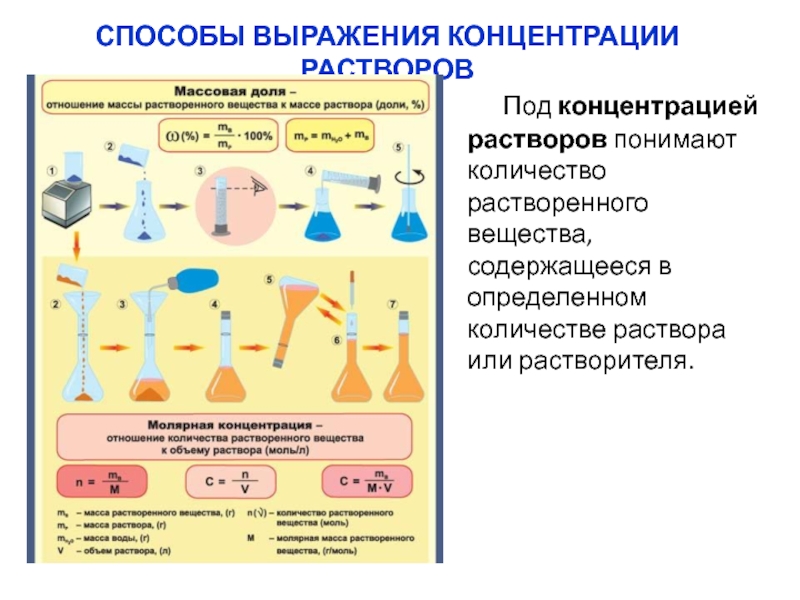
Слайд 3СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Под концентрацией растворов
понимают количество растворенного вещества, содержащееся в определенном количестве раствора или
растворителя.Слайд 4Молярная концентрация – число молей растворенного вещества, содержащегося в 1
л раствора
Нормальная концентрация – число моль-эквивалента растворенного вещества, содержа-щегося
в 1 л раствора, где nЭ = n·ZЭСлайд 5Титр раствора – число единиц массы растворенного вещества, содержащегося в
1 см3 ( 1мл) раствора
Мольная доля
– отношение числа молей раство-ренного вещества к общему числу молей раство-ренного вещества и растворителяСлайд 6Моляльная концентрация – число молей растворенного вещества, содержащегося в 1
кг растворителя
Массовая доля –процентное отношение массы растворенного вещества к массе
раствораСлайд 7РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
Растворы неэлектролитов не проводят электрический ток и в них
растворенное растворенное вещество находится в виде молекул.
Например водный раствор сахара.
Растворы
неэлектролитов своими свойствами приближаются к идеальным растворам, в которых силы межмолекулярного взаимодействия отдельных компонентов одинаковы и между компонентами нет химического взаимодействия Слайд 8Свойства растворов неэлектролитов
1) Они обладают осмотическим давлением Росм
Осмос – это
явление, когда через полупроницаемую мембрану растворитель переходит из разбавленного раствора
в более концентрированный.Осмотическое давление – это гидростатическое давление, которое надо приложить к раствору, чтобы задержать осмос.
Слайд 9Свойства растворов неэлектролитов
1) осмотическое давление Росм для разбавленных растворов пропорционально
молярной концентрации раствора и рассчитывается по формуле Ван-Гоффа
Росм = СМТR
Где
СМ моляльная концентрация, моль/гТ – температура, К,
R – универсальная газовая постоянная
R = 8,314 дж/моль·К
Росм – осмотическое давление, Па
Слайд 10Свойства растворов неэлектролитов
2) Давление насыщенного пара растворителя над растворителем (Ро)
выше, чем над раствором (Р) (1 закон Рауля)
Понижение давления насыщенного пара
растворителя над раствором прямо пропорционально мольной доле растворенного вещества NВ мольная доля растворенного веществаСлайд 11Свойства растворов неэлектролитов
3) Растворы кипят при более высокой и замерзают
при более низкой температуре, по сравнению с чистым растворителем.
(2
закон Рауля)Повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворов
где k – криоскопическая постоянная К (константа понижения температуры замерзания)
или эбуллиоскопическая постоянная Э (константа повышения температуры кипения)
m и М – соответственно масса растворенного вещества (г) и его молярная масса (г/моль)
m1 – масса растворителя (г)
Δt - понижение температуры замерзания или повышение температуры кипения (оС)
Слайд 12криоскопическая и эбуллиоскопическая постоянные для воды
Температура кипения воды -100оС
эбуллиоскопическая постоянная
Э
(моляльная константа повышения температуры кипения)
Э =
0,52 оС/мольТемпература замерзания – 0оС
криоскопическая постоянная К
(моляльная константа понижения температуры замерзания) К = 1,86 оС/моль
Слайд 13Сванте Аррениус
(1859-1927)
В 1903 г получил Нобелевскую премию за разработку теории
электролитической диссоциации
«Теория электролитической диссоциации»
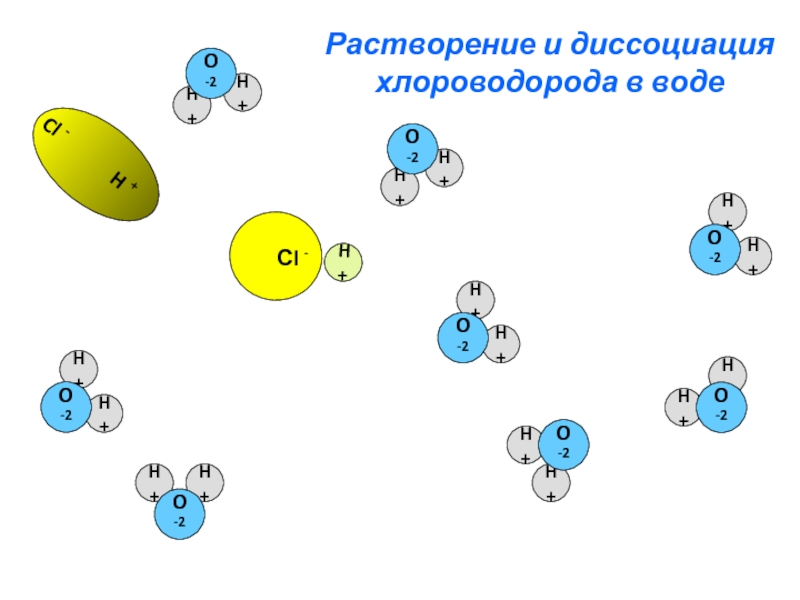
Слайд 14Растворение и диссоциация
хлороводорода в воде
Cl -
H +
H +
H +
O -2
H +
H
+O -2
H +
H +
O -2
H +
H +
O -2
H +
H +
O -2
H +
H +
O -2
H +
H +
O -2
H +
H +
O -2
Сl -
H +
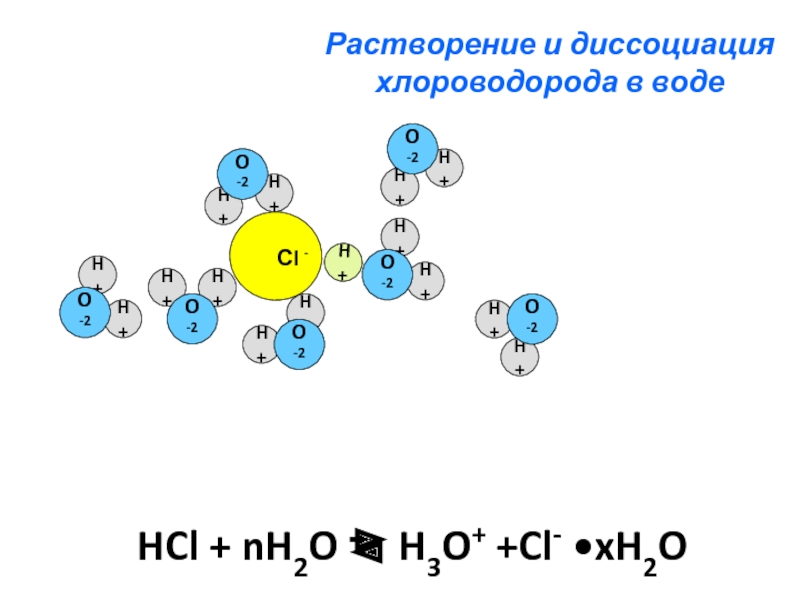
Слайд 15Растворение и диссоциация
хлороводорода в воде
H +
H +
O -2
H +
H +
O
-2
H +
H +
O -2
H +
H +
O -2
H +
H +
O -2
H
+H +
O -2
H +
H +
O -2
HCl + nH2O H3O+ +Cl- •xH2O
Сl -
H +
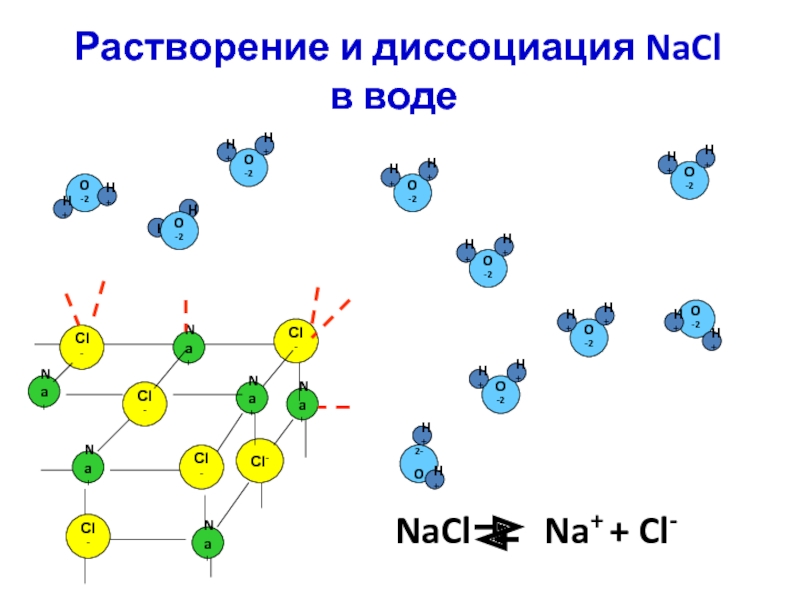
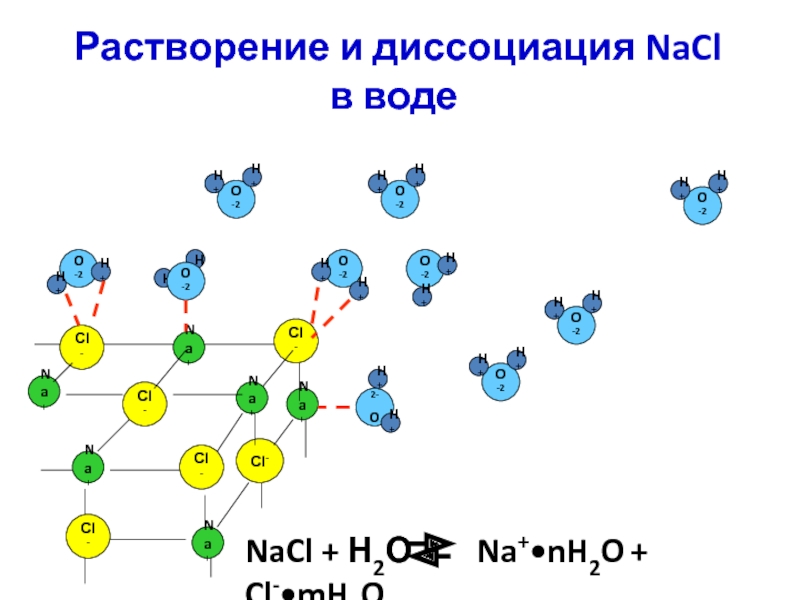
Слайд 16 Растворение и диссоциация NaCl в воде
Na+
Сl-
Na+
Na+
Na+
Na+
Na+
Сl-
Сl-
Сl-
Сl-
Сl-
H
H
O-2
O-2
2-O
O-2
H+
H+
H+
H+
H+
H+
NaCl
Na+ + Cl-
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
Слайд 17 Растворение и диссоциация NaCl в воде
Na+
Сl-
Na+
Na+
Na+
Na+
Na+
Сl-
Сl-
Сl-
Сl-
Сl-
H
H
O-2
O-2
2-O
O-2
H+
H+
H+
H+
H+
H+
NaCl + Н2О
Na+•nH2O + Cl-•mH2O
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
O-2
H+
H+
Слайд 183. Основные положения теории электролитической диссоциации
В момент растворения молекулы электролитов
диссоциируют, распадаются на ионы под действием полярных молекул растворителя
Диссоциации подвергаются
лишь молекулы вещества, характеризующиеся ионной или ковалентной полярной химическими связями.Причиной диссоциации является гидратация полярных молекул или ионов кристаллической решетки растворенного вещества.
Диссоциирующая сила растворения определяется величиной диэлектрической проницаемости ε. Чем больше ε , тем выше диссоциирующая способность растворителя. Наиболее значительная величина ε=81 характеризует полярные молекулы воды.
Ионы в водном растворе находятся в гидратированном состоянии. При этом число гидратированных к иону молекул воды тем больше, чем больше радиус иона и больше его заряд.
Слайд 194. Кислоты, основания, соли и амфотерные соединения в теории электролитической
диссоциации.
Основания
соединения диссоциирующие в водном растворе на катионы металла
(или
NH4+) и гидроксид-анионы.
NH4OH NH4+ + OH-
Процесс диссоциации многоосновных оснований является ступенчатым:
Ca(OH)2 CaOH+ + OH-
CaOH+ Ca 2+ + OH-Слайд 204. Кислоты, основания, соли и амфотерные соединения в теории электролитической
диссоциации.
Кислоты
соединения, диссоциирующие в водном растворе на катионы водорода (протоны) и
анионы кислотного остаткаHNO3 H+ + NO3-
Процесс диссоциации многоосновных кислот является ступенчатым:
H2SO4 H+ + HSO4-
HSO4- H+ + SO42-
Слайд 214. Кислоты, основания, соли и амфотерные соединения в теории электролитической
диссоциации.
Средние соли
соединения, диссоциирующие в водном растворе с образованием катионов металла
и анионов кислотных остатков.Средние соли диссоциируют сразу не ступенчато
Na2SO4 2Na+ + SO42-
Если при диссоциации соли образуется катион металла и анион кислоты содержащий водород, то соль называется кислой солью. Диссоциация такой соли проходит ступенчато:
Na2HPO4 2Na2+ + HPO42-
HPO42- H+ + PO43-
Если при диссоциации соли образуется анион кислоты и катион содержащий гидроксид-анион ОН-, то соль называется основной солью. Диссоциация такой соли проходит ступенчато:
CuOHCl CuOH+ + Cl-
CuOH+ Cu2+ + OH-
Слайд 224. Кислоты, основания, соли и амфотерные соединения в теории электролитической
диссоциации. Амфотерные соединения способные диссоциировать в водном растворе при одних
и тех же условиях с образованием как катиона водорода, так и гидрокисид-аниона.Al 3+ + 3OH- Al(OH)3
H3AlO3↔ 3H+ + AlO3 3-
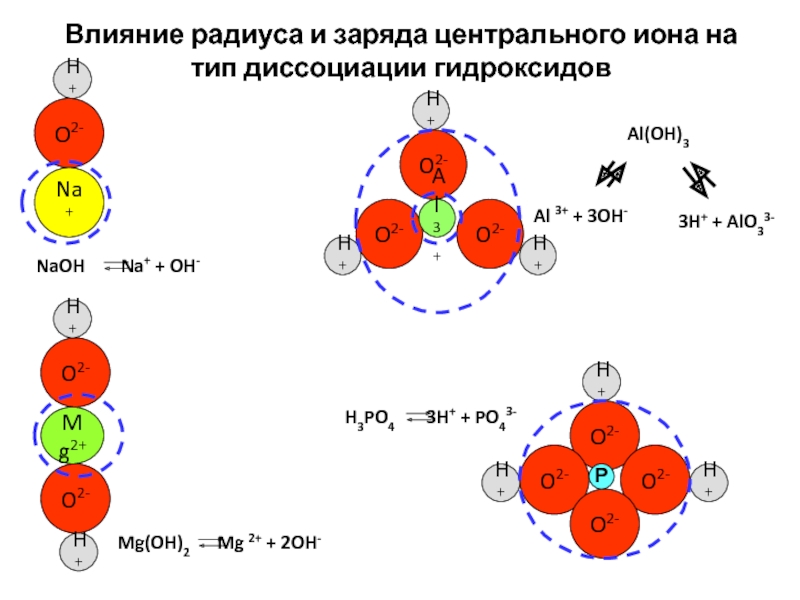
Слайд 23Влияние радиуса и заряда центрального иона на тип диссоциации гидроксидов
NaOH
Na+ + OH-
O2-
O2-
O2-
Al3+
H+
H+
H+
O2-
O2-
O2-
O2-
H+
H+
H+
O2-
Mg2+
H+
O2-
H+
O2-
Na+
H+
Mg(OH)2 Mg 2+
+ 2OH-H3PO4 3H+ + PO43-
Р
Al(OH)3
Al 3+ + 3OH-
3H+ + AlO33-
Слайд 24Степень диссоциации
Степень диссоциации α – число показывающее какая часть молекул
электролита находится в растворе в виде ионов.
Слайд 26Закон разбавления Оствальда
CH3COOH ↔ CH3COO- + H+
Используя закон действующих масс
получим выражение константы равновесия реакции диссоциации кислоты:
(1)Учитывая, что при диссоциации кислоты число продиссоциировавших молекул кислоты равно числу протонов и числу ацетат ионов, то можно записать
(2)
Объединяя уравнения (1) и (2) запишем:
Вводим упрощение если α ≤ 0,03 то 1- α ≈ 1, и тогда
Кд = α2См
Слайд 27Факторы, влияющие на степень диссоциации
1. Температура
Степень диссоциации возрастает при повышении
температуры
2. Концентрация электролита в растворе
Степень диссоциации возрастает при увеличении разбавления
раствора3. Влияние добавок
Согласно принципу Ле Шателье: равновесие смещается так, чтобы компенсировать внешнее воздействие.
Например: диссоциация уксусной кислоты
CH3COOH ↔ CH3COO- + H+
Если в раствор добавить сильную кислоту Н+, или ацетат ион (СН3СООNa), то равновесие сместится в сторону исходных веществ (влево) т.е. степень диссоциации уменьшится Если добавить щелочь (ОН-), то произойдет взаимодействие Н+ + ОН- = Н2О и образуется малодиссоциирующее вещество вода, тогда равновесие сместится в сторону продуктов реакции (влево) и степень диссоциации увеличится