Слайд 1Теория электролитической диссоциации. Свойства разбавленных растворов электролитов
Лекция №7
Слайд 2↑ План лекции.
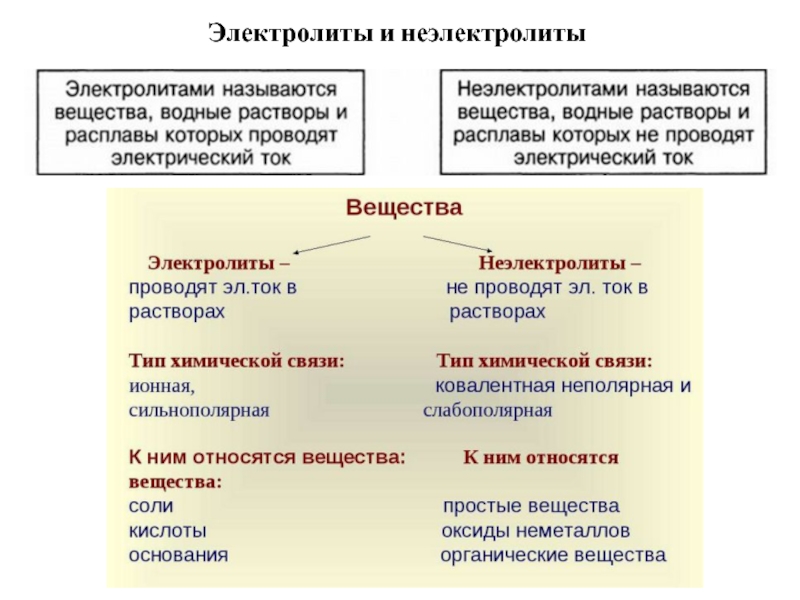
Отклонение поведения растворов электролитов от неэлектролитов.
Теория электролитической
диссоциации (ТЭД) Аррениуса.
3. Кислоты, основания, щелочи с точки зрения ТЭД
Степень
диссоциации электролитов
5. Способы выражения концентраций растворов.
6. Ионные реакции.
Слайд 41. Отклонение поведения растворов электролитов от неэлектролитов.
i- изотонический коэффициент показывает
меру отклонения поведения растворов электролитов от неэлектролитов. ( i эл.>1).
Закон
Вант-Гоффа для растворов электролитов:
Росм. эл. = i СмRT
i- изотонический коэффициент
См – молярная концентрация, моль/л,
R - универсальная газовая постоянная 8,31 Дж/моль·К,
Т – температура, К.
Слайд 5Законы Рауля для растворов электролитов:
Δ t кип. эл. = i
ЕСm
Δ t зам. эл. = i КСm
Сm- моляльная концентрация, моль/кг
р-ля
Е - эбуллиоскопическая постоянная,
К- криоскопическая постоянная
i- изотонический коэффициент
Слайд 62. Теория электролитической диссоциации
Аррениуса (ТЭД)
1. Молекулы электролитов при растворении или
плавлении распадаются на ионы.
2. При пропускании электрического тока через раствор
или расплав электролита положительные ионы движутся к катоду (это катионы), а отрицательные – к аноду (это анионы).
3. Диссоциация – процесс обратимый.
Слайд 73. Кислоты, основания, щелочи с точки зрения ТЭД
Кислоты - это
электролиты, которые при диссоциации в качестве катионов образуют только ионы
:
Основания - это электролиты, которые при диссоциации в качестве анионов, образуют гидроксид-ионы :
Соли – это электролиты, которые при диссоциации образуют катионы метало и анионы кислотных остатков:
Слайд 84. Степень диссоциации электролитов
Степень диссоциации (α) равна отношению
продиссоциированных молекул вещества n к общему числу его молекул N.
Выражается в долях или процентах.
Слайд 9Связь между изотоническим коэффициентом i и степенью диссоциации α
При растворении электролита он диссоциирует на ионы и число
частиц в растворе электролита больше, чем в растворе неэлектролита.
Степень диссоциации электролита зависит от числа ионов, образующихся при диссоциации 1 молекулы его и от изотонического коэффициента:
Слайд 10Факторы, влияющие на степень диссоциации электролита
1. Природа растворителя
2. Природа растворенного
вещества
3. Температура (t)
4. Концентрация раствора (С)
5. Наличие одноименных ионов
Слайд 115 . Способы выражения концентрации растворов
1. Массовая доля, С, %
- показывает сколько граммов растворенного вещества содержится в 100 г
раствора
2. Молярная концентрация, ,М, моль/л – показывает сколько моль растворенного в-ва содержится в 1 л раствора
Слайд 123. Моляльная концентрация, , моль/кг растворителя.
- показывает сколько моль растворенного вещества содержится в
1 кг растворителя
4. Нормальная концентрация, , экв/л – показывает сколько эквивалентов растворенного вещества содержится в 1 литре раствора
Слайд 135. Титр, Т, г/мл – показывает сколько граммов растворенного вещества
содержится в 1 мл раствора
6. Мольная доля, N, показывает отношение
количества растворенного вещества к количеству всех компонентов раствора
Слайд 14 6. Ионные реакции.
1.Ионные реакции идут, если образуется осадок, газ
или слабый электролит.
2. В виде ионов в ионных реакциях записывают
сильные кислоты, сильные основания и растворимые соли.
Пример.