Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлические элементы 3-А группы
Содержание
- 1. Металлические элементы 3-А группы
- 2. Характеристика элементов по положению в ПС
- 3. Открытие металлов. Металлы в природеАлюминий – руда
- 4. Получение металловAl – электролиз расплава оксида с
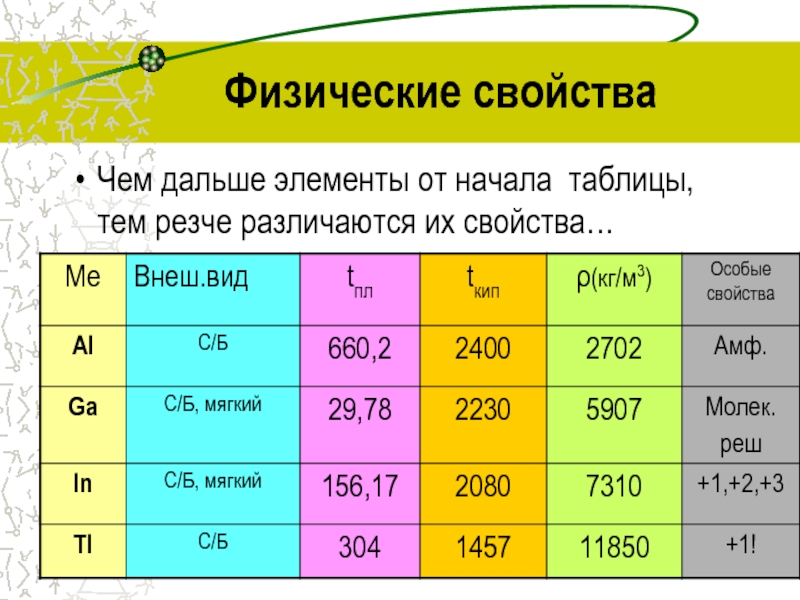
- 5. Физические свойстваЧем дальше элементы от начала таблицы, тем резче различаются их свойства…
- 6. Характеристика химических свойств элементов и их соединенийАлюминийГаллийИндийТаллий
- 7. Алюминий Химический элементЭлектронная формула – 1s22s2p63s2p1Характерная степень
- 8. Алюминий Простое вещество1. Взаимодействие с кислотами: 2Al +
- 9. Оксид алюминия Al2O3 – типичный амфотерный оксидС
- 10. Гидроксид алюминия Типичный амфотерный гидроксид С кислотами образует
- 11. Соли алюминияГалогениды – белые кристаллические, хорошо растворимы
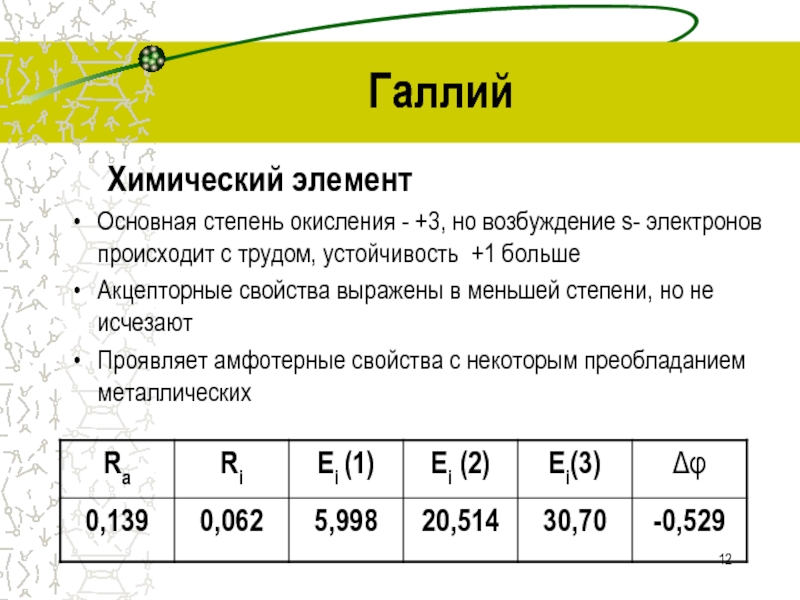
- 12. Галлий Химический элементОсновная степень окисления - +3,
- 13. Галлий Простое веществоПри затвердевании расширяется на 3,2%Имеет
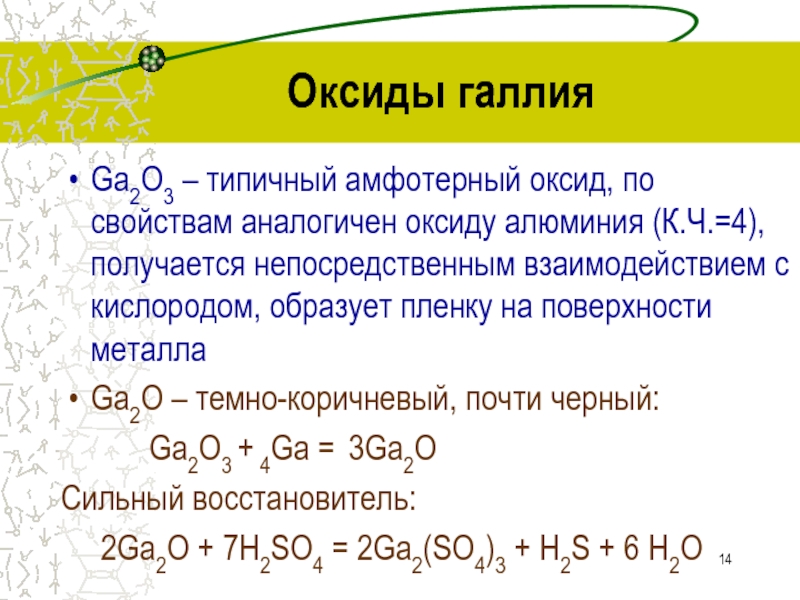
- 14. Оксиды галлияGa2O3 – типичный амфотерный оксид, по
- 15. Гидроксид галлияGa(OН)3 – идеально амфотерен, осадок белого
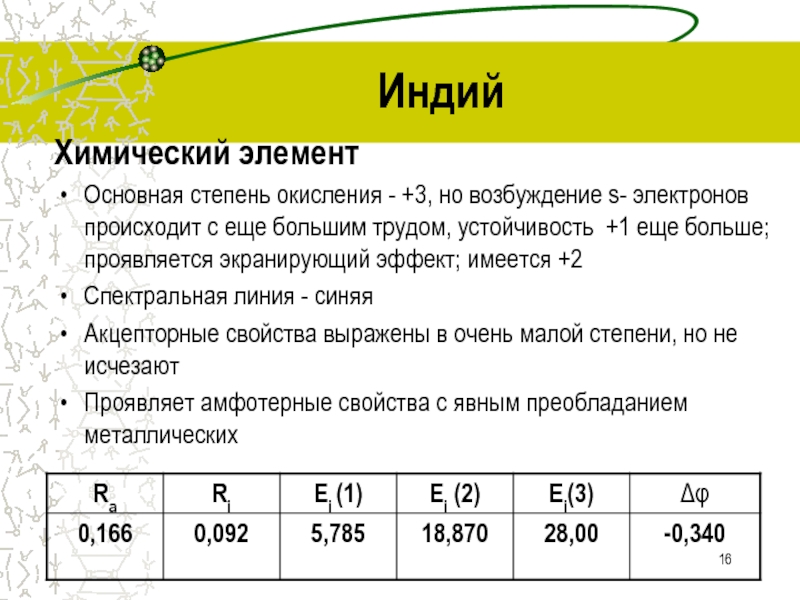
- 16. Индий Химический элементОсновная степень окисления - +3,
- 17. Индий Простое вещество1. Неординарное сочетание мягкости, прочности и
- 18. Оксиды индия Трем степеням окисления соответствуют три
- 19. Гидроксид индия In(ОН)3По внешнему виду похож на
- 20. Соединения индия Используются редко, только в лабораторной
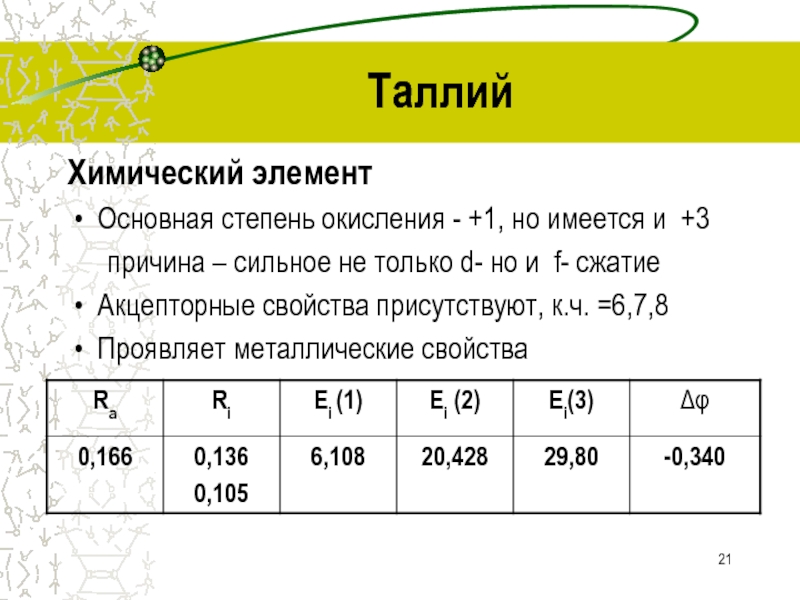
- 21. Таллий Химический элемент Основная степень окисления -
- 22. Таллий Простое вещество1. Белый металл с голубоватым
- 23. Оксиды и гидроксиды таллия Оксиды 1. Tl2O – вещество
- 24. Применение Алюминий – сплавы, электротехникаГаллий – полупроводники,
- 25. Спасибо за внимание!
- 26. Скачать презентанцию
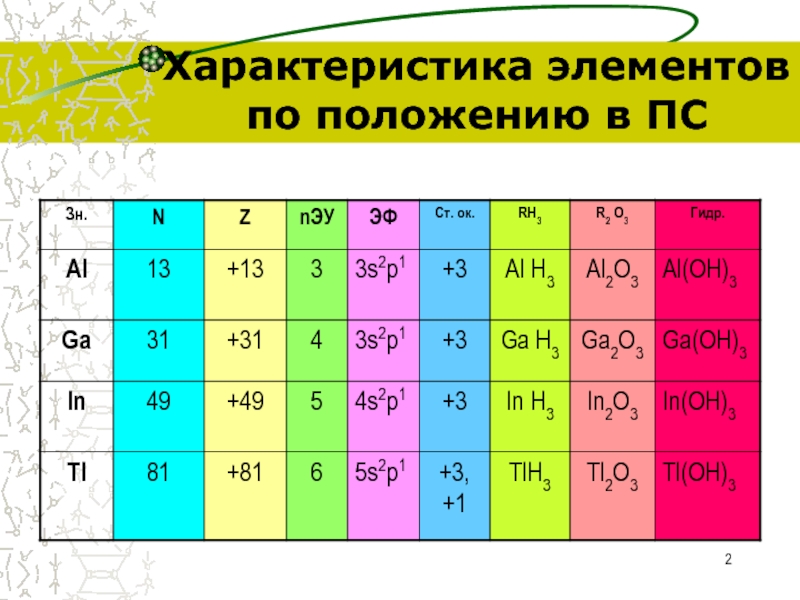
Характеристика элементов по положению в ПС
Слайды и текст этой презентации
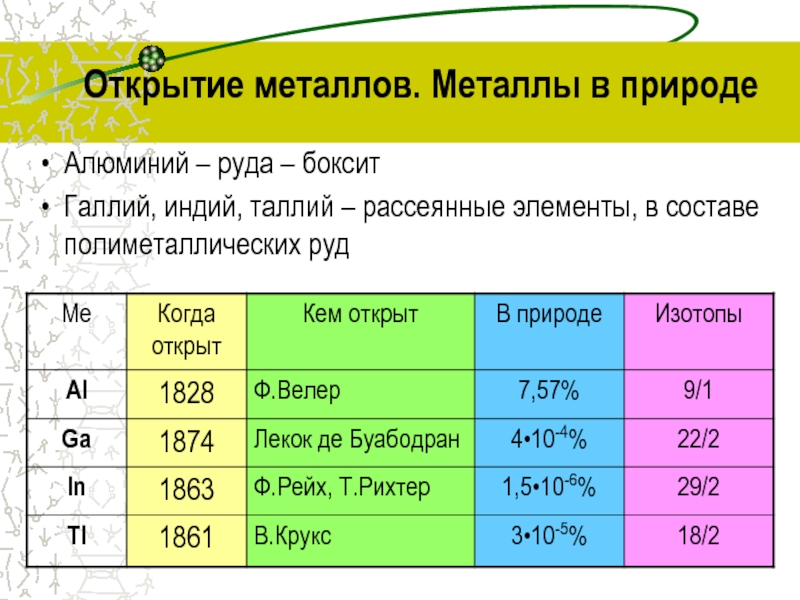
Слайд 3Открытие металлов. Металлы в природе
Алюминий – руда – боксит
Галлий, индий,
таллий – рассеянные элементы, в составе полиметаллических руд
Слайд 4Получение металлов
Al – электролиз расплава оксида с добавлением криолита Na3[AlF6]
Ga,
In, Tl - рассеянные элементы, для выделения используют пирометаллургические, гидрометаллургические
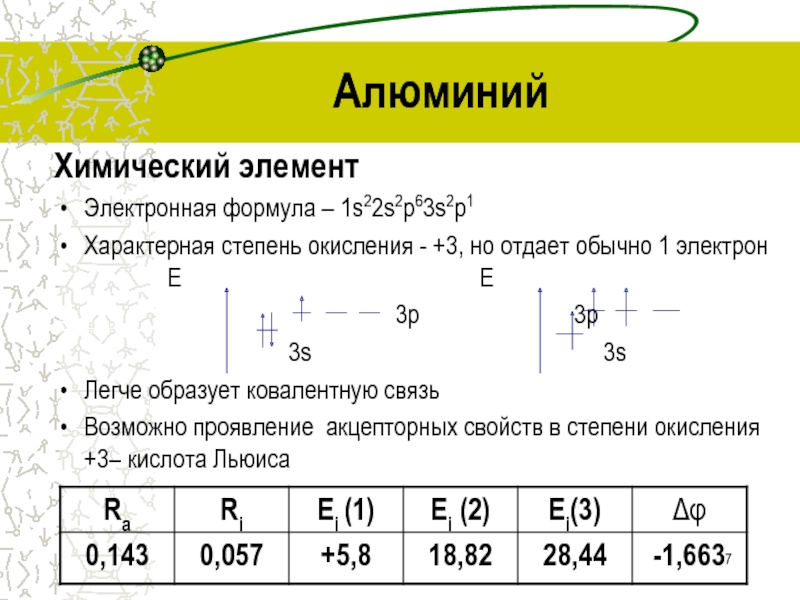
и электролитические методыСлайд 7Алюминий
Химический элемент
Электронная формула – 1s22s2p63s2p1
Характерная степень окисления - +3,
но отдает обычно 1 электрон
E E3p 3p
3s 3s
Легче образует ковалентную связь
Возможно проявление акцепторных свойств в степени окисления +3– кислота Льюиса
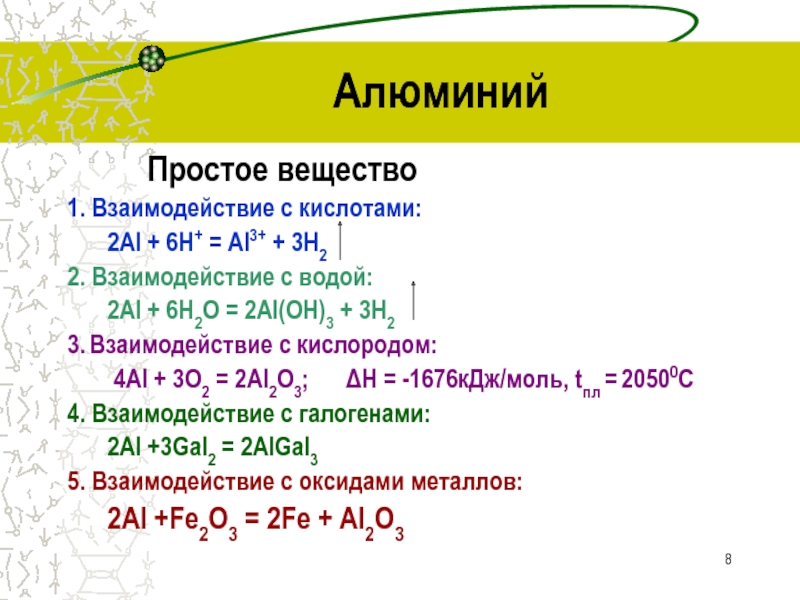
Слайд 8Алюминий
Простое вещество
1. Взаимодействие с кислотами:
2Al + 6H+ = Al3+
+ 3H2
2. Взаимодействие с водой:
2Al + 6H2О = 2Al(ОН)3 +
3H23. Взаимодействие с кислородом:
4Al + 3О2 = 2Al2О3; ΔН = -1676кДж/моль, tпл = 20500С
4. Взаимодействие с галогенами:
2Al +3Gal2 = 2AlGal3
5. Взаимодействие с оксидами металлов:
2Al +Fe2O3 = 2Fe + Al2O3
Слайд 9Оксид алюминия
Al2O3 – типичный амфотерный оксид
С кислотами образует соли:
Al2О3
+ 6H+ = 2Al3+ + 3H2О, в растворе – [Al(H2О)3
]3+С растворами щелочей образует комплексные соединения:
Al2О3 + 2NaOH + 7H2О = 2Na[Al(OH)4 (H2О)2 ]
При сплавлении со щелочами образует безводные метаалюминаты: Al2О3 + 2NaOH = 2NaAlО2
Взаимодействует с кислотными и основными оксидами с образованием солей:
Al2О3 + 3N2O5 = 2Al(NO3)3 ; Al2О3 + СaO = Сa(AlО)2
Взаимодействует с солями, растворы которых имеют кислую или щелочную среду:
Al2О3 + 6NaНSO4 = Al2(SО4)3 +3Na2SO4 + 3H2О; Al2О3 + Na2СO3 = 2NaAlО2 + СО2
Слайд 10Гидроксид алюминия
Типичный амфотерный гидроксид
С кислотами образует соли:
Al(ОН)3 + 3H+
= [Al(H2О)3 ]3+
С растворами щелочей образует соли:
Al(ОН)3 + 3NaOH =
Na3[Al(OH)6 ]Термически неустойчив:
Al(ОН)3 = AlО(ОН) + Н2О – метагироксид, t = 2000С
2 AlО(ОН) = Al2О3 + Н2О, t = 4000С
При сплавлении со щелочами образуются соли орто- и метаалюминиевых кислот:
Al(ОН)3 + КОН = К AlО2 + 2Н2О
Слайд 11Соли алюминия
Галогениды – белые кристаллические, хорошо растворимы в воде, гидролизуются
по катиону, AlCl3 – промышленный катализатор
Сульфат алюминия - Al2(SО4)3 •
18Н2О – бесцветное кристаллическое вещечство, хорошо растворим, используется для протравки тканей перед крашением и для удаления из воды взвешенных примесей (коагулянт)Природные алюмосиликаты – драгоценные и поделочные материалы – рубин, сапфир, ортоклаз
Слайд 12Галлий
Химический элемент
Основная степень окисления - +3, но возбуждение s-
электронов происходит с трудом, устойчивость +1 больше
Акцепторные свойства выражены в
меньшей степени, но не исчезаютПроявляет амфотерные свойства с некоторым преобладанием металлических
Слайд 13Галлий
Простое вещество
При затвердевании расширяется на 3,2%
Имеет молекулярное строение, молекулы
сохраняются и в жидком состоянии
Модификации
По химическим свойствам близок к
алюминиюСлайд 14Оксиды галлия
Ga2O3 – типичный амфотерный оксид, по свойствам аналогичен оксиду
алюминия (К.Ч.=4), получается непосредственным взаимодействием с кислородом, образует пленку на
поверхности металлаGa2O – темно-коричневый, почти черный:
Ga2O3 + 4Ga = 3Ga2O
Сильный восстановитель:
2Ga2O + 7H2SO4 = 2Ga2(SO4)3 + H2S + 6 H2O
Слайд 15Гидроксид галлия
Ga(OН)3 – идеально амфотерен, осадок белого цвета, аналог гидроксида
алюминия
При взаимодействии с растворами щелочей образует галлаты (координационные соединения), причем
осадок должен быть свежим, координационное число равно 4 Может быть получен взаимодействием оксида с водой
Ga2O3 + 3H2O = 2Ga(OН)3
Слайд 16Индий
Химический элемент
Основная степень окисления - +3, но возбуждение s-
электронов происходит с еще большим трудом, устойчивость +1 еще больше;
проявляется экранирующий эффект; имеется +2Спектральная линия - синяя
Акцепторные свойства выражены в очень малой степени, но не исчезают
Проявляет амфотерные свойства с явным преобладанием металлических
Слайд 17Индий
Простое вещество
1. Неординарное сочетание мягкости, прочности и хрупкости:
в 20
раз пластичнее золота
как графит, оставляет черную черту на бумаге
при ударе
может разрушаться, прочность на разрыв в 6 раз меньше, чем у свинца2. По химическим свойствам – металл, расположен в РАМ между железом и оловом, взаимодействует с кислотами:
2In + 6HCl =2InCl3 + 3H2
3. Со щелочами образует индаты – Ме3[In(OH)6]•2H2O
4. С кислородом и неметаллами взаимодействует при нагревании с образованием соединений In+3
Слайд 18Оксиды индия
Трем степеням окисления соответствуют три оксида: In2О3 ,
InО, In2О
In2О3: 4 In + 3О2 = 2In2О3; ΔН =
-928 кДж/мольвещество желтого цвета, при 8500С переходит в In3О4
InО – в твердом состоянии не обнаружен, не изучен, получается в парáх: In2О3 = InО + О
In2О – вещество черного цвета, получается по реакции: 2In + СО2 = In2О + СО
Слайд 19Гидроксид индия
In(ОН)3
По внешнему виду похож на гидроксид алюминия
Обладает амфотерными
свойствами, но в кислотах растворяется легче, в щелочах – при
высоких концентрациях и нагреванииПри нагревании разлагается с образованием оксида
Слайд 20Соединения индия
Используются редко, только в лабораторной практике
Ионы индия –
In3+ - бесцветны, в растворах гидратированы (К.Ч.=6)
Соли подвергаются гидролизу по
катионуНаиболее интересны:
Нитрат – In(NO3)3 – при нагревании разлагается с образованием оксида, возгоняется
Хлорид – InCl3 – возгоняется без разложения
Сульфат – In2(SO4)3 – образует кристаллогидраты – квасцы со щелочными металлами
Слайд 21Таллий
Химический элемент
Основная степень окисления - +1, но имеется
и +3
причина – сильное не только d- но и f-
сжатиеАкцепторные свойства присутствуют, к.ч. =6,7,8
Проявляет металлические свойства
Слайд 22Таллий
Простое вещество
1. Белый металл с голубоватым оттенком:
2. По
химическим свойствам – металл, расположен в РАМ до водорода, сравним
со щелочными металлами:взаимодействует с водой: Tl + H2O + O = TlOH
вытесняет водород из спиртов: Tl +C2H5OH + O = C2H5OTl + H2O
взаимодействует с кислотами (кроме соляной, хлорид не растворим)
3. Со щелочами не взаимодействует
4. С кислородом и неметаллами взаимодействует при нагревании с образованием соединений In+1
Ядовит сам и его соединения!
Слайд 23Оксиды и гидроксиды таллия
Оксиды
1. Tl2O – вещество черного цвета, основный
оксид
2. Tl2O3 – вещество бурого цвета, основный оксид
3. Tl3O4 –
промежуточный оксидTl2O + О2 Tl2O3
Гидроксиды
TlOН – аналогичен гидроксидам щелочных металлов; вещество желтого цвета, устойчив, раствор поглощает СО2
Tl(OН)3 – неустойчив, осадок бурого цвета, основание
Из соединений интересны галогениды – образуют комплексы между собой: 3TlCl3 = Tl[TlCl4]+Cl2
Слайд 24Применение
Алюминий – сплавы, электротехника
Галлий – полупроводники, оптика
Индий – полупроводники,
легкоплавкие сплавы, отражатели, атомная энергетика
Таллий – яды-зооциды, оптика, низкотемпературные сплавы,
кислотоустойчивые сплавы

![Металлические элементы 3-А группы Получение металловAl – электролиз расплава оксида с добавлением криолита Na3[AlF6]Ga, In, Получение металловAl – электролиз расплава оксида с добавлением криолита Na3[AlF6]Ga, In, Tl - рассеянные элементы, для выделения](/img/thumbs/961e830e3be3e49594cb225db05bfb77-800x.jpg)


![Металлические элементы 3-А группы Гидроксид алюминия Типичный амфотерный гидроксид С кислотами образует соли: Al(ОН)3 + 3H+ = Гидроксид алюминия Типичный амфотерный гидроксид С кислотами образует соли: Al(ОН)3 + 3H+ = [Al(H2О)3 ]3+С растворами щелочей образует соли: Al(ОН)3](/img/thumbs/7bd476cdb3dba6b5dfbb610207205908-800x.jpg)