Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы количественного определения антибиотиков
Содержание
- 1. Методы количественного определения антибиотиков
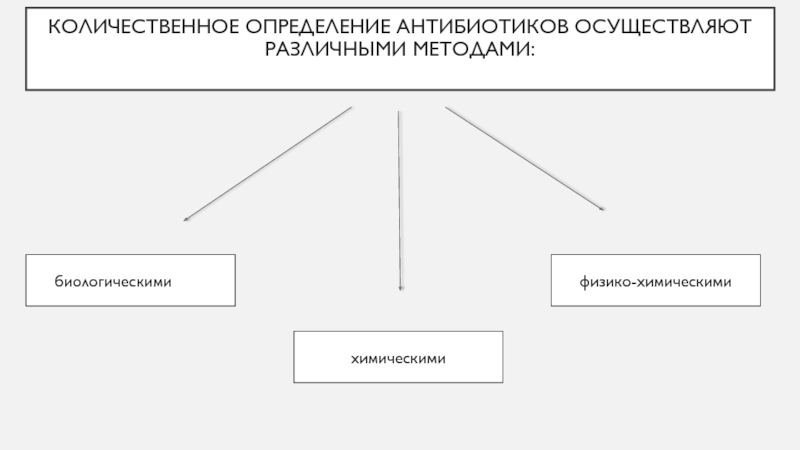
- 2. физико-химическимихимическими биологическимиКоличественное определение антибиотиков осуществляют различными методами:
- 3. Однако биологические методы определения антибиотиков имеют и
- 4. Биологические методы количественного определения антибиотиковНаиболее широкое распространение
- 5. Метод последовательных разведений Данный метод используется для
- 6. Слайд 6
- 7. Метод последовательных разведений Методом последовательных разведений можно
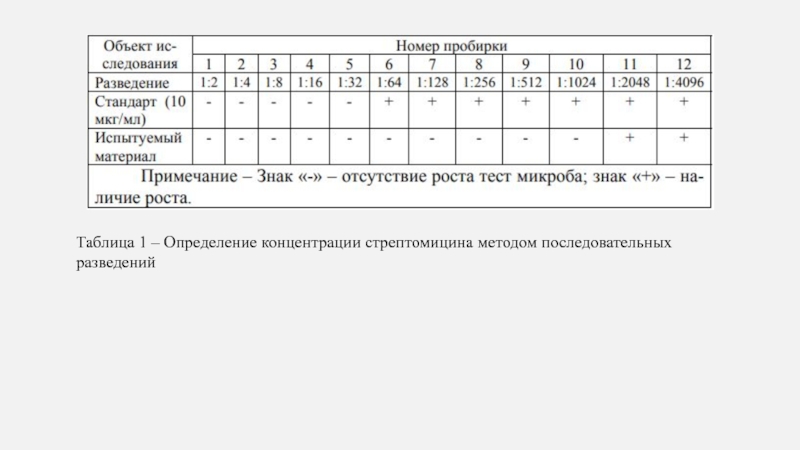
- 8. Таблица 1 – Определение концентрации стрептомицина методом последовательных разведений
- 9. В данном случае (таблице 1) 10 мкг/мл
- 10. 1) тщательная стерильность проведения анализов; Метод последовательных
- 11. Определение антибиотической активности Методом серийных разведений можно
- 12. Диффузионные методыКоличественное определение антибиотиков диффузионными методами основано
- 13. Используя этот метод, можно примерно в два
- 14. Таблица 2 – Величина зон угнетения роста
- 15. Анализы необходимо проводить через определенный интервал времени,
- 16. Рисунок 3 – Определение биологической активности антибиотиков диффузионным методом с использованием металлических цилиндриков
- 17. Метод с применением лунок в толще агара.
- 18. Метод использования дисков фильтровальной бумаги. На поверхность
- 19. Турбидиметрические методы Метод основан на измерении концентрации
- 20. Спасибо за внимание!
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Методы количественного определения антибиотиков
Научный рук. Е.В. Бибарцева
Автор Т.С. Шостак
Соавтор А.Н. СизенцовСлайд 2физико-химическими
химическими
биологическими
Количественное определение антибиотиков осуществляют различными методами:
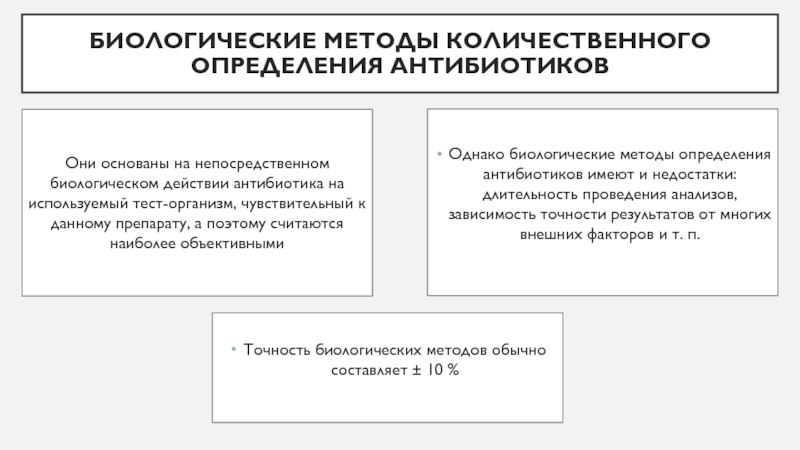
Слайд 3Однако биологические методы определения антибиотиков имеют и недостатки: длительность проведения
анализов, зависимость точности результатов от многих внешних факторов и т.
п.Точность биологических методов обычно составляет ± 10 %
Они основаны на непосредственном биологическом действии антибиотика на используемый тест-организм, чувствительный к данному препарату, а поэтому считаются наиболее объективными
Биологические методы количественного определения антибиотиков
Слайд 4Биологические методы количественного определения антибиотиков
Наиболее широкое распространение среди биологических методов
количественного определения антибиотиков получили
метод последовательных разведений,
диффузионный
турбидиметрический метод.
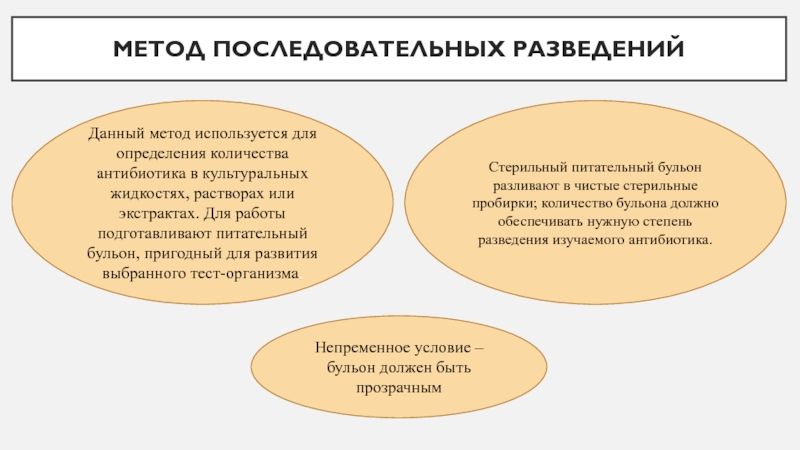
Слайд 5Метод последовательных разведений
Данный метод используется для определения количества антибиотика
в культуральных жидкостях, растворах или экстрактах. Для работы подготавливают питательный
бульон, пригодный для развития выбранного тест-организма.Непременное условие – бульон должен быть прозрачным
Стерильный питательный бульон разливают в чистые стерильные пробирки; количество бульона должно обеспечивать нужную степень разведения изучаемого антибиотика.
Слайд 7Метод последовательных разведений
Методом последовательных разведений можно определить количество антибиотика
не только в условных единицах разведения, но и в весовых
или стандартных единицах. Для этой цели титрование (разведение) должно проводиться стандартным раствором данного антибиотика, имеющего известную активность, выраженную в мкг/мг или в ед/мг препарата.Разведение испытуемой жидкости и разведение стандартного раствора антибиотика необходимо проводить в бульоне с фосфатным буфером при рН 7,8-8,0.
Пример расчета приведен в таблице 1
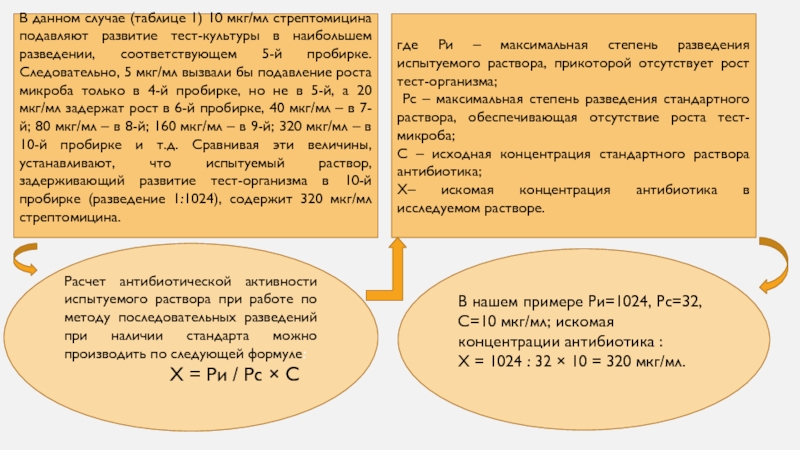
Слайд 9В данном случае (таблице 1) 10 мкг/мл стрептомицина подавляют развитие
тест-культуры в наибольшем разведении, соответствующем 5-й пробирке. Следовательно, 5 мкг/мл
вызвали бы подавление роста микроба только в 4-й пробирке, но не в 5-й, а 20 мкг/мл задержат рост в 6-й пробирке, 40 мкг/мл – в 7-й; 80 мкг/мл – в 8-й; 160 мкг/мл – в 9-й; 320 мкг/мл – в 10-й пробирке и т.д. Сравнивая эти величины, устанавливают, что испытуемый раствор, задерживающий развитие тест-организма в 10-й пробирке (разведение 1:1024), содержит 320 мкг/мл стрептомицина.где Ри – максимальная степень разведения испытуемого раствора, прикоторой отсутствует рост тест-организма;
Рс – максимальная степень разведения стандартного раствора, обеспечивающая отсутствие роста тест-микроба;
С – исходная концентрация стандартного раствора антибиотика;
Х– искомая концентрация антибиотика в исследуемом растворе.
В нашем примере Ри=1024, Рс=32, С=10 мкг/мл; искомая концентрации антибиотика :
X = 1024 : 32 × 10 = 320 мкг/мл.
Расчет антибиотической активности испытуемого раствора при работе по методу последовательных разведений при наличии стандарта можно производить по следующей формуле:
Х = Ри / Рс × С
Слайд 101) тщательная стерильность проведения анализов;
Метод последовательных разведений может дать
сопоставимые результаты лишь при соблюдении определенных условий, а именно:
4)
определенная длительность инкубации пробирок, засеянных тест-культурой3) внесение определенного количества клеток или спор тест-Организм
2) использование постоянных сред для разведения одного итого же антибиотика
Слайд 11Определение антибиотической активности
Методом серийных разведений можно производить и на
чашках Петри. В пробирки, содержащие по 9 мл расплавленного питательного
агара, вносят по 1 мл определенного разведения изучаемого антибиотика или культуральной жидкости. После тщательного перемешивания содержимое пробирки выливают в чашку Петри и дают агару застыть. Затем по поверхности пластинки штрихами производят посев тест-организмов. Чашки выдерживают в термостате при оптимальной для используемых тест-организмов температуре в течение 20-21ч.Преимущество этого метода по сравнению с пробирочным методом разведений состоит в том, что в данном случае каждое разведение изучаемого препарата может быть использовано для многих тест-организмов.
Слайд 12Диффузионные методы
Количественное определение антибиотиков диффузионными методами основано на способности антибиотических
веществ диффундировать в агаровых средах и образовывать зоны, в которых
не развиваются используемые тест-организмы.Величина зоны диффузии антибиотика зависит, прежде всего, от химической природы антибиотического вещества и его концентрации, состава агаровой среды, ее рН, температуры и других факторов, которые необходимо учитывать при проведении анализа.
Антибиотики-полипептиды, обладающие большой и сложной молекулой, диффундируют гораздо медленнее, чем, например, антибиотики ациклического строения или антибиотики тетрациклиновой природы и гетероциклического строения. Поэтому для количественного определения антибиотиков, трудно диффундирующих в агаризованных средах, необходимо подбирать условия, обеспечивающие лучшую их диффузию. К таким условиям можно отнести добавление к среде отдельных веществ, повышающих диффузию антибиотиков.
Слайд 13Используя этот метод, можно примерно в два раза увеличить скорость
диффузии антибиотика при нормальном периоде роста тест-организма. Концентрации испытуемых антибиотиков
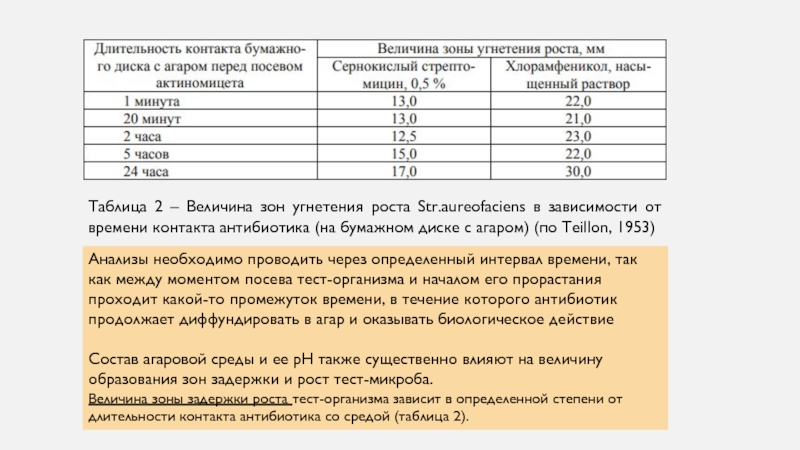
не должны быть слишком высокими, так как установлено, что диаметр зоны задержки роста тест-организма есть линейная функция логарифмов концентрации антибиотика, но лишь в определенных пределах концентрации. Так, увеличение концентрации неомицина выше 5 % по существу не сказывается на величине зоны задержки роста тест-микроба. Величина зоны задержки роста тест-организма зависит в определенной степени от длительности контакта антибиотика со средой (таблица 2)Слайд 14Таблица 2 – Величина зон угнетения роста Str.aureofaciens в зависимости
от времени контакта антибиотика (на бумажном диске с агаром) (по
Teillon, 1953)Анализы необходимо проводить через определенный интервал времени, так как между моментом посева тест-организма и началом его прорастания проходит какой-то промежуток времени, в течение которого антибиотик продолжает диффундировать в агар и оказывать биологическое действие
Состав агаровой среды и ее рН также существенно влияют на величину образования зон задержки и рост тест-микроба.
Величина зоны задержки роста тест-организма зависит в определенной степени от длительности контакта антибиотика со средой (таблица 2).
Слайд 15Анализы необходимо проводить через определенный интервал времени, так как между
моментом посева тест-организма и началом его прорастания проходит какой-то промежуток
времени, в течение которого антибиотик продолжает диффундировать в агар и оказывать биологическое действие.Состав агаровой среды и ее рН также существенно влияют на величину образования зон задержки и рост тест-микроба.
Стрептомицин, стрептотрицин, неомицин проявляют антибиотические свойства более сильно в щелочной среде (рН 7,5-8,0), тетрациклиновые антибиотики наиболее активны в слабо-кислой зоне (рН среды 6,3-6,4)
Применение в опытах постоянной плотности вегетативных микробных клеток и спор тест-организма в агаровой среде дает возможность получать зоны угнетения роста используемой тест-культуры соответствующей величины с резко очерченными краями.
Разработаны соответствующие поправки, которые необходимо вносить при использовании взвеси спор тест-организмов в процессе определения биологической активности антибиотиков. Поправки по отношению к числовому эквиваленту мутности для взвесей тифозных бактерий следующие:
-Споры L2 (типа B.subtilis) .......................1/12
-Споры В.mycoides ....................................1/6
-Споры В.mycoides (гладкий вариант) .….1/5
Зная эти поправки, можно рассчитать число спор в 1 мл суспензии.
Слайд 16Рисунок 3 – Определение биологической активности антибиотиков диффузионным методом с
использованием металлических цилиндриков
Слайд 17Метод с применением лунок в толще агара.
В толще агаровой
пластинки делают лунки диаметром 8 мм. используя пробочное сверло соответствующего
диаметра или специально сделанное приспособление, состоящее из резиновой груши, в которую вставляют заостренную с одного конца металлическую трубочку с внешним диаметром 8 мм. Блочки, надрезанные пробочным сверлом на всю глубину агаровой пластинки, удаляют с помощью стерильного скальпеля или специального крючка. В одни лунки вносят раствор испытуемого антибиотика, а в другие – стандартный раствор антибиотика (рисунок 4).Рисунок 4 – Определение антибиотической активности препаратов в кюветах с использованием лунок в толще агара
Метод лунок имеет некоторые преимущества по сравнению с первым методом (нет необходимости в очистке и стерилизации цилиндриков).
Слайд 18Метод использования дисков фильтровальной бумаги.
На поверхность питательного агара, засеянного
тест-организмом, помещают диски фильтровальной бумаги, пропитанные испытуемым раствором антибиотика. В
качестве стандарта используют диски, смоченные раствором антибиотика известной концентрации, или специально приготовленные диски, содержащие уже известное количество антибиотиков. Дальнейшие операции проводят так же, как и при работе с применением лунок в толще агара. В некоторых случаях при использовании бумажных дисков получаются зоны неправильной формы. Это связано с тем, что в данном случае диск фильтровальной бумаги оказывается хроматограммой изучаемого антибиотика и препарат концентрируется в одном участке диска.Слайд 19Турбидиметрические методы
Метод основан на измерении концентрации клеток тест-микроба, образующих
определенную оптическую плотность среды (мутность) в результате роста в присутствии
небольших количеств антибиотика. В присутствии небольших количеств антибиотика не происходит полного подавления роста тест-микроба, а лишь задержка темпа их роста, что и сказывается на оптической плотности бульона.Турбидиметрические методы определения антибиотиков обычно неприемлемы для плотно окрашенных растворов
Эти методы пригодны для количественного определения любых антибиотиков при условии наличия стандартного раствора изучаемого препарата. При подборе быстрорастущих организмов, используемых в качестве тест-объектов, турбидиметрический метод можно использовать как экспресс метод – ответ получают через 3,5-4 ч.