Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы разделения и концентрирования Спецкурс Лектор – проф. С.Г. Дмитриенко
Содержание
- 1. Методы разделения и концентрирования Спецкурс Лектор – проф. С.Г. Дмитриенко
- 2. Лекция 2 Жидкость - жидкостная экстракция органических соединений и ионов металлов1. Жидкостная экстракция органических соединений
- 3. ПРИ ОПИСАНИИ Э. И ВЫБОРЕ УСЛОВИЙ НАС
- 4. Гидратация ↔ Сольватация Типы
- 5. Экстракция по механизму физического распределенияОрганические соединения экстрагируются
- 6. Природа экстрагента (органического растворителя) Состав водной фазы
- 7. Экстрагенты – органические растворители самой разной
- 8. Тип связи, образуемый растворителем с экстрагируемым веществом
- 9. Сложные эфиры спирты простые эфиры
- 10. Требования к растворителямОбеспечивать высокие R,%Обладать низкой растворимостью
- 11. ИОННЫЕ ЖИДКОСТИ (ИЖ)ИЖ – расплавы некоторых органических солей, жидких при комнатной температуре
- 12. НЕКОТОРЫЕ СВОЙСТВА ИЖ: НегорючестьТермическая устойчивостьНизкое давление паровНесмешиваемость с водойНетоксичность, экологичность (Green chemistry)
- 13. Экстракционные свойства ИЖ 1. По экстракционным
- 14. 2. Состав водной фазы Высаливание - понижение
- 15. Всаливание - повышение Sв органического соединения в
- 16. Состав водной фазы Влияние рН Э. неионизированных
- 17. 3. Природа экстрагирующегося соединения Молекулярная масса соединения
- 18. Изменение экстракционных свойств в ряду гомологов1. КD возрастают с увеличением числа атомов углерода в молекуле
- 19. 2. КD возрастают при введении в молекулу
- 20. Kt+о + An- о↔ Kt+An-оKt+о + An-
- 21. Факторы, оказывающие влияние на экстракцию ионных ассоциатовГидрофобность
- 22. Комплексообразование «гость-хозяин» Хозяин – макроциклические аналитические
- 23. Слайд 23
- 24. 2. Жидкостная экстракция ионов металлов
- 25. Движущая сила процессаГидратация ↔ Сольватация Sв
- 26. Реакционная экстракция(ионы M(H2O)n m+ , M(L) n
- 27. Основные процессы, протекающие при проведении реакционной Э.1.
- 28. Комплексообразование и экстракция Экстракция элементов
- 29. Условия экстракции ионов металлов1. Нейтрализация заряда
- 30. Типы и группы экстрагирующихся соединений
- 31. Основные типы экстрагентов
- 32. Слайд 32
- 33. Выбор экстрагента в соответствии с принципом о
- 34. Классификация ионов металлов (кислот) в соответствии с принципом ЖМКО
- 35. Классификация экстрагентов (оснований) в соответствии с принципом ЖМКО
- 36. Принцип Пирсона утверждает, что жесткие
- 37. Априорная оценка экстракционного поведения ионов металловВопросы??? 1.
- 38. Особенности экстракции элементов по типам и группам экстрагирующихся соединений
- 39. Координационно несольватированные соединения с ковалентной связьюI2, Br2
- 40. Факторы, влияющие на экстракциюKэх = βMXn ×KD,MXnЭкстракция
- 41. Зависимость коэффициента распределения As(III) (a)
- 42. Нейтральные координационно сольватированные соединенияMXnLm
- 43. Выбор экстрагента, исходя из принципа ЖМКО 1.
- 44. Хелаты (внутрикомплексные соединения)MLmХелат – комплексное соединение,
- 45. От чего зависит коэффициент распределения хелата (D)?М(в)
- 46. Примеры функционально-аналитических группировок и образуемых хелатных циклов с ионами металлов
- 47. Виды хелатовКоординационно-насыщенные хелаты Причины образования:
- 48. Виды хелатов2. Координационно-ненасыщенные хелатыПричины образования: координационное число
- 49. Виды хелатов3. Катионные хелатыПричины образования: 1. К.ч.
- 50. Виды хелатов4. Анионные хелатыПричины образования: 1. Использование
- 51. Координационно-несольватированные ионные ассоциаты [Kt+][A─] [Kt+],
- 52. Факторы, влияющие на экстракцию ИА Экстракция возрастает:1.
- 53. Экстракция ионов металлов краун-эфирами и
- 54. ПримерыI — 12-краун-4; (1,4,7,10-тетраоксоциклододекан) II — 1,10-диаза-18-краун-6; (1,4,10,13-тетраокса-7,16-диазациклооктадекан) III — 1,7-дитиа-15-краун-5 IV — дибензо-18-краун-6 V — циклогексано-15-краун-5
- 55. Особенность комплексообразования: краун-эфиры образуют комплексы с солями
- 56. Комплексные металлгалогенидные кислотыHnMXmn M
- 57. Слайд 57
- 58. Факторы, влияющие на экстракциюD Kex ×Hn(в)
- 59. Факторы, влияющие на экстракциюАнион1 Концентрация Х 2.
- 60. Литература 1. Концентрирование следов органических соединений
- 61. Спасибо за внимание
- 62. Основные представители органических реагентов
- 63. Количественное описание экстракции хелатовОпределение состава комплекса
- 64. М(в) + mHL(о) α = lgKex +
- 65. Влияние рН на экстракцию тория, полония,
- 66. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Лекция 2
Жидкость - жидкостная экстракция органических соединений и ионов металлов
1.
Жидкостная экстракция органических соединений
Слайд 3ПРИ ОПИСАНИИ Э. И ВЫБОРЕ УСЛОВИЙ
НАС БУДУТ ИНТЕРЕСОВАТЬ:
1. Движущая
сила процесса
2. Тип экстрагента, характер его взаимодействия с экстрагируемым
компонентом3. Количественные характеристики Э.
4. Способ осуществления Э.
5. Выбор условий экстракционного К.
Слайд 4Гидратация ↔ Сольватация
Типы экстракционных систем
1. Физическое
распределение (∆Gгидр. ∆Gcольв.)
2. Реакционная экстракция (∆Gгидр.
∆Gcольв.)(распределение, сопровождающееся хим. реакциями )
Дериватизация – перевод соединений в производные с большей молекулярной массой, которые, как правило, менее растворимы в воде и, следовательно, полнее экстрагируются органическим растворителем.
Ее применяют для повышения эффективности извлечения органических соединений
Движущая сила процесса
Слайд 5
Экстракция по механизму
физического распределения
Органические соединения экстрагируются в нейтральной форме
Ав
↔ Ао
Главная причина Э. – различие в растворимости
Слайд 6Природа экстрагента (органического растворителя)
Состав водной фазы
Природа экстрагирующегося соединения
рН
водной фазы (для ионизированных органических соединений)
Факторы, влияющие на экстракцию
Слайд 7 Экстрагенты – органические растворители самой разной природы, которые экстрагируют
молекулы органических соединений по механизму физического распределения
1. Природа органического
растворителя Эффективность Э. определяется способом сольватации экстрагируемого соединения орг. растворителем;
Способ сольватации определяется донорно-акцепторными свойствами растворителя и его способностью к образованию связей разных типов с веществом
.
Слайд 9Сложные эфиры спирты простые эфиры ароматические
хлорсодержащие непредельные У. предельные У.
Экстракционная способность растворителей убывает
в ряду:Слайд 10Требования к растворителям
Обеспечивать высокие R,%
Обладать низкой растворимостью в воде
Обладать высокой
Ткипения (>500)
Обладать нужной степенью чистоты
Безопасность (негорючесть, нетоксичность и др)!!!
Ионные жидкости – перспективная альтернатива классическим растворителям Слайд 11ИОННЫЕ ЖИДКОСТИ (ИЖ)
ИЖ – расплавы некоторых органических солей, жидких при
комнатной температуре
Слайд 12НЕКОТОРЫЕ СВОЙСТВА ИЖ:
Негорючесть
Термическая устойчивость
Низкое давление паров
Несмешиваемость с водой
Нетоксичность, экологичность
(Green
chemistry)
Слайд 13Экстракционные свойства ИЖ
1. По экстракционным свойствам ИЖ
похожи на сложные эфиры и замещенные ароматические
углеводороды2. ИЖ экстрагируют органические соединения в нейтральной форме
3. Для большинства органических соединений R,% > 90%.
Слайд 142. Состав водной фазы
Высаливание - понижение Sв
органического соединения
в присутствии
неорганических
солей
Чем объясняется
высаливающее действие солей?
а) уменьшением диэлектрической проницаемости среды;
б) изменением структуры воды (уменьшением количества несвязанной воды)Высаливающий эффект возрастает:
а) при увеличении концентрации соли-высаливателя
б) с уменьшением радиуса катиона, входящего в состав соли;
в) с ростом заряда катиона, входящего в состав соли
KCl < NaCl < LiCl < BaCl2 < CaCl2 < MgCl2 < AlCl3
Слайд 15Всаливание - повышение Sв органического соединения в присутствии некоторых веществ)
Какие
вещества обладают всаливающим действием?
Мочевина, уротропин, этиленгликоль,
ПАВ, карбоновые кислотыЧем объясняется всаливающий эффект?
а) наличием комплексообразования между соединениями;
б) солюбилизацией экстрагируемого соединения мицеллами ПАВ
Состав водной фазы
Слайд 16Состав водной фазы
Влияние рН
Э. неионизированных орг. соединений не
зависит от рН
Экстракция органических кислот максимальна при рН
и падает до нуля при рН > рКа + 2
Рис. 1. Зависимость коэффициента распределения органической кислоты HL в системе вода – органический растворитель при KD, HL = 103 и
pKa, HL = 7,62
Слайд 173. Природа экстрагирующегося соединения
Молекулярная масса соединения
(число атомов С)
Его полярность или гидрофобность и связанную
с ними растворимость в воде и в органическом растворителеСпособность к тем или иным межмолекулярным взаимодействиям
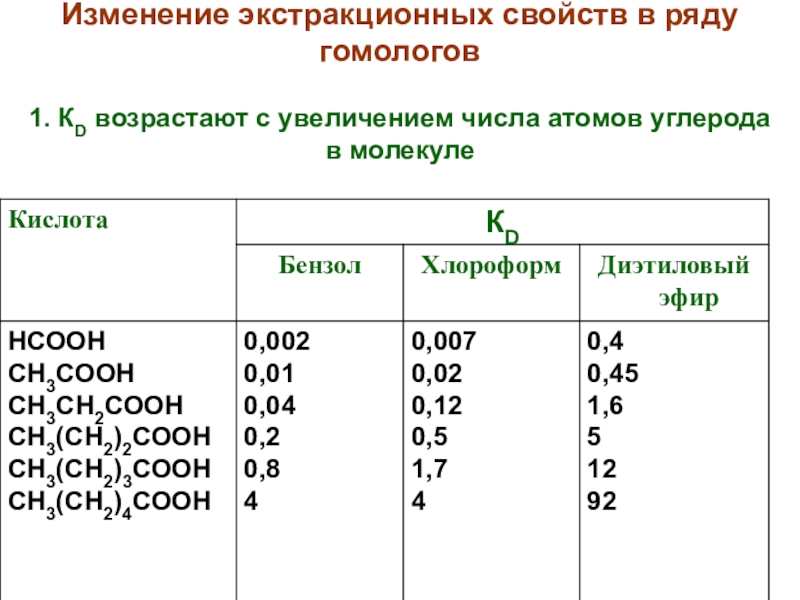
Слайд 18Изменение экстракционных свойств в ряду гомологов
1. КD возрастают с увеличением
числа атомов углерода в молекуле
Слайд 192. КD возрастают при введении в молекулу
заместителей, например, галоидов
Важно!
1) КD возрастают в ряду: F
< IКислота: СН3СООН ClСН2СООН BrСН2СООН IСН2СООН
КD : 0,004 0,03 0,04 0,06
2) КD возрастают с увеличением числа атомов галоида
Кислота : ClСН2СООН Cl2СНСООН Cl3ССООН
КD: 0,03 0,05 0,05
Слайд 20Kt+о + An- о↔ Kt+An-о
Kt+о + An- о↔ Kt+An-о
Экстракционно-фотометрические и
экстракционно-люминесцентные методы определения органических соединений
Экстракция в виде ионных ассоциатов
Слайд 21Факторы, оказывающие влияние на экстракцию ионных ассоциатов
Гидрофобность компонентов, образующих ионную
пару
(в качестве противоионов используют красители с большой
молекулярной массой)Природа органического растворителя (используют растворители с низкой диэлектрической проницаемостью, в которых практически отсутствует диссоциация ионных пар, например бензол или хлороформ)
Состав водной фазы
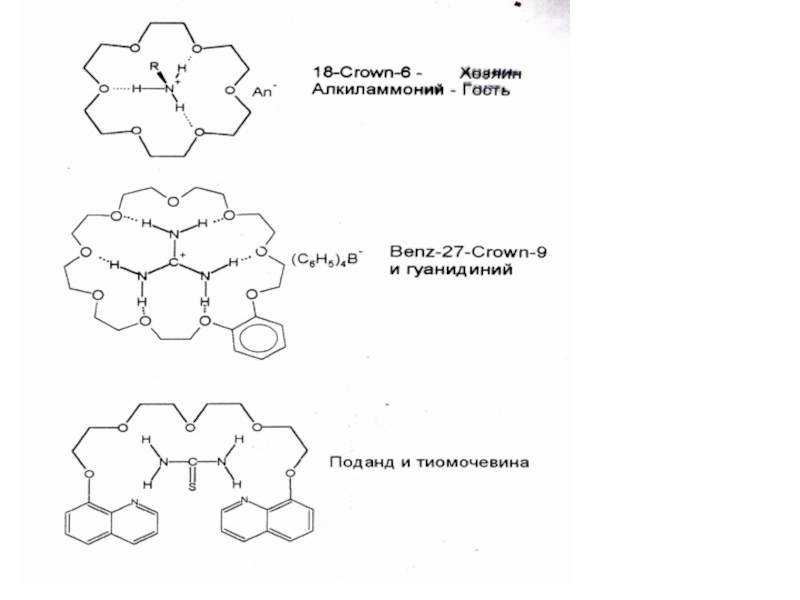
Слайд 22Комплексообразование
«гость-хозяин»
Хозяин – макроциклические аналитические реагенты (краун-эфиры, поданды и
др. циклические молекулы).
Гости – определяемые органические соединения или ионы (мочевина,
тиомочевина, амины, фенолы и др.).Основная особенность – высокая (иногда) уникальная избирательность
Движущая сила комплексообразования – нековалентные взаимодействия разных типов (ион-ионные, ион-дипольные, диполь-дипольные, гидрофобные, водородные связи).
Слайд 25Движущая сила процесса
Гидратация ↔ Сольватация
Sв
систем
1. Физическое распределение
2. Реакционная экстракция (распределение, сопровождающееся
хим. реакциями)Слайд 26Реакционная экстракция
(ионы M(H2O)n m+ , M(L) n m+ , M(A)
n m- )
∆Gгидр. ∆Gcольв.
Экстракцию этих групп соединений проводят
после перевода заряженных частиц в незаряженные комплексы или ионные ассоциаты раствором экстрагента в орг. разбавителе (CHCl3, C6H6 и др.)Слайд 27Основные процессы, протекающие при проведении реакционной Э.
1. Дегидратация ионов (затрата
энергии)
2. Ассоциация ионов и комплексообразование (выделение энергии)
3. Перенос комплекса
из водной фазы в органическую и его сольватация (частичная компенсация энергии)Движущая сила переноса комплекса в о.ф. – энергия, выделяемая при образовании комплекса и его сольватация должна превышать затраты энергии на дегидратацию ионов.
∆Gcольв.+ ∆Gкомпл. ∆Gгидр.
Слайд 28Комплексообразование и экстракция
Экстракция элементов – это реакция комплексообразования,
протекающая в двухфазной гетерогенной системе;
Для экстракционного извлечения
ионов металлов используют весьма разнообразные экстракционные реагенты, которые образуют с ионами металлов комплексные соединения разных типов; Экстрагент – соединение, ответственное за образование экстрагируемого комплекса
Слайд 29Условия экстракции ионов металлов
1. Нейтрализация заряда
Ионы металла связывают в незаряженный комплекс;
Заряженные
частицы экстрагируют в виде ионных ассоциатов 2. Гидрофобность экстрагирующегося соединения
Отсутствие гидрофильных групп в составе экстрагента;
Отсутствие молекул воды во внутренней координационной сфере комплекса
3. Размер молекул экстрагирующегося соединения
С увеличением размера молекул экстрагирующегося соединения степень извлечения обычно повышается;
крупные молекулы сильнее нарушают структуру воды.
Устойчивость комплекса
При прочих равных условиях более устойчивые комплексы экстрагируются лучше
5. Заряд и размер ионов, входящих в состав ионного ассоциата
Экстракция ионных ассоциатов ухудшается с увеличением заряда и уменьшением размера ионов.
При прочих равных условиях обычно лучше экстрагируются однозарядные ионы, хуже — двух- и особенно трехзарядные.
Слайд 33Выбор экстрагента в соответствии с принципом о жестких и мягких
кислот и оснований (ЖМКО, принцип Пирсона)
Согласно теории Льюиса
комплексообразование можно трактовать как один из видов кислотно-основных равновесий;Кислота – акцептор электронов (ион металла, содержащий вакантную орбиталь);
Основание – донор электронов (лиганд-экстрагент, содержащий заполненную орбиталь)
Слайд 36 Принцип Пирсона утверждает, что жесткие кислоты предпочтительно реагируют
с жесткими основаниями и, наоборот – мягкие кислоты – с
мягкими основаниямиСлайд 37Априорная оценка экстракционного поведения ионов металлов
Вопросы???
1. В какой последовательности
будут изменяться константы устойчивости комплексов и экстрагируемость в группе металлов
для данного экстракционного реагента?2. В какой последовательности будут изменяться константы устойчивости комплексов одного металла и экстрагируемость для группы реагентов ?
:
.
Слайд 39Координационно несольватированные соединения с ковалентной связью
I2, Br2
HgCl2, AsCl3, SbCl3,
GeCl4
HgBr2, AsBr3, SbBr3, GeBr4, SeBr4
HgI2, AsI3, SbI3, SnI4
Особенность: эти соединения
в заметной степени не гидратируются и не сольватируютсяЭкстрагенты: органические растворители самой различной природы, в том числе инертные (бензол, тетрахлорид углерода)
Механизм экстракции: физическое распределение
(Степень извлечения определяется соотношением их растворимостей в органической и водной фазах).
Слайд 40Факторы, влияющие на экстракцию
Kэх = βMXn ×KD,MXn
Экстракция возрастает:
С увеличением констант
устойчивости (βMXn)
HgCl2 < HgBr2 < HgI2,
2. С увеличением гидрофобности экстрагируемого
соединения (KD);3. С увеличением его размера (KD);
3. С ростом сольватирующей способности орг. растворителя (KD);
Слайд 41
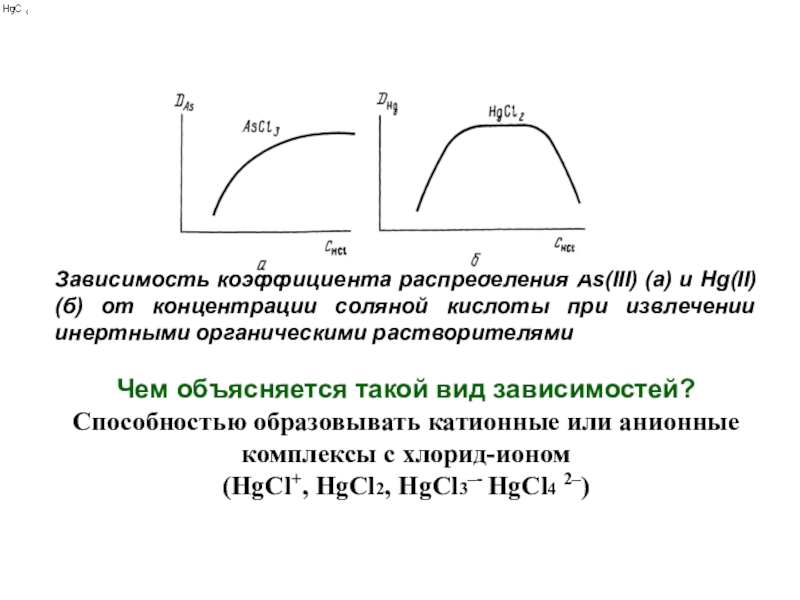
Зависимость коэффициента распределения As(III) (a) и Hg(II) (б)
от концентрации соляной кислоты при извлечении инертными органическими растворителями
Чем объясняется
такой вид зависимостей?Способностью образовывать катионные или анионные комплексы с хлорид-ионом
(HgCl+, HgCl2, HgCl3–- HgCl4 2–)
Слайд 42Нейтральные координационно сольватированные соединения
MXnLm
M – ион
металла,
X – неорганический анион (Cl, Br,
I ,SCN ),L – нейтральный экстрагент
Примеры соединений: хлориды Sc(III), Zr(IV), Hf(IV), Th(IV), Au(III) и др.); нитраты M(NO3)nLy (M = UO2 2+ , Zr (IV)
Экстрагенты: нейтральные O-, S-содержащие соединения, растворенные в органических растворителях
Механизм экстракции: сольватный (координационный)
MXn(H2O)m(о) mL(о) MXnLm(о) m H2O(в)
Kэх =(β MXnLm ×Kd, MXnLm) / K D,L
Слайд 43Выбор экстрагента, исходя из принципа ЖМКО
1. Для жестких РЗЭ,
актинидов, циркония, железа используют жесткие кислородсодержащие экстрагенты:
трибутилфосфат,
триоктилфосфиноксид и др.2. Для мягких платиновых металлов, ртути, кадмия, висмута и серебра используют серосодержащие экстрагенты:
производные тиомочевины, различные органические сульфиды, трифенилфосфин.
Слайд 44Хелаты
(внутрикомплексные соединения)
MLm
Хелат – комплексное соединение, образованное при взаимодействии ионов
металлов с органическими полидентатными реагентами, содержащими, по крайней мере, два
донорных атома (O, S, N), способных одновременно координироваться с металлом.Внутрикомплексное соединение (ВКС) –хелат, при образовании которого выделяется ион водорода
Примеры соединений: 8-гидроксихинолинаты, дитизонаты, диэтилдитиокарбаминаты, β-дикетонаты и др.
Экстрагенты: хелатообразующие реагенты, растворенные в органических растворителях
Механизм экстракции: сольватный (координационный) +
катионообменный
Слайд 45От чего зависит коэффициент распределения хелата (D)?
М(в) + mHL(о) =
МLm(о) + mH(в)
lgD = lgKex + mlg[HL](о) + mpH
1. рН
2.Концентрации реагента НL,
3. Константы экстракции
С учетом всех равновесий, протекающих в системе, можно показать (домашнее задание), что:
Kэх =(βMLn×KD,MLn ×Knа,НL )/ KnD,НL
Для увеличения значения Кex необходимо, чтобы:
1.Реагент должен быть как можно более сильной кислотой (Ka, HL)
Экстрагирующийся хелат имел по возможности высокую устойчивость (βm)
Константа распределения реагента (KD, HL) должна быть как можно меньше
Константа распределения экстрагирующегося комплекса (KD, MLm) должна быть как можно больше.
Слайд 46Примеры функционально-аналитических группировок и образуемых хелатных циклов с ионами металлов
Слайд 47Виды хелатов
Координационно-насыщенные хелаты
Причины образования: координационное число равно
удвоенному заряду иона металла.
Пример: ацетилацетонат алюминия. К.ч.=6;
ацетилацетон – бидентатный реагент;
в составе комплекса AlA3 свободных мест нет
Экстрагенты: хелатообразующие реагенты, растворенные в растворителях любой природы, в том числе и инертных.
При выборе растворителя учитывают растворимость в нем хелатообразующего экстрагента: чем лучше растворитель растворяет экстрагент, тем, как правило, он будет лучше растворять и экстрагируемое соединение.
Слайд 48Виды хелатов
2. Координационно-ненасыщенные хелаты
Причины образования: координационное число больше
удвоенного заряда иона металла.
Пример: 8-гидроксихинолат
кальция. К.ч.=6; два аниона 8-HOx занимают четыре места, два других координационных места занимают молекулы воды, которые придают комплексу СаOx2(Н2О)2 значительную гидрофильность
Экстрагенты: хелатообразующие реагенты, растворенные в растворителях с добавками нейтральных экстрагентов, способных вытеснить воду.
СаOx2(Н2О)2 экстрагируется при введении в систему трибутилфосфата в виде комплекса СаOx2(ТБФ)2
Слайд 49Виды хелатов
3. Катионные хелаты
Причины образования:
1. К.ч. меньше
удвоенного заряда иона металла;
Пример: Au(III), К.ч.=4; AuL3 не образуется; образуется AuL2+, где HL- бидентатный дитизон, ДЭДТК
2. Стерические препятствия
Пример: 2-метил-8- HOx не образует нейтральных комплексов с редкоземельными элементами: этому мешают метильные группы
3.Использование полидентатных (1-(2-пиридилазо)-2-нафтол), но моноосновных реагентов, которые чаще всего образуют комплексы состава 1:1,
Экстрагенты: хелатообразующие реагенты, растворенные в растворителях с добавками крупных гидрофобных анионов, например анионов кислотных красителей, тетрафенилбората, нафталинсульфоната
Слайд 50Виды хелатов
4. Анионные хелаты
Причины образования:
1. Использование экстрагентов, содержащих, помимо
хелатообразующей группировки, легко диссоциирующуюся сульфогруппу
2. Избыток анионов экстрагента и высокое
координационное число иона металлаЭкстрагенты: хелатообразующие реагенты, растворенные в растворителях с добавками крупных гидрофобных катионов, например катионов основных красителей, тетрафениларсония и др.
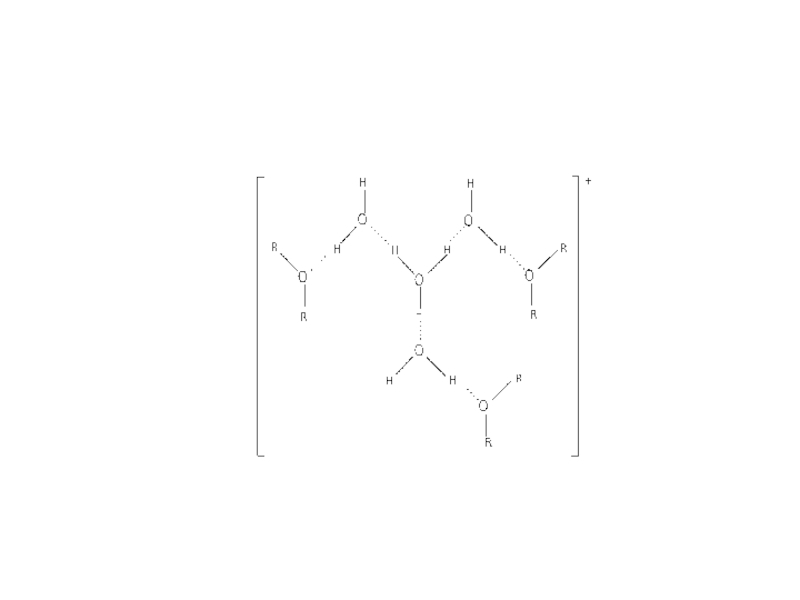
Слайд 51Координационно-несольватированные ионные ассоциаты
[Kt+][A─]
[Kt+], [A─] - крупные
и гидрофобные катионы и анионы, которые не сольватированы координационно
Примеры
соединений: 1. Ме в форме Kt+
Анионы ?
Ph4B‾; ReO4‾; MnO4‾; ClO4‾; IO4‾;
Анионные сульфофталеиновые красители
2. Ме в форме анионного металлгалогенидного камплекса
Катионы?
Ph4As+, Ph4P+, R4N+, трифенилметановые и
ксантеновые катионные красители,
Экстрагенты: органические растворители самой различной природы, в том числе инертные
Механизм экстракции: физическое распределение
Слайд 52Факторы, влияющие на экстракцию ИА
Экстракция возрастает:
1. С увеличением ε
растворителей
2. С увеличением размера ионов, входящих в ИА
3. С увеличением
гидрофобности ионов, входящих в ИАСлайд 53Экстракция ионов металлов
краун-эфирами и макроциклическими соединениями
Краун-эфиры – это
макроциклические полиэфиры, содержащие от 4 до 20 атомов кислорода отделенных друг
от друга двумя, или большим числом атомов углерода.Номенклатура: В тривиальных названиях краун-эфиров общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят перед и после слова «краун». Согласно ИЮПАК краун-эфиры представляются как производные циклических углеводородов
Слайд 54Примеры
I — 12-краун-4; (1,4,7,10-тетраоксоциклододекан)
II — 1,10-диаза-18-краун-6; (1,4,10,13-тетраокса-7,16-диазациклооктадекан)
III — 1,7-дитиа-15-краун-5
IV — дибензо-18-краун-6
V — циклогексано-15-краун-5
Слайд 55Особенность комплексообразования: краун-эфиры образуют комплексы с солями щелочных и щелочноземельных
металлов. При комплексообразовании катион включается во внутреннюю полость краун-эфира и
удерживается там за счет ион-дипольного взаимодействия с гетероатомами кислородаСпецифические свойства краун-эфиров:
1. Высокая избирательность реакций комплексообразования: наиболее устойчивые комплексы образуются с теми катионами, размер которых больше всего соответствует размеру полости краун-эфира – например, 18-краун-6 особенно селективен к ионам калия и стронция.
2. Комплексы, в отличие от образующих их неорганических солей, часто растворимы в органических растворителях (например, как окислитель используется раствор перманганата калия в бензоле в присутствии краун-эфиров - "пурпурный бензол").
Особенности экстракции:
1. Экстрагируемый краун-эфирами металл входит в состав катионной части ионного ассоциата,
2. В качестве противоионов используют крупные и гидрофобные анионы-партнеры.
Слайд 56Комплексные металлгалогенидные кислоты
HnMXmn
M – ион металла,
X – неорганический анион (F, Cl, Br,
I,SCN , CN)Примеры соединений: (HTaF4 , HFeCl4, HAuBr4 H2CdI4, HAuCN4 и др.);
Экстрагенты: кислородсодержащие растворители
Механизм экстракции: гидратно-сольватный (Ю.А. Золотов,1961)
nH(H2O)(x1)(в)Mm(в)(mn)X(в) yS(о) Hn(H2O)(x1)SyMX(mn)(о)
РОЛЬ ВОДЫ?
Слайд 58Факторы, влияющие на экстракцию
D Kex ×Hn(в) × X(n
m)(в) × Sy(о)
Катион
1.Влияние концентрации Н+
1.1. За счет вхождения
в состав экстрагируемого соединения1.2. За счет подавления гидролиза
1.3. За счет уменьшения активности воды
2.Гидратация и сольватация
Экстракция улучшается при использовании растворителей с большей сольватирующей способностью (трибутилфосфатметилизобутилкетондипропилкетон
диэтиловый эфир)
Слайд 59Факторы, влияющие на экстракцию
Анион
1 Концентрация Х
2. Размер иона.
С ростом размера в ряду: F< Cl < Br
< I4. Для мягких ионов экстракция растет с увеличением констант устойчивости, для жестких может и уменьшаться (H3FeF6 и HFeCl4 )
Почему?
Слайд 60Литература
1. Концентрирование следов органических соединений /Под ред. Н.М. Кузьмина.
М.: Наука, 1990. 280 с. .
2. Майстренко В.Н.,
Хамитов Р.З., Будников Г.К. Эколого-аналитический мониторинг супертоксикантов. М.: Химия, 1996. 319 с.3. Майстренко В.Н., Клюев Н.А. Эколого-аналитический мониторинг стойких органических загрязнителей. М.: БИНОМ. Лаборатория знаний, 2004. 323 c.
4. Другов Ю.С., Родин А.А. Пробоподготовка в экологическом анализе. М.: Lab-Press, 2005. 695 c.
Слайд 64М(в) + mHL(о)
α = lgKex + m pH α
= lgKex + m lg[HL](о)
lgD = lgKex + mlg[HL](о) +
mpHpH = const [HL](о) const









































](/img/tmb/7/605278/db4643dcb4705a0ae402f2823b59253c-800x.jpg)





![Методы разделения и концентрирования
Спецкурс
Лектор – проф. С.Г. Дмитриенко Координационно-несольватированные ионные ассоциаты [Kt+][A─] [Kt+], [A─] - крупные и гидрофобные Координационно-несольватированные ионные ассоциаты [Kt+][A─] [Kt+], [A─] - крупные и гидрофобные катионы и анионы, которые не](/img/tmb/7/605278/3f5269bebe40256028da14c31ce80b44-800x.jpg)











lgD = lgKex](/img/tmb/7/605278/ab3eceaa1a0814d287c9212ba70817a4-800x.jpg)