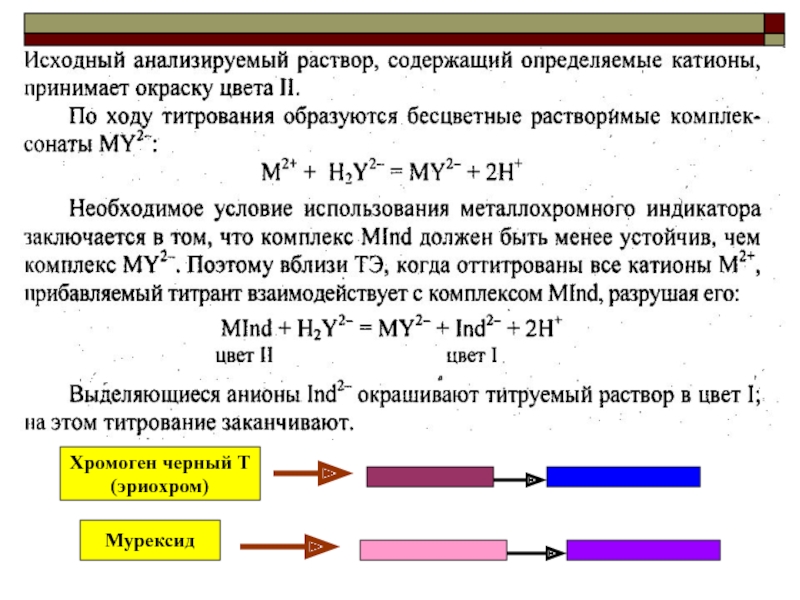
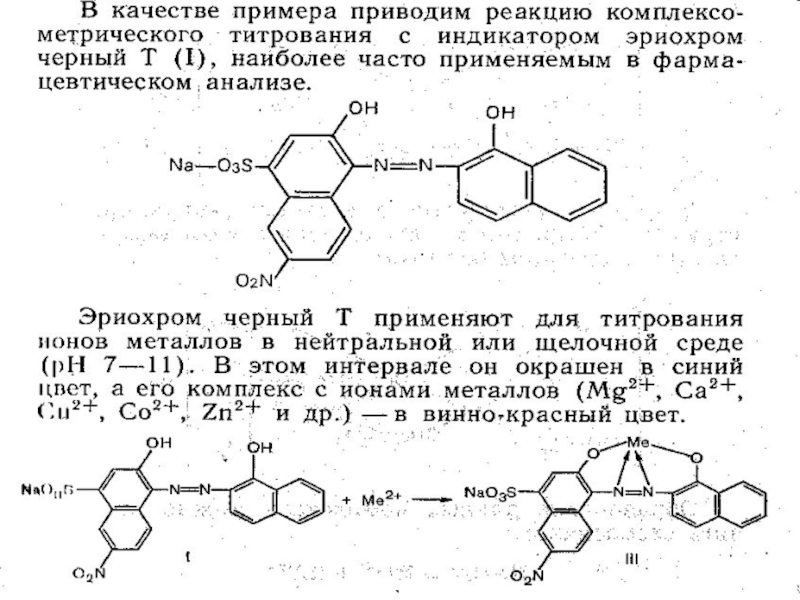
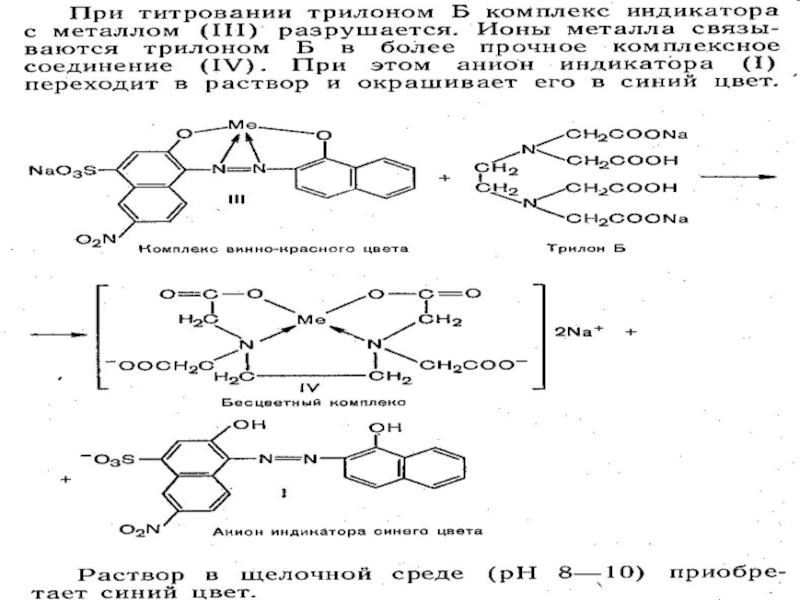
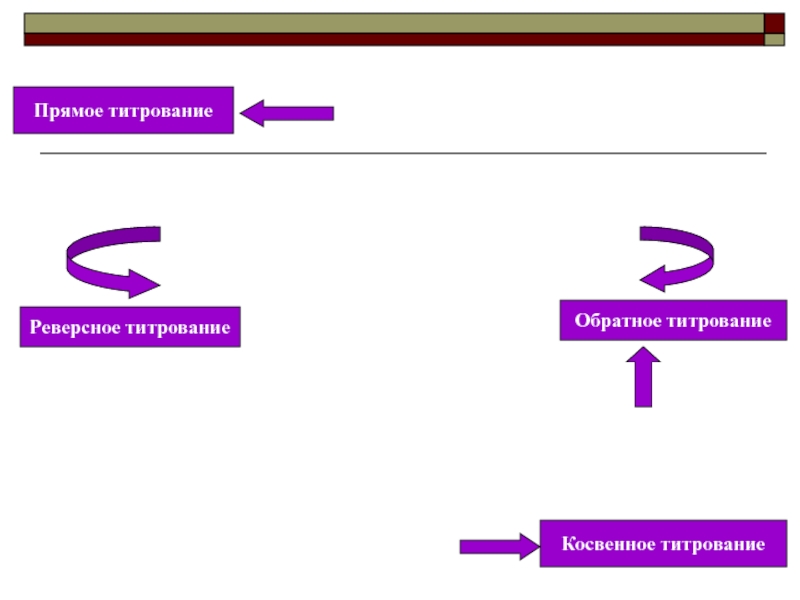
Что это за реакция?
КОТ – методы кислотно-основного титрования (методы
нейтрализации) основаны на взаимодействии кислот и оснований друг с другом: Н+ + ОН- = Н2О
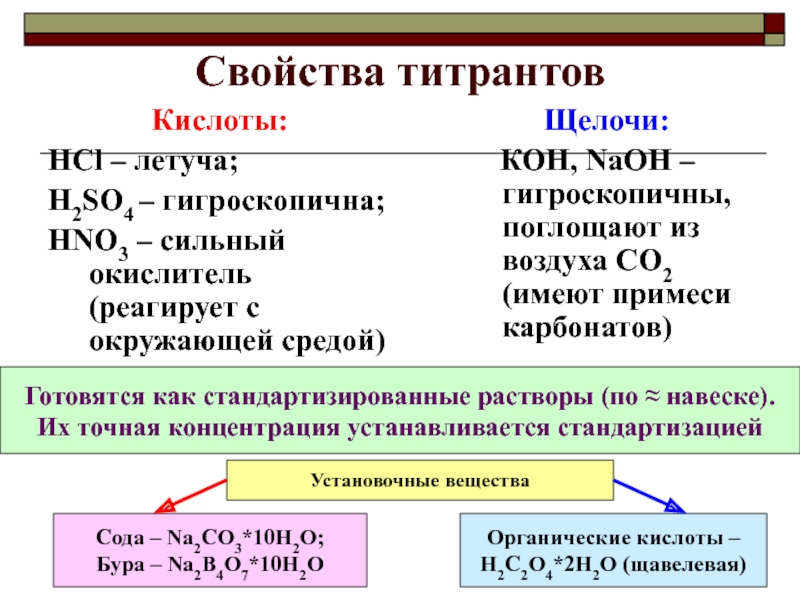
Применяется для определения концентрации кислот, оснований и гидролизующихся солей
(по катиону – как кислот ZnCl2,
по аниону – как оснований K2CO3).












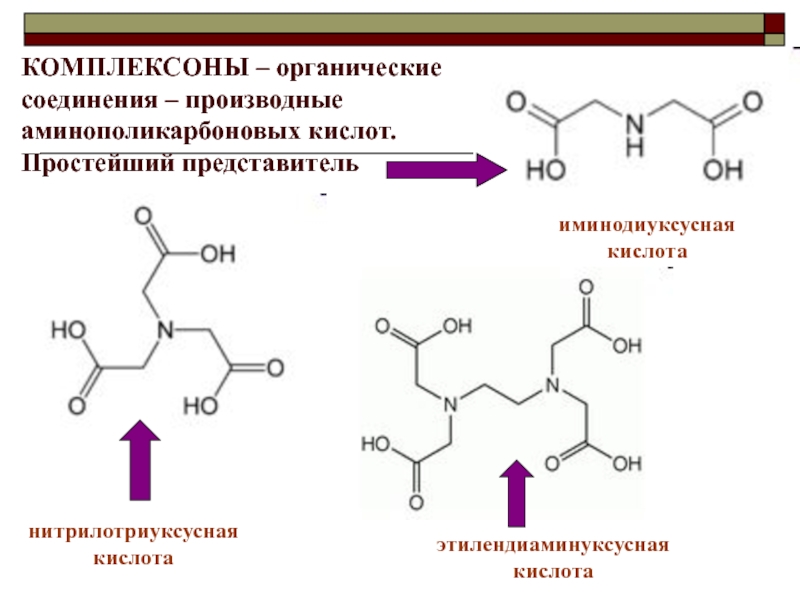
![МЕТОДЫ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА КОМПЛЕКСОН III (ТРИЛОН Б) или ЭДТА – это этилендиаминтетраацетат динатрия.Молекулярная формула КОМПЛЕКСОН III (ТРИЛОН Б) или ЭДТА – это этилендиаминтетраацетат динатрия.Молекулярная формула – С10Н14N2O8Na2*2H2O. (Na2[H2ЭДТА])ЭДТА –титрант комплексонометрии. Он](/img/thumbs/103214fdedcff8b8c240c3589b33c23c-800x.jpg)